surfactin高产菌株的等离子体诱变及其高通量筛选
surfactin高产菌株的等离子体诱变及其高通量筛选
利用常压室温等离子体(atmospheric pressure and room temperature plasma, ARTP)方法对枯草芽孢杆菌BacillussubtilisE7进行快速诱变,筛选表面活性素(surfactin)高产菌株。采用表观初筛,溶血圈初筛,孔板复筛,多功能酶标仪检测,摇瓶验证相结合的方法提高了筛选通量,加快了筛选进程,构建了高通量诱变筛选surfactin高产菌株的体系,并使用高效液相(high performance liquid chromatography, HPLC)检测方法对产物进行检测。优化处理时间为220 s,获得了遗传稳定的突变菌株BacillussubtillusSF90-5,其产surfactin能力提高到约0.8 g/L,是原始菌株的5倍。ARTP诱变技术结合高通量筛选体系极大程度减少了工作量,提高了筛选通量,加快了筛选进度,并快速获得了目的菌株,为脂肽类表面活性剂进一步的工艺研究提供了基础。
surfactin;常压室温等离子体;枯草芽孢杆菌;高通量
脂肽类生物表面活性剂是一种由肽链和脂肪酸链组成的两性分子,其一端为多个氨基酸组成的亲水基肽链,另一端为亲油基脂肪烃链。常见的脂肽类生物表面活性剂主要以同系物方式存在,主要成分有surfactin、fengycin、iturin等[1]。该类表面活性剂独特的化学结构使其拥有广谱抗菌性、更高的表面活性及耐热、耐酸、稳定等特点,同时具有天然、低毒、可降解的优点,在食品、化妆品、专用化学品、农业、医药、石油开采及生物修复方面具有巨大的应用潜力[2]。随着人们生活水平的提高,对食品添加剂及防腐剂的安全性要求越来越高,与传统食品添加剂相比,脂肽类表面活性剂的广谱抗菌性使其对革兰氏阳性菌和革兰氏阴性菌都有较好的抑制性,且无毒、可降解、乳化性强、不会产生耐药性,因此在新型食品保鲜中替代现有防腐剂、乳化剂等方面具有重要意义[3]。
目前所报道的产脂肽类生物表面活性剂的菌株主要有芽孢杆菌属(Bacillussp.)、沙雷氏菌属(Serratiasp.)、曲霉菌属 (Aspergillussp.)、假单胞菌属(Pseudomonassp.)、梭菌属 (Clotridiumsp.)、隐杆菌属(Empedobacterhaloabiumsp.)及游动放线菌属(Actinoplanessp.)、链霉菌属(Streptomycessp.)、节杆菌属(Arthrobactersp.)、分枝杆菌属(Mycobacteriumsp.)等,研究较为深入的菌株主要集中在芽孢杆菌属[4-6]。但天然芽孢杆菌产脂肽类生物表面活性剂的能力相对较低,开发成本较高,因此提高菌株的产脂肽能力,一直是研究人员追求的目标。闫冬等人采用原生质体融合的方法选育出抗菌脂肽高产菌株,最终以HPLC方法检测得到surfactin产量为0.274g/L[7]。YAO等人在对发酵工艺进行调节后采用干重法最终获得4g/L的脂肽类生物表面活性剂产量[8]。传统的摇瓶筛选方式工作量大,步骤繁琐,得到高产菌株的周期较长,因此,高通量的菌株筛选能有效加快高产菌株获得速度,ZHU等人通过微孔板的方式最终获得1株surfactin产量为0.473g/L的枯草芽孢杆菌[9]。
出发菌株B.subtilisE7,为河南大学发酵工程实验室筛选获得的1株surfactin高产菌株。为了进一步提高surfactin的产量,本研究采用常压室温等离子(atmospheric pressure and room temperature plasma, ARTP)的诱变方法,对B.subtilisE7进行诱变,以多孔板培养的方式扩大筛选量,构建了surfactin生产菌诱变及筛选的高通量模式,并获得1株产量较高的surfactin生产菌,为进一步开发利用该菌株生产surfactin提供了基础。
1 材料与方法
1.1 实验材料
1.1.1 实验菌种
枯草芽孢杆菌BacillussubtilisE7(河南大学发酵工程实验室筛选保藏)。
1.1.2 培养基
种子培养液:葡萄糖20 g/L、酵母膏5 g/L、味精10 g/L、K2HPO42 g/L、MgSO40.25 g/L。
血平板培养基:牛肉膏3 g/L、蛋白胨10 g/L、酵母膏0.1 g/L、NaCl 5 g/L、琼脂20 g/L,羊血50 mL/L。
摇瓶发酵基础培养基:蔗糖30 g/L、尿素4 g/L、酵母膏1 g/L、KH2PO410 g/L、Na2HPO44g/L、NaCl 5 g/L、MgSO40.3 g/L,pH 8.2~8.3,灭菌条件为121 ℃,20 min。
1.2 仪器与设备
叠加式大容量恒温培养摇床,常州英德生物科技有限公司;ARTP诱变仪,无锡源清天木生物科技有限公司;多功能酶标仪MD SpectraMax M2,Molecular Devices公司;高效液相色谱仪,岛津Prominence LC-20A。
1.3 实验方法
1.3.1 菌种活化
将4 ℃保藏菌种转接活化平板,37 ℃培养12 h,挑取单菌落接入到种子活化瓶,37 ℃,200 r/min再次活化培养9 h。
1.3.2 发酵培养
将活化种子液以1%接种量接入摇瓶或24孔板中37 ℃,200 r/min发酵培养60 h。
1.3.3 ARTP诱变
在无菌环境内取10 μL种子液涂于无菌载片上,使菌液在载片表面均匀铺开。置于ARTP中进行处理,处理距离2 mm、气量10 SLM、功率120 W(以上参数均为机器恒定最佳参数,不需改变)[10],处理时间梯度在60~300 s之间。将诱变处理后的载片置于1 mL无菌生理盐水中,在漩涡振荡器上振荡约2 min将菌种洗下。将洗脱液稀释至合适浓度后均匀涂布于种子平板进行复苏,复苏完成后根据菌株表观特征选取菌株点接至血平板。挑取有明显溶血圈的单菌落二次活化后保藏同时进行复筛。
1.3.4 高通量培养
传统的摇瓶筛选方式工作量大,步骤繁琐,单次处理量较低,不适合高通量筛选模式。深孔板由于其通量大、体积小而逐渐成为微生物培养及检测等研究的主要选择[9],近些年来随着微孔板摇床的研发水平进步,孔板培养的方式也逐步发展起来。根据孔的形状微孔板主要分为圆形和方形两种,根据孔数量适合微生物培养的主要有24、48、96孔等类型。由于发酵结束后需要足够的发酵液进行检测,考虑装液量及实际培养效果后最终选定24孔方形孔板进行菌种活化及发酵培养[11]。
24孔板的最大装液量为10 mL,发酵周期较长,装液量过少在培养结束后剩余发酵液无法满足检测所需,装液量过多则会影响发酵液中溶氧,且在摇床振动过程中发酵液会溢出,增加染菌风险,在经过多次预实验对比效果后最终确定装液量为2 mL[11]。
使用24孔深孔板对诱变所得菌种进行活化,种子液装液量2 mL,挑取适量菌落后37 ℃,200 r/min条件下培养9 h,1%接种量转接至装有2 mL发酵液的24孔深孔板中,37 ℃,200 r/min条件下培养60 h。发酵结束后检测其OD600及发酵液排油圈直径,并计算其标准偏差(RSD)以验证微孔板孔间平行性。

1.3.5 surfactin含量检测
排油圈法[12]。发酵液离心取上清液。洁净平板中倒入40 mL 40 ℃左右温水,滴加15 μL原油液使其铺匀,加入5 μL的发酵液上清,静置30 s,量取排油圈的直径Φ(cm)。
HPLC检测:Inertsil ODS-SP C18反向色谱柱(5 μm×150 mm)。柱温30 ℃,流动相分别为乙腈(含0.1%TFA)、去离子水(含0.1%TFA)。流速0.8 mL/min,检测波长214 nm。0~3 min,乙腈浓度从45%梯度至50%;3~8min乙腈浓度由50%梯度至80%;8~25 min乙腈浓度由80%梯度至100%[13]。发酵液调pH 2使产物沉淀弃上清,甲醇复溶,0.4 μm滤膜过滤后进样。
1.3.6 高通量检测方法
氯化十六烷基吡啶-溴百里酚蓝(CPC-BTB)比色法[14]: 0.2 mmol/L CPC(氯化十六烷基吡啶)和0.2 mmol/L BTB(溴百里酚蓝)等体积混合在0.1 mol/L PBS(磷酸缓冲溶液,NaH2PO4/Na2HPO4,pH 8.0)中配制成CPC-BTB溶液。在酶标板内分别加入800 μL CPC-BTB溶液和100 μL发酵液上清样品,25 ℃下反应5 min,使用酶标仪测定其A600nm。
2 结果与分析
2.1 ARTP诱变条件的确立
2.1.1 出发菌株生长曲线
B.subtillusE7从保藏斜面转接至种子平板活化12 h后再次转接至三角瓶内,37 ℃,200 r/min条件下培养获得其生长曲线见图1。
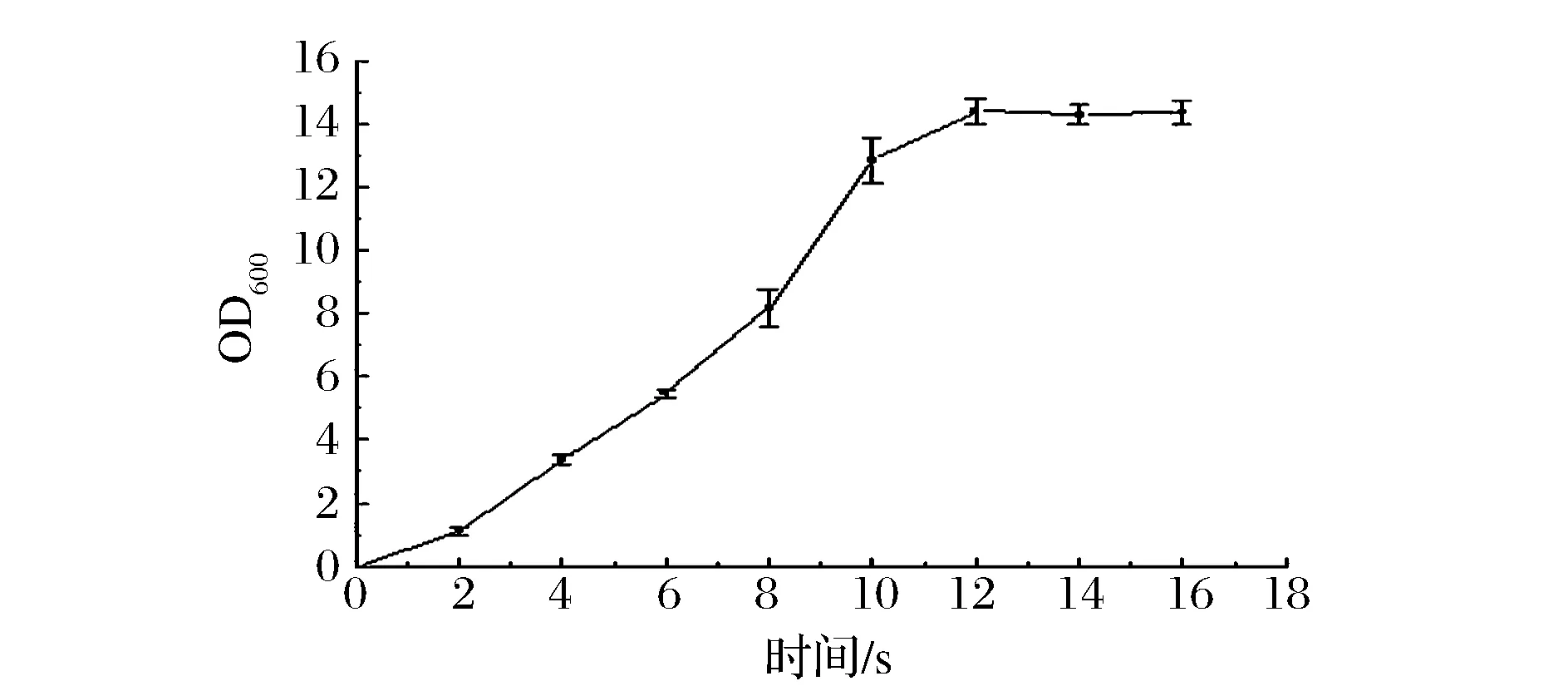
图1 枯草芽孢杆菌出发菌株生长曲线Fig.1 Growth curve of B.subtilis E7
由图1可看出,菌株在4 h进入对数期,12 h后结束对数生长期开始进入稳定期。一般对数中期的菌株在浓度以及生理特性方面都达到了较优水平,比较适合进行诱变处理[15],因此本实验选用9 h的菌株作为诱变样品。
2.1.2 ARTP诱变处理时间
使用种子液,以不同的处理时间进行ARTP诱变,对菌株ARTP致死率进行测定。由图2可以看出,诱变处理时间在60~150 s时,随处理时间的增加,致死率增加;180 s时致死率达到99%;210 s时致死率达到99.4%;300 s致死率达到99.9%。为获得surfactin高产及生存力较强的菌株,本研究选择将致死率控制在99%以上。因此对产surfactin菌株合适的诱变处理时间为100~220 s。研究中发现220 s的处理剂量下菌株正突变率较高,在后续的研究中选取220 s作为实验处理剂量。
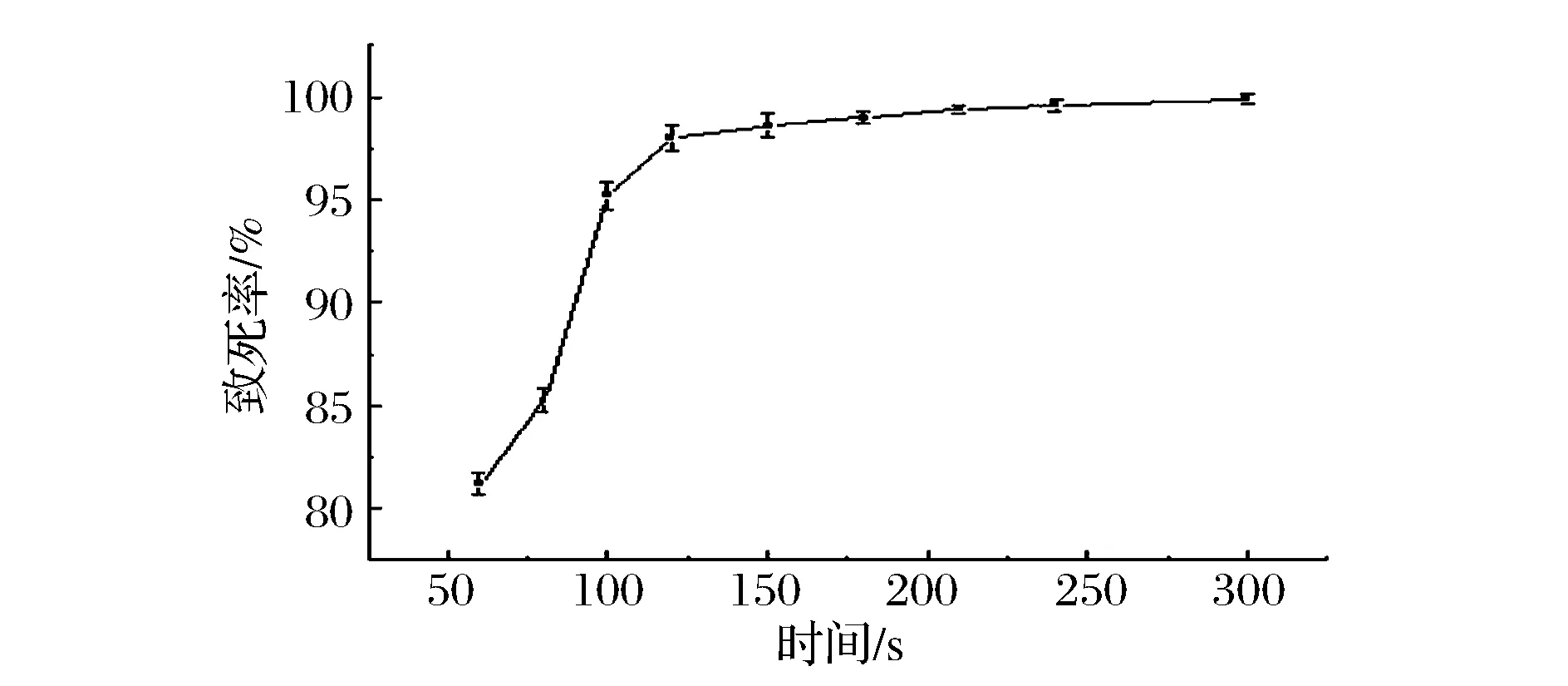
图2 脂肽合成菌ARTP诱变致死率曲线Fig.2 Plasma mutagenic lethality rate curve of B. subtis E7
2.1.3 高产surfactin突变株的初筛
经ARTP诱变后的菌株由于其基因发生突变,致使某些菌株在其表现型上也会发生部分变化,突变株形态大致可分为9种类型,分别对其从a-i进行编号。对不同形态菌株进行培养并对比其OD600和排油圈直径后发现,菌落中间部位有凸起的为正突变菌株,其形态与原始菌株形态(a)相似(如图3中b、c、e、f),其OD600及发酵液排油能力都稍高;中间处凹陷,菌落偏小的为负突变株(如图3中 d、g、h、i)发酵液排油能力较低或无排油能力[16]。

图3 诱变后菌株外观(左)与溶血圈初筛(右)Fig.3 Appearance of strain after mutagenesis (left) , diametr of hemolytic circle (right)
在对surfatin的研究中发现其具有较强的溶解血细胞的能力,因此在含血液的平板培养基培养过程中会出现溶血圈[17]。结合这一特性建立了通过溶血圈来筛选产surfactin菌株的经典血平板法。选取表观初筛后所得的正突变表型菌株转接至含有新鲜羊血细胞的的血平板培养基中,37 ℃培养12 h选取在血平板上有明显溶血圈的菌株进行下一步筛选。
2.2 高通量筛选流程的建立
2.2.1 孔间平行性分析
由于深孔板孔数较多,因此实验过程中在同一块孔板中孔与孔之间发酵结果的平行是保证实验结果可行且能与摇瓶发酵结果对比的关键[11]。
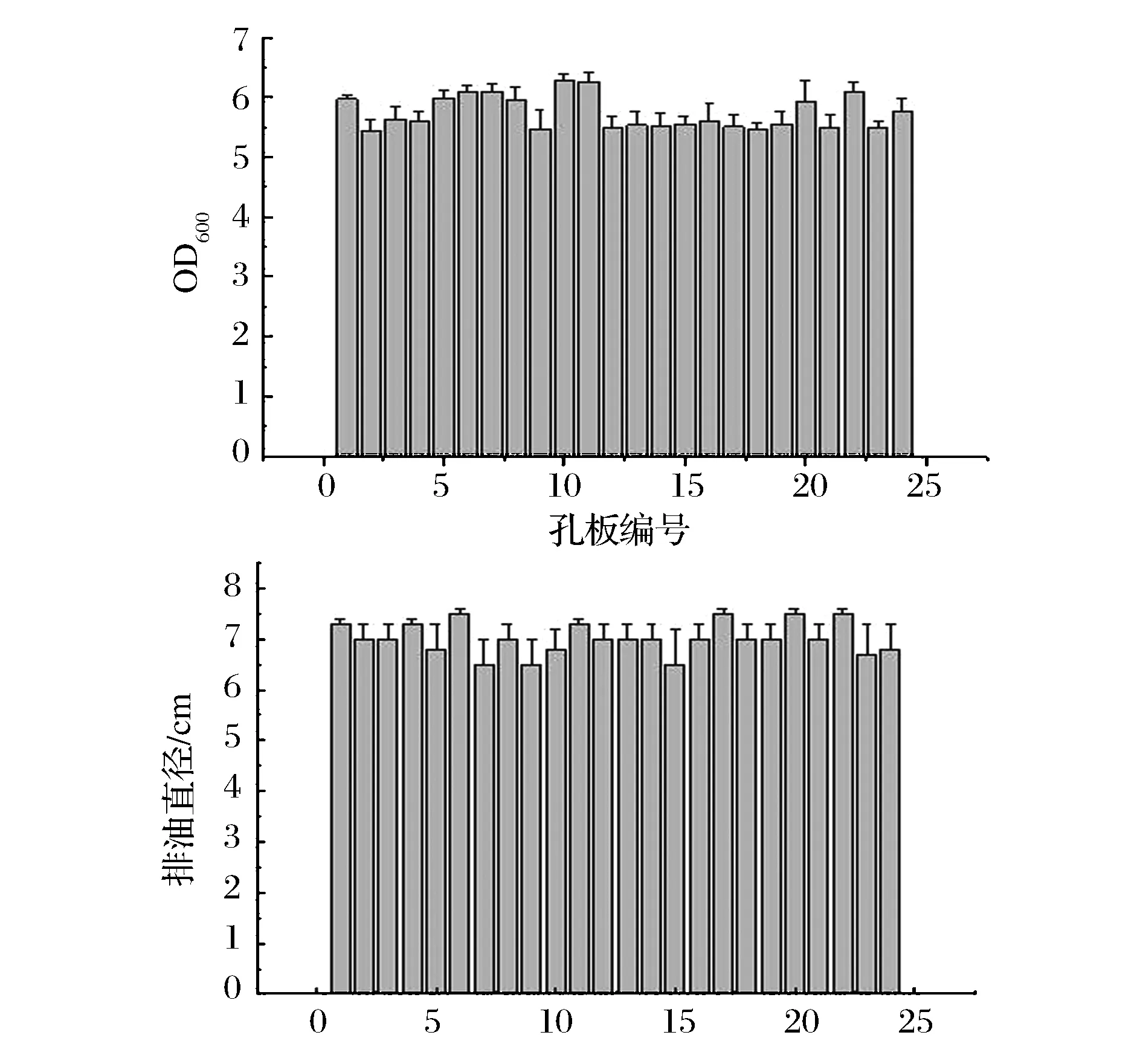
图4 24孔板孔间平行性Fig.4 The parallelism between differentplates of 24 square deepwell plates
分别对24孔板中各孔发酵液OD600及发酵上清排油能力进行统计,统计结果如图4所示。根据图4所得结果比较其标准偏差RSD值后发现孔间OD600标准偏差(RSD)值为4.93%,发酵液排油圈直径标准偏差(RSD)值为4.42%,两标准偏差值均小于5%,证明孔间平行性达到要求,可用于发酵实验的进行。
2.2.2 高通量检测体系
溴百里酚蓝(BTB)与氯化十六烷基吡啶(CPC)结合后颜色由深蓝色变为浅黄绿色,surfactin作为一种带负电荷的生物表面活性剂会与阳离子CPC结合从而使BTB游离出来,surfactin浓度不同,与CPC结合程度也会有差异,使作为显色剂的BTB游离出的浓度也不同,从而显色体系的颜色会由浅黄绿色渐变为鲜蓝色[18-19],颜色二次转变的过程可以用分光光度计或者酶标仪测量。制作相应标准曲线,根据标准曲线得到surfactin浓度与A600nm之间关系的公式为:
y=0.034 25+0.352 88x
式中:y为surfactin浓度;x为A600nm。
由标准曲线可看出x与y值存在正相关性。但该标准曲线R2值偏小,仅为0.988 69,因此该标准曲线并不能作为准确定量发酵液中surfactin浓度的依据,该方法只能作为一个快速检测模式在前期初筛的基础上进一步筛选出产量相对较高的菌株。在之后仍需其他数据辅助验证并进行摇瓶复筛。
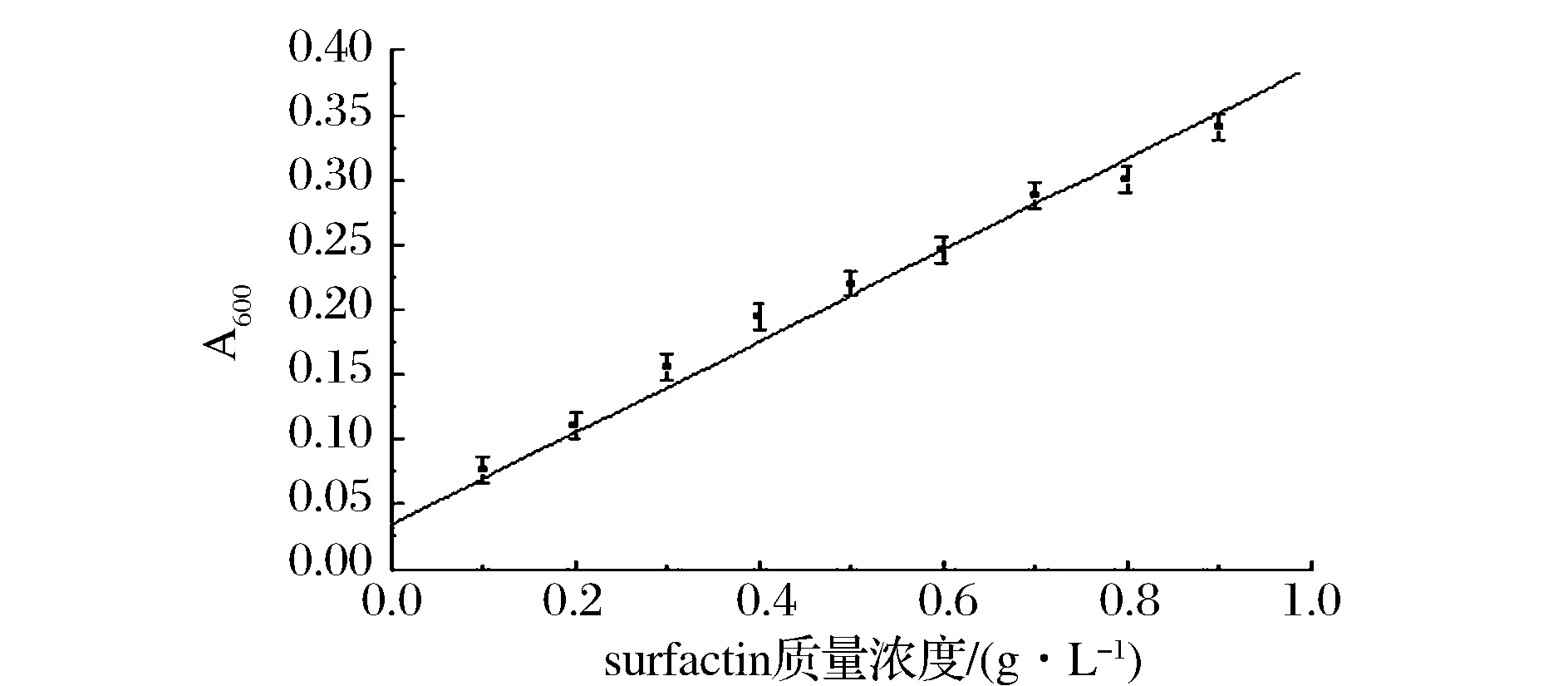
图5 600 nm处surfactin标准曲线Fig.5 The standard curve at 600 nm of surfactin
发酵样本稀释至合适浓度后加入含有CPC-BTB试剂的微孔板中,混合均匀后25 ℃下反应5 min,取120 μL转移至酶标板并使用酶标仪测定其A600nm,将筛选出的颜色亮蓝或在600 nm处吸光值较大的样品使用250 mL三角瓶进行第二轮复筛,并用HPLC对复筛所得发酵样本进行产量检测后对比筛选出产量最高菌株。在经过多次ARTP诱变筛选后最终获得1株surfactin高产菌株,经HPLC检测其产量为0.8 g/L,并将其命名为B.subtilisSF90-5。
2.3 菌株验证
2.3.1 与出发菌株的比较
使用三角瓶(250 mL装液量40 mL)在37 ℃,200 r/min条件下发酵培养突变菌株B.subtilisSF90-5及原始菌株60 h,发酵结束后其生物量和产量对比结果如图6。与原始菌株相比,B.subtilisSF90-5菌株发酵液生物量稍高于出发菌株,脂肽类表面活性剂合成明显增加,且通过排油圈方法测得其排油能力相比出发菌株提高约2.3倍。

图6 出发菌株B. subtis E7与B. subtis SF90-5菌株对比结果Fig.6 The different between B. subtis E7 and B. subtis SF90-5
分别将原始菌株与B.subtisSF90-5菌株发酵液调pH 2酸沉过夜,离心弃上清,沉淀用等量甲醇溶解,并用0.4 μm滤膜过滤。进样50 μL并对比原始菌株及突变株B.subtisSF90-5在214 nm下的出峰图,由图7可以看出,原始菌株中surfactin产量为0.12 g/L,而突变株中surfactin含量则达到0.8 g/L,是原始菌株的7倍,在目前已发文献中同样处于较高水平,使用价值较强。

图7 原始菌株与B. subtis SF90-5 HPLC检测surfactin对比图Fig.7 HPLC profile of surfactin produced by parent strain and B. Subtilis SF90-5
2.3.2B.subtilisSF90-5突变株的遗传稳定性检测
为了验证所获突变菌株的遗传稳定性,将诱变所得B.subtilisSF90-5菌株用固体种子平板连续传代5次,对5代菌株进行摇瓶发酵;同时对-85 ℃甘油管保存3个月的B.subtilisSF90-5菌株经活化后进行摇瓶发酵,结果见表1。由表1可知,在连续传代培养后发酵液排油能力均在7.5左右,HPLC检测所得产量均在0.8 g/L左右,表明诱变所得菌株B.SubtilisSF90-5具有良好的遗传稳定性。

表1 B. subtilis SF90-5菌株的遗传稳定性生物表面活性检测
3 讨论
本研究采用的诱变方式为常温常压等离子体(ARTP)诱变,ARTP是近些年来新兴的一种诱变处理方式,其具有处理温度低、常压下就可产生高活性等离子体射流等优点。高活性的等离子体射流通过改变细胞膜通透性从而引起细胞基因损伤最终使其产生突变[20-21]。原始菌株在平板培养时菌落中间会有凸起,对突变株进行产surfactin验证发现,突变株形态与原始株相似时surfactin产量较高,而当突变株菌落形态中间凸起消失,与原始菌形态差异较大时发酵不产或少产surfactin。WANG等人在阿维菌素链霉菌的ARTP诱变中发现了经ARTP诱变后的菌体形态与产量之间有着一定的相关性[22],与本研究中枯草芽孢杆菌经ARTP诱变后,菌落形态与脂肽产量具有的相关性现象类似。因此,在诱变后首先以简单表型初筛作为筛选依据可减少工作量,提高筛选效率[23]。
诱变育种与基因工程育种不同,ARTP引起细胞基因突变的效率虽高但却有着很大的随机性,因此大量的筛选工作是在诱变后获得目的菌株的关键。高通量作为近年来比较热门的一种研究思路,孔板在经过选型、装液量及孔间平行性等预实验之后可以完美代替摇瓶的工作,改善了摇瓶筛菌中工作量大,通量小等问题,短期内使筛选通量增加数十倍。多孔板的应用必然要结合高速快捷的检测方法才能有效提高工作效率,真正实现高通量筛选。血平板法能有效在初筛过程中排除不产surfactin或产surfactin较少的菌株,CPC-BTB法可快速对枯草芽孢杆菌产surfactin的能力进行评定,2种方法的使用极大程度加快了筛选的进度。但CPC-BTB法并不能十分精确地对产物进行定量,该方法只能作为经过简单初筛后快速筛选出产surfactin能力较强的菌株的依据,后续仍需通过传统检测方式对所筛选出的突变株进行摇瓶复筛并检测产量。现阶段深孔板摇床的使用已解决高通量发酵的问题,但为进一步加快筛菌速率,产物的快速检测方法仍需进一步完善。
本研究旨在提供一种高效快捷的高通量诱变筛选流程。通过ARTP诱变结合高通量筛菌的方式成功获得脂肽高产菌株B.SubtilisSF90-5。其发酵产量达到0.8 g/L,这为进一步的发酵工艺放大提供了有利的先导条件,为surfactin的进一步研究提供了重要基础。而surfactin的产量与多种不同因素有关,除了菌种诱变外,发酵工艺的优化对其产量的提高也相当重要,同时易产泡的特性对surfactin发酵过程的稳定进行造成了一定困难,因此更高效的发酵模式的提出对surfactin的大规模生产也有着重要的影响。
[1] 侯红漫, 靳艳, 金美芳, 等. 环脂肽类生物表面活性剂结构、功能及生物合成[J]. 微生物学通报, 2006, 33(5):122-128.
[2] MAIRA T S S, CLEIDE M F S, ALVARO S L, et al. Integral production and concentration of surfactin fromBacillussp.ITP-001 by semi-batch foam fractionation[J]. Biochemical Engineering Journal, 2015, 104(15):91-97.
[3] WEI Yu-hong, WANG Li-chuan, CHEN Wei-chuan, et al. Production and characterization of Fengycin by indigenousBacillussubtilisF29-3 originating from a potato farm[J]. International Journal of Molecular Sciences, 2009, 11(11):4 526-4 538.
[4] 龚谷迪, 周广田, 郭阳, 等. 脂肽surfactin、iturin、fengycin性质鉴定的研究与展望[J]. 中国食品添加剂, 2013, 3(3):211-215.
[5] 黄翔峰, 詹鹏举, 陆丽君, 等. 培养基中铁离子对枯草芽孢杆菌 CICC 23659发酵产脂肽的影响研究[J]. 中国生物工程杂志, 2013, 33(6):52-61.
[6] 魏浩. 淀粉液化芽抱杆菌ES一2抗菌脂肽生产工艺的研究[D]. 南京:南京农业大学, 2011:18-27.
[7] 闫冬, 韩金至, 别小妹, 等. 原生质体融合选育高产脂肽LI-F-多粘类芽胞杆菌及融合菌株表达差异分析[J]. 生物工程学报, 2015, 31(9):1 401-1 407.
[8] YAO Shu-lin, ZHAO Sheng-ming, LU Zhao-xin, et al. Control of agitation and aeration rates in the production of surfactin in foam overflowing fed-batch culture with industrial fermentation[J]. Rev Argent Microbiol, 2015, 47(4):344-349.
[9] ZHU Ling-yan, XU Qing, JIANG Ling, et al. Polydiacetylene-based high-throughput screen for surfactin producing strains ofBacillussubtilis[J]. Plos One, 2014, 9(2):1-9.
[10] 金丽华, 方明月, 张翀, 等. 常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J]. 生物工程学报, 2011, 27(3):461-467.
[11] 谭俊. 基于多尺度创新原理的工业微生物高通量筛选平台构建及应用领域[D]. 上海: 华东理工大学, 2012:26-39.
[12] MORIKAWA M, HIRATA Y, IMANAKA T. A study on the structure function relationship of lipopeptide biosurfactants[J]. Biochimica et Biophysica Acta, 2000, 14(3):211-218.
[13] YANG Huan, LI Xu, LI Xue, et al. Identification of lipopeptide isoforms by MALDI-TOF-MS/MS based on the simultaneous purification of iturin, fengycin, and surfactin by RP-HPLC[J]. Analyticaland Bioanalytical Chemistry, 2015, 407(10):2 529-2 542.
[14] YANG Huan, YU Hui-min, SHEN Zhong-yao. A novel high-throughput and quantitative method based on visible color shifts for screeningBacillussubtilisTHY-15 for surfactin production[J]. Journal of Industrial Microbiology, 2015, 42(8):1-9.
[15] 蔡聪, 姜婷, 郑兆娟, 等. 等离子体诱变凝结芽孢杆菌提高木糖利用能力高产L-乳酸[J]. 食品科学, 2014, 35(1):125-130.
[16] 唐小玲. 脂肽高产菌株的ARTP诱变选育、发酵优化及鉴定[D]. 开封: 河南大学, 2015: 32-33.
[17] ZHAO Shu-lin, MENG Li-zhen, JIANG Yi-min, et al. Study on the spectrophotometric determination of anionic surfactants with bromothymol blue-cetylpyridinium chloride[J]. Journal of Yunnan University (Natural Sciences), 1999, 21(3):80-81.
[18] WANG Yong-sheng, LI Gui-rong, LU Chang-yin, et al. Study on the chromogenic reaction of anionic surfactants with quaternary ammonium salts and sulphonphthalein dyes and its applications[J]. Environmental Chemistry, 1997, 5(3):5-14.
[19] 曹小红, 蔡萍, 李凡, 等. 利用响应面法优化BacillusnattoTK-1产脂肽发酵培养基[J]. 中国生物工程杂志, 2007, 27(4):59-65.
[20] 邢新会, 王立言, 赵洪新, 等. 一种利用等离子体对微生物进行诱变育种的方法:200810116220.5[P]. 2008. 07. 07.
[21] WANG Li-yan, ZHAO Hong-xin, XING Xin-hui, et al. Study on the mutation breeding of theStreptomycesavermitiliswith atmospheric-pressure non-equilibrium plasmas[J]. Proceedings of the end International Symposium on Advanced Biological Engineering and Science (ISABES-2), 2008, 31(1):199-200.
[22] WANG Li-yan, HUANG Zi-liang, LI Guo, et al. Novel mutation breeding method forStreptomycesavermitilisusing an atmospheric pressure glow discharge plasma[J]. Journal of Applied Microbiology, 2010, 108(3):851-858.
[23] A RAJKARNIKAR H J, KWON Y W, RYU, et al. Catalytic domain of Afskav modulates both secondary metabolism and morphologic differentiation inStreptomycesavermitilisATCC 31272[J]. Current Microbiology, 2006, 53(3):204-208.
李光1,唐小玲1,韦璇3,朱学亮1,张勇2,张乐乐2,陈双喜1*
1(河南大学 生命科学学院, 河南 开封,475000) 2(无锡源清天木生物科技有限公司,江苏 无锡,214000)3(沈阳师范大学 生命科学学院,辽宁 沈阳,110000)
High-throughput screening ofBacillussubtilismutants with high yield of surfactinby ARTP
LI Guang1, TANG Xiao-ling1, WEI Xuan3, ZHU Xue-liang1,ZHANG Yong2, ZHANG Le-le2, CHEN Shuang-xi1*
1(School of Life Science, Henan University, Kaifeng 475000, China)2(Wuxi Tmaxtree Biotechnology Co., Ltd, Wuxi 214000, China)3(College of Life Science, Shenyang Normal University, Shenyang 110034, China)
In this study,ARTP(atmospheric pressure and room temperature plasma, ARTP) method was used to obtain rapid mutagenesis ofBacillussubtilisE7 in atmospheric pressure and room temperature, to screen strain with high yield of surfactin. Several methods such as appearance screening, determination of diameter of hemolytic circle, culture in Microflask, detection by multifunctional enzyme standard detector, and shake flask test were combined to improve screening throughput and speed up screening process. A high-throughput screening system for mutant strain with high yield of surfactin was preliminarily built.High performance liquid chromatography (HPLC) was used to detect target product. After mutagenesis for 220 s,Bacillussubtillusstrain SF90-5 with good genetic stability was obtained. Its surfactin yield increased to 0.8 g/L, which was 5 times of that of the original strain. Mutagenesis with ARTP resulted inreduced workload,effectively increased screening flux, and accelerated screening process. Desired target strain was obtained fleetly. This experiment provided a foundation for study of strain with high yield of surfactin.
surfactin; atmospheric pressure and room temperature plasma (ARTP);Bacillussubtilis; high-throughput
10.13995/j.cnki.11-1802/ts.201702012
硕士研究生(陈双喜教授为通讯作者,E-mail:csx1231@126.com)。
2016-08-16,改回日期:2016-10-21

