发酵酸肉胆酸盐结合肽的分离纯化及初步鉴定
谢月英,李成龙,2,韦诚,朱丽娟,周才琼*
1(西南大学 食品科学学院,重庆,400715) 2(重庆啤酒股份有限公司,重庆,400715)
发酵酸肉胆酸盐结合肽的分离纯化及初步鉴定
谢月英1,李成龙1,2,韦诚1,朱丽娟1,周才琼1*
1(西南大学 食品科学学院,重庆,400715) 2(重庆啤酒股份有限公司,重庆,400715)
以传统发酵酸肉为原料,制备胆酸盐结合肽并进行初步鉴定。结果表明:磷酸盐缓冲液溶解法提取发酵20 d酸肉粗肽含量较高且胆酸盐结合能力较好。通过不同极性大孔树脂筛选,发现DA201-C对酸肉粗肽样品的吸附和解吸效果最好,纯化酸肉粗肽最佳工艺条件为上样质量浓度5 mg/mL、上样流速1.5 mL/min、洗脱流速3 mL/min、洗脱体积3.5 BV、洗脱剂体积分数75%乙醇(V/V)。进一步采用葡聚糖凝胶层析分离得到F1和F2两组分,F2组分胆酸盐结合能力较好,是由分子质量范围在265 Da~1.4 kDa的混合小肽组成,F2有高含量的疏水性和芳香族氨基酸。这可能是F2组分具有胆酸盐结合效果的原因,苯丙氨酸可能是其具有胆酸盐结合活性的关键组分。
发酵酸肉;胆酸盐结合肽;分离纯化;初步鉴定
传统发酵酸肉是以新鲜猪肉为原料,配以米粉、盐及香辛料,在自然条件下厌氧发酵而成的一种发酵肉制品[1],由于微生物的生长,在微生物胞外酶和自身存在酶系作用下,原料基质中蛋白质、脂类、糖类等大分子降解,赋予发酵食品独特的风味和营养特性[2]。微生物胞外蛋白酶可降解蛋白质产生活性肽类,如ACE抑制肽、抗血栓肽、酪蛋白磷酸肽和细胞生长调节肽等[3-5]。目前的研究显示发酵酸肉蛋白质、脂肪及胆固醇降解,并有辅助调降血脂效果,一些食物蛋白含有降血脂小肽[6-7]。为此,拟以胆酸盐结合能力为指标,采用系列提取和分离纯化方法从发酵酸肉中制备胆酸盐结合肽并进行初步鉴定,为传统发酵食品的功能化开发提供有关降血脂的基础研究数据。
1 材料与方法
1.1 原料及处理
新鲜后腿猪肉,加碘食盐及大米:重庆北碚永辉超市。大米淘洗后炒至微黄,磨粉过20目筛,备用。发酵酸肉制备:原料肉→清洗→切成厚度约4 mm片状→加调味料(盐、米粉等)→揉制装坛→密封(水封)→发酵(10~20 ℃)→成品。
1.2 主要试剂
K3PO4、酒石酸钾钠、NaH2PO4、Na2HPO4,茚三酮等,均为分析纯,成都市科龙化工试剂厂;氧化型谷胱甘肽、还原型谷胱甘肽、牛磺胆酸钠(STC),北京Solarbio公司;甘氨胆酸钠(SGC)、胆酸钠(SC),damas-beta试剂公司;乳链菌肽、杆菌肽,阿达玛斯试剂有限公司;考来烯胺,上海永叶生物科技有限公司。
D101大孔树脂、NKA-9极性大孔树脂,成都市科龙化工试剂厂;AB-8大孔树脂、DA201-C大孔树脂,上海摩速科学器材有限公司;SephadexG-25凝胶,Pharmacia公司;乙腈色谱纯,上海泰坦科技有限公司。
1.3 主要仪器设备
DZF-6020真空干燥箱,上海齐欣科学仪器有限公司;Avanti J-30I贝克曼冷冻离心机,美国贝克曼库尔特公司;ALPHA1-4LSC真空冷冻干燥机,德国Christ公司;UV-2450紫外分光光度计,日本岛津公司;DBS-100电脑全自动部分收集器,上海沪西分析仪器厂有限公司;日立L-8800氨基酸全自动分析仪,日本HITACH公司。
1.4 实验方法
1.4.1 肽提取及胆酸盐结合能力分析
1.4.1.1 盐酸溶解法[8]提取肽
取不同发酵时段酸肉,剔除可见脂肪和筋膜,生理盐水去脂后切碎,称取50 g入三角瓶中,加入200 mL 0.01 mol/L HCl溶液,高速匀浆6次(15 000 r/min,每次15 s,间隔10 s),然后置冷冻离心机(4 ℃,8 000 r/min)离心25 min,离心后取上清液过滤,加入约3倍体积40%(V/V)乙醇,4 ℃放置12 h,再次离心(4 ℃,8 000 r/min,20 min),取上清液在旋转蒸发仪中真空浓缩,浓缩干燥后溶于去离子水,经真空冷冻干燥48 h制成干粉,-20 ℃保存备用。
1.4.1.2 磷酸盐缓冲液溶解法[9]提取肽
取不同发酵时段酸肉,剔除可见脂肪和筋膜,生理盐水洗去脂肪后切碎,称取50 g入三角瓶,加入150 mL 0.2 mol/L pH=7.2磷酸盐缓冲液,高速匀浆4次(18 000 r/min,每次10 s,间隔10 s),静置20 min后,4 ℃,8 000 r/min,离心25 min,离心后取上清液过滤,加入约3倍体积40%(V/V)乙醇,4 ℃放置12 h,再次离心(4 ℃,8 000 r/min,20 min),取上清液旋转蒸发仪真空浓缩后经真空冷冻干燥48 h制成干粉,-20 ℃保存备用。
1.4.1.3 结合胆酸盐能力分析
根据参考文献[10]略作修改。粗肽样品用纯水配成5 mg/mL溶液,取1 mL于10 mL具塞试管中;各试管加入1 mL 0.01 mol/L HCl模拟人体胃酸性环境,37 ℃恒温振荡消化1 h;以0.1 mol/L NaOH调至pH 6.3,分别加入配制好的胆酸盐标准液5 mL,恒温振荡1 h;然后转入离心管(4 000 r/min)离心20 min;取上清液2.5 mL,加入7.5 mL质量分数为60%的硫酸溶液,70 ℃水浴30 min,取出,冰浴5 min,在386 nm测定各样品吸光度,通过标准曲线计算单位质量粗肽样品结合胆酸盐能力。
1.4.2 胆酸盐结合肽的分离纯化
1.4.2.1 大孔树脂预处理及筛选[11-12]
选择不同极性大孔树脂DA201-C、AB-8、NKA-9和D101。95%乙醇浸泡24 h使充分溶胀。弃掉乙醇,蒸馏水冲洗树脂至无乙醇味,然后用2~3倍体积4%的NaOH浸泡3~5 h,用蒸馏水洗至中性,再用2~3倍体积4%的HCl浸泡3~5 h,用蒸馏水洗至中性,蒸馏水浸泡备用。
以吸附率及解吸率为指标,比较4种大孔树脂对酸肉粗肽的吸附与解析效果。分别称取5 g预处理好的大孔树脂(湿重),置100 mL锥形瓶中,加入20 mL质量浓度为5 mg/mL的酸肉粗肽溶液,于25 ℃,150 r/min摇床振荡12 h,使大孔树脂充分吸附,测定吸附前后溶液酸肉粗肽含量变化。同理,将充分吸附后的大孔树脂用滤纸吸取表面溶液,置于100 mL干燥锥形瓶中,加入20 mL 70%的乙醇解吸,在25 ℃(150 r/min)恒温摇床中振荡12 h。按公式(1)和(2)分别计算吸附率与解吸率。
(1)
式中:Q,吸附率,%;C0,多肽初始浓度,mg/mL;Ce,吸附后的溶液多肽质量浓度,mg/mL。
(2)
式中:R,解吸率,%;V1,解吸液的体积,mL;V0,原液体积,mL;C1,解吸后的多肽质量浓度,mg/mL。
1.4.2.2 DA201-C大孔树脂吸附与解吸[13]
(1)静态吸附与解吸
称取5 g DA201-C大孔树脂于100 mL干燥锥形瓶中,加入20 mL 5 mg/mL粗肽溶液,于25 ℃,150 r/min摇床中振荡5 h,每30 min取样1次,测定多肽含量,计算吸附率,绘制静态吸附曲线。称取5 g吸附充分的大孔树脂,用滤纸吸干表面溶液,置100 mL干燥锥形瓶中,加入20 mL 70%乙醇,于25 ℃,150 r/min摇床中振荡5 h,每30 min取样1次,测定多肽浓度,以时间为横坐标,解吸量为纵坐标绘制解吸曲线。
(2)动态吸附与解吸
a.上样浓度: 将不同浓度粗肽溶液以1 mL/min速度上样,待吸附4 h后,分别取吸附后的溶液测吸附率,确定最佳上样浓度。
b.上样流速: 将质量浓度为5 mg/mL粗肽液10 mL以不同上样流速进样,待吸附4 h后,取吸附后溶液测定多肽吸附率,以确定最佳上样流速。
c.洗脱剂浓度: 在径高1.6 cm×100 cm层析柱中装入预处理的DA201-C大孔树脂,湿法上柱,让其自然沉降得柱高约80 cm,柱床体积(BV)约160 mL树脂固定床。控制恒流泵以1.5 mL/min上样速度进样浓度为5 mg/mL的样品溶液10 mL,待树脂吸附饱和后,分别用25%、50%、75%、100%体积分数乙醇以2 mL/min流速进行洗脱,测定不同体积分数乙醇洗脱液解吸量,确定最佳洗脱液体积分数,并测定各体积分数乙醇洗脱液解吸物质的胆酸盐结合能力。
d.洗脱流速: 将质量浓度为5 mg/mL粗肽液10 mL以1.5 mL/min上样流速进样,待树脂吸附饱和,用体积分数75%乙醇以不同流速进行洗脱,确定最佳洗脱流速。
e.洗脱体积:在径高1.6 cm×100 cm层析柱中装入预处理的大孔树脂,湿法上柱,让其自然沉降得柱高约80 cm,柱床体积约160 mL树脂固定床。控制恒流泵以1.5 mL/min进样速度上样5 mg/mL的样品液10 mL,待树脂吸附饱和后用75%乙醇以3 mL/min流速进行洗脱,直到不再有多肽析出,确定最佳洗脱液体积。
1.4.2.3 葡聚糖凝胶Sephadex G-25分离纯化
取适量葡聚糖凝胶,用约5倍体积超纯水浸泡24 h,弃上层悬浮物,沸水浴1 h,使其充分溶胀后除去上层细小颗粒,用超纯水洗涤2~3次,真空泵除气泡备用。取预处理好的葡聚糖凝胶,加入适量超纯水,边搅拌边将均匀的凝胶液倒入层析柱中,打开出水口,使其自然沉降,待凝胶柱高约60 cm时,停止装柱,关闭出水口。将经DA201-C大孔树脂纯化组分用超纯水配成5 mg/mL溶液,经0.45 μm微孔滤膜过滤后,取5 mL上样进行分离,洗脱流速0.5 mL/min,洗脱组分分管收集,每管收集6 min,220 nm检测。重复上样,相应组分峰各试管洗脱组分合并,经旋转蒸发和真空冷冻干燥制成干粉,测定各组分峰洗脱物质胆酸盐结合效果。
1.4.2.4 肽浓度的测定
双缩脲法[14]。以Gly-Gly-Tyr-Arg四肽标品绘制标准曲线,经拟合回归方程为:y=0.354 2x+0.000 6,R2=0.996 1。
1.4.3 胆酸盐结合肽初步鉴定
1.4.3.1 分子量[15]
将已知分子量的氧化型谷胱甘肽GSSG(M612)、还原型谷胱甘肽GSH(M307)、乳链菌肽(M3510)、杆菌肽(M1422)分别溶于超纯水,配成浓度为5 mg/mL标准品溶液,将4种标准品混合均匀,取5 mL上样分离,洗脱流速0.5 mL/min,每管收集6 min,220 nm检测。以标准品的分子量对数为纵坐标,以保留时间为横坐标绘制标准曲线。
1.4.3.2 反相高效液相色谱(RP-HPLC)分析
用超纯水将胆酸盐结合肽配成5 mg/mL溶液,利用RP-HPLC分析。色谱条件:检测波长:220 nm;色谱柱:Kromasil C18色谱柱(4.6 mm×250 mm,5 μm);柱温:35 ℃;进样量:10 μL;流动相:A:超纯水(过0.45 μm滤膜)B:乙腈(过0.45 μm滤膜);洗脱流速:1 mL/min;洗脱条件:0~5 min,0%~10% B,5~10 min,10%~20% B,10~15 min,20%~40% B,15~20 min,40%~20% B,20~25 min,20%~10% B,25~30 min,10%~0% B。
1.4.3.3 氨基酸组成分析
(1)水解样品前处理:准确称取样品0.110 0 g于15 mm×150 mm试管中,向试管中加入10 mL浓度为6 mol/L的HCl,振荡混匀。用酒精喷灯把该试管口下1/3处拉细到4~6 mm,抽真空10 min后密封试管。将处理过的试管置于110±1 ℃恒温烘箱中沙浴水解22 h,取出冷却至室温,摇匀后过滤,取1 mL滤液于50 mL烧杯中,60 ℃恒温水浴蒸干,用0.02 mol/L HCl将其稀释4倍,用0.22 μm滤膜过滤,上机分析。
(2)未水解样品前处理:准确取样品0.180 0 g于5 mL塑料离心管中,加入4 mL 4%磺基水杨酸溶液,超声30 min,冰箱静置过夜,15 000 r/min离心4 min,稀释8倍后用0.22 μm滤膜过滤上机分析。
(3)全自动氨基酸分析条件:分离柱(4.6 mm×60 mm):洗脱液流速0.4 mL/min,柱温70 ℃,柱压11.627 MPa ;反应柱:茚三酮及茚三酮缓冲液流速0.35 mL/min,柱温135 ℃,柱压1.078 MPa。
1.5 数据处理
2 结果与分析
2.1 不同发酵时段粗肽提取
如图1,2种提取方法均以发酵20 d酸肉粗肽得率最高,以磷酸盐缓冲液法最高为2.28%,是盐酸溶解法的1.56倍。经对所得粗肽纯度进行测定,磷酸盐缓冲液提取法所得粗肽纯度40.1%,稍高于盐酸溶解法的38.2%。后续研究选择磷酸盐缓冲液提取酸肉粗肽。
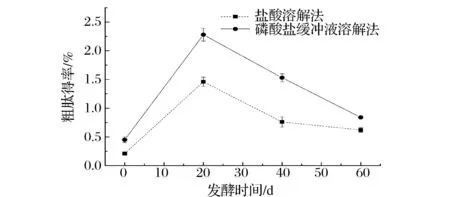
图1 不同发酵时段酸肉粗肽得率Fig.1 The crude peptide yield of sour meat in different fermentation time
2.2 不同发酵时段粗肽胆酸盐结合能力
如图2,发酵20~40 d酸肉粗肽对3种胆酸盐吸附量明显高于其他发酵时段(P<0.05)。各发酵时段粗肽对甘氨胆酸钠和胆酸钠结合效果优于对牛磺胆酸钠结合效果。发酵20 d粗肽胆酸钠、牛磺胆酸钠和甘氨胆酸钠吸附能力分别是其他发酵时段的1.1~4.6倍、1.1~2.1倍和1.2~1.9倍。后续采用发酵20 d酸肉进行分离纯化和肽的初步鉴定。

图2 不同发酵时段酸肉粗肽胆酸盐结合能力Fig.2 The binding capacity of crude peptide from different fermentation time sour meat on bile acid salt
2.3 胆酸盐结合肽的分离纯化
2.3.1 大孔树脂的筛选
按1.4.2.1处理树脂,吸附与解吸效果如表1,非极性及弱极性的3种大孔树脂吸附及解吸效果均明显好于极性的NKA-9,说明酸肉粗肽样品疏水性较高。其中DA201-C解吸与吸附效果均最好。后续实验选择DA201-C大孔树脂作为粗肽进一步分离纯化材料。
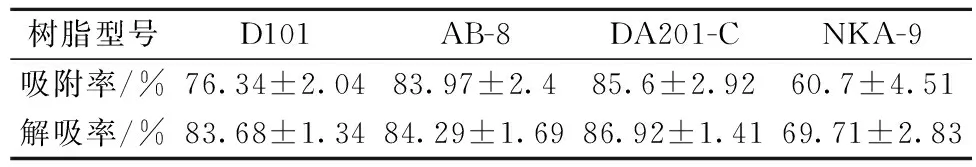
表1 不同树脂对酸肉粗肽的吸附解吸效果
2.3.2 DA201-C大孔树脂的静态吸附与解吸
如图3,DA201-C大孔树脂在0~4 h内对样品吸附率较快,随时间延长快速增加,约4 h时对样品吸附趋缓而接近平衡,选择4 h为适宜的静态吸附时间。相对于吸附率变化来说,DA201-C大孔树脂样品解吸速率较快,1.5 h时解吸趋于完全,3.5 h后解吸达到平衡,如图4,选择3.5 h为合适的解吸时间。

图3 吸附时间对吸附率的影响Fig.3 The effect of absorption time on adsorption
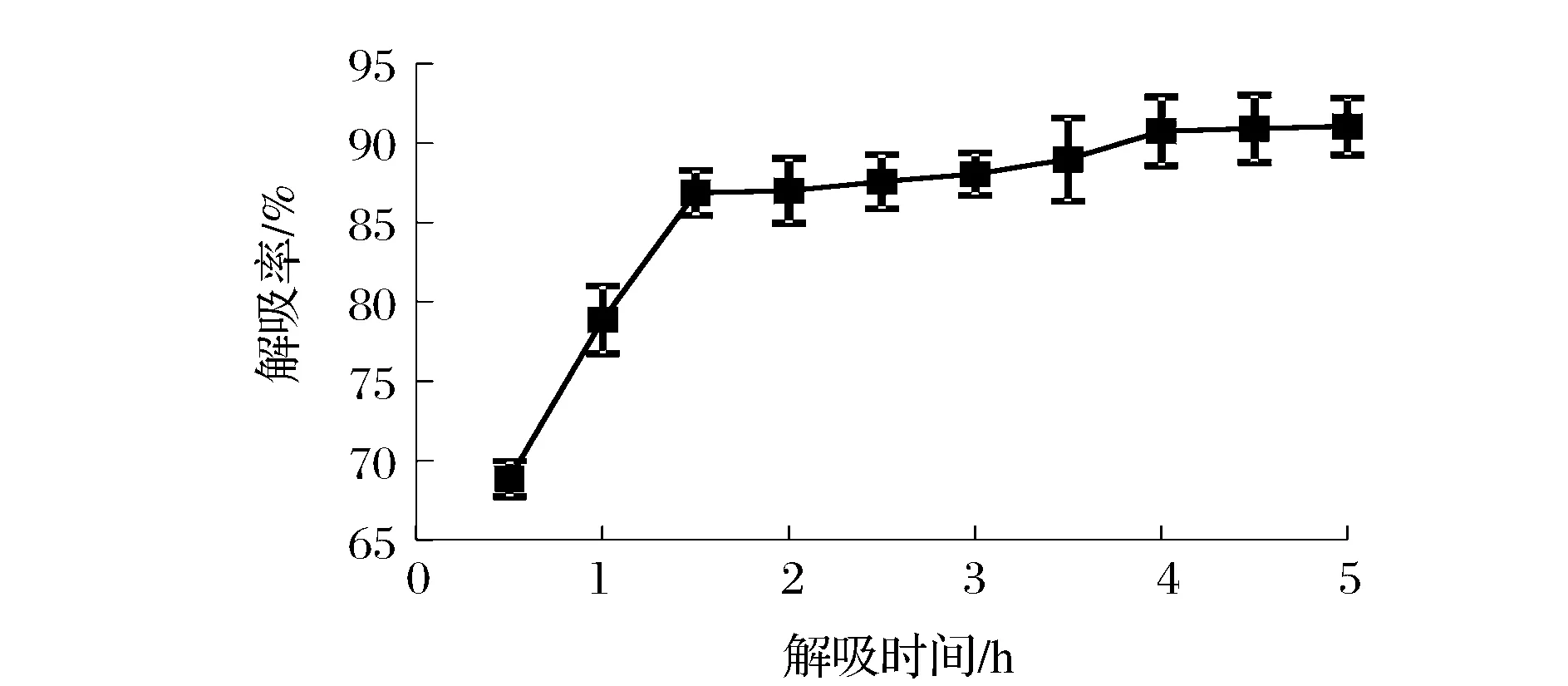
图4 解吸时间对解吸率的影响Fig.4 The effect of desorption time on desorption
2.3.3 DA201-C大孔树脂的动态吸附与解析
2.3.3.1 动态吸附
如图5,多肽吸附率随粗肽浓度升高快速增加后趋缓,考虑到大孔树脂利用率及后续的解吸和树脂再生等,选择5 mg/mL为适宜上样浓度。如图6,树脂对样品吸附率随上样流速增加逐渐降低,综合考虑选择1.5 mL/min为合适上样流速。

图5 上样质量浓度对吸附率的影响Fig.5 The effect of concentration of crude peptide on adsorption
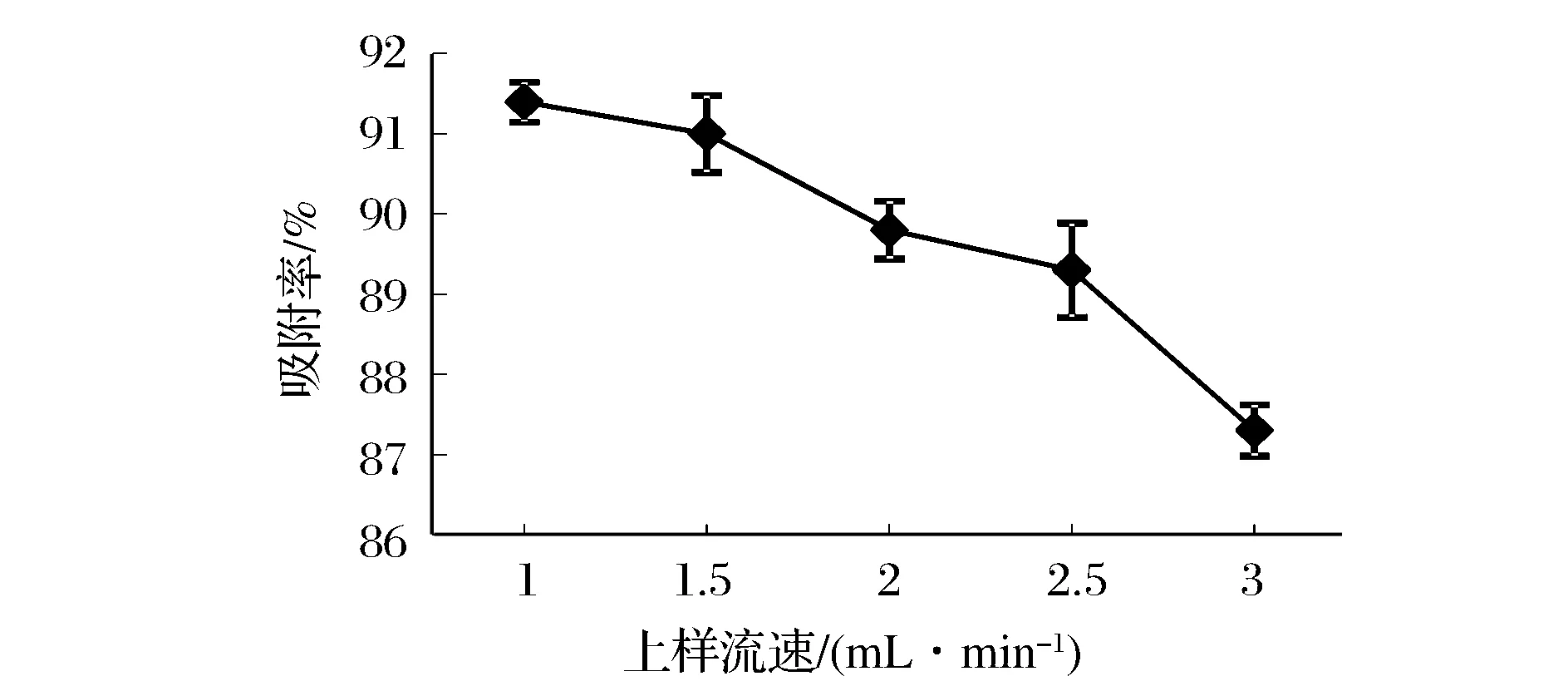
图6 流速对吸附率的影响Fig.6 The effect of sample flow velocity on adsorption
2.3.3.2 动态解吸
如图7,随乙醇体积分数增加,多肽解吸率快速增加后略降,体积分数75%的乙醇效果最好。洗脱流速对解吸率的影响显示洗脱流速2~3 mL/min解析效果较好,选择3 mL/min为最佳洗脱流速,如图8。进一步以体积分数75%乙醇进行洗脱体积实验,其解吸效果与用量成正比,随洗脱剂用量增加解吸率越大,当洗脱剂用量为3.5 BV时,解吸率趋于平衡,从节省试剂角度考虑,选择3.5 BV为最佳洗脱剂用量,如图9。
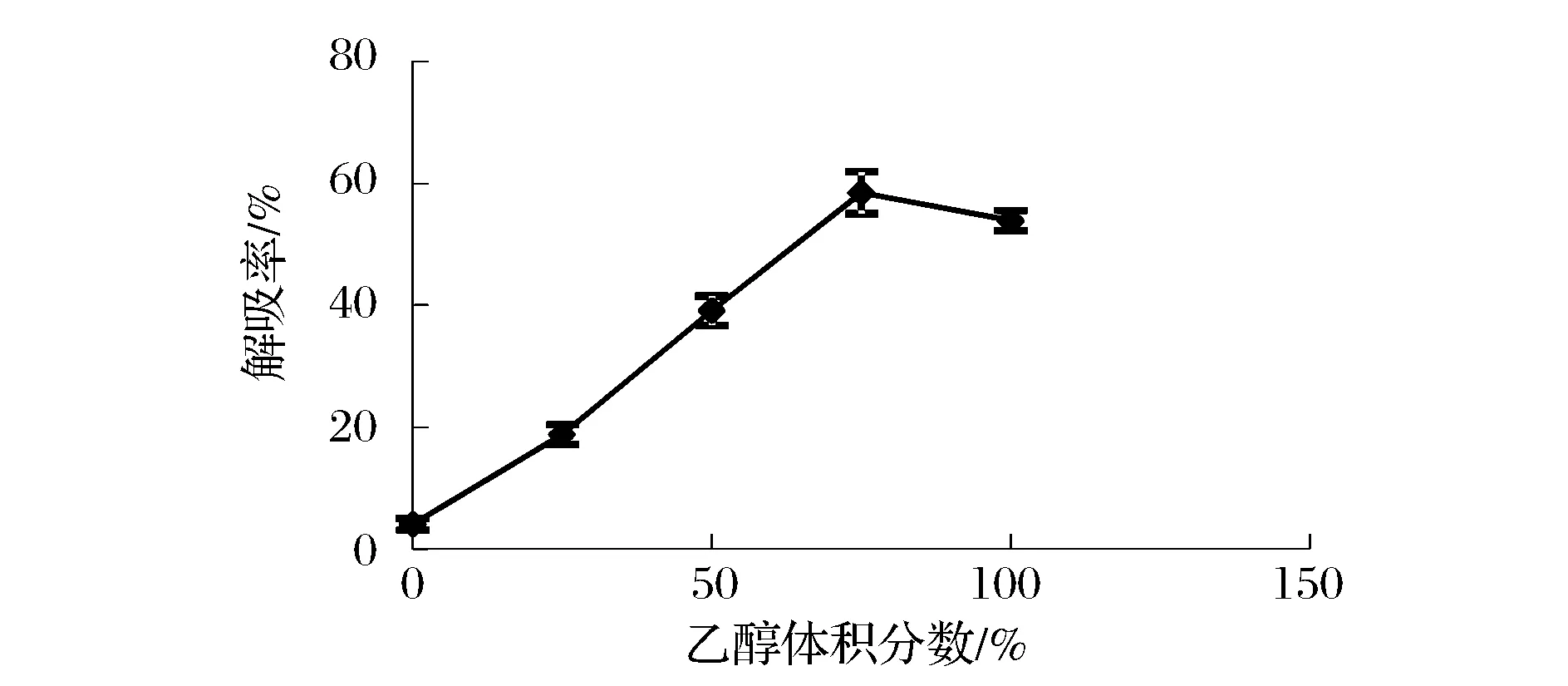
图7 乙醇体积分数对解吸率的影响Fig.7 The effect of ethanol concentration on desorption

图8 洗脱流速对解吸率的影响Fig.8 The effect of concentration of elution velocity on desorption

图9 洗脱体积对解吸率的影响Fig.9 The effect of elution volume on desorption
将经上述实验优化后收集的不同乙醇浓度洗脱组分经旋转蒸发和真空冷冻干燥制成干粉。将多肽干粉用纯水配成5 mg/mL溶液,按1.4.1.3方法测定胆酸盐结合能力。结果如图10。75%乙醇洗脱组分对胆酸盐结合效果显著高于其他处理(P<0.05),其对胆酸钠、牛磺胆酸钠、甘氨胆酸钠吸附能力分别是粗肽的1.4、1.6和1.3倍。

图10 不同体积分数乙醇洗脱组分的胆酸盐结合效果Fig.10 The binding effect of elution component through different volume fraction ethanol on bile acid salt
2.3.4 葡聚糖凝胶Sephadex G-25分离纯化
DA201-C大孔树脂75%乙醇洗脱组分经SephadexG-25葡聚糖凝胶层析后,洗脱得2个组分,分别为F1和F2(图11)。收集各组分,经旋转蒸发和真空冷冻干燥制成干粉,测定各组分肽含量及胆酸盐结合能力。结果如表2。F2胆酸盐结合能力增加,是F1结合能力的1.7倍,相当于考来烯胺结合量的28.07%。表明具有高胆酸盐结合活性的肽主要集中于F2组分中。
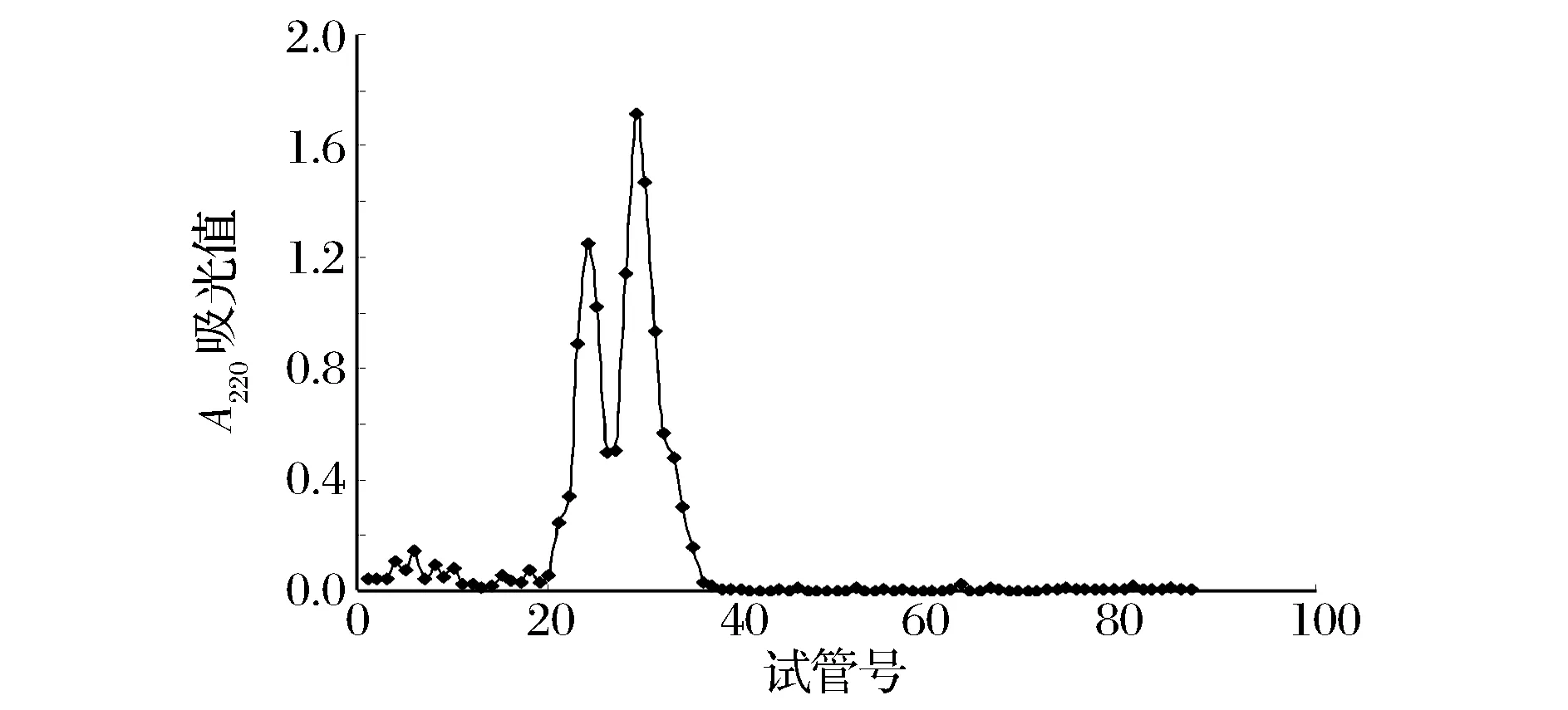
图11 胆酸盐结合肽的Sephadex G-25层析分离结果Fig.11 Sephadex G-25 chromatography results of bile acid salt binding peptide
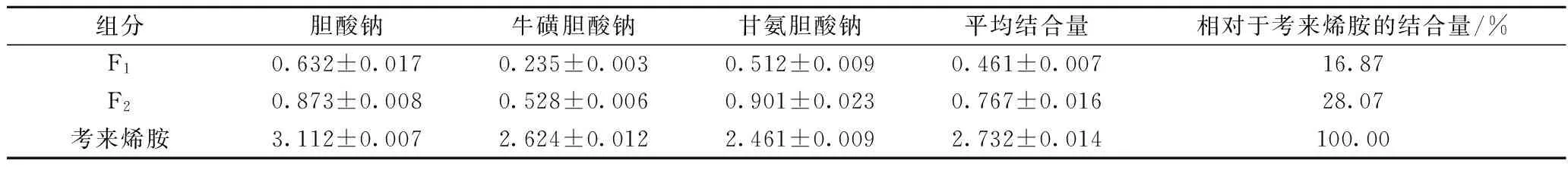
Table 2 The binding effect of chromatography separation component on bile acid salt
2.4 胆酸盐结合肽初步分析
经分析F2组分分子量范围265 Da~1.4 kDa,表明为小肽。进一步进行RP-HPLC分析,主要出现6个峰(图12),说明F2组分是由几种小肽组成的混合物,有待进一步纯化。
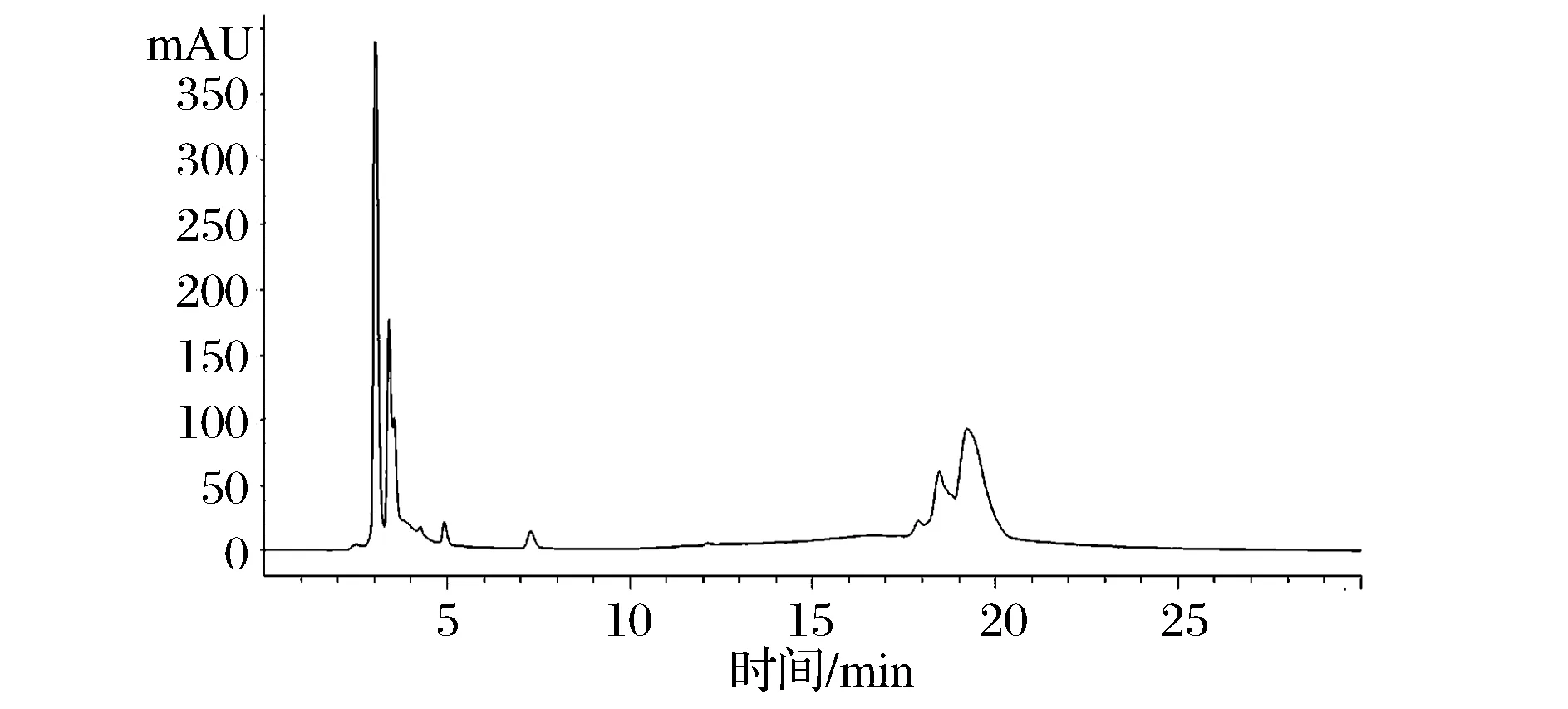
图12 RP-HPLC分离F2组分图谱Fig.12 The RP-HPLC map of component F2
经对F2水解前和水解后氨基酸组成进行分析,结果如表3,F2中肽占比为75.7%,含少量游离氨基酸,占比24.3%;游离氨基酸和肽中疏水值较高的苯丙氨酸和亮氨酸,合计含量分别为2.93 g/100 g和8.40 g/100 g。组成肽的含量较高的氨基酸有组氨酸、苯丙氨酸、谷氨酸、缬氨酸和亮氨酸,占比53.8%。含量和疏水值较高的有苯丙氨酸、亮氨酸、酪氨酸和缬氨酸,占比35.3%,表明F2的胆酸盐结合能力主要受肽的影响。这与报道的疏水性和芳香族氨基酸肽段有较强胆酸盐结合能力及NAGAOKA等[16]报道的胆酸盐结合肽富酪氨酸吻合。考虑苯丙氨酸疏水性及含量,可能是F2有胆酸盐结合活性的关键组分。
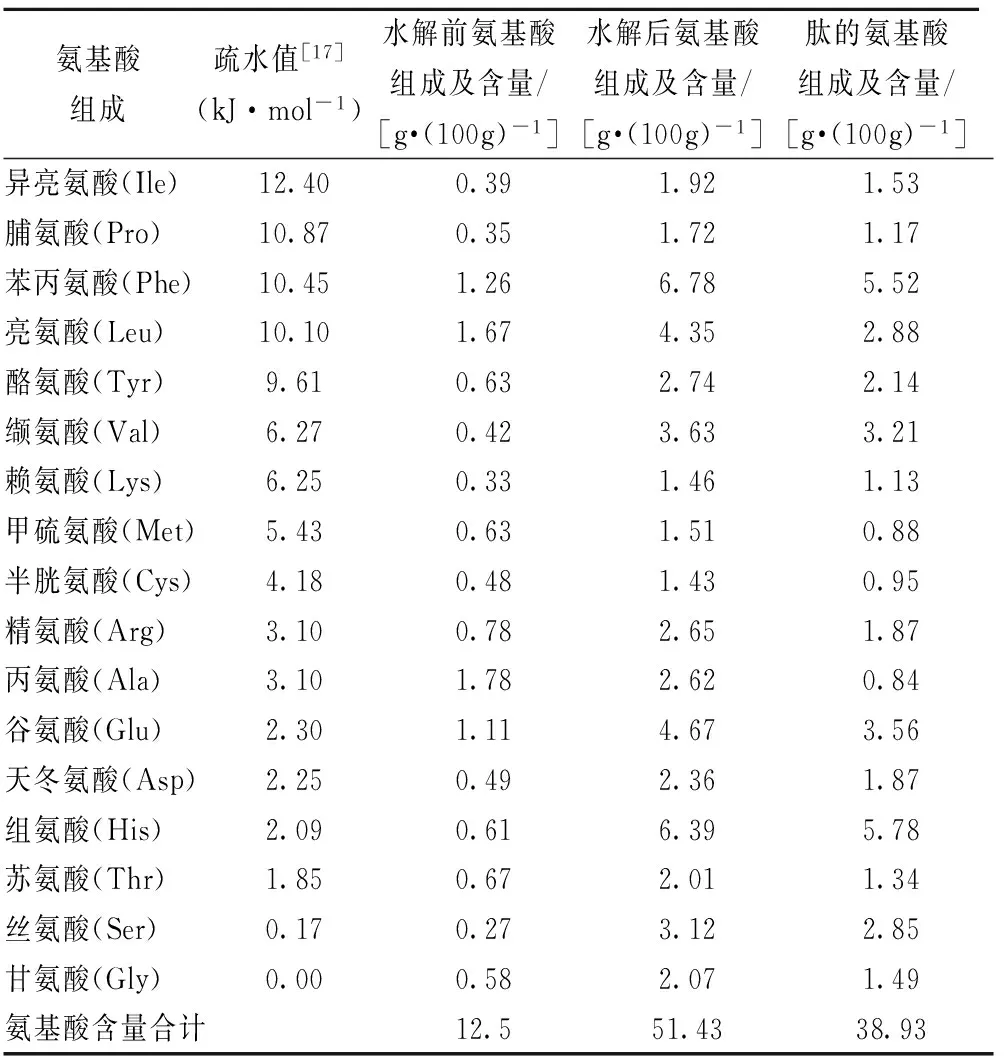
表3 F2组分氨基酸组成与含量分析
注:F2多肽氨基酸组成=F2水解后氨基酸组成-F2水解前氨基酸组成
3 结论
在不同发酵时段和不同提取方法研究中,以磷酸盐缓冲液溶解法提取发酵20 d酸肉得率最高,胆酸盐结合能力较好,其中对牛磺胆酸钠结合能力相对较弱。后续在胆酸盐结合肽分离纯化中,以胆酸盐结合能力为指标对发酵20 d酸肉中粗肽进行分离纯化。
通过不同极性大孔树脂筛选,发现DA201-C对酸肉粗肽样品的吸附和解吸效果最好,选择作为初步纯化胆酸盐结合肽的材料。通过静态吸附-解吸和动态吸附-解吸实验确定了DA201-C大孔树脂纯化酸肉粗肽最佳工艺条件:上样浓度5 mg/mL、上样流速1.5 mL/min、洗脱流速3 mL/min、洗脱体积3.5 BV、洗脱剂体积分数75%乙醇(V/V)。经DA201-C大孔树脂纯化后,酸肉粗肽体外胆酸结合相比粗肽,其对胆酸钠、牛磺胆酸钠、甘氨胆酸钠吸附能力分别是粗肽的1.4、1.6和1.3倍。
进一步采用葡聚糖凝胶层析分离得到F1和F2两组分,F2组分胆酸盐结合能力较好。经对其分子量、RP-HPLC和氨基酸组成分析显示,F2是由分子量范围在265 Da~1.4kDa的几个小肽组成的混合肽,有待进一步纯化。氨基酸分析显示F2含少量游离氨基酸,肽的氨基酸含量占比75.7%,其中含量和疏水值较高的有苯丙氨酸、亮氨酸、酪氨酸和缬氨酸。通过与相关文献比较,高含量的疏水性和芳香族氨基酸,可能是F2组分具有胆酸盐结合效果的原因,具体到氨基酸,苯丙氨酸可能是其具有胆酸盐结合活性的关键组分。
[1] 李宗军,江汉湖,李红琼.中国传统酸肉生产工艺探讨[J].湖南农业大学学报, 2001(4): 31-34.
[2] 李里特,马艳莉.发酵食品酿造过程中组分和营养功能因子的变化和调控[J].中国食品学报, 2011, 11(9):82-92.
[3] CHOI J W. Bioactive peptides in dairy products[J].International Journal of Dairy Technology,2012,65(1):1-12.
[5] NIELSENM S, MARTINUSSEN T, FLAMBARD B, et al.Peptide profiles and angiotensin-I-converting enzyme inhibitory activity of fermented milk products: Effects of bacterial strain, fermentation pH, and storage time[J].International Dairy Journal, 2009(19):155-165.
[6] 卫飞.不同发酵时段酸肉对实验小鼠血脂的影响研究[D].重庆:西南大学,2012.
[7].陈东华.酸腌肉的营养及安全性研究[D].重庆:西南大学,2008.
[8] 胡亚亚,邢路娟,周光宏,等.不同提取方法对金华火腿粗肽液抗氧化活性的影响[J].食品工业科技, 2015, 36(14):115-118.
[9] 邢路娟,胡亚亚,周光宏,等.宣威火腿中粗肽的提取与抗氧化活性鉴定[J].南京农业大学学报, 2015, 38(4):661-666.
[10] 陈雅蕙,余瑞元.生物化学实验原理和方法[M].第2版.北京:北京大学出版社,2005: 262-267.
[11] 宋倩,赵声兰,刘芳,等.大孔吸附树脂分离纯化核桃壳总黄酮[J].食品与发酵工业, 2012,38(12):180-184.
[12] 赵芳春,赵兵,黄云祥.大孔吸附树脂纯化芦笋皂苷工艺优化[J].食品工业科技,2012,33(18):248-252.
[13] 杨晓艳,马骥,彭飞,等.大孔树脂法分离纯化荚果蕨总三萜[J].食品工业科技, 2015,36(2):238-242.
[14] 冯雅蓉,马俪珍,李黎. SephadexG-25对羊骨胶原降血压肽的分离纯化效果研究[J].肉类研究, 2011(6):30-33.
[15] 于娜.卵黄多肽的分离纯化及降血脂活性研究[D].沈阳:沈阳农业大学, 2012.
[16] NAGAOKA S, NAKAMURA A, SHIBATA H,et al. A novel bile acid-binding peptide, decreased micellar solubility and inhibited cholesterol absorption in rats[J]. Bioscience Biotechnology and Biochemistry, 2010, 74(8):1 738-1 741.
[17] 张晓梅,钟芳,麻建国.大豆降胆固醇活性肽的初步分离纯化[J].食品与机械,2006(2):33-37.
Purification and preliminary identification of bile acid salt binding peptide from fermented sour meat
XIE Yue-yin1, LI Cheng-long1,2, WEI Cheng1, ZHU Li-juan1, ZHOU Cai-qiong1*
1(Food Science College, Southwest University, Chongqing 400715,China)2(Chongqing Beer,Chongqing 400715,China)
The cholate binding peptides was prepared and preliminarily identified by using traditional fermented sour meat as raw material. Results showed that the extraction rate of phosphate buffer solution was the highest, the content of crude polypeptide was higher and the binding ability of cholate was better after fermentation for 20 d. It was found that the effect of DA201-C on the adsorption and desorption of acidic crude peptide was the best through screening of different polar macroporous resins. The optimal conditions for the purification of acidic crude peptide with DA201-C macroporous resin were as follows:sample concentration of 5 mg/mL, sample flow rate of 1.5 mL/min, elution flow rate of 3 mL/min, elution volume of 3.5 BV, elution volume fraction of 75% ethanol (V/V). Two components F1 and F2 were obtained through further separation using dextran gel chromatography, wherein the binding capacity of F2 group was better, F2 group was composed of small peptides with molecular weights ranged from 265 Da to 1.4 kDa and had a high content of hydrophobic and aromatic amino acids. This may be the reason for the binding of F2, and Phenylalanine may be a key component for its binding activity.
fermented sour meat; cholate binding peptides; separation and purification; preliminary identification
10.13995/j.cnki.11-1802/ts.201702009
硕士研究生(周才琼教授为通讯作者,E-mail:zhoucaiqiong@swu.edu.cn)。
重庆市特色食品工程技术研究中心能力提升项目(cstc2014pt-gc8001)
2016-06-07,改回日期:2016-08-06

