细菌纤维素管的发酵条件优化及结构性能研究
汤卫华,贾士儒
1(天津现代职业技术学院 生物工程学院,天津,300350) 2(天津市工业微生物重点实验室,天津,300457)
细菌纤维素管的发酵条件优化及结构性能研究
汤卫华1,贾士儒2*
1(天津现代职业技术学院 生物工程学院,天津,300350) 2(天津市工业微生物重点实验室,天津,300457)
木醋杆菌是一种革兰氏阴性专性需氧菌,采用透气管材硅胶管作为发酵容器生产细菌纤维素(Bacterial Cellulose, BC)管,实验中考察发酵培养基种类、发酵时间、接种量对BC管产量的影响。结果表明,最适发酵时间为6 d,发酵培养基为复合培养基,最适接种量为4 %(v/v)。采用FTIR、XRD对BC管的结构性能进行表征,结果发现BC管的结晶度稍低于BC膜,BC管的拉伸性能达到50.25 MPa,与BC膜相当。采用原子力显微镜(AFM)观察BC管的微观形貌,发现BC管是由纤维束高度缠绕而形成,与BC膜相比,BC管的纤维束大小相差较大,这也可能是造成BC管在结晶度和拉伸性能上稍低于BC膜的原因。该研究可为BC管在高附加值的食品包装材料、组织工程支架材料等的应用提供基础数据。
细菌纤维素管;发酵条件;优化;性能表征
细菌纤维素(bacterial cellulose,BC)是某些细菌合成的高分子化合物,具有超精细网状结构,虽然BC和植物或海藻产生的纤维素具有相同的分子结构单元,但BC却具有很多独特的性质如高结晶度、高化学纯度、高抗张强度、高弹性模量、高持水性、良好的生物相容性、生物合成的可调控性等[1-2],这些性质是其他来源的纤维无法比拟的。
基于BC生物合成具有可调控性,很多研究者探索不同发酵技术和方法合成管状BC,如BODIN[3]等人采用2种不同的发酵技术合成BC管,并探讨其作为组织工程支架血管的潜力;KLEMM[4]采用圆柱形玻璃基 (cylindrical glass matrix)作为发酵容器, BC管在玻璃基间隙形成。管状细菌纤维素的出现,不仅可以丰富细菌纤维素的品种,同时可以拓展细菌纤维素的应用领域。管状细菌纤维素将在高附加值食品包装和组织工程支架材料如人造血管和人工食管等上具有应用潜力。
作者在前期也进行了大量的BC管的研究,比较2种发酵细菌纤维素管的模式,从发酵效率等方面确定发酵模式2为生产BC管的最适方法[5]。在此基础上,本研究对BC管的发酵条件进行优化,同时对BC管性能进行的表征,以期全面把握BC管的性能,有利于其推广应用。
1 材料与方法
1.1 菌种和主要的材料
木葡糖酸醋杆菌(Gluconacetobacteroboediens),工业微生物教育部重点实验室保藏。硅胶管(Φ9 mm×6 mm、Φ16 mm×12 mm、Φ20 mm×16 mm、Φ25 mm×20 mm、Φ31 mm×25 mm):市售。
1.2 培养基
细菌纤维素合成培养基是在SON等人[6]优化的合成培养基上进行修改的,培养基组成(g/L):葡萄糖 25,(NH4)2SO410, Na2HPO43.5, KH2PO41,MgSO4·7H2O 1.0, FeSO4·7H2O 0.015,烟酸 0.003,生物素 0.02,pH 6.0,121 ℃灭菌20 min。
细菌纤维素复合培养基组成(g/L): 葡萄糖 25,酵母粉 7.5,蛋白胨 10,Na2HPO410,pH 6.0,121 ℃灭菌20 min。
1.3 BC管和BC膜的制备
1.3.1 BC 管的制备
在灭过菌的硅胶管中倒满发酵培养基,以6%(v/v)的比例接入种子培养基,然后用胶塞将管材两端密封。在30 ℃下静置培养6 d。培养结束后,将细菌纤维素管从管材中取出[5]。
1.3.2 BC膜的制备
以6%(v/v)的接种量接入液体培养基(500 mL的锥形瓶盛有100 mL液体培养基),接种时需充分振荡,以使菌液均匀,30 ℃恒温静置培养6 d。
1.4 细菌纤维管提取和处理方法
培养结束后,从硅胶管内BC管取出,用水多次冲洗,除去管表面培养基及杂质。再将管浸泡于0.1 mol/L的NaOH溶液中,100 ℃煮沸20 min,去除液管中的菌体和残留培养基,管呈乳白色半透明。然后用蒸馏水多次冲洗,用pH试纸轻压膜测pH值,约7.2。80 ℃干燥至恒重,进行称重。
1.5 原子力显微镜(AFM)
BC膜和BC管的表面形貌采用原子力显微镜((JSPM-5200, Japan)观察。扫描模式为轻敲模式,通过自动平滑和低通滤波处理消除慢扫的低频噪音。
1.6 红外光谱(FTIR)
采用傅立叶变换红外光谱仪VECTOR 22来进行,波长扫描范围为4 000~400 cm-1,分辨率为4 cm-1。
1.7 X-射线衍射(XRD)
采用X-射线衍射仪(X-ray diffractometer),Rigaku(日本理学株式会社),D/max-250。将BC膜和BC管平整固定在框架上,Cu靶,10 kV高压,管流100 mA,进行2θ=5~40°大范围扫描。结晶度(C.I)的计算公式(1)计算[7]:
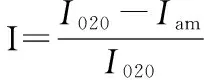
式中:I020,晶格衍射的最高强度值;Iam是2θ=18°的强度值。
1.8 拉伸性能
用微机控制电子万能试验机(RG-5)来测定BC膜的拉伸强度和断裂伸长率,首先截取长度为10 cm、宽度为1 cm的BC,速度为5 mm/s,当BC片拉伸后开始记录为零应力。使用CH-1-SST型塑料薄膜薄片测厚仪测定BC膜的厚度。拉伸强度公式(2)计算:

(2)
2 结果与讨论
2.1 BC管发酵条件的优化
2.1.1 不同的发酵培养基对BC管生物合成的影响
考察复合培养基和合成培养基对BC管生物合成的影响,采用硅胶管(Φ16 mm×12 mm)为发酵容器,以6 %(v/v)的接种量接入培养基中,在30 ℃下培养6 d。结果如表1所示。
表1的结果表明,复合培养基中形成的BC管产量及厚度均高于合成培养基。这可能是木葡糖酸醋杆菌在复合培养基中生长较好,而木葡糖酸醋杆菌的生长与细菌纤维素的产量相偶联。因此在复合培养基中合成的BC管厚度和产量高于合成培养基中。

表1 不同的发酵培养基对合成BC管的影响
2.1.2 不同培养时间对BC管生物合成的影响
采用硅胶管(Φ20 mm×16 mm)为发酵容器,以6 %(v/v)的接种量接入培养基中,在30 ℃条件下培养,考察不同的培养时间1、2、4、6、8 d对BC管生物合成的影响,结果如表2所示。

表2 不同的培养时间对BC管生物合成的影响
表2的结果表明,木葡糖酸醋杆菌在培养的第6天生物合成的细菌纤维素管产量最高,同时菌体量也达到最高值。确定生物合成BC管的时间为6 d。
2.1.3 接种量对BC管生物合成的影响
采用硅胶管(Φ20 mm×16 mm)为发酵容器。接种量分别为2 %、4 %、6 %、8 %(v/v)。在30 ℃下培养6 d,结果如图1所示。
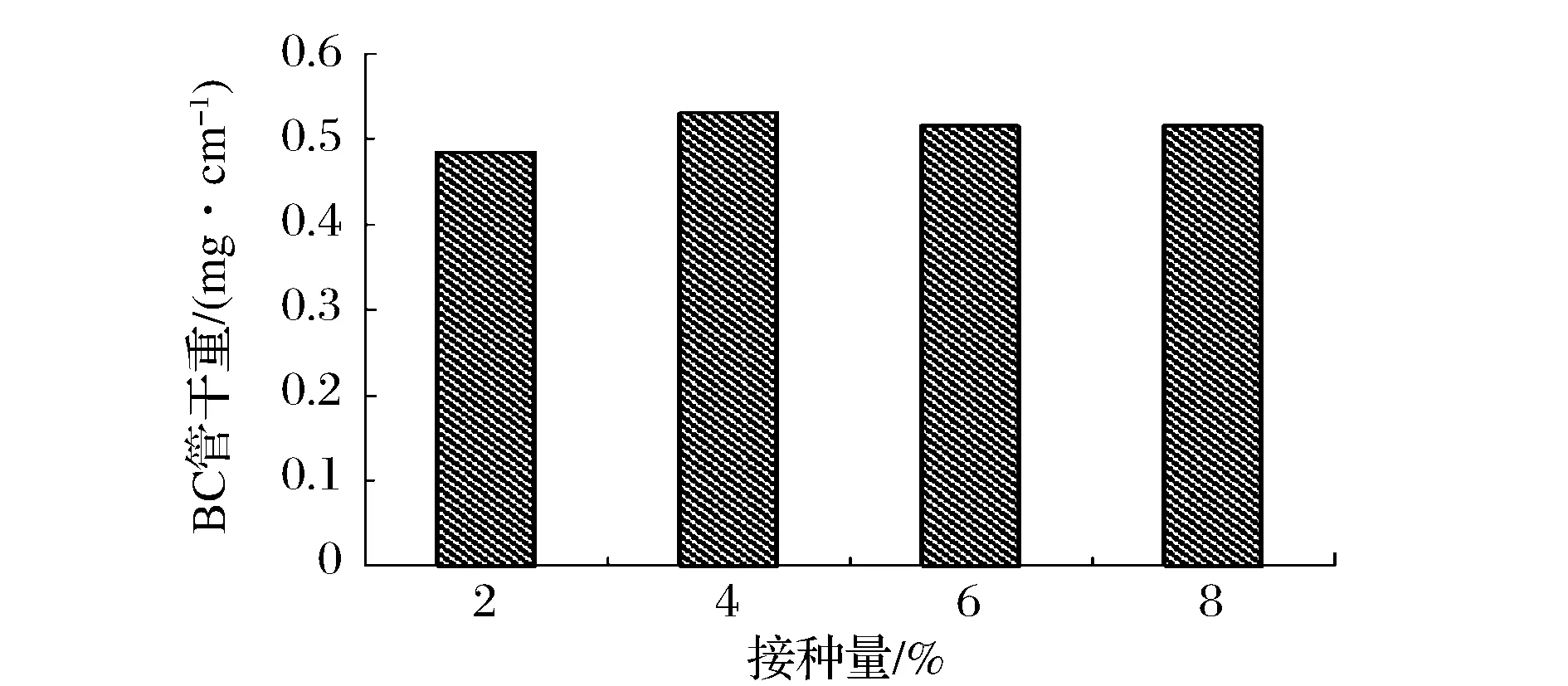
图1 接种量对BC管生物合成的影响Fig.1 Effect of inoculums volume on BC tubes
图1的结果表明,接种量对木葡糖酸醋杆菌合成细菌纤维素管的产量影响不大,其中接种量为4 %~8 %(v/v) 区间,BC产量非常接近,综合考虑, BC管的生物合成的最适接种量为4 %(v/v)。
2.1.4 不同管径BC管的生物合成
采用不同管内径(Φ9 mm×6 mm、Φ16 mm×12 mm、Φ20 mm×16 mm、Φ25 mm×20 mm、Φ31 mm×25 mm)的硅胶管作为发酵容器,在优化条件下(接种量4 %、复合培养基和发酵时间6 d)生物合成BC管,结果如图2所示。

(a)管内径为6、12、16、20、25 mm的BC管的横切面(b)管内径为25 mm的BC管全貌图2 不同管径BC管的生物合成Fig.2 Digital images of BC tubes with different diameters
由图2可知,在优化的发酵条件下,不同的管径中均能形成BC管,具体看的BC管横切面图,如图2(a)。同时也可以看到形成的BC管是均匀的,见图2 (b)。这说明,采用硅胶管作为发酵容器,在接种量4 %(v/v)、复合培养基和发酵时间6 d的条件下,在不同的管径中均能合成均匀的BC管。
2.2 BC管的结构性能
2.2.1 红外光谱(FTIR)
由BC管的红外光谱谱图可知(图3),位于1 060 cm-1为C—O—C和C—O—H键的伸缩振动引起的,是纤维素的特征吸收峰;在3 350 cm-1处的吸收峰,反映了O—H键的伸缩振动;2 895 cm-1处的吸收峰则是由O—H键的伸缩振动产生的;在1 428 cm-1处的吸收峰是由C—H键弯曲振动引起的,深度与纤维素结晶度有关;在1 200~1 500 cm-1之间出现多个吸收峰,主要是—CH,—CH2以及OH的弯曲与摇摆振动引起的。在897 cm-1的吸收峰是糖苷键的特征峰。SUGIYAMA[8]等认为在600~800 cm-1区域之间的吸收峰,由于存在很多重叠以及不同峰之间的极化现象,造成该区域的吸收峰不明确,因此通常很难解释。

图3 BC管的FTIR谱图Fig.3 FTIR spectra of BC tube
2.2.2 X-射线衍射(XRD)
纤维素X-射线衍射图谱是以衍射角为横坐标,衍射强度为纵坐标,以晶胞(1-10),(110)和(020)面的衍射峰为计算基准,其他位置的衍射峰与结晶度计算关系不大[9]。图4中BC管和BC膜是典型的细菌纤维素XRD图谱,没有明确的结晶锐衍射和非晶漫散射之分,有的只是介乎它们之间的宽化衍射峰。说明在细菌纤维素中不存在单一的、明确的结晶相和非晶相,而是在晶态和非晶态之间存在一种整体的有序度变化。同时从XRD谱图发现BC膜和BC管具有极其相似的衍射峰分布,BC膜的3个主要衍射峰位于14.580、16.800和22.620,BC管的3个主要衍射峰位于14.460、16.520和22.680,分别对应于晶面(1-1 0), (1 1 0)和 (0 2 0),如图4所示,这与前人的结论非常相似[10-12]。

图4 BC管和BC膜的XRD谱图Fig.4 XRD patterns of BC tube and BC membrane

样品结晶度/%2θ(d(1,-1,0))2θ(d(110))2θ(d(020))BC膜83.914.580(6.07)16.800(0.282)22.620(0.941)BC管82.614.460(6.12)16.520(5.36)22.680(3.91)
由表3可知,BC管和BC膜均有较高的结晶度,分别为82.6 %和83.9 %,BC膜的结晶度稍高于BC管。 这说明BC管在结晶度上已达到普通BC膜的水平。
2.2.3 BC管的微观形貌
BC管的微观形貌与在相同条件下制备的BC膜相比较,结果如图5所示。

(a)BC管(50 000×); (b) BC膜(50 000×)图5 BC管和BC膜的微观形貌图Fig.5 Graphs of BC tube and BC membrane
由图5(a)可知,BC管通过纤维束相互缠绕而形成,其表面较为致密。与BC膜相比,BC管的表面致密度和均匀度均低于BC膜,同时BC管的纤维束粗细相差很大,而BC膜的纤维束粗细比较均匀,见图5(a)和(b)。这可能是BC管和BC膜结构性能存在一些差异的原因。
2.2.4 拉伸性能
采用微机控制电子万能试验机测定BC膜和BC管的拉伸强度,结果见图6。
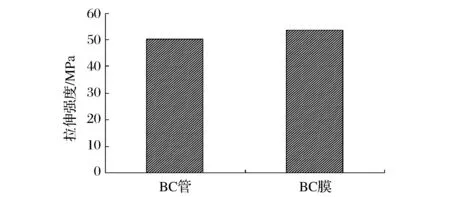
图6 BC管与BC膜的拉伸性能Fig.6 Tensile strength of bacterial cellulose tube and bacterial cellulose membrane
在相同发酵条件(接种量4 %、复合培养基和发酵时间6 d)下,制备得到的BC管和BC膜拉伸强度相当,BC管的拉伸强度达到50.25 MPa。这说明BC管也具有良好的拉伸性能。
3 结论
采用硅胶管作为发酵容器培养木醋杆菌生产细菌纤维素管,其最适发酵条件时是发酵时间为6 d,发酵培养基为复合培养基,接种量为4 %(v/v)。采用FTIR、XRD和微机控制电子万能试验机对BC管的结构性能进行表征,发现BC管具有纤维素的特征峰,结晶度达到82.6%,拉伸强度为50.25 Mpa。采用AFM对 BC管的微观形貌进行观察, BC管是由纤维束高度缠绕而形成,构成BC管的纤维束尺寸差异较大,而BC膜的较为均匀,其原因有待进一步研究。
[1] ROSS P, MAYER R, BENZIMAN M. Cellulose biosynthesis and function in bacteria[J]. Microbiol Rev, 1991, 55(1):35-58.
[2] YAMANAKA S, WATANABE K, KITAMURA N, et al. The structure and mechanical propertied of sheets prepared from bacterial cellulose[J]. J Mater Sci, 1989, 24:3 141-3 145.
[3] NGUYEN V T, GIDLEY M J, DYKES G A. Potential of a nisin-containing bacterial cellulose film to inbibit Listeria monocytogenes on processed meats[J]. Food Microbiology, 2008, 25:471-478.
[4] KLEMM D, SCHUMANN D, UDHART U, et al. Bacterial synthesized cellulose- artificial blood vessels for microsurgery[J]. Progress in Polymer Science, 2001, 26(9): 1561-1603.
[6] SON H J,KIM H G , KIM K K, et al. Increased production of bacterial cellulose byAcetobactersp.V6 in synthetic media under shaking culture conditions[J]. Bioresource Technol, 2003, 86(3):215-219.
[7] KESHK K, SAMESHIMA K. Influence of lignosulfonate on crystal structure and productivity of bacterial cellulose in a static culture[J]. Enzyme and Microbial Techonology, 2006, 40:4-8.
[8] SUGIYAMA J, PERSSON J, CHANZY H. Conbined infrared and electron diffraction study of the polymorphism of native celluloses[J]. Macromolecules, 1991,24(9):2461-2466.
[9] 陈嘉翔.制浆化学[M].北京:中国轻工业出版社,1990.
[10] GIAMBERNARDI T A, KLEBE R J. Use of oxygen-permeable silicone rubber pouches for growing mass culture of bacteria[J]. Letters in Applied Microbiology, 1997, 24, 207-210.
[11] HUTCHENS S A, BENSON R S, EVANS B R, et al. Biominetic synthesis of calcium-deficient Hydroxylapatite in a natural hydrogel[J]. Biomaterials, 2006, 27:4 661-4 670.
[12] ZHOU L L, SUN D P, HU L Y, et al. Effect of addition of sodium alginate on bacterial cellulose production by Acetobacter xylinum[J]. Journal of Industrial Microbiology and Biotechnology, 2007, 34(7):483-489.
Optimization of fermentation conditions for bacterial cellulose tube and study on its structure performance
TANG Wei-hua1, JIA Shi-ru2*
1(Department of Chemical Biology, Tianjin Modern Vocational Technology College, Tianjin 300350, China)2(Key Laboratory of Tianjin Industrial Microbiology, Tianjin 300457, China)
Acetobacterxylinumare γ-negative, aerobic, rod-shaped bacteria. Bacterial cellulose (BC) tube was produced by fermentingAcetobacterxylinumon inner surface of oxygen-permeable silicone tube. The effects of culture medium, fermentation time, and inoculum on the yield of BC tube were studied. The culture medium was complex culture.The maximum BC tube concentration was achieved after culture with 4 %(v/v) inoculums for 6 days. The bacterial cellulose tube was characterized by FTIR and XRD. The crystallinity index of the BC tubes was 82.6 %, which was slightly lower than the value of BC membrane. Tensile strengths of BC tubes were 50.25 MPa, which was close to the value of BC membrane. The morphology of the tubes was characterized by Atomic Force Microscope (AFM).Results revealed that BC tube was synthesized in the form of microfibrils creating highly entangled network of micro-and nanofibers.Compared with BC membrane, microfibrils of BC tubes had significant differences in geometrical dimensions. This may be able to explain why the crystallinity and tensile properties of BC tube were slightly lower than BC membrane. The experiment results can provide basic data for the application of BC tube on high value-added food packaging materials and tissue engineering scaffolds.
bacterial cellulose tube; fermentation condition; optimization; structure performance
10.13995/j.cnki.11-1802/ts.201702007
博士研究生,教授(贾士儒教授为通讯作者)。
国家自然科学基金(21106105)
2016-07-28,改回日期:2016-10-08

