茴香醚对雨生红球藻(Haematococcuspluvialis LUGU)虾青素积累和脂肪酸合成的影响
丁巍,尚敏敏,余旭亚,赵鹏,李涛,徐军伟
(昆明理工大学 生命科学与技术学院,云南 昆明,650500)
茴香醚对雨生红球藻(HaematococcuspluvialisLUGU)虾青素积累和脂肪酸合成的影响
丁巍,尚敏敏,余旭亚,赵鹏,李涛,徐军伟
(昆明理工大学 生命科学与技术学院,云南 昆明,650500)
雨生红球藻虾青素积累过程与脂肪酸合成密切相关。实验研究了添加不同质量浓度的茴香醚(butyl hydroxyanisole,BHA)对雨生红球藻HaematococcuspluvialisLUGU,生物量浓度、虾青素积累量以及脂肪酸合成的影响。结果显示,在茴香醚质量浓度为2 mg/L,虾青素积累量显著提高,最大含量可达31.56 mg/g,比对照组(15.42 mg/g)提高到2.05倍,此时藻细胞内总脂肪酸的含量也达到最大值(12.27 %),比同时刻对照组的含量(6.22 %)提高到1.97倍,单不饱和脂肪酸成分相比于对照组也产生了较大变化。脂肪酸合成关键基因acp、kas表达量也分别上调16.77、27.53倍。研究表明,适当浓度的BHA不仅能够显著提高虾青素合成,而且影响了脂肪酸总量和组成。
茴香醚;雨生红球藻;虾青素;脂肪酸;脂肪酸合成基因
虾青素由于具有超强的抗氧化能力和出色的着色能力,在水产养殖业、化妆品行业、保健食品行业和制药行业已经被广泛地运用[1-4]。雨生红球藻(Haematococcuspluvialis)是一种生存于淡水中的单细胞双鞭毛绿藻,该藻细胞中虾青素含量很高,约占细胞干重的1%~4%[5]。因此,雨生红球藻成为获取虾青素的最佳来源。在胁迫条件下雨生红球藻细胞会逐渐变大并积累虾青素[6],于是,使用诱导子作为胁迫条件诱导藻细胞更高效积累虾青素,已是当前虾青素生产和研究中的热点。
利用不同性质的化学物质作为诱导子促进雨生红球藻积累虾青素发现,在适当浓度诱导子的诱导下,可以明显的提高虾青素积累量[7-9]。茴香醚(butyl hydroxyanisole,BHA)是一种化学合成抗氧化剂[10],FRANZ等人[11]将其作为诱导子来提高次级代谢产物的积累,结果表明,微量的外源BHA能够提高产油微藻细胞内油脂的产量。由此推测,BHA对雨生红球藻中虾青素的积累及脂肪酸的合成可能具有一定的影响。
在大多数高等植物代谢过程中,类胡萝卜素类物质积累于叶绿体或者有色体的质体球滴结构中[12-13],而雨生红球藻合成的95%的虾青素与脂肪酸发生甲酯化反应,储存在富含有甘油三酯的脂囊泡中[14-15]。另一方面,藻类细胞通常会通过调节脂肪酸代谢通路进而改变细胞内脂肪酸组分及其百分含量来对胁迫环境做出应激反应[16]。acp,kas编码脂肪酸生物合成途径中最初的缩合反应,作为脂肪酸合成路径上的关键基因,在胁迫条件下表达量会发生变化从而对脂肪酸合成产生影响。因此,研究胁迫条件下雨生红球藻细胞积累虾青素和脂肪酸合成及相关基因变化成为必要。
本课题以雨生红球藻(HaematococcuspluvialisLUGU)作为研究对象,研究了不同浓度的BHA对雨生红球藻细胞生长和虾青素产量及BHA胁迫对脂肪酸合成及相关基因变化的影响,为虾青素的生产提供参考。
1 材料与方法
1.1 材料与试剂
雨生红球藻(HaematococcuspluvialisLUGU),由本实验室筛选、保存。茴香醚(BHA),TCI(上海)化成工业发展有限公司;DMSO,≥99.5%、 KOH,≥99.5%、甲醇(分析纯),北京鼎国昌盛生物技术有限公司。
1.2 仪器与设备
显微镜XS-212-202,JNOEC;超净工作台VS-840-1,上海博讯;冷冻干燥机FD5-12,SIM International Group;紫外可见分光光度计(Ultrospec 2100pro),Amersham Biosciences;灭菌锅LDZX-50KBS,上海申安;分析天平FA2004N,上海箐海;水浴锅HHW-D6,金坛双捷;离心机5804R,Eppendorf;高速冷冻离心机,1730R Labogene Scan speed;超声波微波组合体系DS-8510DTH,上海生析。
1.3 实验方法
1.3.1 雨生红球藻的培养
以BBM(Bold’s Basal Medium)[17]为基础培养基,取保藏于试管中的藻种,接种到3 L(内置2 L培养基)光生物反应器中,室内恒温(25±1) ℃,光照强度2 800 lx,通入0.1 vvm的无菌空气进行培养,直至培养到指数中期(12 d,约6.5×105cells/mL)。
1.3.2 茴香醚处理
将培养至指数中期的种子液于3 800×g离心5 min,用无菌水洗去营养盐,然后把藻液沉淀重新悬浮到BBM缺氮培养基中,(接种量约为2×105cells/mL,培养基总体积为400 mL)。用DMSO(Dimethyl Sulfoxide)溶解BHA作为母液,将不同体积的BHA母液添加到缺氮的BBM培养基诱导培养,使诱导培养基中添加BHA质量浓度分别为0 mg/L对照、2 mg/L、4 mg/L和8 mg/L(保持DMSO加入量相等),每组设3个平行样。持续鼓入0.4 vvm的含1.5 % CO2的无菌空气,24 h 8 000 lx光照,置于27±1℃室内培养15 d,以诱导藻细胞积累虾青素。每隔1天取样1次,测定HaematococcuspluvialisLUGU虾青素含量和生物量。
1.3.3 虾青素含量和生物量浓度的测定
准确称取9.5 g虾青素标准品(Sigma),用甲醇-二氯甲烷(体积比3∶1)溶液配制成100 mg/L的储备液(超声波促进溶解),存放于棕色瓶中,保存在4 ℃冰箱,使用前配成合适含量的工作液用于液相色谱分析。
取5 mL雨生红球藻培养物于10 mL试管中,3 000 g低温(4 ℃)离心15 min,弃去上清液,藻细胞沉淀用超纯水洗3次,加入5 mL甲醇-二氯甲烷(体积比3∶1)提取液,在低温环境下(试管外冰水冷却)用高速组织匀浆机2 800 r/min匀浆20 s,匀浆液10 000 g低温离心15 min,将上清液转移至另一试管中。重复以上色素提取步骤3~4次,直至藻细胞中色素基本提取完全,细胞沉淀物变为灰白色为止。将所有收集的提取液10 000 g,再次低温离心15 min,取上清液保存于-20 ℃,待用。
色谱柱为C18柱(waters, 25 cm×4.6 mm,5 mm);流动相A为丙酮,流动相B为甲醇-水(9∶1),洗脱梯度为:25 min B 80%~20%, 10 min 20% B, 5 min B 20%~80%, 流速为1.25 mL/min;检测器为waters 996光电二极管阵列检测器,进样量为30 mL;光谱扫描波长范围为250~700 nm,积分定量用检测波长为476 nm,通过积分得到虾青素质量浓度c(mg/L)。每隔1天定期取出50 mL处于诱导阶段的藻液5 000 r/min离心10 min、-20 ℃冷冻、干燥、称重,具体计算见式(1):
DBW=WA/V
式中,DBW,藻细胞生物量浓度, g/L;WA,藻粉干重,g;V,藻液体积,L。
进一步得出虾青素含量:
P=c/DBW
式中,P,虾青素含量,mg/g;c,虾青素质量浓度。
1.3.4 脂肪酸组成的测定
将离心冻干后的微藻粉称取5 mg,置于有垫片的密闭的玻璃中,依次加入0.2 mLV(氯仿)∶V(甲醇)(2∶1),0.3 mL 35%的V(HCl)∶(甲醇)(1∶19),将瓶口旋紧,置于85 ℃的水浴锅内水浴加热60 min;待取出冷却至室温后,将900 μL正己烷加入瓶内混匀,置于25 ℃,150 r/min 摇床内摇晃提取1 h,静止后吸取上层正己烷萃取液,即完成脂肪酸甲酯化,转移至GC-MS进样瓶中待测脂肪酸组分。
利用Agilent 7890进行GC-MS 分析,色谱条件为:色谱柱为HP-5MS (5% Phenyl Methyl Silox, 30m×250μm×0.25 μm),二阶升温程序为:170 ℃ 维持0 min, 每分钟10 ℃的速度增加到190 ℃,维持1 min;再以每分钟0.8 ℃ 的速度将温度升高至 207 ℃,维持1 min;进样量以分流比40∶1的标准,分流进样1 μL;进样口的温度维持在250 ℃;高纯氦气(He)为载体,以每分钟1.0 mL的流速流入;质谱条件:四级杆温度为150 ℃,EI 离子源温度为230 ℃,溶剂延迟2 min;质量扫描的范围是50~550 amu。以NIST08.L作为数据库,利用峰面积归一化法进一步计算出脂肪酸各组分之间的相对百分含量。
1.3.5 虾青素诱导过程中脂肪酸合成相关基因表达量的测定
本实验由Primer 5.0软件设计,上海生工生物工程技术服务有限公司合成acp、kas酶基因的上下游扩增引物(表1)。扩增所得序列测序(上海生工)后BLAST比对,并以此为模板设计荧光定量引物(表2)。
Trizol法提取不同浓度BHA处理的雨生红球藻RNA,利用逆转录试剂盒(TaKaRa)将RNA逆转录合成cDNA,以其为模板,进行RT-PCR扩增,检测不同浓度BHA对雨生红球藻acp、kas基因表达的影响。通过ABI 7500荧光定量仪对acp、kas基因的表达进行定量,RT-PCR的数据结果用2-ΔΔCT的方法处理分析[18]。以18s(上游引物18sF:5’-CGGTCTGCCTCTGGTATG-3’,下游引物18sR: 5’-GCTTGCTTTGAACACGCT-3’)基因作为内标以调节RNA的用量和循环数,使内标基因在诱导条件下的表达丰度一致,最终得到基因表达量之间的倍数关系。
进行多元线性回归分析(回归方程中Y为虾青素含量,X1,X2为acp、kas基因表达水平),研究BHA诱导下雨生红球藻脂肪酸合成和acp、kas基因表达量之间的相关性。

表1 酶基因克隆引物表

表2 酶基因荧光定量引物
1.3.6 数据处理
本文全部试验均设置3组平行,利用ANOVA(SPSS19.0)一步法分析实验数据。最小显著性差异进行多重比较检验调查不同试验的组间差异,且当P<0.05具有显著性意义。
2 结果与分析
2.1 BHA对诱导培养微藻细胞生长的影响
由图1可知,将不同浓度的BHA分别添加至培养基中,在培养15 d的过程中,对照组藻细胞的生长符合一般生长趋势,即在第0~7天时,藻细胞生长缓慢,之后呈对数生长趋势快速生长,在第11天进入稳定期,第13天达到最大值(0.71 g/L)之后藻细胞生物量浓度开始快速下降。相比之下,茴香醚处理的实验组的生长和分裂受到抑制,四组实验组中藻细胞的生物量浓度均低于对照组生物量。此外,随着茴香醚浓度的增高,最大生物量质量浓度逐渐降低1 mg/L BHA处理下,生物量浓度为0.54 g/L,2 mg/L BHA处理下,生物量浓度为0.52 g/L,4 mg/L BHA处理时为0.46 g/L,而当BHA浓度增加到8 mg/L时生物量浓度仅为 0.45 g/L。由此可见藻细胞在诱导阶段,诱导剂BHA的添加不利于藻细胞的生长,使藻细胞的生长量降低。这种现象与之前文献中发现的抗氧化剂不利于藻细胞生长相同[19]。

图1 不同质量浓度茴香醚对雨生红球藻生长的影响Fig.1 Effect of BHA on biomass of H. pluvialis during induction days
2.2 BHA对诱导培养微藻细胞虾青素积累的影响
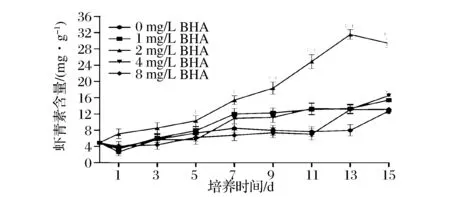
图2 不同质量浓度茴香醚对雨生红球藻虾青素含量的影响Fig.2 Effect of BHA on astaxanthin content of H. pluvialis during induction days
从图2中可以看出,用不同质量浓度BHA诱导微藻细胞,虾青素积累量未表现出良好的剂量效应,实验组中微藻虾青素积累量最大值随BHA浓度的增加先增加后逐渐降低,但相对于对照组呈现明显的提高。在2 mg/L茴香醚处理下,虾青素含量在13天时达到了最大值31.56 mg/g,比对照组(15.42 mg/g)增加2.05倍。虽然1、4 mg/L BHA处理组虾青素积累量相对于对照组表现出了促进作用,但相比2 mg/L BHA处理组还是相对较低,对虾青素积累的促进作用不太明显。8 mg/L BHA处理组在3天后积累量甚至低于对照组,这种情况一直持续到了诱导的第11天,之后开始增长在第13天才高于对照组。虾青素产量也得到了相同的结果(图3),在培养前期虾青素产量增加缓慢,2 mg/L BHA处理组在第七天开始急剧增加,在15天达到了最大值显著高于对照组。因此,藻细胞在诱导阶段, BHA虽然抑制了微藻细胞的生长却有利于虾青素的积累,用合适浓度BHA诱导可以较大幅度提高虾青素的积累量。

图3 不同质量浓度茴香醚对雨生红球藻虾青素产量的影响Fig.3 Effect of BHA on astaxanthin production of H. pluvialis during induction days
2.3 BHA对藻细胞内脂肪酸组成的影响
对2 mg/L BHA 实验组和对照组藻细胞内脂肪酸的含量及组分进行分析测定,得到表 3、表 4。总体上,脂肪酸的含量在第13天最高,而由2.2中可知,此时虾青素产量也达到最大值。这种结果的原因可能是因为脂肪酸大量合成促使虾青素转化成虾青素酯进一步储存,而虾青素酯的合成需要大量的脂肪酸,因此脂肪酸与虾青素在同一时间达到最大值。然而,当虾青素产量下降时,过多的脂肪酸产生产物抑制效应,脂肪酸含量也会进一步降低[20]。虽然对照组与实验组的饱和脂肪酸含量最后相差无几,但对照组的饱和脂肪酸含量在第5天时大幅增加,达到最大值64.52%,而实验组中并未发现饱和脂肪酸。然而单不饱和脂肪酸的情况却截然相反:第5天时实验组单不饱和脂肪酸含量高达49.68%,但在对照组中却未检测到单不饱和脂肪酸的存在。这表明用BHA诱导雨生红球藻积累虾青素时,脂肪酸总量虽然没多大变化但对脂肪酸组成产生了较大影响。

表3 实验组藻细胞内脂肪酸含量及成分的变化

表4 对照组藻细胞内脂肪酸成分及含量的变化
续表4
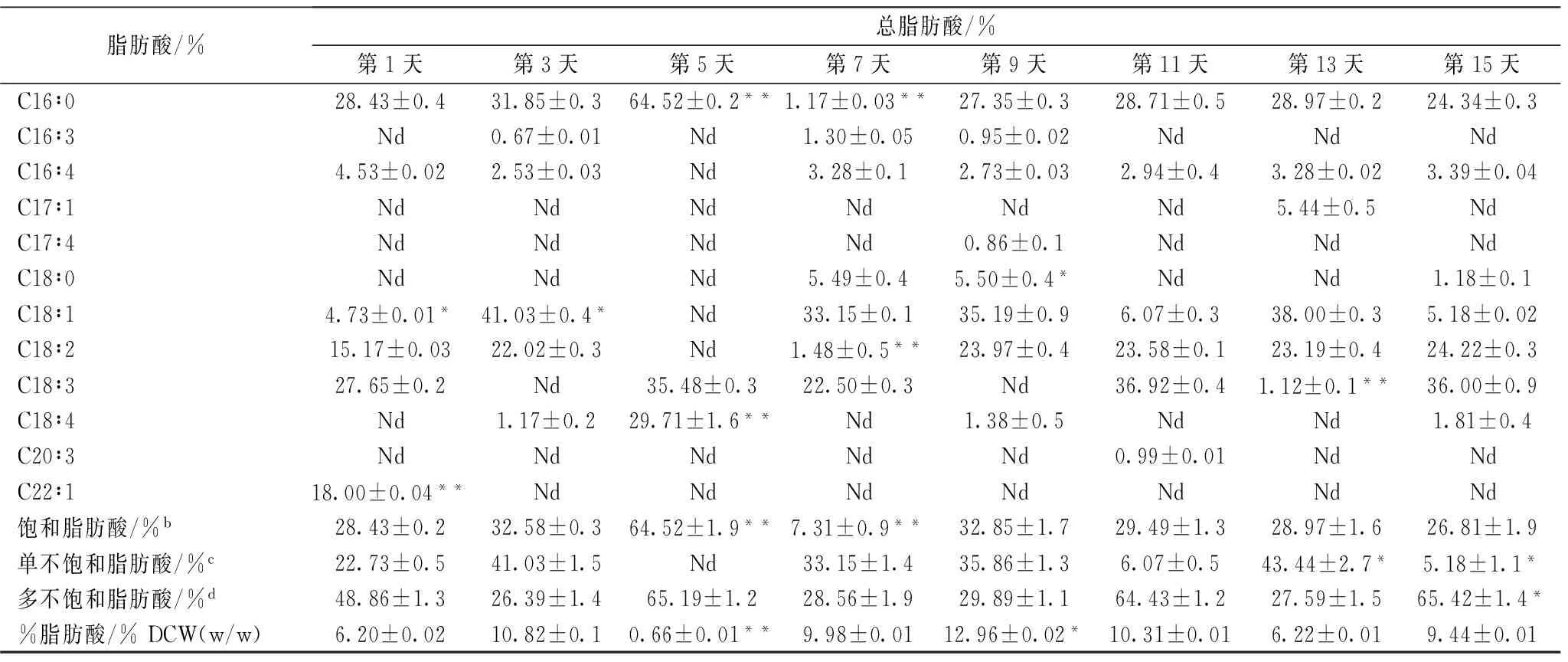
脂肪酸/%总脂肪酸/%第1天第3天第5天第7天第9天第11天第13天第15天C16∶028.43±0.431.85±0.364.52±0.2**1.17±0.03**27.35±0.328.71±0.528.97±0.224.34±0.3C16∶3Nd0.67±0.01Nd1.30±0.050.95±0.02NdNdNdC16∶44.53±0.022.53±0.03Nd3.28±0.12.73±0.032.94±0.43.28±0.023.39±0.04C17∶1NdNdNdNdNdNd5.44±0.5NdC17∶4NdNdNdNd0.86±0.1NdNdNdC18∶0NdNdNd5.49±0.45.50±0.4*NdNd1.18±0.1C18∶14.73±0.01*41.03±0.4*Nd33.15±0.135.19±0.96.07±0.338.00±0.35.18±0.02C18∶215.17±0.0322.02±0.3Nd1.48±0.5**23.97±0.423.58±0.123.19±0.424.22±0.3C18∶327.65±0.2Nd35.48±0.322.50±0.3Nd36.92±0.41.12±0.1**36.00±0.9C18∶4Nd1.17±0.229.71±1.6**Nd1.38±0.5NdNd1.81±0.4C20∶3NdNdNdNdNd0.99±0.01NdNdC22∶118.00±0.04**NdNdNdNdNdNdNd饱和脂肪酸/%b28.43±0.232.58±0.364.52±1.9**7.31±0.9**32.85±1.729.49±1.328.97±1.626.81±1.9单不饱和脂肪酸/%c22.73±0.541.03±1.5Nd33.15±1.435.86±1.36.07±0.543.44±2.7*5.18±1.1*多不饱和脂肪酸/%d48.86±1.326.39±1.465.19±1.228.56±1.929.89±1.164.43±1.227.59±1.565.42±1.4*%脂肪酸/%DCW(w/w)6.20±0.0210.82±0.10.66±0.01**9.98±0.0112.96±0.02*10.31±0.016.22±0.019.44±0.01
2.4 茴香醚对藻细胞内脂肪酸合成基因的影响

图4 茴香醚对脂肪酸合成相关酶基因表达量的影响Fig.4 Effects of BHA on the transcript levels expression kinetics of seven astaxanthin biosynthetic genes in H. pluvialis during induction days
图4表明,茴香醚诱导虾青素积累过程中,脂肪酸合成相关的关键基因的表达量有很明显的变化。acp、kas作为脂肪酸合成的关键基因,与对照组比2者表现出较高水平的表达,总体上,表达量表现出不同程度的上调。其中,诱导第7天虾青素大量累积,并伴随着饱和脂肪酸、不饱和脂肪酸,特别是油酸的含量的巨大变化,而这些成分的变化也伴随着脂肪酸酶基因表达量的波动。C18∶1含量增加33.15倍而C16∶0含量下降63.35%,而此时acp、kas表达量分别上调16.77、27.53倍。因此,这种结果进一步表明BHA可以改变脂肪酸合成基因的表达从而影响虾青素的积累,这也将有利于在添加BHA条件下雨生红球藻细胞中虾青素的积累。
BHA诱导H.pluvialisLUGU脂肪酸合成和acp、kas基因表达量之间的相关性表明,当acp、kas表达水平低时,微藻虾青素含量随其后表现出低含量;如acp、kas表达水平提高,虾青素的含量随之增加,两者呈现线性相关,回归方程为:y=4.755X1-2.829X2+4.894,R2=0.985(式中,y为H.pluvialisLUGU虾青素含量;X1,X2为acp、kas基因的表达水平;R2直线方程的相关系数)。
3 讨论
近年来抗氧化剂逐渐被许多研究者用作诱导子来提高生物体内次生代谢产物,如在培养过程中加入1.48μmol/L没食子酸来诱导微藻细胞中油脂的积累,微藻Nannochloropsissalina油脂浓度可以增加 217 %[11]。这表明抗氧化剂可以明显的提高次级产物的积累。LU等[7]利用不同的植物激素作为诱导子来促进雨生红球藻积累虾青素发现,将不同浓度的茉莉酸甲酯(MJ)、赤霉素 (A3) 作为诱导子分别加入处于生长对数期的藻液中,置于高光照、缺氮等诱导条件下诱导微藻积累虾青素,结果表明,20 mg/ L茉莉酸甲酯和赤霉素(A3)大大提高了微藻虾青素积累量,有效促进雨生红球藻虾青素的合成,但低浓度的诱导剂对微藻细胞虾青素积累促进作用较弱。可见只有在适当浓度诱导子的诱导下,虾青素积累量才能得到明显的提高。GAO等[9]利用乙烯利作为诱导子,在质量浓度为0.05 mL/L处理组虾青素积累量最高,而高质量浓度(≥0.15 mL/L)乙烯利对雨生红球藻细胞有强烈的致死作用。这说明植物激素对于微藻细胞也具有双重性,即只有合适的浓度才能发挥其生物学作用,过低时不起作用,过高时产生抑制甚至毒害作用。茴香醚作为一种化学合成的抗氧化剂[10],能够鳌合金属离子、清除自由基、淬灭单线态氧、清除氧、抑制氧化酶活性等。有研究表明[21],BHA质量浓度达到 16 mg/L时斜生栅藻几乎完全受到抑制,随着暴露时间的延长,细胞生长受抑制越来越明显,生长越来越缓慢。但在BHA质量浓度小于 8 mg/L 时,斜生栅藻 48 h 细胞的抑制率反而比 24 h 降低,这说明较低质量浓度的 BHA 暴露在短时间内不会对斜生栅藻的生长产生严重影响,甚至藻类可产生一定的适应性,受抑制程度减弱。在用1、2、4、8 mg/L BHA 诱导雨生红球藻积累虾青素过程中,也得到相似的结论。添加外源BHA可刺激植物防御基因的表达,诱导植物的生理防御,促使防御相关化合物的合成。虾青素是雨生红球藻在胁迫条件下积累的次级代谢产物,因此研究BHA对雨生红球藻的生长以及虾青素积累的影响有广阔的应用前景。在本实验中,微藻在积累虾青素的过程中也同样具有相同的结果。BHA与没食子酸类似,也促进了次级代谢产物的积累,在一定程度上提高了虾青素的积累量,另一方面,也和植物激素一样表现出了剂量效应。
油酸(18∶1)是单不饱和脂肪酸的主要成分,并有研究表明油酸是厚囊孢子中与虾青素联系最为紧密的脂肪酸组分[15]。ZHEKISHEVA[22]等人也发现,油脂是在胁迫环境下与虾青素酯的合成最为相关的组分。acp、kas在脂肪酸合成途径中起着关键的调节作用[20],本实验结果也显示,实验组油酸的含量比对照组中高,然而当第5天时油酸含量呈微量,这可能由于在诱导培养第5天时,油酸被大量利用和虾青素发生酯化反应合成虾青素酯,因此油酸的含量很少。之后,油酸的缺乏作为一种信号反馈刺激油酸在接下来时间内大量合成,另一方面,BHA作为抗氧化剂可以减少脂肪酸的氧化,从而提高虾青素的积累。随着饱和脂肪酸、单不饱和脂肪酸以及多不饱和脂肪酸的含量不断变化,虾青素积累也不断变化,证明了诱导过程中脂肪酸合成和组分变化会影响虾青素的积累。
4 结论
适宜浓度的BHA有利于促进雨生红球藻H.pluvialisLUGU细胞虾青素的积累和脂肪酸的合成。添加浓度为2 mg/L BHA,微藻细胞虾青素积累量达到最大31.56 mg/g,比对照组提高到2.05倍;通过不同脂肪酸组分的含量变化及关键基因acp、kas表达量分析,结果表明诱导条件下acp、kas基因上调促进了脂肪酸的合成进而增加虾青素酯的合成,提高虾青素的积累。
[1]SHEIKHZADEHN,PANCHAHIK,ASADPOURR,etal.EffectsofHaematococcuspluvialisin maternal diet on reproductive performance and egg quality in rainbow trout (Oncorhynchusmykiss)[J]. Animal Reproduction Science, 2012, 130(1): 119-123.
[2] TOMINAGA K, HONGO N, KARATO M, et al. Cosmetic benefits of astaxanthin on humans subjects[J]. Acta Biochimica Polonica, 2012, 59(1): 43-47.
[3] PALOZZA P, TORELLI C, BONINSEGNA A, et al. Growth-inhibitory effects of the astaxanthin-rich algaHaematococcuspluvialisin human colon cancer cells[J]. Cancer Letters, 2009, 283(1): 108-117.
[4] FASSETT R G, COOMBES J S. Astaxanthin, oxidative stress, inflammation and cardiovascular disease[J]. Future Cardiology, 2009, 5(4): 333-342.
[5] 凌善锋. 雨生红球藻培养基和诱导条件优化[J]. 江苏农业科学, 2013, 41(11): 266-267.
[6] 庄惠如, 陈文列, 卢海声, 等. 雨生红球藻不同形态细胞的超微结构研究[J]. 应用与环境生物学报, 2001, 7(5): 428-433.
[7] LU Yan-du, JIANG Peng, LIU Shao-fang, et al. Methyl jasmonate-or Gibberellins A3-induced astaxanthin accumulation is associated with up-regulation of transcription of β-carotene ketolase genes (bkts) in microalgaHaematococcuspluvialis[J]. Bioresource Technology, 2010, 101(16): 6 468-6 474.
[8] WEN Ze-wen, LIU Zhi-yong, HOU Yu-yong, et al. Ethanol induced astaxanthin accumulation and transcriptional expression of carotenogenic genes inHaematococcuspluvialis[J]. Enzyme and Microbial Technology, 2015, 78(5): 10-17.
[9] GAO Zheng-quan, MENG Chun-xiao, ZHANG Xiao-wen, et al. Differential expression of carotenogenic genes, associated changes on astaxanthin production and photosynthesis features induced by JA inH.pluvialis[J]. PloS One, 2012, 7(8): 243-252.
[10] 张怀玉. 高效液相色谱法同时测定植物油中BHA、BH和游离棉酚[J]. 中国卫生检验杂志, 2004, 14(3): 343-344.
[11] FRANZ A K, DANIELEWICZ M A, WONG D M, et al. Phenotypic screening with oleaginous microalgae reveals modulators of lipid productivity[J]. ACS Chemical Biology, 2013, 8(5): 1 053-1 062.
[12] POZUETA-ROMERO J, RAFIA F, HOULNE G, et al. A ubiquitous plant housekeeping gene, PAP, encodes a major protein component of bell pepper chromoplasts[J]. Plant Physiology, 1997, 115(3): 1 185-1 194.
[13] KESSLER F, SCHNELL D, BLOBEL G. Identification of proteins associated with plastoglobules isolated from pea (PisumsativumL.) chloroplasts[J]. Planta, 1999, 208(1): 107-113.
[14] GRÜNEWALD K, HIRSCHBERG J, HAGEN C. Ketocarotenoid biosynthesis outside of plastids in the unicellular green algaHaematococcuspluvialis[J]. Journal of Biological Chemistry, 2001, 276(8): 6 023-6 029.
[15] HOLTIN K, KUEHNLE M, REHBEIN J, et al. Determination of astaxanthin and astaxanthin esters in the microalgaeHaematococcuspluvialisby LC-(APCI) MS and characterization of predominant carotenoid isomers by NMR spectroscopy[J]. Analytical and Boanalytical Chemistry, 2009, 395(6): 1 613-1 622.
[16] HU Zheng-yu, LI Yan-tao, SOMMERFELD M, et al. Enhanced protection against oxidative stress in an astaxanthin-overproductionHaematococcusmutant(Chlorophyceae)[J]. European Journal of Phycology, 2008, 43(4): 365-376.
[17] EBRAHIMIAN A, KARIMINIA H R, VOSOUGHI M. Lipid production in mixotrophic cultivation ofChlorellavulgarisin a mixture of primary and secondary municipal wastewater[J]. Renewable Energy, 2014, 71(4): 502-508.
[18] LIVAK K J, SCHMITTGEN T D, Analysis of relative gene expression data using Real-Time Quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25(4): 402-408.
[19] CHE Rao-qiong, HUANG Li, YU Xu-ya. Enhanced biomass production, lipid yield and sedimentation efficiency by iron ion[J]. Bioresource Technology, 2015, 192(1): 795-798.
[20] LEI An-ping, CHEN Huan, SHEN Guo-ming, et al. Expression of fatty acid synthesis genes and fatty acid accumulation inHaematococcuspluvialisunder different stressors[J]. Biotechnology for Biofuels, 2012, 5(1): 1-11.
[21] 鹿金雁, 李潇, 聂湘平, 等. 叔丁基对羟基茴香醚和诺氟沙星对水生生物的影响[J]. 生态科学, 2007, 26(1): 55-58.
[22] ZHEKISHEVA M, BOUSSIBA S, KHOZIN-GOLDBERG I, et al. Accumulation of oleic acid inHaematococcuspluvialis(Chlorophyceae) under nitrogen starvation or high light is correlated with that of astaxanthin esters1[J]. Journal of Phycology, 2002, 38(2): 325-331.
Effects of butyl hydroxyanisole on astaxanthin accumulation and the fatty acid biosynthesis ofHaematococcuspluvialisLUGU
DING Wei, SHANG Min-min, YU Xu-ya, ZHAO Peng, LI Tao, XU Jun-wei*
(Faculty of Life Sciences and Technology, Kunming University of Science and Technology, Kunming 650500, China)
The accumulation ofHaematococcuspluvialiscompound astaxanthin is correlated with fatty acid pathway. In this paper, different concentration of Butyl hydroxyanisole (BHA) were studied for their effect on the production of astaxanthin inHaematococcuspluvialisLUGU under unfavorable condition. The results showed that 2 mg/L BHA was optimal for astaxanthin production, which reached 31.56 mg/g and was 2.05 times of the control (15.42 mg/g). Moreover, the content of total fatty acids in algal cells also reached maximum level (12.27%), which was 1.97 times of that of the control (6.22%) and the components of monounsaturated fatty acid also changed significantly. The transcription levels ofacp,kasgenes which was important for fatty acid synthesis were up-regulated 16.77 and 27.53 fold, respectively. The results demonstrated that appropriate concentration of BHA couldnot only improve astaxanthin synthesis, but also affect the micro algae amount and composition of fatty acids.
butyl hydroxyanisole (BHA);HaematococcuspluvialisLUGU; astaxanthin; fatty acids; fatty acid synthesis genes
10.13995/j.cnki.11-1802/ts.201702005
硕士研究生(徐军伟副教授为通讯作者,E-mail:xjuwei@163.com)。
国家自然科学基金资助项目(21266013)
2016-07-03,改回日期:2016-11-03

