微波水热法降解壳聚糖的研究
武泰恒, 邵 谦, 赵雯丽
(山东科技大学 化学与环境工程学院,山东 青岛 266590)
微波水热法降解壳聚糖的研究
武泰恒, 邵 谦, 赵雯丽
(山东科技大学 化学与环境工程学院,山东 青岛 266590)
在H2O2和α-淀粉酶存在的条件下,使用微波水热法,在低浓度醋酸溶液中快速降解壳聚糖。研究了醋酸浓度、H2O2和α-淀粉酶用量以及微波水热时间对壳聚糖降解的影响,并利用FTIR对降解的壳聚糖进行了分析。结果显示,在V(H2O2):m(壳聚糖) =2 mL/g,m(壳聚糖):m(α-淀粉酶)=3的条件下,40 ℃微波水热反应40 min,即可使壳聚糖粘均分子量下降99.8 %以上,而用普通水热法达到相同分子量则需约9 h,微波水热法大大提高了降解壳聚糖的效率,同时不破坏壳聚糖本身的结构,是一种高效环保的壳聚糖降解方法。
壳聚糖;微波水热;降解;H2O2;α-淀粉酶
壳聚糖 (chitosan) 又被称作脱乙酰甲壳素,是由自然界中相当普遍的几丁质 (chitin) 脱乙酰化而得到的,化学名称为聚葡萄糖胺 (1-4)- 2- 氨基-B-D 葡萄糖。自1859年法国人Rouget第一次得到壳聚糖,这类高分子的生物安全性、官能性、微生物降解性、血液相容性等良好的性能就被很多行业广泛关注[1],近年来,在食品、医疗、化妆品、化学化工、污水处理、贵重金属回收、生物工程等方面的应用获得了突破性进展[2-4]。然而,壳聚糖的分子量从几十万到几百万甚至上千万不等,且分子间和分子内部存在着大量氢键,因而不易溶于水及一些普通的溶剂,而且难以被人体吸收利用,限制了壳聚糖的应用。
低聚壳聚糖是壳聚糖降解后的产物,有较高的溶解度,易被吸收利用。近些年来,随着研究的深入,低聚壳聚糖展现出了独特的生理活性和功能,如抑制肿瘤细胞的转移和生长、具有明显的抗菌抑菌效果、降低血脂含量以及胆固醇含量、提高巨噬细胞的功能、促进蛋白质合成、活化植物细胞促进植物生长以及具有显著的保湿能力等[5]。目前,针对壳聚糖的降解方法大致可以划分为酸降解法、氧化降解法以及酶降解法,还有通过这三种方法结合而衍生出来的一些切合实际生产应用的复合降解法。酸降解法通常使用强酸作为降解剂,并通过提高酸的浓度来提高降解效率,这种降解方法不仅不好控制并且会导致一系列环境问题。氧化降解法通常使用强的氧化剂,会破坏壳聚糖的官能团如羧基、氨基,甚至会改变壳聚糖的化学结构[6],所以很少被广泛使用。而过氧化氢容易控制、环境友好[7-8],同时产生的自由基能够攻击糖单元间的β- (1,4) 糖苷键而导致壳聚糖降解,保持壳聚糖原有的由2-氨基-2-脱氧-D-葡萄糖单元和2-乙酰氨基-2-脱氧-D-葡萄糖单元组成的共聚体化学结构。但是使用H2O2降解壳聚糖的降解效率较低,所以一般很少单独使用[9]。酶降解法具有众多优点,例如温和的反应条件、特异性高、不改变壳聚糖结构等[10],但是特异性酶成本较高,不利于商业应用和大批量生产低聚壳聚糖。
本研究结合了H2O2和酶降解法环境友好的优点,在低醋酸浓度(1%V/V)下用H2O2和价格低廉的α-淀粉酶降解壳聚糖,采用微波水热法将反应体系置于微波反应釜中进行降解,降解40 min即可使壳聚糖粘均分子量下降99 %以上,大大提高了降解效率。
1 实验
1.1 仪器与试剂
主要仪器:XH-800S微波水热反应仪 (中国北京),乌氏粘度计 (中国沈阳),DF-101S集热式磁力加热搅拌器 (中国上海),Nicolet-380傅里叶变换红外分析仪 (美国)。
实验试剂:壳聚糖 (生物纯,BR,粘均分子量3.1×107Da),过氧化氢 (分析纯,AR),α-淀粉酶 (生物纯,BR)。
1.2 水热法降解壳聚糖
向三口烧瓶中加入3 g壳聚糖和300 mL浓度为2 % (V/V)醋酸溶液,同时开动搅拌和加热,设定水浴温度为40 ℃,当壳聚糖完全溶于醋酸溶液中时,使用恒压滴液漏斗逐滴缓慢滴加6 mL的H2O2,并缓慢加入1 g α-淀粉酶,直至全部溶解。然后恒温反应7 h。反应结束后,将所得溶液烘干,得到深棕色固体,将该固体研磨成粉末状,即为壳聚糖降解后的产物。测定其脱乙酰度和粘均分子量。
1.3 微波水热法降解壳聚糖
向三口烧瓶中加入3 g壳聚糖和300 mL浓度为1 % (V/V)醋酸溶液,并按1.2中的方法加入H2O2和α-淀粉酶直至完全溶解。然后将溶液倒入微波水热反应釜中,将反应釜置于微波水热仪中,于800 W、40 ℃下分别反应40、60、90、180 min。将所得溶液烘干,得到深棕色固体,将该固体研磨成粉末状,即为壳聚糖降解后的产物。测定其脱乙酰度和粘均分子量。
1.4 壳聚糖脱乙酰度的测量
用傅立叶变换红外光谱仪在 4 000~400 cm-1的范围内扫描降解过后的壳聚糖,所有扫描都在室温下进行。壳聚糖脱乙酰度按照 Baxter方法计算[11]。
A1320/A1420=0.382 2+0.031 3 (100-DD%)。
(1)
其中:DD为脱乙酰度,A1320为壳聚糖在1 320 cm-1处的吸收峰,A1 420为壳聚糖在1 420 cm-1处的吸收峰。
1.5 壳聚糖粘均分子量的测定
测定高聚物分子量的方法有很多,其中黏度法设备简单且操作方便,并有很好的实验精度,是常用的测量高聚物平均分子质量的方法。粘均分子量(MV) 采用乌氏粘度计测定[12]。将壳聚糖样品溶于 0.2 mol/L 的 CH3COOH/CH3COONa 缓冲溶液中,通过乌式粘度计在温度 (25±0.5) ℃下测得流出时间 (ts) 和溶剂的流出时间 (t0)。其中,特性粘度 [η] 通过以下公式计算:

(2)
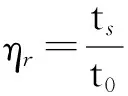
(3)
ηsp=ηr-1。
(4)
其中:ηr为相对粘度,ηsp为增比粘度,c为壳聚糖溶液的浓度。
根据特性粘度[η],粘均分子量MV可以利用Mark-Houwink方程式[13]求得。

(5)
其中,K= 1.64×10-30×DD14。
(6)
α= -1.02×10-2×DD+1.82。
(7)
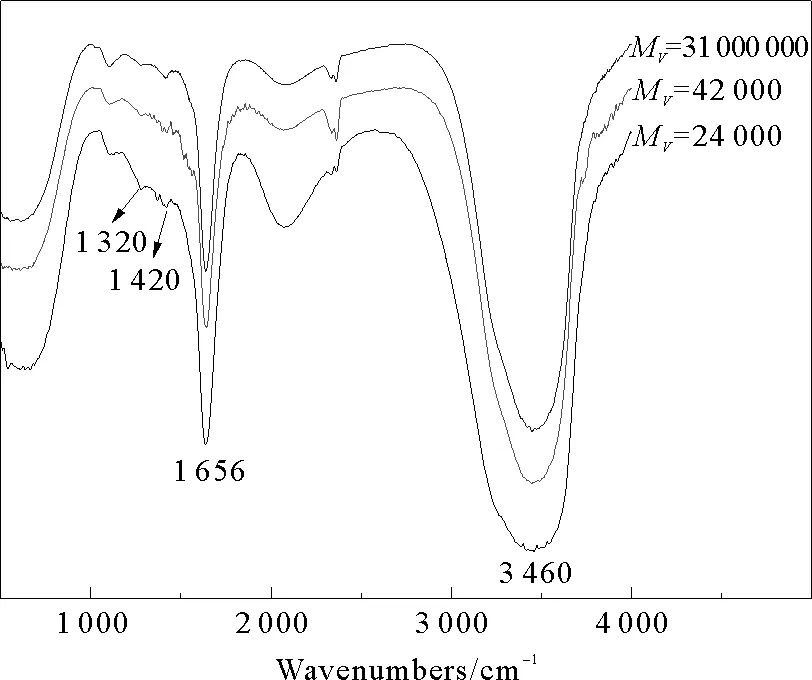
图1 壳聚糖降解前后的FTIR光谱
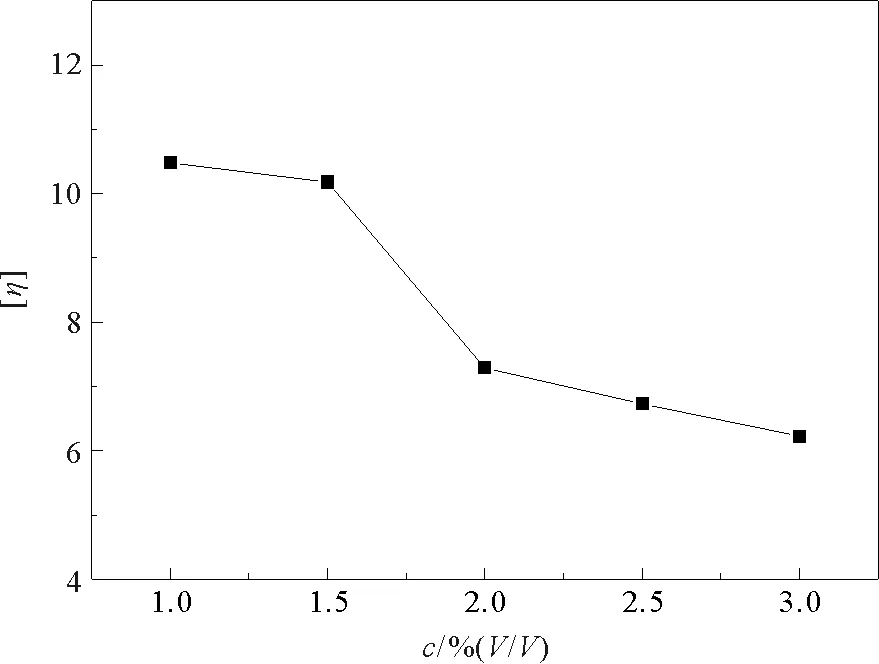
图2 醋酸浓度c与壳聚糖溶液特性粘度[η]的关系图
式中DD为壳聚糖脱乙酰度的百分比表示形式[14]。
2 结果与讨论
2.1 FTIR光谱分析
未降解的壳聚糖和降解后的壳聚糖FTIR光谱如图1所示。在>3 000 cm-1处是壳聚糖—OH 和—NH—的一个强的伸缩振动吸收峰,在1 656 cm-1处是—NH2中的N—H弯曲振动峰和酰胺Ⅰ带吸收峰[15],1 320 cm-1处出现的吸收峰是N-乙酰氨基葡萄糖特征峰[11],1 420 cm-1处出现的峰是酰胺Ⅲ带吸收峰[15]。从图中可见,降解前后壳聚糖的FTIR谱图十分相似,不同分子量的壳聚糖的红外吸收峰的位置一致,峰的相对强弱略微有所不同,但基本保持一致,这表明降解前后壳聚糖的化学结构没有明显改变,降解反应主要发生在糖单元间的β-(1, 4) 糖苷键的断裂。
2.2 醋酸浓度对壳聚糖降解的影响

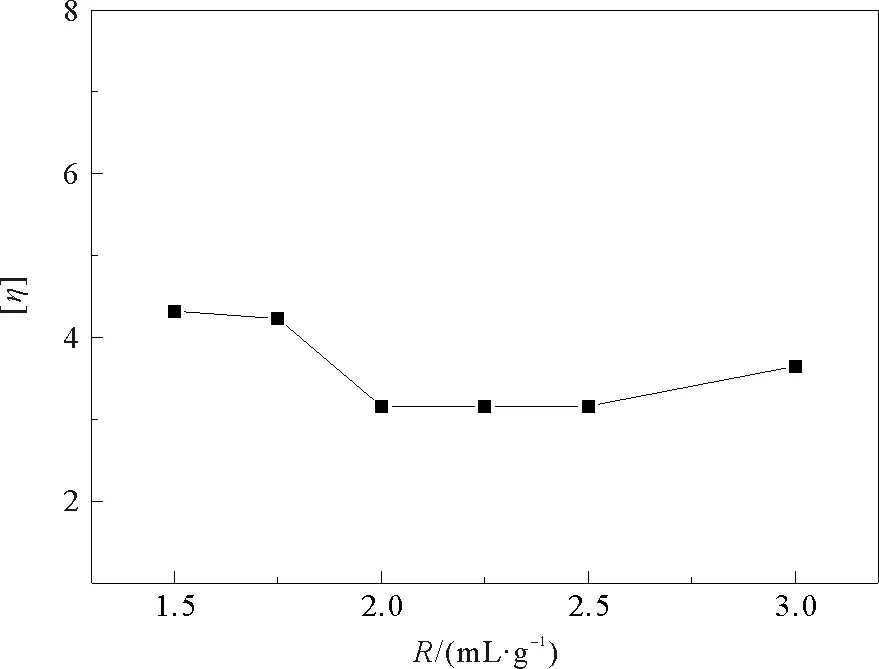
图3 R与壳聚糖特性黏度[η]的关系图

图4 壳聚糖与α-淀粉酶质量比与壳聚糖特性粘度[η]的关系图
2.3 H2O2用量对壳聚糖降解的影响
图3为壳聚糖溶液的特性粘度随溶液中H2O2用量变化的关系曲线,其中R(mL·g-1)为H2O2体积与壳聚糖质量之比。从图中可见随着H2O2用量的增加,特性粘度先减少后上升,在R为2.00~2.50范围内溶液的特性粘度可以达到最低。这是因为在H2O2降解壳聚糖的过程中,H2O2在溶液中分解形成的HO2·、HO·以及(O)等游离基团的量会增加,如式(8)、(9)和(10)所示[6]。
H2O2→ H++ HOO-
(8)
HOO-→ OH-+ (O)
(9)
H2O2+HOO-→ HO· + O2-· + H2O
(10)

2.4 α-淀粉酶用量对壳聚糖降解的影响
图4为壳聚糖在不同α-淀粉酶用量的溶液中降解后的特性粘度曲线。结果表明,随着α-淀粉酶用量的增加,壳聚糖的特性粘度逐渐减少,这表明α-淀粉酶的加入对壳聚糖的降解有明显的促进作用。2 %(V/V)醋酸溶液提供了壳聚糖降解的均相反应条件,而H2O2的存在又提供了氧化能力极强的HO·以及新生态的 (O)等游离基团,α-淀粉酶的加入,能够进一步使壳聚糖的β-(1,4) 糖苷键水解,解决了单纯使用H2O2容易导致褐变反应的问题,能明显加快降解速度,同时使得到的壳聚糖产物保持更好的生物活性和更窄的平均分子量分布[5]。因此醋酸、H2O2和α-淀粉酶相互协同降解壳聚糖,降解效果明显高于单一降解法。然而随着壳聚糖的降解,当特性粘度下降到1.0时,m(壳聚糖):m(α-淀粉酶)=3.0,壳聚糖粘均分子量已经下降了95.48%,此时再加入更多的α-淀粉酶对壳聚糖降解的影响越来越小,同时考虑到成本因素,所以选择适宜α-淀粉酶的用量为m(壳聚糖):m(α-淀粉酶)=3.0。
2.5 微波水热时间对壳聚糖降解的影响
在上述确定的普通水热法降解壳聚糖的适宜条件下,对壳聚糖降解的时间不同,根据公式 (1) 测得的样品的脱乙酰度DD均在80 %左右,同时计算得出降解不同时间壳聚糖的粘均分子量如表1所列。由表1可见降解7 h后,壳聚糖分子量才从31 000 kDa下降到约1 400 kDa,降解速率比较慢。为提高降解效率,在上述优选出来的降解反应体系条件下,采用微波水热法替代普通水热法,仍然在40℃下对壳聚糖进行降解,不同时间下得到的壳聚糖粘均分子量如表2所示。
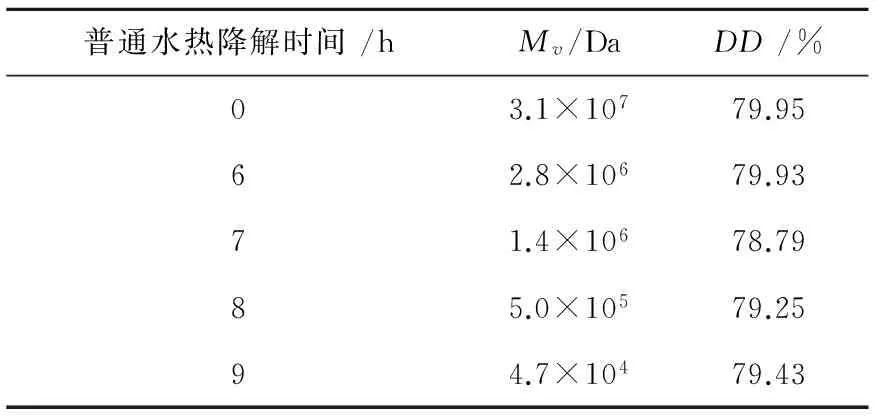
表1 不同普通水热降解时间下的壳聚糖的粘均分子量

表2 不同微波水热降解时间下壳聚糖的粘均分子量
由表2可见,采用微波水热法降解壳聚糖,相比于普通水热法,在相同的反应体系与温度条件下,微波水热降解40 min效果与传统水热9 h的降解效果相当,即壳聚糖粘均分子量下降99.8 %以上。微波水热降解180 min后,壳聚糖粘均分子量从3.1×107Da 下降到2.4×104Da,大大提高了降解效率,缩短降解时间,并且降解后壳聚糖的脱乙酰度没有明显变化,均在80 %左右。
3 结论
使用微波水热法,协同H2O2与α-淀粉酶在40℃下对壳聚糖进行降解,降解40 min的效果即与普通水热法降解9 h的相当,降解时间大大缩短,有效提高了降解效率。FTIR光谱分析表明降解后的壳聚糖化学结构没有明显的改变,并且脱乙酰度也基本未变,是一种高效环保的壳聚糖降解方法,具有广阔的应用前景。
[1]HUANG Y C,WU Y,HUANG W C,et al. Degradation of chitosan by hydrodynamic cavitation[J].Polymer Degradation and Stability,2012,98(1):37-43.
[2]LAYEK B,SINGH J. Chitosan for DNA and gene therapy[J].Chitosan Based Biomaterials,2017(2):209-244.
[3]SALEHI E,DARAEI P,SHAMSABADIA A.A review on chitosan-based adsorptive membranes[J].Carbohydrate Polymers,2016,152(5):419-432.
[4]SIONKOWSKA A,KACZMAREK B,GADZALA-KOPCIUCH R.Gentamicin release from chitosan and collagen composites[J].Journal of Drug Delivery Science & Technology,2016,35:353-359.
[5]韩永萍,林强.壳聚糖降解制备低聚壳聚糖和壳寡糖的研究进展[J].食品科技,2006,7(4):35-38. HAN Yongping,LIN Qiang.Progress of study on preparation of oligochitosan and chitobiose by degrading chitosan[J].Food Science and Technology,2006,7(4):35-38.
[6]QIN C Q,DU Y M,XIAO L.Effect of hydrogen peroxide treatment on themolecular weight and structure of chitosan[J].Polymer Degradation & Stability,2002,76(2):211-218.
[7]WU T,WU C,XIANG Y,et al.Kinetics and mechanism of degradation of chitosan by combining sonolysis with H2O2/ascorbic acid[J].RSC Advances,2016,6(80):76280-76287.
[8]姚邦涛,陈继伟.过氧化氢氧化降解法制备水溶性壳聚糖工艺的研究[J].造纸科学与技术,2015,34(6):60-62. YAO Bangtao,CHEN Jiwei.Study on the preparation of soluble chitosan through the chitosan degraded by hydrogen peroxide[J].Paper Science& Technology,2015,34(6):60-62.
[9]欧春艳,李林通.壳聚糖降解研究的最新进展[J].广州化工,2013,41(6):13-15. OU Chunyan,LI Lintong.Recent progress of study on degradation of chitosan[J].Guangzhou Chemical Industry,2013,41(6):13-15.
[10]LAFFLEUR F,HINTZEN F,RAHMAT D,et al.Enzymatic degradation of thiolated chitosan[J].Drug Development and Industrial Pharmacy,2013,39(10):1531-1539.
[11]BRUGNEROTTO J,LIZARDI J,GOYCOOLEA F M,et al.An infrared investigation in relation with chitin and chitosan characterization[J].Polymer,2001,42:3569-3580.
[12]CHEN R H,HUA H D.Effect of molecular weight of chitosan with the same degree of deacetylation on the thermal,mechanical,and permeability properties of the prepared membrane[J].Carbohydrate Polymers,1996,29(4):353-358.
[13]LU F L,CAO Z S,WANG C,et al.Preparation of low-molecular-weight chitosans[J].Chinese Journal of Biochemical Pharmaceutics,1997,18(4):178-179.
[14]WANG W,BO S,LI S,et al.Determination of the Mark-Houwink equation for chitosans with different degrees of deacetylation[J].International Journal of Biological Macromolecules,1991,13(5):281-285.
[15]WANG W P,DU Y M,QIU Y L,et al.A new green technology for direct production of low molecular weight chitosan[J].Carbohydrate Polymers,2008,74:127 -132.
[16]覃彩芹,肖玲,杜予民,等.过氧化氢氧化降解壳聚糖的可控性研究[J].武汉大学学报,2000,46(2):196-198. TAN Caiqin,XIAO Ling,DU Yumin,et al.Prediction and control of extent of deploymerization of chitosan by hydroperoxide[J].Wuhan University Journal of Natural Sciences,2000,46(2):196 -198.
[17]黄群增,王世铭,王琼生.UV/H2O2降解壳聚糖的研究[J].福建师范大学学报(自然科学版),2004,20(4):63-67. HUANG Qunzeng,WANG Shiming,WANG Qiongsheng.Study on degradation of chitosan with UV/H2O2[J].Journal of Fujuan Normal University (Natural Science Edition),2004,20(4):63 -67.
(责任编辑:吕海亮)
Microwave Hydrothermal Degradation of Chitosan
WU Taiheng, SHAO Qian, ZHAO Wenli
(College of Chemical and Environmental Engineering, Shandong University of Science and Technology, Qingdao, Shandong 266590, China)
A novel method of degradation of chitosan was investigated by using microwave hydrothermal method in the presence of H2O2and α-amylase with dilute acetic acid solution as solvent. The effects of the concentration of acetic acid, the dosage of H2O2and α-amylase, and the time of microwave hydrothermal on the degradation of chitosan were evaluated. And the structure of the degraded product was characterized by FTIR(Fourier Transform Infrared Spectroscopy). The results show that with the microwave hydrothermal method, the viscosity-average molecular weight of chitosan can decrease by more than 99.8% after 40 minutes’ reaction at 40℃ under the condition ofV(H2O2):m(chitosan)=2 mL/g andm(chitosan):m(α-amylase)=3, while it takes 9 hours to get the same degree of degradation with the traditional hydrothermal method. Therefore, the microwave hydrothermal method, which greatly improves the efficiency of the degradation of chitosan without changing the main macromolecular structure of chitosan, is a high efficient and environmentally friendly degradation method.
chitosan; microwave hydrothermal method; degradation; H2O2; α-amylase
2016-04-17
山东科技大学优秀教学团队建设计划项目(JXTD20160510)
武泰恒(1991—),男,山东济南人,硕士研究生,主要从事应用化学研究. 邵 谦(1964—),女,浙江宁波人,教授,博士,主要从事应用化学研究, 本文通信作者. E-mail: shaoqian01@163.com
O636.1
A
1672-3767(2017)02-0081-06

