丹参多酚酸盐的药理作用机制及临床应用研究进展
赵彩霞 靳会欣
·综述与讲座·
丹参多酚酸盐的药理作用机制及临床应用研究进展
赵彩霞 靳会欣
丹参多酚酸盐为丹参素的衍生物,是酚类物质的高度纯化,为丹参的主要活性部位之一。其功能为活血、化瘀、通脉,用于冠心病稳定型心绞痛。目前,随着细胞水平及分子水平的发展,该成分的药理作用及机制也进一步被揭示,临床应用范围不断扩大,在脑梗死、肝肾系统疾病等方面均有涉及。本研究通过查阅近5年文献,丹参多酚酸盐的作用机制及临床应用范围进行综述。
丹参;丹参多酚酸盐;药理机制
丹参为唇形科多年生草本植物丹参Salvia miltiorrhizaBge.的干燥根茎,其味苦,性微寒,入心、肝经,具有活血通络、散瘀止痛、清心安神、凉血消肿之功效,是我国应用最为广泛的中草药。临床常作为活血化瘀类药物治疗心脑血管疾病、神经性疾病、脏器纤维化及肿瘤等,并有抗氧化、免疫调节等作用[1]。其化学成分主要分为脂溶性二萜醌类和水溶性酚酸类2类,其中水溶性酚酸类以丹参素和原儿茶醛含量较高,活性较强。丹参多酚酸盐为丹参素的衍生物,是酚类物质的高度纯化,为丹参的主要活性部位之一。目前,随着细胞水平及分子水平的发展,该成分的药理作用及机制也进一步被揭示,临床应用范围不断扩大[2],现就近年来国内外对丹参多酚酸盐的药理作用及临床应用作一综述,为进一步研究开发和临床合理应用提供有力借鉴和指导。
1 对心血管的保护作用
丹参多酚酸盐对心血管系统具有非常广泛的药理作用,如清除缺血部位的自由基、保护血管内皮损伤,抗动脉粥样硬化;改善微循环,减轻心肌缺血损伤;抗血小板聚集及黏附,扩张冠状动脉,增加冠脉流量,保护心脏功能等。
1.1 抑制氧化应激 有学者从氧化应激的角度探讨丹参多酚酸盐对心血管的作用。氧化应激在动脉粥样硬化的发生发展过程中起着重要作用,大量实验表明,丹参素是一种强抗氧化剂[3]。亲环素A(cyclophilin A,CyPA)属于亲环素家族,在蛋白质的折叠、运输、细胞内信号传导等方面具有重要作用,是影响内皮细胞、血管平滑肌细胞和炎性细胞功能的中介物。作为一种氧化应激诱导因子,胞外的CyPA可促进内皮细胞表达黏附分子,促进炎性细胞浸润,促进平滑肌细胞增殖迁移以及通过调节清道夫受体的表达促进血管壁低密度脂蛋白(LDL)的摄取等途径参与动脉粥样硬化的形成。动物实验研究证实,丹参多酚能够下调动脉粥样硬化大鼠血清CyPA,提高机体抗氧化能力[4]。
缺血性心肌损伤时,心肌中的自由基过氧化代谢产物的释放量增多,同时抗氧化酶的酶活力降低。NADPH氧化酶(Nox)是血管内生成活性氧簇(ROS)的主要酶体,是参与氧化应激的主要的酶系[5],而丹参多酚酸盐可明显减弱吞噬细胞NADPH氧化酶p22phox活性,进一步抑制氧化应激的水平,从而发挥抗心肌缺血,保护缺血-再灌注损伤的作用[6]。张殿福等[7]研究显示,丹参多酚酸盐能够降低血浆BNP水平,升高血浆超氧化物歧化酶(SOD)、谷脱甘肽过氧化物酶(GSH-Px),清除氧自由基活性,阻断心肌梗死后的氧化应激状态,促进梗死心功能改善。
1.2 保护血管内皮损伤 血管内皮损伤是导致或加重动脉粥样硬化的重要因素,也是高血压、心力衰竭、冠心病等多种心脑血管疾病的共同病理基础。临床试验证实丹参多酚酸盐是一个安全、高效、质量稳定的具有改善血管内皮损伤的药物,能够促进舒张血管的活性因子一氧化氮(NO)的释放,减少收缩血管的活性因子内皮素-1(ET-1)的释放,从而恢复血管正常的舒缩功能[8]。血管内皮损伤过程中的炎症可造成细胞释放炎性介质和细胞黏附分子,加重内皮损伤。丹参多酚酸盐能有效降低血管细胞黏附分子-1(VCAM-1)、血管性假血友病因子(vWF)、内皮细胞钙黏蛋白(VE-Ca)等,调控黏附分子的表达,降低肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-1)和C-反应蛋白(CRP)等炎性因子水平,阻断内皮细胞参与的炎性反应从而发挥对心脑血管血管内皮的保护作用[9,10]。
1.3 抗血小板聚集及黏附 血栓形成是许多心脑血管疾病的主要发病原因,在血栓形成过程中血小板的活化发挥了重要作用。临床研究显示,丹参多酚酸可能够改善冠心病稳定性心绞痛患者血小板凝集率抑制血小板聚集与黏附,并呈时间依赖性,在3~5 h达到高峰,药效的达峰时间落后于血药浓度达峰时间,随后逐渐下降,作用维持约15 h[11]。纤维蛋白原是存在于血浆中的一种应激反应蛋白,由肝脏合成,具有凝血功能,是凝血反应中的关键凝血因子。丹参多酚酸可降低冠心病心绞痛及脑梗死患者血小板聚集功能,降低血浆纤维蛋白原,改善凝血系统[12,13]。
血小板膜糖蛋白GPⅡb/Ⅲa是血小板膜上最丰富的受体,其受体与相应的配体相结合是血小板黏附、聚集的关键环节。目前,国内外在临床上应用GPⅡb/Ⅲa复合物拮抗剂取得了较好的临床联系。刘磊等[14]研究显示,丹参多酚酸盐对制急性冠脉综合征患者的GPⅡb/Ⅲa复合物和颗粒膜蛋白P选择素表达具有抑制作用,提示丹参多酚酸盐能够抑制血小板聚集最终途径重要糖蛋白表达,可影响血小板ADP的 P2Y12受体后的信号传导。国外研究显示,丹参多酚酸盐能够通过影响整联蛋白α2β1发挥抗血小板聚集作用[15]。HCY可通过对血管内皮细胞的毒性作用,引起血管内皮损伤,促进血管平滑肌细胞增殖,活化血小板,促进血栓形成。丹参多酚酸盐可降低高血压及脑梗死患者体内血浆HCY水平,防止血栓形成,进而改善患者内皮功能,降低其他心血管事件的发生[16,17]。另有研究显示,丹参多酚酸盐能够在一定浓度增加血小板一氧化氮合酶eNOS活性,增加NO含量,从而抑制血小板膜Ca2+的跨膜转运,减少血小板内Ca2+水平,从而抑制血小板聚集[18]。
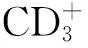
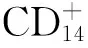
1.5 稳定斑块 细胞外基质的变化与心血管疾病的发展关系密切,其含有的胶原具有弹性和韧性,对稳定斑块的完整、防止斑块破裂至关重要。基质金属蛋白酶(MMPs)是一类降解细胞外基质的蛋白酶,能通过降解血管内细胞间质的胶原成分促进粥样斑块破裂。研究显示,不稳定斑块中存在着MMP-9、MMP-2等MMPs家族的高表达,其中MMP-9表达量是较稳定斑块的3~5倍[28]。丹参多酚酸盐能够下调MMP-9 mRNA的表达,降低血清MMP-2水平,从而稳定易损斑块,改善冠心病、心绞痛患者预后[29]。血管内的组织因子(TF)能够诱导细胞凋亡,促进斑块不稳定,组织因子途径抑制物2(TFPI-2)是体内重要的TF生理性拮抗剂,它存在于细胞外基质,可抑制基质金属蛋白酶,稳定斑块。动物实验显示,丹参多酚酸盐能够增加兔股动脉斑块中TFPI-2的表达,从而阻止细胞外基质中的proMMPs活化为MMPs,使MMP-2表达下调,提高斑块的稳定性,进而抑制了因斑块破裂所致的TF释放[30]。Ang Ⅱ是肾素血管紧张素系统(RAS)的主要活性肽,可促进血管内皮细胞紧密连接的开放及VEGF的表达,同时促进斑块中的血管生成,促进斑块生长,增加了斑块的不稳定性;AngⅡ还可抑制血液纤溶系统活性,加快缓激肽降解,促进血小板聚集、释放,从而影响冠状动脉斑块的稳定。丹参多酚酸盐可通过降低循环中AngⅡ水平、稳定斑块发挥心血管保护作用[31]。
1.6 促进血管生成 近年来,治疗性血管新生的观点使冠心病的防治研究从单纯改善病变血管供血转为促进侧支循环的建立[32]。动物实验表明,丹参多酚酸盐能够促进猪急性心肌梗死周围促进血管新生及侧支血管的生成,从而改善心肌缺血及心功能[33]。VEGF是促进血管生成特异性最高、功能最强的调控因子,吴峰等[34]研究显示,丹参多酚酸盐促进斑马鱼血管新生的机制可能与通过上调VEGF的表达有关。体外研究显示,丹参多酚酸盐能有效促进EA-hy926细胞增殖、血管新生及VEGF的表达,从而实现改善心肌梗死后大鼠心功能的作用[35]。徐杰[36]的迁移实验结果示经丹参多酚酸盐处理后内皮细胞的迁移数增加,单核细胞VEGF mRNA和bFGF mRNA均有升高,VEGF和bFGF蛋白水平也有上升,因此具有促血管生成效应。方凌燕等[37]研究显示,丹参多酚酸盐对心肌梗死后大鼠血管新生有促进作用,其作用机制为上调心肌miR-126、VEGF表达,并呈剂量依赖性。陈建军等[38]通过体外研究证实,丹参多酚酸盐干预后髓间充质干细胞(MSCs)中的细胞外调节蛋白激酶1(ERK1)、磷酸化细胞外信号调节激酶(pERK1)、蛋白激酶(AKT)、磷酸化蛋白激酶(pAKT)蛋白表达量明显增加,推测丹参多酚酸盐通过ERK/AKT途径促进血管新生,为干细胞移植治疗心肌梗死提供一条新思路。
1.7 保护缺血性心肌损伤 丹参多酚酸盐对各种原因引起的心肌缺血均具有明显的改善作用,其作用机制有:(1)通过上调心肌细胞增强Bcl-2表达,抑制半胱氨酸蛋白-3(Caspase-3)表达,阻遏心肌细胞凋亡,防止心室重构[39,40];通过增加心肌细胞Calumenin表达,缓解内质网应激,减少心肌细胞凋亡[41];(2)改善微循环障碍和血液流变性异常,降低血清中sCD40L,影响E-选择素、P选择素水平从而保护血管内皮内皮功能,调控不稳定斑块部位的炎性反应,逆转或减慢血管的重塑,减少心肌缺血再灌注损伤[42];(3)可减轻氧化应激反应,提高SOD、NO水平,降低血清CTnT 水平,减少心肌细胞凋亡,促进心肌细胞修复;(4)降低肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH),抑制其对心肌的损伤[43,44];(5)维持大鼠缺血心肌线粒体Na+,K-ATP酶和Ca2+-ATP酶的活性,持线粒体正常的结构和功能,从而降低缺血再灌注对心肌线粒体的损伤保护心肌[45]。杨春娟等[46]研究还显示,能够相对增加线粒体呼吸链酶复合体Ⅰ~Ⅳ的活性,改善其能量代谢,减少氧自由基的生成,实现对大鼠离体心肌缺血/再灌注损伤的保护作用。
2 对脑血管的保护作用
临床研究显示,丹参多酚酸主要用于轻中度脑梗死恢复期的辅助治疗,能有效改善患者临床症状及神经功能缺损情况,提高患者日常生活能力,促进急性脑梗死患者认知功能的恢复,有具有良好的效果,且临床应用安全、对患者肝肾功能及生命体征影响甚小。其具体的作用机制体现以下几个方面[47,48]:
2.1 调节纤溶系统 纤溶功能在脑梗死的发病机制中起重要,血液在血管中的正常流动有赖于血浆中凝血功能及纤溶功能的动态平衡。组织型纤溶酶原激活物(tPA)和纤溶酶原激活抑制剂(PAI)-1是纤溶系统中相互拮抗的一对因子,tPA为纤溶酶原激活物,可溶解血栓,使血管再通,PAI-1是tPA的拮抗物,二者平衡对机体纤溶功能起着决定性的作用。而在脑缺血/再灌注损伤过程中纤溶系统失衡,PAI-1水平明显上升、tPA水平明显下降,血液处于高凝状态。赵利等[49]研究显示,丹参多酚酸盐可以调节改善PAI-1、tPA水平,恢复脑梗死患者纤溶系统平衡。此外,丹参多酚酸盐还能降低、凝血酶调节蛋白(TM)、血小板计数、血栓素B2(TXB2),升高前列环素化时产物、抗凝血酶-Ⅲ,从而恢复纤溶系统平衡[50]。
2.2 抗炎 脑缺血性损伤后大脑神经胶质细胞被激活,外周血液系统中白细胞即开始向中枢神经系统渗出、黏附,炎性因子大量释放,如TNF-α、白介素-Iβ(IL-1β)、IL-6等,进而损伤神经系统内皮细胞,导致血脑屏障破坏、神经细胞凋亡坏死,引发炎性级联反应,加重脑缺血性损伤[51]。丹参多酚酸能够降低脑梗死的血黏度和炎性反应,提高神经功能[52]。动物实验显示,丹参多酚酸治疗能够减轻脑缺血再灌注损伤大鼠血清及脑组织炎性因子反应,起到了缺血再灌注脑损伤的保护作用[53]。此外,丹参多酚酸还可通过提高抗炎性因子IL-10的表达来减轻炎性反应,发挥脑缺血损伤中的神经保护作用[54]。
2.3 抗脑缺血/再灌注 丹参多酚酸有明确的抗脑缺血损伤作用,其作用机制主要有:(1)神经保护:降低脑梗死患者血液黏滞度,改善脑血流动力学,增强受损脑部的血管扩张,改善缺氧脑组织的代谢率,促进脑梗死患者神经功能;上调脑组织内SOD、GSH-Px活性、过氧化氡酶(CAT)活性,降低MDA、黄嘌呤氧化酶(XO)含量,抑制自由基引起的脂质过氧化反应,保护抗氧化酶的活性,从而介导神经保护作用[55,56]。增加急性脑梗死后脑源性神经营养因子营养神经[57]。基因研究显示,丹参多酚酸能下调原癌基因家庭成员中的c-fos基因表达,抑制脑缺血再灌注后细胞凋亡,促进恢复[58]。可抑制NADPH胞浆亚基p47phox,p67phox的膜转位及胞膜亚基gp91phox的增加,激活AMPK,抑制Akt的磷酸化及PKC的转位,即调节AMPK/Akt/PKC相关通路抑制脑缺血再灌注后NADPH 氧化酶的激活,从而发挥脑缺血再灌注损伤保护作用[59]。(2)血脑屏障保护:S100β是一种钙结合蛋白,主要分布于周围神经系统及中枢神经系统的雪旺细胞和星状胶质细胞,健康成人由于正常的血脑屏障血液中难以检测到S100β。而当脑组织受到损伤后,S100β可释放入脑脊液,同时由于血、脑屏障破坏、通透性增加,导致血S100β蛋白水平升高。报道显示,丹参多酚酸能够降低急性脑患梗死者S100β,提示该药有血脑屏障保护的作用[57]。何前松等[58]从分子机制研究显示,丹参多酚酸能通过下调MMP-9改善糖尿病脑缺血再灌注损伤血脑屏障通透性,拮抗脑损伤,促进神经功能恢复。(3)促进血管新生:白蓉等[60]研究显示,丹参多酚酸在缺血性脑血管病早期可通过增强VEGF 的表达促进血管内皮细胞的增殖,发挥血管保护、促进神经突触增生及缺血大脑重塑的作用。李耀汝[61]研究显示,丹参多酚酸可通过JAK2/STAT3信号通路调节血管生长因子VEGF、Ang-1、Ang-2,促进脑缺血后血管生成,改善脑缺血小鼠神经功能评分。
3 对肾的保护作用
丹参多酚酸对肾的保护作用可通过改善微循环、抗炎、抗氧化、改善缺血再灌注损伤、阻滞钙通道等多种药理活性为多靶点、多环节起效。近年来,又有学者进行了深入研究。邵命海等[62]从肾内氧耗变化的角度研究其作用机制显示,丹参多酚酸盐可以降低血清尿素氮 (BUN)、肌酐酐(Scr)水平,提高内生肌酐清除率和血红蛋白水平,升高残余肾组织血流量(RBF)和左肾静脉氧压(RVPO),从而降低肾内氧耗,改善肾功能和肾组织纤维化,延缓慢性肾脏疾病的进展和终末期肾衰的到来,其作用强度与科素亚加蒙诺相当。
转化生长因子-β1(TGF-β1)主要分布于肾脏,参与细胞外基质代谢,在正常情况下能调节组织的损伤修复,而过量生成则促进肾组织纤维连接素的表达过程。MCP-1属于趋化因子C—C,是TGF-β1作用的上游因子,介导单核细胞、巨噬细胞的募集和浸润。MCP-1在生理状态下呈低表达,可通过TGF-β途径促进肾小球纤维化,导致肾脏的病变。赵琪等[63]报道显示,丹参多酚酸盐注射液可以通过降低糖尿病肾病患者TGF-β和MCP-1水平来减少细胞外基质,延缓肾组织纤维化,改善近端肾小管功能。
温海滨等[64]报道,丹参多酚酸盐能通过其显著的抗氧化能力,抑制H2O2诱导的肾小管上皮细胞凋亡,其作用机制可能与其增加Survivin mRNA表达有关,可用于肾脏急性损伤的治疗。丹参多酚酸盐还可通过降低血中Hcy、ET-1水平,增加血浆CGRP水平,改善血管内皮功能,保护早期肾病肾脏的残余功能,防止肾功能的进一步恶化[65]。血管性血友病因子裂解酶(vWF-CP)裂解vWF起到抗血栓形成的作用,有助于机体维持出血、凝血平衡,人肾小管上皮细胞可表达vWF-CP,丹参多酚酸盐可能通过对其的上调作用来防止微血管内微血栓形成,改善肾脏局部微循环,延缓肾功能减退,且在一定浓度范围内与药物剂量呈正相关性[66]。动物实验证实,丹参多酚酸还可通过其较强的抗脂质过氧化及清除氧自由基能力,降低氧化应激对肾小管上皮细胞膜的损害,减轻肾小管上皮细胞损伤,进而减少尿草酸钙结晶在肾小管上皮黏附,抑制肾草酸钙结晶的生成,为治疗肾结石提供了依据[67]。
4 其他
4.1 治疗肺相关疾病 临床报道显示,丹参多酚酸盐治疗特发性肺纤维化的疗效纤维化有较好的疗效,可能与其抗氧化损伤作用,减少氧自由基生成,减轻成纤维细胞增生及胶原蛋白的合成有关[68]。丹参多酚酸盐在单肺通气肺损伤中保护作用体现在通过抗氧化应激、抗炎以及提高表面活性蛋白A(SPA)分泌以维持维持肺通气及局部微循环[69]。滕飞等[70]研究证实,丹参多酚酸盐还具有减轻肝脏缺血再灌注后肺损伤的作用,能降低疾病小鼠肺湿/干重比,减轻肺组织水肿,其作用机制为抑制肺组织内TNF-α、IL-6、IL-1β等炎性介质的释放及NF-кB等炎症信号通路活化。
4.2 治疗肝硬化及肝纤维化 丹参多酚酸盐能改善实验性肝硬化大鼠肝组织炎症程度,降低肝硬化大鼠病死率,其分子作用靶位为抑制肝组织TNF-α和IL-6 mRNA表达;还能促进肠黏膜分泌型免疫球蛋白A(sIgA)肠黏膜上皮slgA合成与分泌增加,降低肝硬化大鼠门静脉血内毒素水平,促进肠黏膜上皮结构损伤恢复,保持形态完整,增强黏膜局部免疫功能,维护肠黏膜屏障功能[71,72]。对肝纤维化的治疗上,丹参多酚酸盐可改善肝纤维化大鼠肝脏病理组织学结构,降低血清中ALT、AST、CIV、LN表达,其作用机制为提高大鼠肝脏组织胞质内NF-кB和IкBα的表达、降低胞核内来NF-кB的表达抑制肝纤维化的进展[73]。
4.3 骨科 脊髓缺血再灌注损伤是原发性脊髓损伤的继发性损害,是造成神经细胞损伤的重要因素之一,常见于脊柱外科手术导致的脊髓缺血。李夏静等[74]总丹参多酚酸预处理大鼠脊髓缺血再灌注损伤,在光学显微镜下脊髓病理改变轻微,损伤较轻,后肢神经功能评分升高,其机制为丹参多酚酸能够降低脊髓匀浆中MDA 的水平,增强 SOD 和 CAT 酶的活力,降低 GSH-Px 酶的活力,改善氧化和抗氧化系统的平衡,减少氧化应激反应,从而保护并改善脊髓的神经和运动功能,并能缓解病理学损伤。习诗良[75]研究显示,丹参多酚酸对佐剂型关节炎大鼠具有一定的治疗作用,能减轻佐剂关节炎大鼠的足趾肿胀度、降低足趾疼痛指数,改善踝关节病理组织形态。
4.4 癫痫 神经肽Y(NPY)有抗癫痫作用,丹参多酚酸可能通过NPY的高表达来降低急性癫痫痉挛性大鼠的发作等级和发作时间。内源性脑源性生长因子(BDNF)是神经生长因子家族的成员之一,与癫痫密切相关,脑内高表达的BDNF对癫痫有保护作用。丹参多酚酸盐可调节神经GABA-Glu的失衡,促进神经元修复,使癫痫发作后海马区BDNF的表达增高,产生特异性抑制神经元损伤的作用。FOS蛋白作为即早反应基因c-fos基因的蛋白产物已被广泛用于神经元兴奋性的标记物,抗癫痫药物则具有抑制该基因表达的作用,丹参多酚酸盐可通过某种机制抑制癫痫大鼠海马FOS的表达起到抗癫痫作用,但具体的作用机制有待进一步研究[76-78]。
4.5 其他 张彬等[79]研究显示,丹参多酚酸能增加小型猪下血管穿支皮瓣(DlEP)皮肤血流灌注量,降低血液黏稠度,抑制血小板聚集,改善血液流变学,抑制皮瓣血栓形成,降低血管危象的发生率,提高皮瓣存活面积,而对凝血四项无明显影响,安全性高。
丹参多酚酸盐注射液是国家二类中药新药,以其显著的抗氧化应激、改善微循环、抗血小板聚集、调节血脂代谢、抗血栓形成等药理活性,集中应用于冠心病心绞痛、脑梗死的治疗,取得了良好的治疗效果,且可用于肝、肾、肺等相关疾病的治疗。丹参多酚酸盐具有改善血管内皮功能、促进血管生成等作用。随着对其作用机制研究的深入,丹参多酚酸盐临床适应证也不断在扩展,在肝、肾纤维化及肿瘤的防治方面,丹参多酚酸盐有望作为创新药物得到进一步开发。但目前丹参多酚酸盐的研究多为临床报道,基础研究较少,若加强此方面的研究,丹参多酚酸盐能更广泛的应用于临床,得到进一步开发。
1 刘光颖,李峥.丹参现代药理研究概述.实用中医内科杂志,2013,12:153-156.
2 董衍军.丹参多酚酸盐的临床应用.中国实用医药,2011,6:258-259.
3 Tang YQ,Wang MH,Le XY,et al.Antioxidant and cardio-protective effects of Danshensu (3-(3,4-dih-ydroxyph-eny1)-2-hydroxy-propanoic acid from salvia miltiorrhiza)on isoprot-erenol—induced myocardial hypertrophy in rats.Phytomedicine,2011,18:1024-1030.
4 盛冲霄,黎红华.丹参多酚对动脉粥样硬化大鼠血清CyPA、8-iso -PGF2α水平的影响.湖北中医杂志,2015,37:18-20.
5 Braunersreuther V,Jaquet V.Reactive oxygen species in myocardial reperfusion injury:from physiopathology to therapeutic approaches.CurrPharmBiotechnol,2012,13:97-114.
6 李光彩,姚宗芹,杨树国,等.丹参多酚酸盐对急诊PCI患者术后MDA、NADPH氧化酶p22phox活性的影响.中国医学创新,2015,12:35-37.
7 张殿福,王明伟,王连生,等.丹参多酚酸盐对猪急性心肌梗死后氧化应激指标和脑钠肽的影响.中西医结合心脑血管病杂志,2008,6:1304-1306.
8 夏静雯,李岩松,奚茵华.丹参多酚酸盐联合西药治疗冠心病不稳定型心绞痛的临床疗效及对血清 NO、ET-1的影响.现代中西医结合杂志,2016,25:375-378.
9 陈敏.丹参多酚酸盐对术后危重症患者血管内皮细胞的保护作用.中国老年学杂志,2012,32:60-61.
10 马增玉,吕建卫.注射用丹参多酚酸盐注射液对急性脑梗死患者血浆肿瘤坏死因子α及C反应蛋白的影响.河北中医,2013,35:899-901.
11 高辉,李先辉,李春艳,等.丹参多酚酸对健康人血小板聚集与黏附的影响.蚌埠医学院学报,2007,32:514-516.
12 谢晓琴.丹参多酚盐对不稳定型心绞痛患者PAG、Fg、Hcy的影响.福建中医药大学,2011.
13 郝彦超,苏建.丹参多酚酸对脑梗死患者血液流变学和神经功能的影响.中国实用神经疾病杂志,2014,17:67-68.
14 刘磊,温志超,罗心平,等.丹参多酚酸盐抑制急性冠脉综合症血小板膜糖蛋白表达的临床研究.中成药,2012,34:2290-2295.
15 Ma C,Yao Y,Yue QX,et al.Differential proteomic analysis of platelets suggested possible signal cascades network in platelets treated with salvianolic acid B.Plos One,2011,6:e14692-e14692.
16 王建评.注射用丹参多酚酸盐联合阿司匹林在高血压抗血小板聚集中的应用.成都医学院学报,2015,10:734-736.
17 许伟,宋新军,赵林,等.丹参多酚酸对脑梗死患者的疗效及对同型半胱氨酸的影响.河北医科大学学报,2015,36:1053-1055.
18 王稳,徐标.丹参多酚酸盐对健康人血小板内皮型一氧化氮合酶活性的影响.中华高血压杂志,2007,15:554-556.
19 张辉,张杨,杨蓉,等.丹参多酚酸盐对急性冠脉综合征患者炎症因子影响的相关研究.中国中西医结合杂志,2013,33:598-601.
20 邱雅慧,薛凌,高夏青.丹参多酚酸盐对慢性心力衰竭患者心功能及炎症因子的影响.中国实验方剂学杂志,2013,19:321-323.
21 江宗朋,季祥武,张爱元,等.丹参多酚酸盐对不稳定型心绞痛患者炎症反应的影响.中华临床医师杂志:电子版,2012,6:6097-6098.
22 赵惠君,胡剑平,袁美霞,等.丹参多酚酸盐对老年不稳定型心绞痛患者炎症因子的影响.老年医学与保健,2011,17:312-314.
23 王凤儒,李凤霞,金娟.丹参多酚酸盐对冠心病患者免疫相关指标的影响.中医药学报,2014,42:187-189.
24 陈昕琳,顾仁樾,章怡祎.丹参多酚酸B对动脉粥样硬化大鼠炎症细胞因子的影响.上海中医药大学学报,2011,25:63-67.
25 陈昕琳,章怡祎,顾仁樾.丹参多酚酸B对动脉粥样硬化大鼠OX40/OX40L免疫通路研究.陕西中医,2012,33:758-761.
26 周坤,王梅.丹参多酚酸盐对老年冠心病心绞痛患者血清VEGF、MMP-9的影响.临床合理用药杂志,2015,8:1-2.
27 王喜福,叶明,王劲松,等.丹参多酚酸盐对急性心肌梗死PCI术后CD14+单核细胞活性氧和Toll样受体的影响.心肺血管病杂志,2013,32:243-246.
28 Kulach A,Dabek J,Glogowska-Ligus J,et al.Efects of standard treatment on the dynamics of matrix metaloproteinases gene expression in patients with acute coronary syndromes.Pharmacol Rep,2010,62:1108-1116.
29 王金菊,代大顺.丹参多酚酸盐对不稳定型心绞痛疗效及血清MMP-2的影响.临床医学,2013,33:15-17.
30 黄成磊,罗心平,梁旺,等.丹参多酚酸盐对动脉硬化斑块组织因子及组织因子途径抑制物影响的实验研究.上海医学,2007,26:186.
31 江宗朋,季祥武,张爱元,等.丹参多酚酸盐治疗不稳定型心绞痛的疗效及其对AngⅡ、UA、VEGF的影响.山东医药,2012,52:25-27.
32 Yla-Herttuala S,Rissanen Tr,Vajanto I.Vascular endothelialgrowth factors:biology and current status of clinical applications in cardiovascular medicine.J Am CollCardiol,2007,49:1015-1026.
33 王明伟.丹参多酚酸盐对猪急性心肌梗死后侧支循环形成及心功能影响的实验研究.南京医科大学,2009.
34 吴峰,王国坤,安丽娜,等.丹参多酚酸盐对斑马鱼胚胎血管新生的影响及分子机制初步研究.现代生物医学进展,2012,12:7005-7007.
35 史海波.丹参多酚酸盐和三七总甙诱导血管新生作用及对大鼠心肌缺血的保护作用.南京医科大学,2015.
36 徐杰.丹参多酚酸盐对血管生成的研究.复旦大学,2003.
37 方凌燕,刘衍宇,李国达,等.丹参多酚酸盐对大鼠梗死后心肌组织血管新生的影响及机制研究.国际心血管病杂志,2015,42:256-260.
38 陈建军,彭华,郑景辉,等.丹参多酚酸盐干预后骨髓间充质干细胞的成血管作用研究.广西医学,2015,37:1533-1535.
39 王明伟,张殿福,唐建金,等.丹参多酚酸盐对猪急性心肌梗死后心肌细胞凋亡和心功能的影响.中西医结合学报,2009,7:140-144.
40 卫银芝,赵芳,熊世熙,等.丹参多酚酸盐对糖尿病心肌病保护作用及可能机制.安徽医药,2013,17:1656-1659.
41 刘崇斌,王伊林,柴花,等.丹参多酚酸盐对阿霉素诱导的扩张型心肌病大鼠心功能的影响及机制研究.临床心血管病杂志,2016,32:134-138.
42 杨溶海,方长庚,梁建光.丹参多酚酸盐对急性心肌梗死患者血清sCD40L、E-选择素、P-选择素的影响.中国动脉硬化杂志,2014,22:502-504.
43 刘志宁,赵庆霞,尤莉.丹参多酚酸盐注射液对猝死型冠心病复苏过程中的心肌保护作用.南方医科大学学报,2010,30:645-646.
44 叶树林,王晓蕾,陈利平.丹参多酚酸盐对兔心肌再灌注损伤的保护作用.解放军医学院学报,2011,32:654-655.
45 王靖,甄江涛,田志辉,等.丹参多酚酸对大鼠缺血心肌线粒体酶的影响.天津医科大学学报,2012,18:295-298.
46 杨春娟,李忠诚.丹参多酚酸预处理及后处理对大鼠心肌线粒体呼吸链的影响.中国中西医结合急救杂志,2012,19:98-99.
47 侯兴旺,王颖慧.丹参多酚酸对急性缺血性脑卒中的疗效分析.中国现代医生,2015,53:100-102.
48 张玉霞.注射用丹参多酚酸辅治脑梗塞疗效观察.中医临床研究,2014,6:91-92.
49 赵利,郑直,赵榕.丹参多酚酸盐对脑梗塞后患者血浆纤溶平衡的影响.心血管康复医学杂志,2010,19:549-551.
50 刘红梅,肖艳林.注射用丹参多酚酸盐辅助治疗脑梗死患者临床研究.海南医学院学报,2016,22:484-487.
51 Jafarinaveh HR,Allahtavakoli M,Rezazadeh H,et al.Proinflammatory cytokines in the emboliem odel of cerebral ischemia in rat.Iran J Allergy Asthma Immunol,2014,13:125-130.
52 陈红东,吴学永,李春梅.注射用丹参多酚酸钠治疗脑梗死的临床观察.中医临床研究,2016,8:8-9.
53 陈欢,任越,贾万龙,等.丹参多酚酸对大鼠脑缺血再灌注后炎性因子的影响.陕西中医,2015,36:1690-1691.
54 史银玲.丹参多酚酸对脑缺血大鼠TNF-α、IL-10表达的影响.郑州大学,2015.
55 王强,张一,李璐,等.丹参多酚酸盐对大鼠脑缺血再灌注过氧化损伤的保护作用.右江医学,2010,38:665-667.
56 王强,张一,李璐,等.丹参多酚酸盐对缺血再灌注大鼠脑组织中CAT、XO及NO的影响.中国血液流变学杂志,2010,20:522-524.
57 董晓柳,朱丽霞,徐士军,等.丹参多酚酸对急性脑梗死患者脑源性神经营养因子S100β炎性因子认知功能的影响.山西医药杂志,2015:2816-2818.
58 何前松,马萌萌,胡利民,等.丹参多酚酸对大鼠糖尿病脑缺血再灌注损伤恢复期相关基因表达的影响.实验方剂学杂志,2015,21:80-86.
59 唐浩,张双彦.注射用丹参多酚酸对大鼠脑缺血再灌注损伤的保护作用及机制研究//中国微循环学会痰瘀专业委员会学术会议,2015.
60 白蓉,王淑.注射用丹参多酚酸对脑缺血大鼠VEGF、IL-10的影响.中风与神经疾病杂志,2016,33:411-416.
61 李耀汝.注射用丹参多酚酸通过JAK2/STAT3信号通路促进脑缺血小鼠血管生成及改善行为功能.河北医科大学,2015.
62 邵命海,王琛,杨婧,等.丹参多酚酸盐对慢性肾功能衰竭大鼠肾功能和肾内氧耗的影响.上海中医药大学学报,2012,26:66-69.
63 赵琪,冯春玲,孙玉珍,等.丹参多酚酸盐治疗老年糖尿病肾病的临床研究.现代药物与临床,2015,36:441-444.
64 温海滨,覃勋,唐峰年,等.丹参多酚酸盐预处理对肾小管上皮细胞凋亡的保护机制.中国中西医结合肾病杂志,2013,14:997-999.
65 刘玮琳,孙星,张刚,等.注射用丹参多酚酸盐对早期糖尿病肾病患者同型半胱氨酸水平的影响.河北中医,2014,36:1916-1918.
66 蒋丽琼,卢国元.丹参多酚酸盐对人肾小管上皮细胞血管性血友病因子裂解酶表达的影响.临床肾脏病杂志,2013,13:325-328.
67 丁家荣,谌卫,殷晶晶,等.丹参多酚酸盐对实验性小鼠草酸钙结晶生成的影响.临床肾脏病杂志,2014,14:304-307.
68 van den Blink B,Wijsenbeek MS,Hoogsteden HC.Serum biomarkers in idiopathic pulmonary fibrosis.Pulm Pharmacol Ther,2010,23:515-520.
69 徐旭东,汪国香,陈达,等.丹参多酚酸盐在单肺通气肺损伤中保护作用的研究.中华医院感染学杂志,2014,24:638-641.
70 滕飞,傅志仁,孙克彦,等.丹参多酚酸盐对小鼠肝脏缺血再灌注后肺损伤的保护作用.解放军医学杂志,2011,36:1171-1174.
71 杨丹红,叶再元,金波,等.丹参多酚酸盐对实验性肝硬化大鼠肝组织TNF-α和IL-6 mRNA的表达影响.中华中医药学刊,2013:1297-1300.
72 杨丹红,叶再元,何徐军,等.丹参多酚酸盐对实验性肝硬化大鼠肠黏膜屏障功能的改善作用.中国临床药理学与治疗学,2010,15:758-763.
73 王蓉,潘沛,王彧杰,等.丹参多酚酸盐对肝纤维化大鼠NF-κB和IκBα表达的影响.中国新药与临床杂志,2011,30:51-55.
74 李夏静,陈瑞琦,陈旭征,等.总丹参多酚酸预处理对脊髓缺血再灌注损伤的保护作用.中华细胞与干细胞杂志:电子版,2015,5:33-37.
75 习诗良.丹参多酚酸对佐剂型关节炎大鼠的治疗作用.安徽医药,2013,17:1101-1103.
76 陈丽丽,黄靓妹,詹红艳,等.丹参多酚酸盐及神经肽Y干预后癫痫大鼠海马神经肽Y的表达变化.中国实验诊断学,2011,15:1810-1812.
77 陈丽丽,黄靓妹,詹红艳,等.丹参多酚酸盐对匹鲁卡品致痫大鼠BDNF表达的影响.中国实验诊断学,2011,15:1629-1631.
78 陈丽丽,黄靓妹,詹红艳,等.神经肽Y、丹参多酚酸盐对癫痫大鼠海马FOS蛋白表达的影响及作用探讨.中国实验诊断学,2011,15:957-959.
79 张彬,谢庆平,陈盛.丹参多酚酸盐预防小型猪DIEP皮瓣血管危象的实验研究.浙江医学,2014,36:494-495.
10.3969/j.issn.1002-7386.2017.02.041
050081 石家庄市,中国人民解放军白求恩国际和平医院药剂科(赵彩霞);河北省人民医院药学部(靳会欣)
R 972
A
1002-7386(2017)02-0294-06
2016-09-07)

