浮游植物对摇蚊幼虫扰动的响应研究
王昊天,刘 凌,陈 宁,邢西刚,杨艳青,刘 唱
(1.河海大学水文水资源学院,江苏 南京 210098; 2.浙江省水利水电技术咨询中心,浙江 杭州 310009)
浮游植物对摇蚊幼虫扰动的响应研究
王昊天1,刘 凌1,陈 宁2,邢西刚1,杨艳青1,刘 唱1
(1.河海大学水文水资源学院,江苏 南京 210098; 2.浙江省水利水电技术咨询中心,浙江 杭州 310009)
为了探究底栖动物扰动对上覆水浮游植物的影响,在实验室设沉积物-水微系统,引入广泛分布的红裸须摇蚊幼虫(Propsilocerusakamusi)和浮游植物,运用微电极等技术方法监测沉积物-水界面理化指标。结果表明,摇蚊幼虫的扰动降低了沉积物间隙水的溶解性有机磷(SRP)向上覆水的释放通量,减少了上覆水的溶解氧(DO)浓度,导致上覆水浮游植物生物量降低和群落结构向适应低磷的物种组成改变。同时,摇蚊幼虫扰动所引起的沉积物DO渗透量与沉积物-水界面SRP通量变化具有显著相关性,浮游植物生物量和上一次沉积物-水界面SRP通量变化有显著相关性,这些结果揭示了摇蚊幼虫通过改变沉积物结构和理化性质,进而能够抑制浮游植物的生长,有利于抑制水华现象的发生。
浮游植物;生物扰动;生物量;群落结构;微电极
由于人们在经济生产和生活过程中忽视了自然规律,大量工农业和生活废水排入湖泊,加剧了湖泊富营养化的进程,严重危害了湖泊生态系统的健康。与湖泊富营养化相伴的大面积水华的发生,致使湖泊生态系统遭到破坏,淡水资源的可持续利用受到威胁。作为水华的主角,浮游植物受到科研人员的广泛关注,科学认识浮游植物的生理特性对理解水华的发生机制有重要意义。
在湖泊生态系统中,影响浮游植物生长的因素是多方面的。在已有的研究中探讨较多的因素包括氮磷等化学因素、水温和光照等环境因子、风速等水动力学条件的影响[1-3]。浮游植物作为生态系统中的一部分,生物种群相互影响和制约,针对生物因素对浮游植物群落结构和生物量的影响的研究尚属少数。一方面,不同属种的浮游植物对化学因素和物理因素变化的响应不尽相同[4-5],这与不同属种浮游植物的自身特点有关,细胞体积、表面积与体积比的差别使得浮游植物最大生长速率、沉降速率、捕食压力和速率不同[6];另一方面,底栖动物的生理活动能显著改变沉积物-水界面的物理和化学性质[7],但是有关上覆水浮游植物对这一扰动过程的响应的讨论还鲜有报道。
本文通过室内培养试验模拟湖泊沉积物-水界面微环境,通过构造对比试验观察浮游植物群落结构在底栖动物扰动条件下的变化,探究富营养条件下浮游植物对底栖动物扰动的响应机制。试验采用的底栖动物是在淡水湖泊中广泛分布的红裸须摇蚊幼虫(Propsilocerusakamusi),浮游植物则采用湖泊原位野生藻。
1 材料与方法
1.1 野外采样与处理
本试验采样点选在富营养化程度较高的阳澄西湖(31°27′14″N,120°44′49″E),于2015年6月25日利用重力采样器(Φ90 mm×500 mm)采集沉积物柱样,同时收集原位上覆水,用于后续室内培养实验。另用彼得森采样器采集表层10 cm沉积物,过2 mm筛,镜检挑选4龄期摇蚊幼虫,将其置于有3cm厚沉积物的玻璃缸中好氧暂养。
1.2 室内培养试验设计
将所采集沉积物柱样表层20 cm按2 cm切分成10层,将不同沉积物柱相同层位的分层样品混匀,过60目筛以去除其中的底栖生物和大颗粒物。最后将混匀、过筛后的各层沉积物按其原顺序装填到培养柱(Φ11 cm×50 cm)中。将所采集原位湖水用虹吸法小心引入上述培养柱中,使上覆水高度统一为20 cm。将制得的10根培养柱等量放入2个聚乙烯塑料桶中,恒温25℃预培养20 d至稳定。
预培养结束后,挑选采集的4龄期摇蚊幼虫60条均分引入到一个桶的5根培养柱中,记为摇蚊组,摇蚊幼虫投放1h后,将未钻入沉积物的摇蚊幼虫挑出,并以等量健康幼虫替换。另外一个桶中的5根培养柱不做处理,记为对照组。整个试验过程模拟自然条件,培养条件控制温度25℃,明暗交替各12 h。试验期间,每天用蒸馏水及时补充蒸发损失的上覆水。
1.3 样品采集与分析
试验周期引入摇蚊幼虫时记为d0,分别在d0、d7、d14、d21和d28共5个时段,分别测定摇蚊组和对照组沉积物-水界面溶解性有机磷(SRP)通量和DO浓度变化。同时采集摇蚊组和对照组上覆水样品,用于分析浮游植物变化。样品采集时,先用毛刷小心将培养柱柱壁上附着藻类刷掉,用虹吸管采集上覆水1 L,加入25 mL鲁哥溶液固定,避光保存。
沉积物-水界面SRP通量采用上覆水中SRP浓度随时间变化的方法测定[8]。用针筒注射器抽取沉积物-水界面上0.5 cm 处上覆水1 mL,过0.45 μm醋酸纤维滤膜,用0.1 mol/L盐酸酸化至pH值小于2后立即分析。上覆水采样间隔为1 h,共采样5次。为减少光合作用的影响,采样需在黑暗环境中进行。
沉积物-水界面DO浓度利用丹麦unisense微电极测量系统进行微尺度剖面分析,DO微电极尖端直径100 μm,探针剖面穿刺步长200 μm。
上覆水浮游植物鉴定采用镜检法,种类鉴定参考文献[9-10]。将所采集的浮游植物样品置于1 L量筒,静置48 h,沉淀浓缩至30 mL。充分混匀后,用移液枪准确抽取0.1 mL浓缩液至载玻片,将其置于光学显微镜下(10×40)观察计数。计数方法采用行格法,保证计数细胞数在200个以上,每个样品计数2片,若2片计数差在±15%以内,取其平均值;若两次计数差在±15%以上,则计数第3片,取相近2片的平均值[11]。
1.4 数据分析与处理
沉积物-水界面SRP通量按照张雷等[8]的方法计算:
F=kV/A
(1)
式中:F为SRP在沉积物-水界面的通量,mg/(m2·h);k为SRP浓度随时间变化的线性回归率,mg/(L·h);V为上覆水体积,L;A为沉积物表面积,m2。
浮游植物生物量参照Hillebrand等[12]的研究成果,通过体积法计算,取几何近似值。通常,可以将浮游植物的密度近似等于水的密度,故而浮游植物的质量在数值上便与其体积一致。根据浮游植物细胞外形的不同,可以用圆球、圆柱、椭圆柱、圆台等组合起来去拟合细胞体积[13],这种计算生物量的方法就叫作体积法。
本文中数据结果图均采用origin8.0软件绘制。
2 结 果
2.1 浮游植物细胞数和生物量变化
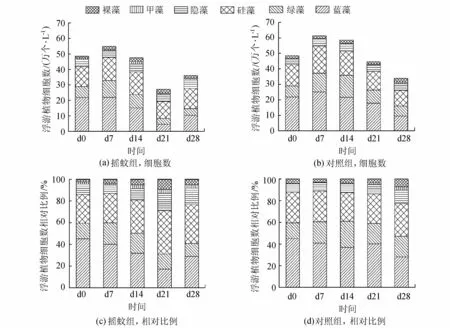
图2 对照组和摇蚊组浮游植物细胞数和相对比例变化
在整个培养期,对照组和摇蚊组上覆水浮游植物细胞数变化范围分别为36.71万~61.34万个/L和30.16万~54.86万个/L。对照组和摇蚊组上覆水浮游植物生物量变化范围分别为0.98 mg/L~1.42 mg/L和0.77 mg/L~1.38 mg/L。在所有统计中,浮游植物细胞数和生物量在对照组和摇蚊组有相同的变化趋势(图1、图2)。根据细胞数和生物量的变化,对照组可以划分为两个阶段:上升期d0—d7和下降期d14—d28,生物量最高出现在d7时,最低出现在d28时。摇蚊组变化则可以分为3个阶段:上升期d0—d7、下降期d14—d21和回升期d28,生物量最高出现在d7时,最低出现在d21时。
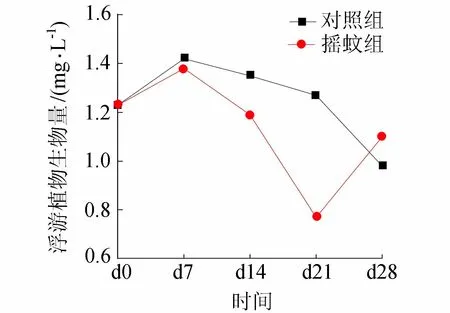
图1 对照组和摇蚊组浮游植物生物量变化
2.2 浮游植物种类组成的变化
摇蚊组和对照组浮游植物种类组成变化如图2所示。对照组在d7出现的种类最多,共检出6门27属47种浮游植物,组成情况详见表1;在d28出现的种类最少,共检出6门17属34种,组成情况详见表1。由图2可知,对照组在试验各阶段,各门类浮游植物占比虽有变化,但蓝藻始终占有绝对优势。在d0和d7时蓝藻占比最高,达到了45.0%和40.9%,蓝藻占比最低时在d28,为28.1%。而摇蚊组,受摇蚊扰动的影响,试验过程中各门类浮游植物占比变化较大,优势群也不断变化。在d0、d7和d28时蓝藻为优势群,在d14和d21以硅藻为优势群,而蓝藻和绿藻占比都下降明显。为将优势种控制在一定数目,本试验以藻种细胞数占本次采样所得藻细胞总数超过10%的藻种作为优势种,两组各次采样优势种变化见表1。
在两组浮游植物生物量下降的同时,浮游植物种类也同时减少了,说明在磷大量减少的情况下,一些藻种数量急剧下降甚至消失以至于镜检不到。虽然两组培养过程中都经历了浮游植物数量的下降,但是不同藻种下降程度却相差很大。数量下降最多的是摇蚊组的蓝藻门(图2),尤其是束丝藻属,从最高2.21万个/L下降为最低0.27万个/L。与此形成鲜明对比的是微囊藻属,下降幅度并不大,从最高3.98万个/L下降为最低3.15万个/L。两组浮游植物数量大幅下降阶段,硅藻门数量下降也不明显,这是浮游植物数量下降时硅藻占比上升的根本原因。
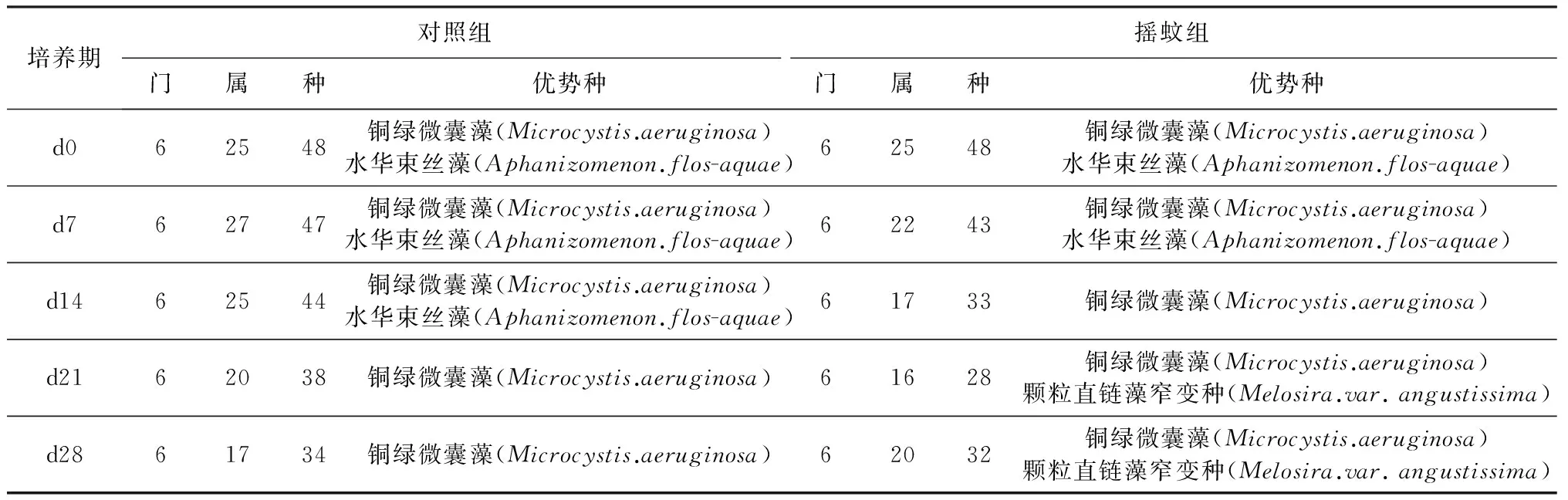
表1 对照组和摇蚊组浮游植物种类统计
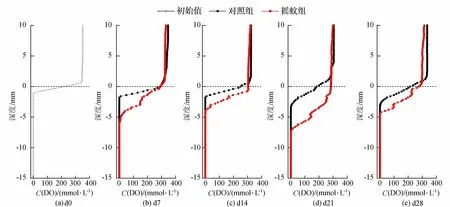
图4 对照组和摇蚊组C(DO)剖面变化
2.3 沉积物-水界面SRP通量的变化
加入摇蚊幼虫前,摇蚊组和对照组SRP在沉积物-水界面通量相近(图3)。加入摇蚊幼虫明显改变了摇蚊组SRP在沉积物-水界面的通量。整个培养过程中,对照组的SRP在沉积物-水界面通量一直下降,从0.156 mg/(m2·h)(d0)下降到0.035 mg/(m2·h)(d28)。摇蚊组在培养前中期,SRP在沉积物-水界面通量比对照组下降更为明显,从0.156 mg/(m2·h)(d0)下降到-0.061 mg/(m2·h)(d14),但在后期回升到0.067 mg/(m2·h)(d28)(图3)。相关性分析显示,上覆水浮游植物生物量与沉积物-水界面SRP通量相关性并不显著,但是与上一次采样的SRP通量具有显著相关性,表明SRP通量对浮游植物的影响具有滞后性(表2)。
2.4 沉积物DO的变化
在投入摇蚊幼虫前,沉积物DO不存在显著差异(图4)。加入摇蚊幼虫后,明显增加了DO的渗透深度,渗透深度和范围最强的时期出现在d21,在d28这种影响又有所减弱。同时,试验结果还显示,

表2 沉积物-水界面SRP通量与浮游植物
*表示相关性不显著。
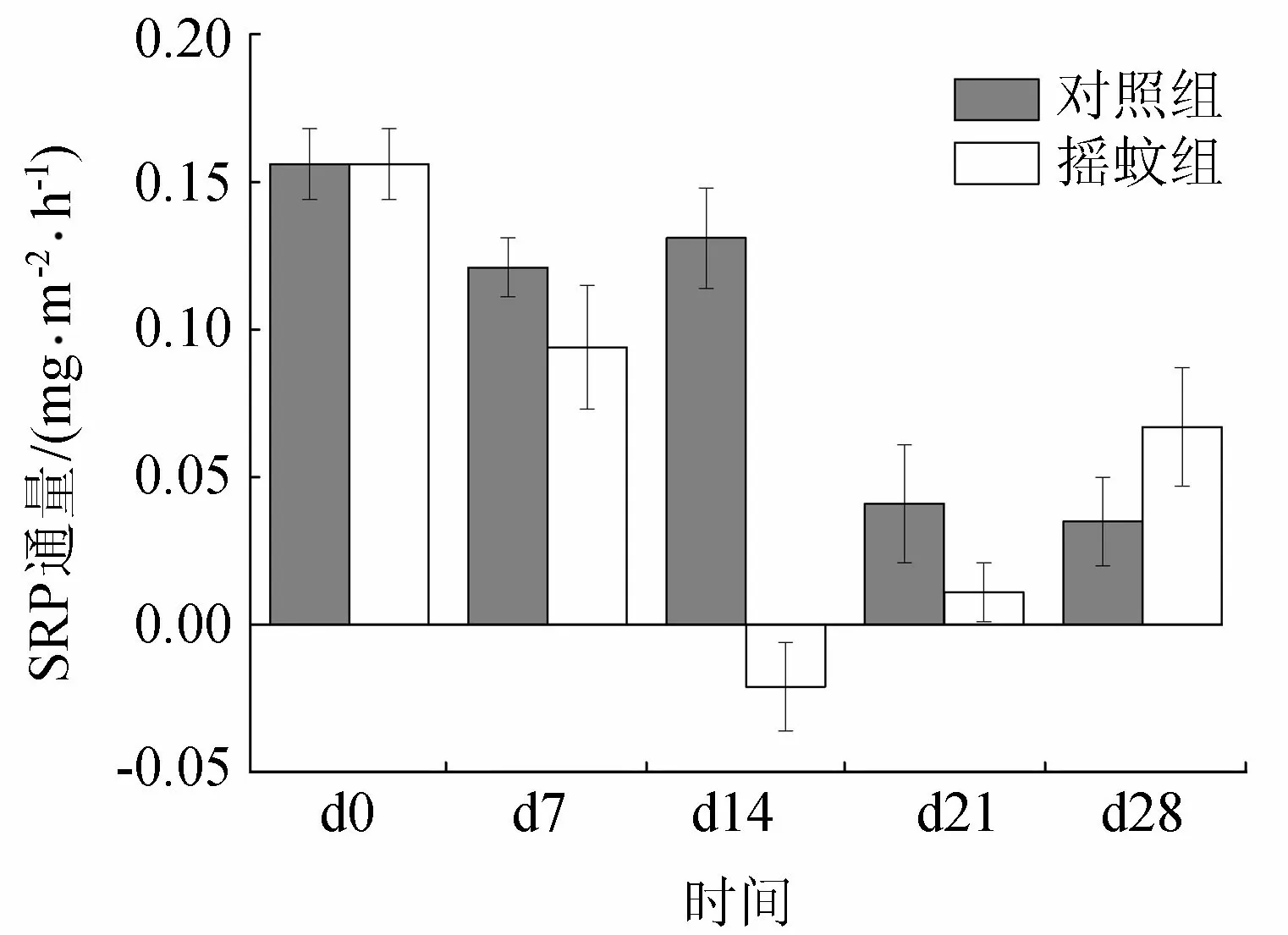
图3 对照组和摇蚊组沉积物-水界面SRP通量变化
上覆水DO浓度受摇蚊扰动影响也有部分下降(图4)。相关性分析显示,沉积物DO渗透量与沉积物-水界面的SRP通量具有显著负相关性,表明由于摇蚊幼虫的扰动引起的DO在沉积物中的渗透量越高,沉积物-水界面的SRP通量越小(表2)。
3 讨 论
浮游植物是水生态系统的重要组成部分,其种类组成和生物量与环境因子密切相关,水体环境因子的改变直接影响着浮游植物的群落结构特征[14]。在河流、水库等水体中,浮游植物群落的种类组成和群落结构的变化主要受水环境物理、化学和生物等环境因子的影响,如光照、水温、水体营养状况、酸碱度以及水文条件等[15]。本研究为室内培养,采取了恒温、恒光照的培养方式,浮游植物生物量和群落组成主要受培养柱内有无摇蚊幼虫及其引起的化学因子变化的影响。
由试验结果可知,摇蚊幼虫的出现使浮游植物的生物量和群落结构发生了显著变化。在试验前期d0~d7,两试验组都经历了浮游植物生物量的短暂上升,这是因为试验前期沉积物中的SRP大量向上覆水释放(图3),上覆水有充足的供浮游植物生长分裂所需的磷。而摇蚊组浮游植物生物量的增长在此阶段明显低于对照组,这可能是摇蚊幼虫的扰动导致沉积物向上覆水释放的磷减少所致。由图3可以看出,摇蚊组沉积物—水界面SRP通量在前期明显小于对照组。受摇蚊扰动影响,摇蚊组沉积物DO渗透深度和渗透量都明显高于对照组(图4),表明有大量的DO从上覆水进入沉积物。DO在沉积物环境中是重要的限制因子和最主要的电子受体[16],DO渗透深度和浓度的变化导致了沉积物氧化还原环境的变化。间隙水中大量的Fe(Ⅱ)氧化所生成的水合铁氧化物对SRP有良好的吸附作用,从而形成铁结合态磷[17]。这一过程被认为是摇蚊幼虫扰动使沉积物SRP减少的最重要的机制[18]。随着Fe(Ⅱ)被氧化量的增加,更多的SRP被Fe(Ⅲ)化合物所吸附,进而导致上覆水浮游植物可利用磷减少,浮游植物生物量也随之降低(图1)。在d14时,沉积物—水界面SRP通量甚至变为负值,表明这种作用达到顶峰,上覆水SRP开始汇入沉积物。而上覆水浮游植物生物量在下一次采样时才降至最低点,表明SRP通量对浮游植物生物量的影响的滞后性,其原因可能在于浮游植物对磷的吸收体现为一个过程,先是磷吸附在浮游植物细胞的表面,再通过细胞膜运送至细胞内部从而被利用[4, 19]。当环境变为还原条件时,被Fe(Ⅲ)化合物所吸附的SRP又能再次释放出来[20],为浮游植物所利用。培养试验后期,由于部分摇蚊幼虫羽化,摇蚊幼虫扰动强度下降,而摇蚊组沉积物DO渗透量也随着摇蚊幼虫扰动的减弱而减少(图4),与此同时,由沉积物间隙水进入上覆水的SRP再次增加(图3),相应地浮游植物生物量也再次回升(图1)。
在整个过程中,摇蚊幼虫扰动对磷的释放起到了一定的缓冲作用。摇蚊幼虫的扰动使大量的上覆水SRP固定在沉积物中,减缓了浮游植物大量增长的趋势。在摇蚊幼虫扰动的强度减弱后,前期固定在沉积物中的SRP又释放进入上覆水,促进上覆水浮游植物的生长。但是,因为后期能够由沉积物进入上覆水的SRP总量比前期少(图3),浮游植物总量也低于前期(图1)。这正是摇蚊幼虫扰动减缓了沉积物中SRP向上覆水释放的结果。
另外,摇蚊幼虫扰动能使沉积物—水界面的总氧气交换速率增加[20-21],这可能是摇蚊组上覆水浮游植物生物量大部分时期显著低于对照组的另一重要原因。首先,摇蚊幼虫的呼吸作用消耗大量DO,使沉积物间隙水DO浓度降低;其次,通过摇蚊幼虫构筑的廊道和生物引灌作用,摇蚊幼虫洞穴及周围的物理化学性质随之改变,沉积物中好氧微生物的活性提高,有机质矿化作用也得到增强[22-23],这都提高了沉积物DO的消耗。研究表明,摇蚊幼虫的扰动加快了沉积物和上覆水的硝化过程,增加了沉积物中总细菌和氨氧化菌的丰度[24]。大量浮游植物与环境因子相关分析的研究显示,DO与浮游植物生物量呈显著正相关[25-26]。上覆水DO的大量减少将导致浮游植物生物量的显著降低。除此之外,摇蚊幼虫摄食浮游植物[27-28],可能也是上覆水浮游植物减少的原因之一。
在摇蚊幼虫扰动显著改变浮游植物生物量的同时,浮游植物群落结构也发生显著变化。上覆水SRP因为摇蚊幼虫的扰动大量减少时,蓝藻大量减少,表明了磷浓度对蓝藻生长的重要性,然而浮游植物的种间差异则导致了藻种应对低磷浓度的不同表现。微囊藻对磷的亲和性比较高,在磷限制的条件下也可能发生水华,而束丝藻发生水华需要的磷浓度要比微囊藻高[5],其原因可能在于在磷胁迫状态下,藻类诱导产生碱性磷酸酶的温度、pH、酶活性保持时间等特性有所不同,说明能够产生碱性磷酸酶的浮游植物之间存在着种属差异[4]。共培养试验也表明,磷匮乏情况下,束丝藻会受到比微囊藻更大的抑制[29]。另外,微囊藻释放的微囊藻毒素对束丝藻会产生溶藻效应,导致束丝藻数量急剧下降[30]。
摇蚊幼虫扰动导致硅藻百分浓度升高,其原因可能是硅藻较高的磷吸收速率和部分硅藻较小的细胞体积使其对低磷环境有更好的适应性[31]。也有可能是因为摇蚊幼虫的扰动增加了沉积物悬浮量,从而增加了上覆水中的硅元素含量,更有利于硅藻的生长[32]。同时,沉积物再悬浮量的增加一定程度上抑制其他藻类的数量,如团状蓝藻[33]。邓建明等[34]在研究洪泽湖浮游植物群落结构与环境因子相关关系时发现脆杆藻和羽纹藻等硅藻数量与悬浮物浓度呈显著正相关。
上覆水SRP下降导致各种浮游植物数量普遍下降也表明磷作为浮游植物生长的限制因子,对浮游植物数量有决定性的作用。许海等[2]的研究也表明,在低磷浓度下,无论氮磷比如何,浮游植物都受到营养盐限制。浮游植物应对低磷环境的各种策略能够减轻低磷的不利影响,但是改变不了生物量整体下降的趋势。
4 结 论
摇蚊幼虫的扰动可将大量DO引入沉积物间隙水,使沉积物间隙水的DO渗透深度和渗透量都得到增加,并导致沉积物-水界面SRP通量大量减少。同时,扰动也降低了上覆水DO浓度。上覆水SRP和DO浓度的降低直接导致了上覆水浮游植物生物量的降低,这也有利于在低磷环境中适应性更好的物种形成优势。摇蚊幼虫的扰动有利于抑制浮游植物大量生长。但在湖泊富营养环境下,由于条件复杂、影响因素较多,摇蚊幼虫如何影响浮游植物还需更深入的研究。
[ 1 ] 吴利,冯伟松,张堂林,等.春、秋季武湖浮游动物群落特征及其与环境因子的关系[J].水生态学杂志,2011,32(2): 31-37.(WU Li,FENG Weisong,ZHANG Tanglin,et al.Community characteristics of zooplankton and its relationship with environmental factors in spring and autumn[J].Journal of Hydroecology,2011,32(2): 31-37.(in Chinese))
[ 2 ] 许海,朱广伟,秦伯强,等.氮磷比对水华蓝藻优势形成的影响[J].中国环境科学,2011,31(10): 1676-1683.(XU Hai,ZHU Guangwei,QIN Boqiang,et al.Influence of nitrogen-phosphorus ratio on dominance of bloom-forming cyanobacteria (Microcystisaeruginosa)[J].China Environmental Science,2011,31(10): 1676-1683.(in Chinese))
[ 3 ] 张毅敏,张永春,张龙江,等.湖泊水动力对蓝藻生长的影响[J].中国环境科学,2007,27(5): 707-711.(ZHANG Yimin,ZHANG Yongchun,ZHANG Longjiang,et al.The influence of lake hydrodynamics on blue algal growth[J].China Environmental Science,2007,27(5): 707-711.(in Chinese))
[ 4 ] 金杰,刘素美.海洋浮游植物对磷的响应研究进展[J].地球科学进展,2013,28(2): 253-261.(JIN Jie,LIU Sumei.Advances in studies of phosphorus utilization by marine phytoplankton[J].Advances in Earth Science,2013,28(2): 253-261.(in Chinese))
[ 5 ] 沈宏,宋立荣.单细胞和群体微囊藻对磷的生理生化响应的比较研究[C]//中国海洋湖沼学会.中国海洋湖沼学会第九次全国会员代表大会暨学术研讨会论文摘要汇编.上海:中国海洋湖沼学会, 2007.
[ 6 ] 卡尔夫.湖沼学:内陆水生态系统[M].北京: 高等教育出版社,2011.
[ 7 ] ZHANG L,SHEN Q,HU H,et al.Impacts ofcorbiculaflumineaon oxygen uptake and nutrient fluxes across the sediment:water interface[J].Water Air & Soil Pollution,2011,220(1): 399-411.
[ 8 ] 张雷,古小治,王兆德,等.水丝蚓(Tubificid worms)扰动对磷在湖泊沉积物-水界面迁移的影响[J].湖泊科学,2010,22(5): 666-674.(ZHANG Lei,GU Xiaozhi,WANG Zhaode,et al.The influence of Tubificid worms bioturbation on the exchange of phosphorus across sediment-water interface in lakes[J].Journal of Lake Sciences,2010,22(5): 666-674.(in Chinese))
[ 9 ] 周凤霞.淡水微型生物图谱[M].北京: 化学工业出版社,2005.
[10] 胡鸿钧,魏印心.中国淡水藻类:系统、分类及生态[M].北京: 科学出版社,2006.
[11] 章宗涉,黄祥飞.淡水浮游生物研究方法[M].北京: 科学出版社,1991.
[12] HILLEBRAND H,DURSELEN C D,KIRSCHTEL D,et al.Biovolume calculation for pelagic and benthic microalgae[J].Journal of Phycology,1999,35(2):403-424.
[13] 孙军,刘东艳,钱树本.浮游植物生物量研究Ⅰ.浮游植物生物量细胞体积转化法[J].海洋学报(中文版),1999,22(2): 75-85.(SUN Jun,LIU Dongyan,QIAN Shuben.Study on phytoplankton biomass I.phytoplankton measurement biomass from cell volume or plasma volume[J].Acta Oceanologica Sinica,1999,22(2): 75-85.(in Chinese))
[14] 孟顺龙,瞿建宏,裘丽萍,等.富营养化水体降磷对浮游植物群落结构特征的影响[J].生态环境学报,2013,22(9): 1578-1582.(MENG Shunlong,QU Jianhong,QIU Liping,et al.Effect of decreasing phosphorus in eutrophic water on the community structure of phytoplankton[J].Ecology and Environment,2013,22(9): 1578-1582.(in Chinese))
[15] 吴湘香,李云峰,沈子伟,等.赤水河浮游植物群落结构特征及其与水环境因子的关系[J].中国水产科学,2014,21(2): 361-368.(WU Xiangxiang,LI Yunfeng,SHEN Ziwei,et al.Relationship between phytoplankton community structure and aquatic environmental factors in the Chishui River,a protected tribu-tary of the Yangtze River[J].Journal of Fishery Sciences of China,2014,21(2): 361-368.(in Chinese))
[16] 商景阁,张路,王建军,等.中国长足摇蚊幼虫和霍普水丝蚓扰动下沉积物氧气特征分析[J].水生生物学报,2011,35(4): 610-615.(SHANG Jingge,ZHANG Lu,WANG Jianjun,et al.Bioturbation effects oftanypuschinensisandlimnodrilushoffmeisterion penetration and distribution[J].Acta Hydrobiologica Sinica,2011,35(4): 610-615.(in Chinese))
[17] 覃雪波,孙红文,彭士涛,等.生物扰动对沉积物中污染物环境行为的影响研究进展[J].生态学报,2014,34(1):59-69.(QIN Xuebo,SUN Hongwen,PENG Shitao,et al.Review of the impacts of bioturbation on the environmental behavior of contaminant in sediment[J].Acta Ecologica Sinica,2014,34(1):59-69.(in Chinese))
[18] CHEN M,DING S,LIU L,et al.Iron-coupled inactivation of phosphorus in sediments by macrozoobenthos (chironomidlarvae) bioturbation: evidences from high-resolution dynamic measurements[J].Environmental Pollution,2015,204: 241.
[19] YAO B,XI B,HU C,et al.A model and experimental study of phosphate uptake kinetics in algae:considering surface adsorption and P-stress[J].Journal of Environmental Sciences,2011,23(2):189-198.
[20] 史晓丹,李大鹏,王忍,等.物理和摇蚊幼虫组合扰动对内源磷再生和形态转化的协同作用[J].环境科学,2015,36(3): 955-962.(SHI Xiaodan,LI Dapeng,WANG Ren,et al.Synergistic effect of physical andchironomusplumosuscombined disturbance on regeneration and transformation of internal phosphorus[J].Environmental Science,2015,36(3): 955-962.(in Chinese))
[21] WELSH D T.It’s a dirty job but someone has to do it: the role of marine benthic macrofauna in organic matter turnover and nutrient recycling to the water column[J].Chemistry & Ecology,2003,19(5): 321-342.
[22] 商景阁,张路,张波,等.中国长足摇蚊(Tanypuschinensis)幼虫底栖扰动对沉积物溶解氧特征及反硝化的影响[J].湖泊科学,2010,22(5): 708-713.(SHANG Jingge,ZHANG Lu,ZHANG Bo,et al.Bioturbation effect ofTanypuschinensislarvaeon denitrification rate and process in sediments[J].Journal of Lake Science,2010,22(5): 708-713.(in Chinese))
[24] 孙旭.富营养化湖泊底栖动物对沉积物氮转化菌群落结构和功能的影响[D].南京: 南京大学,2015.
[25] 郑丙辉,张佳磊,王丽婧,等.大宁河水华敏感期浮游植物与环境因子关系[J].环境科学,2011,32(3): 641-648.(ZHENG Binghui,ZHANG Jialei,WANG Lijing,et al.Exploration of relationships between phytoplankton and related environmental factors in the Daning River during sensitive period of algal blooms[J].Environmental Science,2011,32(3): 641-648.(in Chinese))
[26] 沈会涛,刘存歧.白洋淀浮游植物群落及其与环境因子的典范对应分析[J].湖泊科学,2008,20(6): 773-779.(SHEN Huitao,LIU Cunqi.Canonical correspondence analysis of phytoplankton community and its environmental factors in the Lake Baiyangdian[J].Journal of Lake Sciences,2008,20(6): 773-779.(in Chinese))
[27] 王丽珍,李砥,刘永定,等.滇池摇蚊科幼虫和水丝蚓属的生物学特性分析[J].水利渔业,2004,24(2): 48-50.(WANG Lizhen,LI Di,LIU Yongding,et al.Biological characteristics ofChironomusLarvaeand aquatic worms in the Dianchi Lake,China[J].Reservoir Fisheries,2004,24(2): 48-50.(in Chinese))
[28] 王俊才,王新华.中国北方摇蚊幼虫[M].北京:中国言实出版社,2011.
[29] 顾启华,赵林,谭欣.铜绿微囊藻、螺旋鱼腥藻和水华束丝藻竞争优势的研究[J].安徽农业科学,2007,35(7): 1990-1991.(GU Qihua,ZHAO Lin,TAN Xin.Studies on conpetition predominance ofMicrocystisaeruginosa,AnabaenaspiroidesandAphanizomenoflos-aquae[J].Journal of Anhui Agricultural Sciences,2007,35(7): 1990-1991.(in Chinese))
[30] 胡智泉,刘永定,何光源.微囊藻毒素对滇池水华束丝藻的溶藻效应研究[J].华中科技大学学报自然科学版,2005,33(9): 128-131.(HU Zhiquan,LIU Yongding,HE Guangyuan.Algae-lytic effect of microcystin-RR onAphanizomenonflos-aquaeisolated from Dianchi Lake[J].Journal of Huazhong University of Science and Technology,2005,33(9): 128-131.(in Chinese))
[31] 王丹,黄春秀,黄邦钦,等.黄海两种典型硅藻的磷胁迫生理研究[J].海洋科学,2008,32(5): 22-27.(WANG Dan,HUANG Chunxiu,HUANG Bangqin,et al.Physiological responses of two typical species of diatoms to phosphorus stress in Yellow Sea[J].Marine Sciences,2008,32(5): 22-27.(in Chinese))
[32] GIBSON C E,WANG G,HFOY R.Silica and diatom growth in Lough Neagh: the importance of internal recycling[J].Freshwater Biology,2000,45(3): 285-293.
[33] GER K A,HANSSON L A,LÜRLING M.Understanding cyanobacteria-zooplankton interactions in a more eutrophic world[J].Freshwater Biology,2014,59(9): 1783-1798.
[34] 邓建明,蔡永久,陈宇炜,等.洪湖浮游植物群落结构及其与环境因子的关系[J].湖泊科学,2010,22(1): 70-78.(DENG Jianming,CAI Yongjiu,CHEN Yuwei,et al.Structure of phytoplankton community and its relationship with environment factors in Lake Honghu[J].Journal of Lake Sciences,2010,22(1): 70-78.(in Chinese))
Research on effect of chironomid larvae bioturbation on phytoplankton
WANG Haotian1, LIU Ling1, CHEN Ning2, XING Xigang1, YANG Yanqing1, LIU Chang1
(1.CollegeofHydrologyandWaterResources,HohaiUniversity,Nanjing210098,China; 2.ZhejiangWaterConservancyandHydroelectricPowerConsultingCenter,Hangzhou310009,China)
In order to examine the effect of bioturbation of benthic animals on phytoplankton, a laboratory incubation experiment with a sediment-water interface system was carried out. The widely distributedPropsilocerusakamusiand phytoplankton were used in this experiment. The microelectrode system and other techniques were used to monitor the physicochemical indicators of the sediment-water interface system. The results show that the chironomid larvae bioturbation reduced the flux of soluble reactive phosphorus (SRP) released from pore water to the overlying water and decreased the concentration of dissolved oxygen (DO) in the overlying water, leading to a decrease in the biomass and a change of the community structure of the overlying phytoplankton. The amount of DO infiltration in the sediment was significantly correlated with the change of the flux of SRP released from pore water to the overlying water, as was the relationship between the biomass of the phytoplankton and the flux of SRP examined the previous time. All these results indicate that chironomid larvae bioturbation can cause an inhibition of the phytoplankton growth by changing the sediment structure and physicochemical properties, which contribute to the control of alga blooms.
phytoplankton; bioturbation; biomass; community structure; microelectrode
10.3880/j.issn.1004-6933.2017.02.016
国家自然科学基金(51279060);中央高校基本科研业务费专项(2015B32014)
王昊天(1990—),男,硕士研究生,研究为方向水环境保护和修复。E-mail:wanght1990@qq.com
刘凌,教授,博士生导师。E-mail:lingliu_hhu@hhu.edu.cn
X524
A
1004-6933(2017)02-0088-07
2016-09-28 编辑:徐 娟)

