复发性子宫内膜癌腹腔镜下切除腹主动脉旁转移淋巴结1例报告
黄金江 陈国伟 刘 丽 曲晓力 贺红英
(广西医科大学第四附属医院 广西柳州市工人医院妇瘤科,柳州 545005)
·病例报告·
复发性子宫内膜癌腹腔镜下切除腹主动脉旁转移淋巴结1例报告
黄金江 陈国伟 刘 丽 曲晓力 贺红英*
(广西医科大学第四附属医院 广西柳州市工人医院妇瘤科,柳州 545005)
本文报道2015年11月对1例复发性子宫内膜癌行腹腔镜下切除腹主动脉旁淋巴结病灶,手术时间145 min,出血量50 ml,术后住院7 d。术后第5天开始化疗,辅助放疗。2016年8月随访未见肿瘤复发。我们认为复发性子宫内膜癌腹主动脉旁淋巴结转病灶可在腹腔镜下切除。
子宫内膜癌; 复发; 淋巴结转移
复发性子宫内膜癌是在子宫内膜癌系统治疗结束后再次发生与原发灶完全一致的癌灶。复发性子宫内膜癌腹主动脉旁淋巴结孤立转移病灶发病率较低,手术难度大,国内外临床研究资料较少,我科2015年11月对1例复发性子宫内膜癌行腹腔镜下切除腹主动脉旁淋巴结病灶,取得较好的临床效果,现报道如下。
1 临床资料
女,48岁。因不规则阴道流血1个月于2014年10月11日入院。2014年10月4日外院行诊刮术,病理提示子宫内膜样癌。入院后查:CA12520.8 U/ml(我院正常参考值0.1~35 U/ml),CA19932.3 U/ml(我院正常参考值0.1~27 U/ml),我院会诊外院病理提示子宫内膜样腺癌Ⅰ级。MRI示:①子宫腔内见大小约3.9 cm×1.0 cm×1.7 cm T2W1高信号影,与子宫肌层分界清晰,宫颈未见受侵;②道格拉斯腔结节影(1.4 cm),考虑转移;③左侧卵巢囊实性占位,最大直径3.6 cm,考虑卵巢恶性肿瘤;④两侧附件区囊肿(左侧2 cm×1.7 cm,右侧1.8 cm×1.5 cm);⑤右输卵管积液(2 cm×1.5 cm)。2014年10月16日行腹腔镜下筋膜外全子宫切除术+双附件切除术+盆腔淋巴结切除术+腹主动脉旁淋巴结清扫术+大网膜切除术+腹膜多点活检术。术中见盆腹腔淡黄色积液约150 ml,双侧卵巢表面、阔韧带、膀胱表面、乙状结肠、直肠及部分小肠表面见散在、多发粟粒样结节,直径3~5mm,子宫直肠陷窝见一直径约2 cm暗红色结节,余未见明显病灶。术后病理示:(子宫、双附件)子宫内膜样腺癌Ⅰ~Ⅱ级,癌组织位于宫腔内膜层,双侧输卵管系膜囊肿并囊壁癌转移,宫体浆膜外纤维组织中见癌浸润。免疫组化:ER60%阳性;PR60%阳性。子宫直肠窝肿物、左阔韧带后叶、膀胱表面肿物送检组织均见中-低分化腺癌转移,宫体肌层、宫颈、双侧输卵管、双侧卵巢、双侧宫旁、阴道断端均未见癌浸润。结合病史及镜下形态,符合子宫内膜样腺癌转移。腹主动脉旁、左盆腔、右盆腔送检淋巴结共25枚,均未见癌转移,大网膜未见癌转移。手术病理分期ⅢB期。术后他莫西芬调节雌激素受体后使用甲地孕酮治疗。2014年10~12月行多西他赛75 mg/m2,顺铂70 mg/m2方案化疗共4个疗程。2015年1月8日~2月11日行9野调强放疗,临床靶区(clinical target volume,CTV)包括双侧腹股沟淋巴引流区,计划靶区(planning target volume, PTV)为CTV外扩5 mm,PTV 放疗总量(dose total,DT )50 Gy/25次/5周,2.0 Gy/次,每天1次,每周5次,共25次。2015年3、6月行肿瘤评估未见异常。2015年11月肿瘤评估MRI示:左侧肾动脉下方淋巴结转移(约1.6 cm×1.6 cm×2.5 cm),见图1。胸部和头颅CT、骨ECT检查均未见异常。考虑复发性子宫内膜癌腹主动脉旁淋巴结转移。2015年11月行腹腔镜下腹主动脉旁肿大淋巴结切除术,术中盆腹腔未见明显积液,子宫、双附件、网膜缺如,腹主动脉旁左侧方肾动脉下方、肠系膜下动脉水平上约2 cm处见肿大淋巴结约2.5 cm×1.5 cm,乙状结肠壁与左侧盆壁致密粘连,探查腹膜、肠壁表面、肝胆、横隔、胃表面未见明显异常病灶。超声刀分离肠管与盆腹壁粘连,切除左肾动脉下方肿大淋巴结(图2)。术中出血量50 ml,手术时间145 min。术后病理:(腹主动脉旁淋巴结)淋巴结1枚,见癌转移。该淋巴结外周脂肪、神经、脉管内均见肿瘤侵犯(图3)。免疫组化:CK8阳性;CK18阳性;ER10%阳性;PR阴性;CEA阳性;KI6715%阳性;P53阳性;Vimentin阴性;Myosin阴性;Desmin阴性;Myoglobin阴性;SMA阴性;CD10阳性;MyoD1阴性。诊断:腹主动脉旁淋巴结转移性腺癌。2015年12月4日~2016年2月5日行4次多西他赛+卡铂化疗过程顺利。2016年3月10日~4月28日行9野调强放疗。CTV1腹腔淋巴结引流区域,PTV1由CTV1外扩5 mm获得,PTV1:50.4 Gy/28次/5周,1.8 Gy/次,每天1次,每周5次,共28次。2016年5月复查MRI未见复发性肿瘤病灶,2016年5月14日~6月25日化疗3次,口服甲地孕酮160 mg(计划1.5~2年),2016年8月盆腹腔增强MRI、胸部CT、肿瘤标志物CA125、CA199评估肿瘤未见复发。
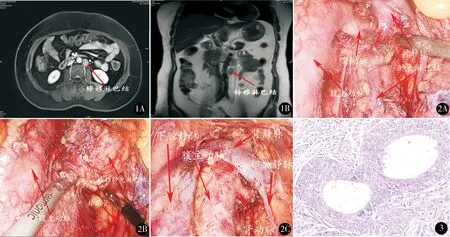
图1 A. MRI(横轴位)见转移淋巴结;B. MRI(矢状位)清楚显示转移淋巴结与周围腹主动脉、肾动脉及输尿管的关系 图2 A.腹腔镜下分离肠粘连和腹膜后暴露肾动静脉、腹主动脉及肿大转移的淋巴结B.暴露输尿管避免损伤,超声刀沿转移淋巴结与周围血管、组织的间隙分离切除;C.切除转移的淋巴结后见腹主动脉、下腔静脉、肾动静脉、卵巢静脉等解剖结构 图3 镜下见癌巢腺腔样排列,癌细胞异型性大HE染色 ×100
2 讨论
子宫内膜癌是来源于子宫内膜的上皮性恶性肿瘤,是女性较常见的恶性肿瘤,占女性全身恶性肿瘤的7%。子宫内膜癌具有直接蔓延、血行转移及淋巴结转移的生物学特征,部分患者在初次系统治疗完全缓解后一段时间,再次发现组织病理学类型与原发灶完全一致癌灶,考虑为复发。复发性子宫内膜癌通常发生于初始治疗后2~3年,复发率12%~15.4%[1],不同期别复发率不同。根据FIGO指南分期,Ⅰ、Ⅱ、Ⅲ、Ⅳ期的复发率分别为6.5%、20%、37.5%、66.7%。诊断主要依据患者的病史、症状、体征、妇科检查、辅助检查及组织病理学检查。复发部位常见于阴道、骨盆,远处转移包括腹 膜、肺、 骨、腹主动脉旁淋巴结、脑等[2]。Alay 等[3]报道179例子宫内膜癌接受手术及其他辅助治疗,随访17个月,10.1%复发,复发时间中位数12.6 月,4.5%患者在盆腔内转移, 2.8%患者在腹腔外转移, 0.6%在上腹部转移。子宫内膜癌淋巴结主要转移途径是先转移至盆腔及腹主动脉旁淋巴结,进而向远处转移。腹主动脉旁淋巴结转移情况对子宫内膜癌患者的预后极为重要,约58%腹主动脉旁淋巴结阳性的患者病情恶化或复发,且90%患者因腹主动脉旁淋巴结转移复发而死亡,大部分患者死于腹腔复发或远处复发[4,5]。
子宫内膜癌的初次治疗以手术治疗为主,辅助以化疗、放疗、激素治疗以及生物分子制剂等。子宫内膜癌的手术范围仍存在争议,是否需要切除腹主动脉旁淋巴结尚没有统一意见。在具有高危因素的患者(肌层浸润深度>1/2,G3,宫颈浸润,淋巴脉管浸润)单纯的盆腔淋巴结清除术不足以减少复发率[6]。腹主动脉旁淋巴结清扫被证实可以改善高风险子宫内膜癌患者的存活率[7],没有共识指出切除腹主动脉旁淋巴结的上限是肠系膜下动脉还是肾静脉水平。Turan等[8]在一份评估复发高危因素(G2 和 G3,非子宫内膜样肿瘤类型,深度浸润>1/2肌层,肿瘤>2 cm,累及宫颈) 的研究中,在淋巴结转移的患者90%累及腹主动脉旁淋巴结,转移部位达肠系膜下动脉水平之上,而孤立性出现肠系膜下动脉水平淋巴结转移的仅占3.8%。Mariani等[9]研究显示很多患者腹主动脉旁淋巴结转移部位达肠系膜下动脉水平之上,这意味着如果淋巴结切除术未达肾静脉水平,38%~46%肠系膜下动脉水平之上的淋巴结转移病灶会遗漏。Turan、Mariani等认为切除腹主动脉旁淋巴结时应达肾静脉水平。
对于复发病灶只局限在阴道或骨盆内的局部或区域性复发的子宫内膜癌患者相对较简单,可以考虑病灶切除、放疗、化疗,或者是三者不同形式的联合治疗。对于远处转移的患者,通常为全身性疾病,很难做到根治性治疗,一般考虑化疗+激素治疗。对于孤立性病灶,手术切除可以延缓疾病进展提高生存率[10]。
腹主动脉旁淋巴结是子宫内膜癌常见转移部位,实施腹主动脉旁淋巴结清扫也是子宫内膜癌手术病理分期的重要组成部分。近年来,腹腔镜技术快速发展,部分医疗机构实施腹腔镜下腹主动脉旁淋巴结切除术技术也日趋成熟,但因其有血管、输尿管、肠管损伤的风险,大多数妇科医生尚未熟练掌握这项技术,该手术没有得到广泛开展。手术治疗是初次诊断子宫内膜癌治疗的基础,随着腹腔镜设备的不断改进、手术操作的逐渐成熟,腹腔镜手术治疗子宫内膜癌是安全可行的,国内外研究相对较多[11],针对复发性子宫内膜癌的手术治疗研究却很少。对于以往手术后放疗的病人,切除腹膜后淋巴结、尿路、肠管等术后并发症和死亡率高,再次大范围手术技术复杂,相对难度较大且可能导致组织器官损伤,仅在少数医疗中心可以实施这类手术,因为需要对手术并发症有应对措施,有修补的能力[12]。手术前仔细评估,需谨慎选择再次手术的子宫内膜癌复发病人。
腹腔镜下切除复发性腹主动脉旁淋巴结转移孤立性病灶的研究不多,仅Ueda等[13]2012年报道1例腹腔镜下切除孤立性肝癌转移至腹主动脉旁淋巴结,提示该手术的可行性。本例为复发性子宫内膜癌腹主动脉旁淋巴结转移孤立性病灶,初次治疗已行手术+放疗+化疗+激素治疗,治疗结束后8个月再次出现腹主动脉旁左侧肾动脉下方淋巴结转移(约1.6 cm×1.6 cm×2.5 cm),影像学提示其边界清楚,未见与周围血管融合(图1)。在为数不多的研究中,出现孤立性肠系膜下动脉水平淋巴结转移的仅占3.8%[8]。子宫内膜癌手术、放化疗后,复发病灶存在粘连严重的风险,在血管旁淋巴结复发病灶还有可能与血管融合,盲目分离切除可能会导致严重的大出血,甚至出现生命危险。部分患者放疗、化疗等治疗后身体耐受性差,术前需要对其既往治疗方案、身体状况仔细评估,结合影像学情况评估病灶与血管之间的关系,需要有应对手术并发症风险的措施,必要时需要请相关科室协助术中会诊,术者需要有腹主动脉旁淋巴结肾静脉水平淋巴结切除的手术经验。术中需要仔细辨认转移淋巴结与周围腹主动脉、下腔静脉、左输尿管、左肾静脉及左肾动脉等重要脏器的毗邻关系,尽量避免损伤周围血管及输尿管,同时尽量遵循肿瘤手术中的无瘤原则,灵活运用超声刀分离病灶与正常组织的间隙,由易至难,紧贴病灶包膜力求将其完整切除。
综上,复发性子宫内膜癌腹主动脉旁淋巴结孤立转移病灶发病率较低,手术难度大,治疗前需要对患者充分评估,制定好治疗方案,术者需要有腹腔镜下清扫淋巴结丰富的经验。
1 Odagiri T, Watari H, Hosaka M, et al. Multivariate survival analysis of the patients with recurrent endometrial cancer. J Gynecol Oncol,2011,22(1):3-8.
2 Huijgens AN , Mertens HJ. Factors predicting recurrent endometrial cancer. Facts Views Vis Obgyn,2013,5(3):179-186.
3 Alay I, Turan T, Ureyen I,et al. Lymphadenectomy should be performed up to the renal vein in patients with intermediate-high risk endometrial cancer. Pathol Oncol Res,2015,21(3):803-810.
4 Mariani A, Webb MJ, Galli L,et al. Potential therapeutic role of para-aortic lymphadenectomy in node positive endometrial cancer. Gynecol Oncol,2000,76(3): 348-356.
5 Barlin JN, Wysham WZ, Ferda AM, et al. Location of disease in patients who die from endometrial cancer: a study of 414 patients from a single institution. Int J Gynecol Cancer,2012,22(9):1527-1531.
6 Chan JK, Cheung MK, Huh WK, et al. Therapeutic role of lymph node resection in endometrioid corpus cancer: a study of 12,333 patients. Cancer,2006,107(8):1823-1830.
7 Todo Y, Kato H, Kaneuchi M, et al. Survival effect of para-aortic lymphadenectomy in endometrial cancer (SEPAL study):a retrospective cohort analysis.Lancet 2010,375(9721):1165-1172.
8 Turan T, Yilmaz SS, Hizli D, et al. A prospective evaluation of lymphatic dissemination in endometrial cancer: is it adequate to perform lymph node dissection up to the inferior mesenteric artery. Int J Gynecol Cancer,2011, 21(5):864-869.
9 Mariani A, Dowdy SC, Cliby WA, et al. Prospective assessment of lymphatic disseminationin endometrial cancer: a paradigm shift in surgical staging. Gynecol Oncol,2008,109(1):11-18.
10 Wang PH, Wen KC, Yen MS, et al. Challenges in the management of recurrent endometrial cancer. J Chin Med Assoc,2016,79(4):171-173.
11 罗翠珍,张洁清,姚丽军,等.腹腔镜与开腹手术治疗子宫内膜癌的比较.中国微创外科杂志,2014,14(3):216-219.
12 Papadia A, Bellati F, Ditto A, et al. Surgical Treatment of recurrent endometrial cancer: time for a paradigm shift. Ann Surg Oncol,2015,22(13):4204-4210.
13 Ueda J, Yoshida H, Mamada Y, et al. Surgical resection of a solitary para-aortic lymph node metastasis from hepatocellular carcinoma. World J Gastroenterol,2012,18(23):3027-3031.
(修回日期:2016-09-01)
(责任编辑:李贺琼)
Laparoscopic Removal of Para-aortic Lymph Node Metastasis From Recurrent Endometrial Cancer: Case Report
HuangJinjiang,ChenGuowei,LiuLi,etal.
DepartmentofGynecologicOncology,TheFourthAffiliatedHospitalofGuangxiMedicalUniversity,Liuzhou545005,China
HeHongying,E-mail:hehongying828@outlook.com
Endometrial cancer; Recurrence; Lymph node metastasis
D
1009-6604(2017)03-0282-04
10.3969/j.issn.1009-6604.2017.03.026
2016-07-19)
*通讯作者,E-mail:hehongying828@outlook.com
【Summary】 In November 2015, laparoscopic removal of para-aortic lymph node metastasis from recurrent endometrial cancer was conducted. The operation took 145 min, and the amount of bleeding during the operation was 50 ml. The length of postoperative hospitalization was 7 days. The patient began to receive chemotherapy and adjuvant radiation therapy from the fifth day after operation. In August 2016, the follow-up visit showed no tumor recurrence. We think that laparoscopic surgery can be utilized for para-aortic lymph node metastasis from recurrent intrauterine membrane carcinoma.

