水稻稻曲病菌拮抗菌的分离、筛选与抑菌活性测定
朱哲远,彭 迪,李祖任,王立峰,柏连阳
(1.湖南农业大学植物保护学院,湖南 长沙 410128;2.湖南省农业生物技术研究所,湖南 长沙 410125)
水稻稻曲病是稻绿核菌(Ustilaginoidea virens)侵染稻谷引起的真菌病害。该病分布广泛,在亚洲、美洲、非洲和欧洲等地稻区都有发生,这些地区病害的报道也越发频繁[1-3]。近年来,随着大规模水稻种植和化肥大量使用,优质稻和杂交稻被侵染的情况增多,影响我国中晚稻比重较大。感染稻曲病的谷粒又被称为“丰收果”,因为病菌在侵染过程中形成孢子球不断膨胀,包裹整个谷粒,降低水稻生产质量,同时分泌真菌毒素(Ustiloxins),造成动植物的细胞分裂受到抑制,对人畜有毒害作用[4]。所以稻曲病的防控在水稻生产中至关重要,关系着粮食生产安全和农田生态环境安全。
稻曲病是水稻生产中重要的危害病害之一,采取的防控措施主要有化学药剂防控、生防微生物防控和使用抗病品种等[5]。化学药剂防控主要在种子处理和侵染前或初期防治,但是在病害发生程度较深时,防控效果明显降低,且化学农药对生态环境的影响日益受到重视[6-7]。在抗病品种选育方面,目前对水稻抗病机理研究尚不明确,选育方向还集中于从水稻类型出发,该方法不能使高产量和高质量方面同时兼备[8-10]。遵循“预防为主,综合防治”的植保方针,发展生物农药防控病害的研究,是结合化学药剂和田间管理措施等综合防控方法的必要组成,也是解决稻曲病危害的重要方向。
近年来,生防微生物在水稻病害防控方面研究进展迅速[11-12]。以芽孢杆菌(Bacillus spp.)为代表的拮抗菌在防治水稻纹枯病、稻瘟病和白叶枯病等病害上相继取得了一系列成果,水稻稻曲病菌的拮抗菌的报道较少[13-16]。本研究从野外水稻田土壤中分离筛选出对稻曲病菌有生长抑制作用的拮抗细菌B-7,通过16S rDNA测序的方法对菌株进行了鉴定,并测定了抑菌活性。初步研究了B-7的生防作用,为拮抗细菌田间应用和微生物农药开发提供了参考。
1 材料与方法
1.1 供试菌株
水稻稻曲病菌(Ustilaginoidea virens)分离自长沙周边区县发病水稻植株的谷粒,纯培养后4℃保存。待筛菌株采用稀释平板法分离自长沙郊外稻田土壤中,与50%甘油1∶1混合,-20℃冰箱保存。
1.2 培养基
病原菌培养、拮抗菌筛选和抑菌活性测定所用培养基为PDA固体培养基(马铃薯200 g、葡萄糖20 g、琼脂15 g,定容至1 000 mL,pH值7.0)。拮抗菌培养采用的是LB液体培养基(胰蛋白胨10 g、酵母提取物5 g、氯化钠10 g,定容至1 000 mL,pH值7.0)。
1.3 待筛菌株的培养
取200 μL待筛菌株甘油保存液于20 mL LB液体培养基中,置于28℃恒温摇床200 r/min培养24 h后,取200 μL菌旋液置于20 mL LB液体培养基同条件培养39 h。
1.4 拮抗菌的筛选
采用划线平板对峙法测定待筛选菌株对水稻稻曲病菌的抑制情况。取新鲜稻曲病菌接种于PDA平板两周距中央6 cm处,用接种环沾取培养好的待筛菌株发酵液,在PDA平板中央呈直线由上而下划线,设无划线处理为对照,每个处理重复3次,置于25℃生化培养箱内培养,观察、记录抑菌现象,待空白对照两个稻曲病菌菌丝相互接触时,查看抑菌效果,测量平板中线与稻曲病菌边缘形成的空白区域长度。挑选空白区域较大,且作用持久的拮抗菌进行复筛和抑菌活性试验。
1.5 拮抗菌的抑菌活性测定
抑菌活性测定采用K-B纸片扩散法[17]。将水稻稻曲病菌接种于PDA平板中央,在两周各6 cm处分别摆上已灭菌的直径8 mm定性滤纸圆片,并用镊子按压固定。按照1.3的方法制备拮抗菌发酵液,用移液枪吸取10 μL,滴加至圆片上,待液体晾干。设不滴加拮抗菌菌液平板为空白对照,每个处理重复3次。平板置于25℃生化培养箱内培养,并观察记录生长状况,测量抑菌圈半径(滤纸片圆心到水稻稻曲病菌最边缘菌丝距离),观察抑菌效果。按公式(1)计算抑菌活性。

1.6 拮抗细菌分子生物学鉴定
使用通用引物提取拮抗菌DNA序列,通过16S rDNA扩增,进行桑格测序后BLAST比对。分子生物学鉴定由擎科生物技术有限公司完成,BLAST比对使用NCBI数据库。
1.7 拮抗细菌对稻曲病的田间防治效果
试验地位于长沙县高桥镇,试验田为稻曲发病较严重的水稻田,水稻品种为农香32。试验包括4个处理:拮抗细菌发酵液(含菌量为1×108CFU/mL);拮抗细菌发酵液(含菌量为5×108CFU/mL);药剂对照生物农药纹曲宁;清水对照。每处理重复4次,共16个小区,每个小区面积为30 m2(6 m×5 m)。各小区按随机区组排列。在水稻破口前喷施药剂,7 d后进行第2次施药。调查方法:每小区随机选取2点,每点40穴,稻曲病记录总穗数和病穗数,计算防治效果:

采用邓肯氏新复极差(DMRT)法分析试验数据的差异显著性。
2 结果与分析
2.1 拮抗细菌筛选
从水稻田土壤中分离出5株细菌菌株,通过划线平板对峙法,对5株细菌菌株的抑菌效果进行了测定。其中细菌菌株B-7对水稻稻曲病菌的抑菌效果最好,B-7与水稻稻曲病菌之间形成了明显的空白区域。
2.2 拮抗菌B-7抑菌活性测定
筛选出拮抗菌B-7作为对水稻稻曲病菌有生长抑制作用的拮抗菌,采用K-B纸片扩散法进行定量抑菌活性测定。试验结果显示,经过39 h的恒温培养之后,空白对照组稻曲病菌的菌丝生长接近平板边缘,抑菌半径为0 cm,B-7菌株的生长对稻曲病菌生长的抑菌半径达到1.4 cm(图1),抑菌活性达到72.0%。表明B-7对水稻稻曲病菌有拮抗作用。
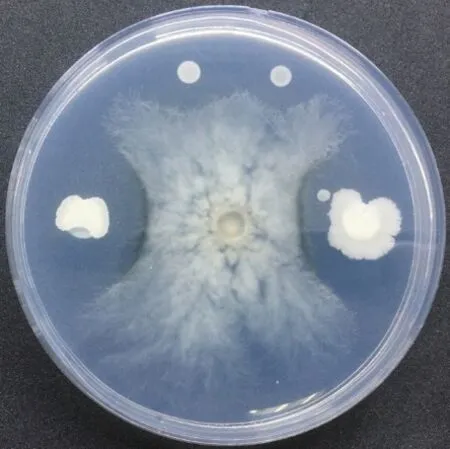
图1 拮抗菌B-7对水稻稻曲病菌抑制效果
2.3 拮抗菌B-7的16S rDNA测序鉴定
拮抗菌B-7通过16S rDNA全长测序之后,经过NCBI上与已经公开的菌株序列进行BLAST比对。结果表明拮抗菌B-7与数据库中Bacillus cereus strain FORT 154的同源性达99%,初步鉴定为蜡质芽孢杆菌(Bacillus cereus)。
2.4 拮抗菌B-7防治稻曲病田间防治效果
田间小区试验结果(表1)表明,蜡质芽孢杆菌B-7对稻曲病的防治效果较好,相对于清水对照处理,其他3个处理的水稻纹枯病的发病率都有明显的降低,其中5×108CFU/mL浓度的 B-7菌悬液处理的发病率最低,对稻曲病的防效达到了63.90%。
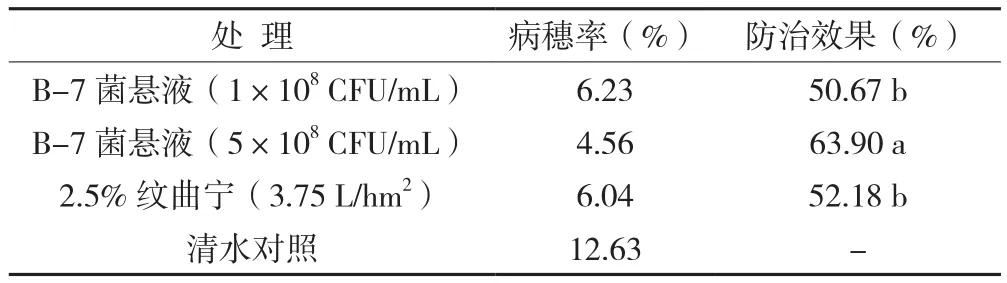
表1 蜡质芽孢杆菌B-7防治稻曲病田间试验效果
3 结论与讨论
水稻稻曲病对水稻生产的威胁不容忽视,病菌产生的菌粉对人畜、环境等方面都有较大的危害。为了减轻稻曲病对水稻生产的影响,一直采取化学药剂防治,盲目、不科学使用化学农药和化肥,导致水稻稻曲病在种植地区大面积发生,对我国粮食生产、环境保护方面都造成了一定的负面影响。使用综合防治的措施,将微生物、化学药剂和田间治理等多种方式结合来治理水稻稻曲病等水稻病害,可以逐步改善农业生态环境和水稻种植品质。完善微生物拮抗菌的研究是其中一大重点。
从生态环境的角度出发,防治真菌病害的措施不再单一,采用生物菌防治的方式是一有力补充。鄢一笑等[18]分离出菌株F26-T,发现对水稻稻曲病菌有较强的抑菌作用,且能够在水稻叶围上定殖生长。尹小乐等[19]从土壤中分离出枯草芽孢杆菌SF-62和SF-3-38,初步研究出对水稻稻曲病菌的拮抗性能。目前蜡质芽孢杆菌的研究有很好的发展前景[20-21]。蜡质芽孢杆菌具有强烈的抗真菌活性,陈刘军等[22]研究蜡质芽孢杆菌AR156能够抑制水稻纹枯菌核的生长,而且可以诱导水稻植株的体内防御酶的提前表达,从而使水稻抗性显著提升。
试验从拮抗菌分离、筛选和抑菌活性等方面,筛选出了有效抑制稻曲病菌生长的拮抗细菌B-7,鉴定为蜡质芽孢杆菌,田间试验结果表明其对稻曲病具有良好的防治效果。通过这一试验说明了蜡质芽孢杆菌在水稻病害防治上的重要作用,继续研究蜡质芽孢杆菌的诱导植物抗性表达,可以深层次了解生防机制,为微生物农药的开发提供参考。
参考文献:
[1] 伏荣桃,王 剑,卢代华,等. 国内外水稻稻曲病研究进展[J]. 中国农学通报,2016,32(12):189-194.
[2] 张俊喜,成晓松,宋益民,等. 中国水稻稻曲病研究进展[J]. 江苏农业学报,2016,32(1):234-240.
[3] 中国农业百科全书总编辑委员会, 植物病理学卷编辑委员会. 中国农业百科全书·植物病理学卷[M]. 北京:农业出版社,1996,114-115.
[4] Tang Y X,Jin J,Hu D W,et al. Elucidation of the infection process ofUstilaginoidea virens(teleomorph: Villosiclava virens) in rice spikelets[J].Plant Pathology,2013,62(1):1-8.
[5] 邱德文. 我国植物病害生物防治的现状及发展策略[J]. 植物保护,2010, 36(4):15-18.
[6] 季宏平,张匀华,王 芊,等. 水稻稻曲病发生为害调查及药剂防治研究[J]. 中国农学通报,2001,17(4):37-38.
[7] 邹克琴,胡东维,王为民,等. 水稻稻曲病的研究进展[J]. 浙江农业科学,2012,1(5): 704-706.
[8] 唐善军,高杜娟,陈友德,等. 水稻品种稻曲病抗性鉴定研究进展[J].中国稻米,2012,18(3):14-18.
[9] 季宏平,张匀华,王 芊,等. 黑龙江省水稻稻曲病发生规律与防治技术研究[J]. 植物保护,2002,28(3):24-26.
[10] 李余生,朱 镇,张亚东,等. 水稻稻曲病抗性的主基因+多基因混合遗传模型分析[J]. 作物学报,2008,34(10):1728-1733.
[11] Khan A A,Singh R. Effect of zinc onTrichoderma harzianumand sheath blight of rice in nursery[J]. Agriways,2015,3(1):25-28.
[12] Chung E J,Hossain M T,Khan A,et al.Bacillus oryzicolasp.nov.,an endophytic bacterium isolated from the roots of rice with antimicrobial, plant growth promoting, and systemic resistance inducing activities in rice[J]. Plant Pathology Journal,2015,31(2):152.
[13] Mew T W,Rosales A M. Bacterization of rice plants for control of sheath blight caused byRhizoctonia solani[J]. Phytopathology,1986,76(11):1260-1264.
[14] 谷春艳,张爱芳,杨 雪,等. 水稻稻瘟病拮抗细菌WH1G的筛选鉴定及其抑菌活性[J]. 植物保护,2016,42(4):48-55.
[15] 兰时乐,陈海荣,肖宏英,等. 稻曲病菌拮抗菌的筛选及拮抗活性测定[J]. 植物保护,2004,30(2):69-72.
[16] 曹琦琦,周登博,郑 丽,等. 水稻纹枯病菌拮抗菌的筛选、鉴定及培养条件探索[J]. 中国生物防治学报,2013,29(2):270-276.
[17] 吴家法,吴思婷,李智鸣,等. 茅尾海红树林土壤可培养放线菌多样性及其抗尖孢镰刀菌活性分析[J]. 中国抗生素杂志,2017,42(4):294-301.
[18] 鄢一笑,刘前刚,杨习群,等. F26-T菌株对水稻稻曲病生防效果的初步研究[J]. 湖南农业科学,2015,(7):24-26.
[19] 尹小乐,陈志谊,刘永锋,等. 稻曲病拮抗细菌的筛选与评价[J].江苏农业学报,2011,27(5):983-989.
[20] Ultee A,Slump R A,Steging G,et al. Antimicrobial activity of carvacrol toward Bacillus cereus on rice[J]. Journal of food protection,2000,63(5):620-624.
[21] 高 芬,马利平,乔雄梧,等. 蜡质芽孢杆菌BC98-Ⅰ发酵液与抑菌粗提物对黄瓜枯萎病菌的抑菌特性研究[J]. 中国生态农业学报,2006,14(1):189-192.
[22] 陈刘军,俞仪阳,王 超,等. 蜡质芽孢杆菌AR156防治水稻纹枯病机理初探[J]. 中国生物防治学报,2014,30(1):107-112.

