结直肠癌患者外周血与肿瘤组织中TAZ表达的关系及临床意义研究*
王爱军,王红钰,徐晋珩,郑宝军,吴 肖,程 健,张 超,施 华,冯俊伟
(河北医科大学附属唐山市工人医院:1.肿瘤外科;2.病理科 063000)
结直肠癌患者外周血与肿瘤组织中TAZ表达的关系及临床意义研究*
王爱军1,王红钰1,徐晋珩2,郑宝军1,吴 肖1,程 健1,张 超1,施 华1,冯俊伟1
(河北医科大学附属唐山市工人医院:1.肿瘤外科;2.病理科 063000)
目的探讨转录共激活因子(TAZ)在结直肠癌患者外周血与肿瘤组织中表达,分析其关系及临床意义。方法选取经病理确诊为结直肠癌并行根治性手术患者85例为手术组,手术后确诊复发的患者35例作为复发组,同时选取年龄性别相匹配的健康人50例为对照组。取结直肠癌患者肿瘤组织及正常黏膜组织石蜡标本,采用免疫组织化学染色检测TAZ表达,酶联免疫吸附试验(ELISA)检测各组外周血中TAZ的水平。结果手术组患者术前外周血中TAZ水平明显高于对照组(P<0.05),手术后TAZ水平较对照组无明显变化(P>0.05),复发组患者外周血TAZ水平明显高于手术组术前(P<0.05)。手术组患者肿瘤组织中TAZ表达明显高于正常黏膜组织(P<0.05),复发组患者肿瘤组织中TAZ表达高于手术组(P<0.05)。手术组和复发组患者肿瘤组织与外周血TAZ水平呈正相关性(P<0.05)。结论监测TAZ水平对及时了解肿瘤复发有明显的参考价值。
结直肠肿瘤;TAZ;复发;肿瘤标志物
结直肠癌是我国常见的消化道恶性肿瘤,占我国恶性肿瘤的第四位,胃肠道肿瘤的第二位,近年来发病率不断升高,严重威胁了人们的健康。由于结直肠癌早期发现困难,因而手术之后患者仍有复发的风险,目前肿瘤复发的概率也有上升的趋势。虽然已有癌胚抗原(CEA)等指标用于复发预测,但效果并不能令人满意[1]。因此,寻找新的肿瘤相关分子预测结直肠癌复发有重要临床意义。转录共激活因子(TAZ)是通过与转录因子和染色体重构蛋白相结合来调节下游基因的转录。有研究显示,TAZ在非小细胞肺癌、乳腺癌、甲状腺癌、多发性骨髓瘤等多种恶性肿瘤中表达增强,且与肿瘤的转移预后有关[2-5]。但目前关于TAZ与结直肠癌复发的报道还不多见。本研究通过检测结直肠癌患者、复发患者外周血及肿瘤组织TAZ表达情况,对不同组织中TAZ的关系进行分析,为结直肠癌复发转移的机制及预测提供依据。
1 资料与方法
1.1一般资料 选取2014-2015年于本院行根治性手术的结直肠癌患者85例为手术组,其中男57例,女28例,年龄26~74岁,平均(61.4±18.3)岁,均有术后病理确诊。同时选取性别、年龄相匹配的健康体检者50例为对照组,同期手术后复发结直肠癌患者35例为复发组,均有活检病理证实,并有影像学资料确定为复发。所有入选者均自愿签署知情同意书,并得到本院医学伦理委员会批准。
1.2主要试剂及仪器 全自动电化学发光免疫分析仪(罗氏E601),TAZ试剂盒购自美国TPI公司,酶免之星全自动免疫分析仪。TAZ兔抗人单克隆抗体购自美国Santa Cruz公司,其他免疫组化试剂及试剂盒均购自北京中山生物技术公司。
1.3方法
1.3.1标本采集 所有入选者晨起空腹抽取静脉血5 mL,室温静置30 min后,3 500 r/min离心15 min,分离血清。手术组在术前1 d、术后1个月各采血1次,复发组及对照组均采血1次。肿瘤组织石蜡标本取自本院病理科,标本均经HE染色确诊,连续4 μm切片后进行免疫组织化学检测;同时自病理科取结直肠癌患者正常黏膜组织标本30例作为TAZ组织检测的对照(标本来自结肠镜活检组织,证实无癌及不典型增生组织存在)。
1.3.2酶联免疫吸附试验(ELISA)检测TAZ在外周血中的表达 各组血清严格依据试剂盒的说明书操作,检测TAZ表达水平。板内、板间变异系数均小于10%,用酶免之星全自动酶标仪检测读数。
1.3.3免疫组织化学检测及结果判断 将石蜡标本进行4 μm连续切片,进一步脱蜡水化,按免疫组织化学试剂盒(SP法)说明书进行染色操作,结果由病理专业医师判断。根据阳性细胞的百分率结合染色强度对免疫组织化学染色结果进行分析。TAZ以细胞核出现黄色或棕黄色染色为阳性。在400倍显微镜下随机计数10个视野,每视野计数100个细胞,计算阳性率(0%~20%为0分,>20%~50%为1分,>50%~75%为2分,≥76%为3分);再按染色强度进行计分:无阳性染色为0分,淡黄色为1分,棕黄色为2分,黄褐色为3分。阳性率及染色强度计分之和结果评分:0~1分为(-),2~3分为(+),≥4分(++)。
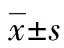
2 结 果
2.1各组外周血TAZ表达水平 手术组患者术前外周血TAZ水平为(3.69±1.02)ng/mL,术后为(0.13±0.08)ng/mL,差异有统计学意义(P<0.05)。对照组外周血TAZ水平为(0.11±0.09)ng/mL,明显低于手术组术前(P<0.05),而与手术组术后比较差异无统计学意义(P>0.05)。复发组外周血TAZ水平为(5.94±1.85)ng/mL,明显高于手术组术前(P<0.05)。
2.2结直肠癌患者肿瘤组织与正常黏膜组织中TAZ表达水平 手术组患者肿瘤组织中TAZ表达阳性率为78.82%(67/85),明显高于正常黏膜组织的阳性率13.33%(4/30),差异有统计学意义(χ2=40.26,P<0.01);复发组患者肿瘤组织中TAZ表达阳性率为94.29%(33/35),高于手术组(χ2=4.27,P=0.039)。
2.3结直肠癌患者外周血与肿瘤组织中TAZ表达的关系 Spearmann相关分析显示,手术组外周血与肿瘤组织中TAZ表达呈正相关(r=0.304 6,P=0.005),复发组外周血与肿瘤组织中TAZ表达也呈明显正相关(r=0.422 8,P=0.011)。
3 讨 论
结直肠癌是我国常见消化道恶性肿瘤,随着生活水平的提高,结直肠癌的发病率也逐渐上升,严重危害人民健康[6-8]。由于结直肠癌早期并无特异性症状,确诊时患者多已处于进展期,即使经过手术、放化疗等综合治疗,也存在较高的复发、转移概率,导致患者预后不良[9-10]。因此,及时准确地预测患者复发在结直肠癌的综合治疗中有重要意义。但目前常用的指标尚不能令人满意。由于TAZ在肿瘤中发挥较为广泛的作用,故本研究对TAZ与结直肠癌的关系进行了研究。
TAZ是由400个氨基酸构成,内含ww结构域和PDZ结合序列。TAZ在许多组织和器官中都存在表达[11-12]。研究发现,TAZ能够促进肿瘤细胞增殖、迁移、凋亡及诱导细胞的恶性转化[13]。多项研究发现,TAZ蛋白在肺癌、乳腺癌、胃癌等许多恶性肿瘤中高表达,可以促进肿瘤的侵袭、转移、耐药形成等过程[2-5]。已有报道发现,TAZ在结直肠癌中存在过表达现象[14-15],但具体作用还不明确。本研究发现,TAZ在肿瘤组织表达明显比正常黏膜组织增强,提示TAZ可能参与结直肠癌的发生。本研究结果还发现,复发患者的肿瘤组织TAZ表达更强,说明TAZ在复发过程中表达进一步增强,提示TAZ在结直肠癌的复发过程中可能发挥了促进作用。
本研究发现,术前结直肠癌患者外周血TAZ水平高于对照组,手术切除肿瘤后TAZ水平明显降低,说明外周血TAZ水平与患者体内的肿瘤负荷关系密切。对复发患者的外周血检测还发现TAZ水平最高,也提示TAZ对结直肠癌的复发有促进作用。相关分析还发现,手术前患者和复发患者的肿瘤组织和外周血TAZ水平存在明显相关性,说明外周血TAZ检测可以反映肿瘤状态。监测TAZ水平对及时了解肿瘤复发有明显的参考价值。
[1]常俊峰,李明,李虎林,等.联合检测血清肿瘤标志物在结直肠癌诊断和预后判断中的应用[J].检验医学与临床,2014,11(8):1082-1083.
[2]Xie M,Zhang L,He CS,et al.Prognostic significance of TAZ expression in resected non-small cell lung cancer[J].J Thorac Oncol,2012,7(5):799-807.
[3]Hiemer SE,Szymaniak AD,Varelas X.The transcriptional regulators TAZ and YAP direct transforming growth factor β-induced tumorigenic phenotypes in breast cancer cells[J].J Biol Chem,2014,289(19):13461-13474.
[4]De Cristofaro T,Di Palma T,Ferraro AA,et al.TAZ/WWTR1 is overexpressed in papillary thyroid carcinoma[J].Eur J Cancer,2011,47(6):926-933.
[5]Eda H,Aoki K,Kato S,et al.The proteasome inhibitor bortezomib inhibits FGF-2-induced reduction of TAZ levels in osteoblast-like cells[J].Eur J Haematol,2010,85(1):68-75.
[6]Chen W,Zheng R,Zuo T,et al.National cancer incidence and mortality in China,2012[J].Chin J Cancer Res,2016,28(1):1-11.
[7]Chen XZ,Hu JK,Zhou ZG.Importance of organized screening and surveillance for colorectal cancer in China:epidemiological differences from Europe[J].Eur J Cancer Prev,2015,24(6):459-460.
[8]Jin K,Wang J,Lan H,et al.Laparoscopic surgery for colorectal cancer in China:an overview[J].Int J Clin Exp Med,2014,7(12):4635-4645.
[9]YusupA,WangHJ,RahmutulaA.ClinicalfeaturesandprognosisincolorectalcancerpatientswithdifferentethnicitiesinNorthwestChina[J].WorldJ Gastroenterol,2013,19(41):7183-7188.
[10]Preisser F,Giehl K,Rehm M,et al.Inhibitors of oxygen sensing prolyl hydroxylases regulate nuclear localization of the transcription factors Smad2 and YAP/TAZ involved in CTGF synthesis[J].Biochim Biophys Acta,2016,186(8):2027-2036.
[11]Hong AW,Meng Z,Guan KL.The Hippo pathway in intestinal regeneration and disease[J].Nat Rev Gastroenterol Hepatol,2016,13(6):324-337.
[12]Zhang K,Qi HX,Hu ZM,et al.YAP and TAZ Take Center Stage in Cancer[J].Biochemistry,2015,54(43):6555-6566.
[13]Azzolin L,Zanconato F,Bresolin S,et al.Role of TAZ as mediator of Wnt signaling[J].Cell,2012,151(7):1443-1456.
[14]Yuen HF,Mccrudden CM,Huang YH,et al.TAZ expression as a prognostic indicator in colorectal cancer[J].PLoS One,2013,8(1):e54211.
[15]Wang L,Shi S,Guo Z,et al.Overexpression of YAP and TAZ is an Independent predictor of prognosis in colorectal cancer and related to the proliferation and metastasis of colon cancer cells[J].PLoS One,2013,8(6):e65539.
RelationshipofTAZexpressionbetweenperipheralbloodandtumortissueinpatientswithcolorectalcanceranditsclinicalsignificance*
WangAijun1,WangHongyu1,XuJinheng2,ZhengBaojun1,WuXiao1,ChengJian1,ZhangChao1,ShiHua1,FengJunwei1
(1.DepartmentofOncologySurgery;2.DepartmentofPathology,AffiliatedTangshanMunicipalWorker′sHospital,HebeiMedicalUniversity,Tangshan,Hebei063000,China)
ObjectiveTo investigate the expression of TAZ in peripheral blood and tumor tissue of the patients with colorectal cancer and to analyze their relationship and clinical significance.MethodsEighty-five cases of pathologically verified colorectal cancer treated by radical operation were selected as the operation group,and 35 cases with postoperative relapse served as the recurrent group.Meanwhile 50 age and sex-matched healthy persons were selected as the control group.The immunohistochemical(SP) technique was adopted to detect the expression of TAZ in tumor tissues and expression of TAZ in peripheral blood was tested with enzyme linked immunosorbent assay(ELISA).ResultsThe level of preoperative TAZ in peripheral blood of the operation group was significantly higher than that of the control group(P<0.05).The level of peripheral blood TAZ after operation in the operation group had no significant change compared with the control group(P>0.05).The level of peripheral blood TAZ in the recurrent group was significantly higher than preoperative level of operation group(P<0.05).The expression of tumor tissue TAZ was significantly higher than that of normal mucosal tissue(P<0.05);the expression of tumor tissue TAZ in the recurrent group was higher than that in the operation group(P<0.05).The tumor tissue TAZ level in the operation group and recurrent group had obvious correlation with peripheral blood TAZ level(P<0.05).ConclusionMonitoring the TAZ level has obvious reference value for predicting colorectal cancer staging and timely understanding tumor recurrence.
colorectal neoplasms;TAZ;recurrence;tumor markers
河北省科技计划基金资助项目(16277702D)。
王爱军(1967-),主任医师,硕士,主要从事胃肠肿瘤的基础及临床研究。
R735.3
A
1671-8348(2017)28-3915-02
2017-04-04
2017-06-30)
10.3969/j.issn.1671-8348.2017.28.011

