紫衫醇对大鼠肝纤维化的抑制作用及机制研究
叶轲,白宁,周乐杜,李劲东,王志明
(中南大学湘雅医院 普通外科,湖南 长沙 410008)
肝纤维化常见的原因是由于酒精、自体免疫反应、HBV和HCV病毒感染、非酒精性脂肪肝疾病及各种肝毒素等因素诱发肝细胞损伤[1],造成一些其他类型肝细胞及迁移的炎性细胞活化,并释放大量细胞因子,这些细胞因子导致肝星状细胞或肌纤维母细胞活化、分化与增殖,合成大量细胞外基质成分,并逐渐沉积从而引起肝纤维化[2]。2,4-二甲基亚硝胺(DMN)是有剧毒的肝毒性化合物[3],有研究[4]证实DMN模型中肝组织病理学改变相似于人类酒精性肝纤维化的病理改变。且在停止DMN造模后自行恢复困难,是一种抗纤维化药物治疗的经典模型[5]。紫杉醇具有抑制细胞分裂和增殖,抗肿瘤的作用[6]。本研究中通过紫衫醇对大鼠肝纤维化的抑制作用,研究肝星状细胞TGF-β信号通路激活情况来探讨紫杉醇抑制肝纤维化的具体分子机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物与细胞 Wistar雄性大鼠,体质量 140~170 g,动物合格证编号 0278596,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号为SCXK(京)2017-1023,饲养于中南大学湘雅三医院实验动物中心,均饲养于(25±2)℃的屏障实验室内,每12 h光照明暗交替,自由进食及饮水。大鼠肝星状细胞HSC-T6购自中科院细胞库,用含10%胎牛血清的DMEM培养。
1.1.2 实验仪器 RM2235 LEICA病理切片机、EG1150C LEICA生 物 组 织 冷 冻 机、EG1150H LEICA生物组织包埋机、ASP200 LEICA生物组织自动脱水机:德国莱卡公司;BX41OLYMPUS显微镜:日本OLYMPUS株式会社;Nikon ECLIPSE Ti显微摄像系统:日本Nikon株式会社。PCR仪:美 国 ABI Veriti; 荧 光 定 量 PCR 仪: 美 国 ABI StepOnePlus;低温高速离心机:美国Microfuge 20R;核算蛋白质定量仪:美国Thermo NanoDrop 2000。
1.1.3 实验药品与试剂 紫杉醇购自深圳信立泰药业有限公司,批号20160112;DMN购买于上海蓝季生物公司,由日本东京化成工业株式会社生产,批号76F72-TF;甲醛溶液,500 mL/瓶,上海凌峰化学试剂有限公司生产,批号201507109;大鼠透明质酸ELISA试剂盒购自上海蓝基生物科技有限公司;α肌动蛋白(α-SMA)、纤连蛋白(fibronectin)以及I、III型胶原抗体均为英国Abcam公司产品;反转录试剂盒、qPCR试剂盒为宝生物工程(大连)有限公司产品。
1.2 实验方法
1.2.1 实验动物分组与处理 将30只大鼠随机均分为3组:正常对照组、肝纤维化模型组、肝纤维化模型+紫杉醇处理组。肝纤维化模型组、肝纤维化模型+紫杉醇组均采用DMN造模(用DMN 10 mg/kg腹腔连续注射7 d,造成大鼠肝脏广泛性肝坏死,然后停药,约14 d后,大鼠肝脏可呈纤维化表现),期间正常对照组以同样的方式给予生理盐水处理,以上连续7 d的注射完成后,于实验第8天开始,肝纤维化模型+紫杉醇组大鼠给予紫杉醇液(1 mg/kg)尾静脉注射,隔日1次,共3次,正常对照组与肝纤维化模型组则以同样的方式给予同体积的生理盐水。
1.2.2 标本采取与处理 于实验第14天,用2%戊巴比妥钠按2 mL/100 g剂量腹腔注射麻醉大鼠,腹主动脉采血,血液 4℃下静置 2 h 后,3 000r/min,15min离心,取上清分装于1.5 mL离心管,于-80℃保存;取肝组织行甲醛液固定、石蜡包埋、切片。
1.2.3 动物实验检测指标与方法 用全自动生化分析仪检测大鼠血清谷草转氨酶(AST)、谷丙转氨酶(ALT)、总胆红素(TBIL)、白蛋白(ALB),ELISA方法检测透明质酸(HA)透明质酸水平,用免疫组化法检测及肝星状细胞标志物α-SMA的水平。
1.2.4 细胞实验与分组 将大鼠肝星状细胞HSC-T6细胞以2×105个/孔的数量接种于6孔细胞培养板上,待贴壁细胞融合度达到60%~70%,弃去含血清培养基,加入0.5%低血清DMEM培养基饥饿24 h,将细胞分为:空白对照组、TGF-β1处理组、紫杉醇+TGF-β1处理组,空白对照组加入10%胎牛血清的DMEM培养液培养24 h,TGF-β1处理组加入10%胎牛血清的DMEM培养液与 5 ng/mL 终浓度 TGF-β1 液培养 24 h,紫杉醇+TGF-β1处理组加入10%胎牛血清的DMEM培养液以及 500 nmol/L(预实验 IC50为 459 nmol/L)紫杉醇+5 ng/mL终浓度 TGF-β1液培养24 h,然后进行后续实验。
1.2.5 细胞实验检测指标与方法 HSC-T6细胞中纤连蛋白及I、III型胶原使用RT-PCR和Western blot检测方法,操作按说明书或常规程序进行。
1.3 统计学处理
采用SPSS 20.0统计软件进行处理。计量资料采用均值±标准差(±s)表示,组间比较采用t检验,计数资料比较采用χ2检验,等级资料比较采用秩和检验,P<0.05为差异有统计学意义。
2 结 果
2.1 病理学检测结果
病理学切片结果显示,正常对照组肝组织结构完全正常,具有完整的肝小叶结构,可见正常肝组织,肝纤维化模型组可见明显的肝纤维化病变,肝纤维化模型+紫杉醇组可见肝组织中度坏死,未见明显坏死结节(图1)。

图1 各组大鼠肝组织病理学检测情况(×100) A:正常对照组;B:肝纤维化模型组;C:肝纤维化模型+紫杉醇组Figure 1 Pathological fi ndings in the liver tissues of each group of rats (×100) A: Normal control group; B: Hepatic fi brosis model group; C: Hepatic fi brosis model plus paclitaxel group
2.2 血清学指标检测结果
与正常对照组比较,肝纤维化模型组与肝纤维化模型+紫杉醇组的AST、ALT、TBIL、HA均明显升高,ALB水平明显降低(均P<0.05);与肝纤维化模型组比较,肝纤维化模型+紫杉醇组的AST、ALT水平无统计学差异(均P>0.05),TBIL、ALB、HA水平明显改善(均P<0.05)(表1)。
表1 各项血清学指标检测结果(n=10,±s)Table 1 Results of tests of serological variables (n=10, ±s)
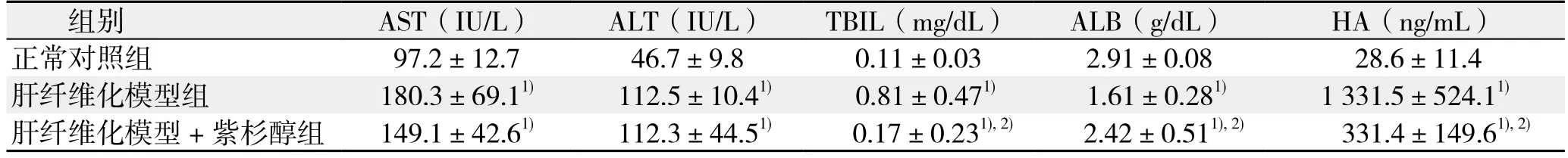
表1 各项血清学指标检测结果(n=10,±s)Table 1 Results of tests of serological variables (n=10, ±s)
注:1)与正常对照组比较,P<0.05;2)与肝纤维化模型组比较,P<0.05Note:1) P<0.05 vs. normal control group; 2) P<0.05 vs. hepatic fibrosis group
组别 AST(IU/L) ALT(IU/L) TBIL(mg/dL) ALB(g/dL) HA(ng/mL)正常对照组 97.2±12.7 46.7±9.8 0.11±0.03 2.91±0.08 28.6±11.4肝纤维化模型组 180.3±69.11) 112.5±10.41) 0.81±0.471) 1.61±0.281) 1 331.5±524.11)肝纤维化模型+紫杉醇组 149.1±42.61) 112.3±44.51) 0.17±0.231),2) 2.42±0.511),2) 331.4±149.61),2)
2.3 肝星状细胞标志物α-SMA表达检测
正常对照组肝组织无明显的α-SMA阳性表达,肝纤维化模型组可见广泛α-SMA阳性表达,集中在纤维化病变区域,而在肝纤维化模型+紫杉醇组α-SMA阳性表达较前者明显减少(图3);3组α-SMA阳性细胞数比较,差异有统计学差异(均P<0.05)(图4)。

图3 各组肝组织α-SMA的表达(×100) A:正常对照组;B:肝纤维化模型组;C:肝纤维化模型+紫杉醇处理组Figure 3 Detection of α-SMA expressions in the liver tissues in each group (×100) A: Normal control group; B: Hepatic fi brosis model group; C: Hepatic fi brosis model plus paclitaxel group
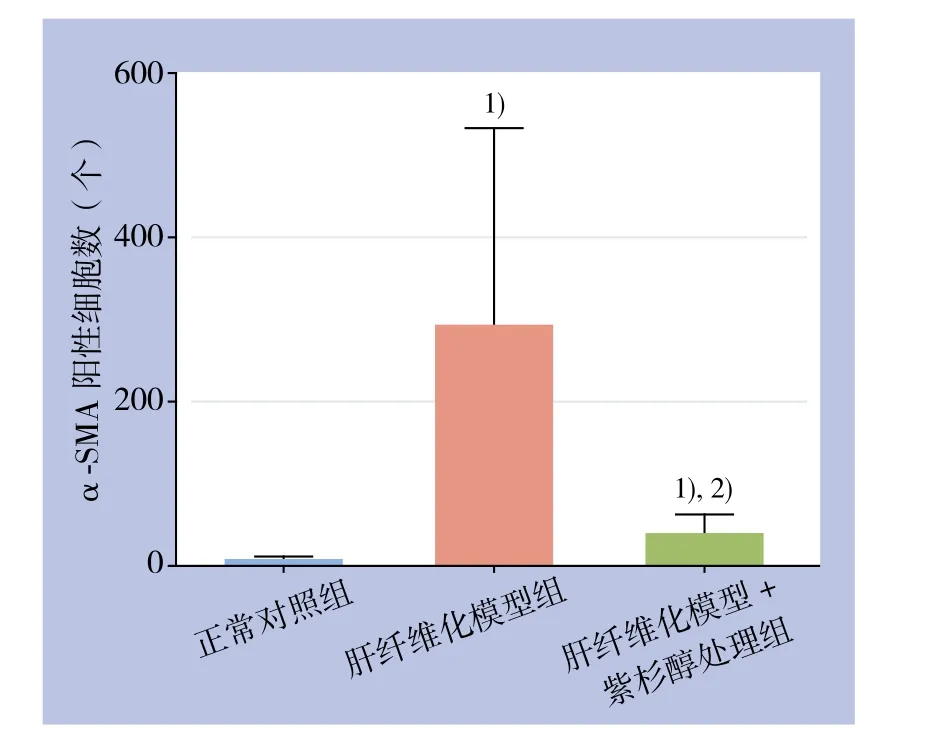
图4 各组α-SMA阳性细胞数比较 注:1)与正对照组比较,P<0.05;2)与肝纤维化模型组比较,P<0.05Figure 4 Comparison of the numbers of α-SMA positive cells among groups Note: 1) P<0.05 vs. normal control group; 2) P<0.05 vs. hepatic fi brosis group
2.4 紫杉醇对TGF-β1诱导的HSC-T6细胞纤连蛋白及I、III型胶原表达的影响
RT-PCR结果显示,TGF-β1处理组HSC-T6细胞纤连蛋白及I、III型胶原mRNA的表达均较空白对照组HSC-T6细胞明显上调,而3种mRNA的表达在紫杉醇+TGF-β1处理组均较空白对照组升高,但均较TGF-β1处理组明显降低,统计分析显示,差异均有统计学意义(均P<0.05)(图5A);Western blot检测结果显示,各组纤连蛋白及I、III型胶原的蛋白表达与其mRNA的表达趋势一致,且半定量统计分析显示,差异均有统计学意义(均P<0.05)(图5B)。
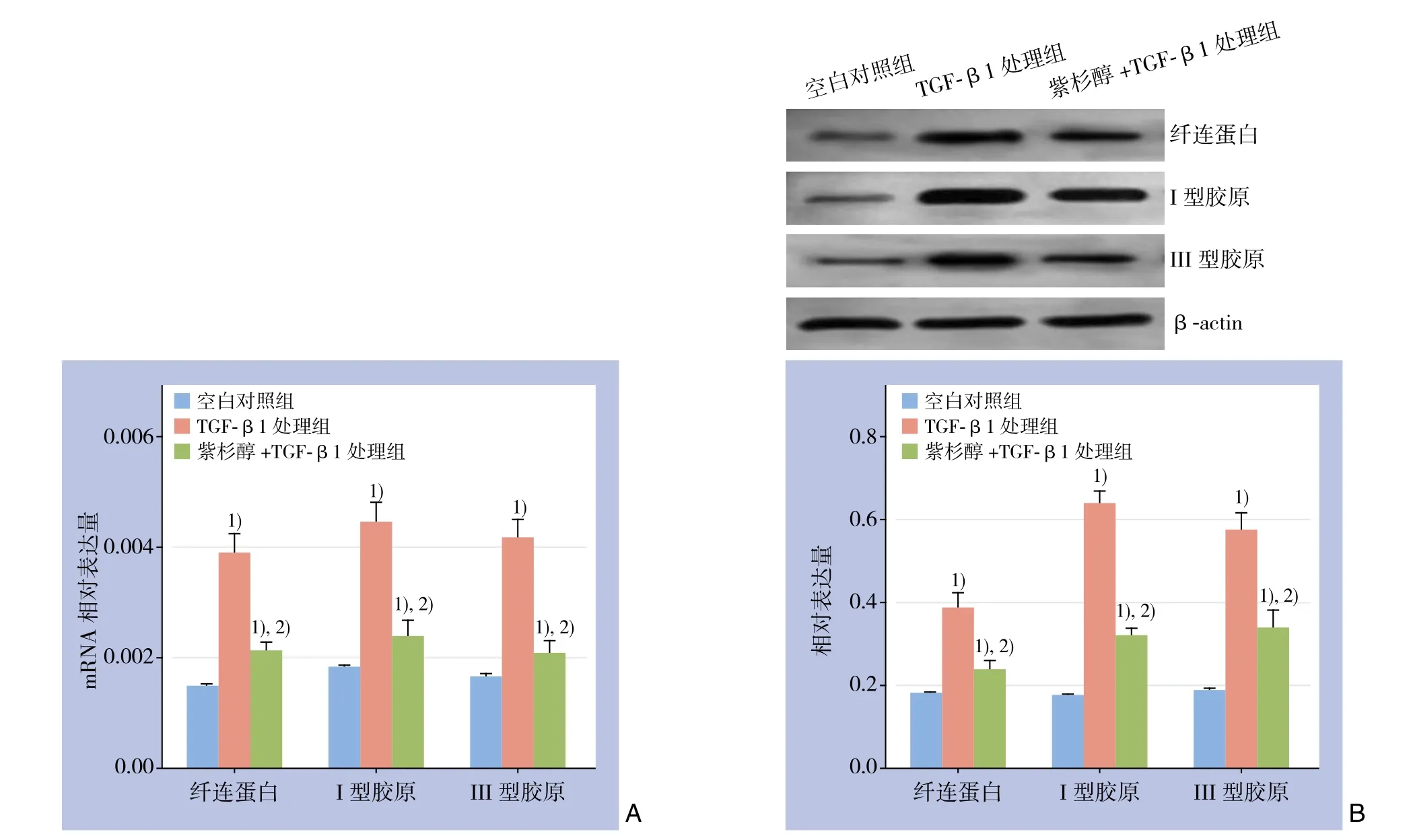
图5 各组细胞纤连蛋白及I、III型胶原表达的检测结果 A:mRNA表达情况;B:蛋白表达情况 注:1)与空白对照组比较,P<0.05;2)与TGF-β1处理组比较,P<0.05Figure 5 Expressions of fi bronectin and type I and III collagen in each group of cells A: The mRNA expressions; B: The protein expressions Note: 1) P<0.05 vs. blank control group; 2) P<0.05 vs. TGF-β1 treatment group
3 讨 论
肝纤维化是肝脏对各种持续性损伤,发生组织修复反应时因细胞外基质合成、降解和沉积不平衡而引起的病理过程[7],是慢性肝病的病理特征,也是进一步向肝硬化发展的关键步骤[8]。在整个肝纤维化发病过程中,肝星状细胞的活化、增殖是核心环节[9-10]。被激活的肝星状细胞是合成细胞外基质的主要细胞[11]。肝脏受损时在各种因素的刺激下,肝星状细胞被激活主要表现为如下几个方面:⑴ 转化为肌纤维母细胞,快速发生形态学改变,脂滴、类维生素A丢失[12];⑵ 表达多种细胞因子及受体;细胞大量增殖,合成大量的细胞外基质[13];⑶ 同时表达平滑肌α-SMA、结蛋白及波形蛋白,具有收缩功能[14]。目前认为,肝星状细胞是肝纤维化时细胞外基质合成的最主要细胞,肝星状细胞的活化是肝纤维化发生的关键。本研究结果显示,肝纤维化模型组可见广泛α-SMA阳性细胞表达,进一步说明肝纤维化发生发展过程中有大量肝星状细胞的活化。
肝纤维化发病过程中,TGF-β是提高肝纤维化最有效的细胞因子,能够抑制肝细胞的增殖,激发肝星状细胞的活化,促进细胞外基质的产生,并调节肝细胞的凋亡[15]。TGF-β家族包括一类细胞因子,它们都为结构上相似一类小的多肽,分为几种亚型,参与许多不同的生物学功能[16]。其中TGF-β1是目前研究的最为广泛,被认为是和肝损伤修复以及肝纤维化十分密切的一种细胞因子[17]。有研究[18]表明,TGF-β1水平在有病变的组织器官中会大大提高,尤其是在纤维病变的区域,外源性TGF-β1若用于实验动物就会导致组织器官的纤维化发生以及细胞的细胞外基质的过量沉积;实验性抗TGF-β1的治疗,包括中和抗体、可溶的II型受体、反义寡核苷酸、小分子抑制剂以及RNA干扰均能够抑制纤维化的形成[19]。这些说明TGF-β1可以激活肝星状细胞,并促进其大量表达细胞外基质[20]。另外激活的肝星状细胞可以自分泌或旁分泌TGF-β1,进一步促进肝星状细胞激活,形成一个正反馈效应[21]。因此,转化生长因子TGF-β1是调控肝纤维化发生发展的核心物质,两者关系密切。本研究采用TGF-β1处理HSC-T6细胞后发现,HSC-T6细胞的细胞外基质成分纤连蛋白及I、III型胶原mRNA与蛋白表达均显著上调,再次证明了TGF-β1在促进细胞外基质过度沉积而导致肝纤维化的重要作用。
紫杉醇是一种稳定已聚合微管和促进微管聚合的天然药物[21-22]。紫杉醇具有在有丝分裂时不能形成纺锤体和纺锤丝,抑制细胞分裂和增殖的药理作用[23-24]。另外紫杉醇抑制有丝分裂所必需的微管网的正常动态再生,防止正常的有丝分裂纺锤体的形成,从而导致染色体断裂并抑制细胞复制和移行[25]。本研究结果显示,紫杉醇能有效抑制DMN诱导肝纤维化的发生,改善肝功能,且明显抑制肝星状细胞的活化;为进一步探讨紫杉醇抑制肝纤维化可能的机制,本研究在HSC-T6细胞上观察了紫杉醇的作用,结果提示,紫杉醇抑制肝纤维化的机制与TGF-β1相关的信号通路有关。
综上,本研究结果提示,紫杉醇可以通过抑制肝星状细胞的激活而有效抑制DMN诱导的大鼠肝纤维化的发生,其作用机制可能是通过抑制TGF-β信号通路,从而抑制肝星状细胞激活和表达分泌细胞外基质有关。
[1]Baffy G, Brunt EM, Caldwell SH. Hepatocellular carcinoma in nonalcoholic fatty liver disease: an emerging menace[J]. J Hepatol,2012, 56(6):1384–1391. doi: 10.1016/j.jhep.2011.10.027.
[2]刘雅静, 夏金荣. 肝纤维化诊断方法研究[J]. 河北医科大学学报,2013, 34(8):982–986. doi:10.3969/j.issn.1007–3205.2013.08.052.Liu YJ, Xia JR. Diagnostic methods for hepatic fi brosis[J]. Journal of Hebei Medical University, 2013, 34(8):982–986. doi:10.3969/j.issn.1007–3205.2013.08.052.
[3]祝靓靓, 吴学银, 刘昕, 等. 2,4-二羟基二苯甲酮对DMN致小鼠急性肝毒性保护作用[J]. 中国公共卫生, 2014, 30(2):206–208.doi:10.11847/zgggws2014–30–02–24.Zhu QQ, WuXY, Liu X, et al. Protective effect of 2,4 -dihydroxybenzophenone on acute liver toxicity induced by DMN in mice[J]. Chinese Journal of Public Health, 2014, 30(2):206–208.doi:10.11847/zgggws2014–30–02–24.
[4]傅大莉. 肝宝胶囊防治二甲基亚硝胺(DMN)致大鼠肝纤维化的作用机理研究[D]. 泸州:泸州医学院, 2010.Fu DL. The effect of ganbao capsule on the prevention and treatment of liver fibrosis induced by DMN in rats[D]. Luzhou:Luzhou Medical College, 2013.
[5]麻莉. 雄芍汤干预DMN诱导大鼠肝纤维化的代谢组学研究[D].武汉: 湖北中医药大学, 2015.Ma L. Research of the metabonomic on Xiongshao decoction intervention on DMN induced liver fibrosis in rats[D]. Wuhan:Hubei University of Chinese Medicine, 2015.
[6]于卫卫. 唑来膦酸与紫杉醇协同抑制恶性肿瘤细胞增殖及诱导调亡的分子机制研究[D]. 天津: 天津医科大学, 2011.Yu WW. The study of molecular synergistic antitumor action and induced apoptpsis of Zoledronic acid and Paclitaxel[D]. Tianjin:Tianjin Medical University, 2011.
[7]何燕. 柴胡皂甙d防治二甲基亚硝胺诱导的肝纤维化伴肾损伤的实验研究[D]. 北京: 北京中医药大学, 2007.He Y. Saikosaponin d preventing dimethylnitrosamine induced hepatic fi brosis with complicated renal injuries[D]. Beijing: Beijing University of Chinese Medicine, 2007.
[8]朱亚平, 卜淑蕊. 肝纤维化发病机制研究新进展[J]. 肝脏, 2016,21(5):401–403. doi:10.3969/j.issn.1008–1704.2016.05.026.Zhu YP, Bu SX. New research progress of pathogenesis of hepatic fi brosis[J]. Chinese Hepatology, 2016, 21(5):401–403. doi:10.3969/j.issn.1008–1704.2016.05.026.
[9]鲍佳春, 袁凤来, 陆伟国, 等. 肝星状细胞激活与增殖相关信号转导通路在肝纤维化中的作用及机制[J]. 中国临床药理学与治疗学, 2009, 14(4):455–459.Bao JC, Yuan FL, Chen WG, et al. Effects and mechanisms of hepatic stellate cells(HSC)activation and proliferation-related signal transduction pathway in liver fi brosis[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 2009, 14(4):455–459.
[10]郝礼森, 张晓岚. 肝星状细胞增殖过程中的信号转导及可能的抗肝纤维化治疗靶点[J]. 临床肝胆病杂志, 2009, 25(1):63–67.Hao LS, Zhang XL. Signaling in proliferation of hepatic stellate cells and potential therapeutic targets for treatment of hepatic fi brosis[J]. Journal of Clinical Hepatology, 2009, 25(1):63–67.
[11]焦黎, 武希润, 王琦. 纤溶酶原激活物抑制因子-1对肝星状细胞活化及细胞外基质合成的影响[J]. 肝脏, 2011, 16(2):116–119.doi:10.3969/j.issn.1008–1704.2011.02.008.Jiao L, Wu XR, Wang Q. The effect of Plasminogen activator inhibitor type-1 on HSC and synthesis of extrocellar matrix[J].Chinese Hepatology, 2011, 16(2):116–119. doi:10.3969/j.issn.1008–1704.2011.02.008.
[12]李春辉, 潘理会, 申兴斌, 等. 二甲基亚硝胺诱发大鼠肝纤维化发生机理的研究[J]. 承德医学院学报, 2006, 23(2):116–119.doi:10.3969/j.issn.1004–6879.2006.02.006.Li CH, Pan LH, Shen XB, et al. Study on the mechanisms of hepatic fibrosis induced by DMN in rats[J]. Journal of Chengde Medical College, 2006, 23(2):116–119. doi:10.3969/j.issn.1004–6879.2006.02.006.
[13]汪志军. ELF参与肝纤维化中星状细胞活化以及再生结节形成的机制研究[D]. 华中科技大学, 2011.Wang ZJ. Embryonic liver fodrin involved in stellate cell activation and formation of regeneration nodule in liver cirrhosis[D].Huazhong University of Science and Technology, 2011.
[14]季菊玲, 张锦生, 王雪晴, 等. 活化大鼠肝星状细胞的蛋白质表达谱[J]. 中华肝脏病杂志, 2009, 17(12):921–924. doi:10.3760/cma.J.issn.1007–3418.2009.12.009.Ji JL, Zhang JS, Wang XQ, et al. Comprehensive proteome pro fi le of activated rat hepatic stellate cells[J]. Chinese Journal of Hepatology, 2009, 17(12):921–924. doi:10.3760/cma.J.issn. 1007–3418.2009.12.009.
[15]陈小亮. 转化生长因子β1介导的信号通路在大鼠肝纤维化和肝星状细胞增殖过程中的调节机制及苦参素的作用[D]. 合肥: 安徽医科大学, 2009.Chen XL. Mechanism of transforming growth factor β1 mediated pathways in regulating proliferation of hepatic stellate cells and interventional effect of kushenin[D]. Hefei: Anhui Medical University, 2009.
[16]廖磊. TGF-β1诱导成纤维细胞转化过程中的信号通路[D]. 上海:复旦大学, 2006. doi: 10.7666/d.y953246.Liao L. Signaling pathways in TGF-β1 induced fibroblast transformation[D]. Shanghai: Fudan University, 2006. doi: 10.7666/d.y953246.
[17]陈未来, 潘陈为, 诸葛璐, 等. 姜黄素阻断大鼠肝纤维化及其影响转化生长因子-β1表达的研究[J]. 中国药物与临床, 2013,13(2):172–173. doi:10.11655/zgywylc2013.02.010.Chen WL, Pan CW, Zhu GL.et al. Curcumin blocking hepatic fibrosis in rats and its influence on expression of transforming growth factor β1[J]. Chinese Remedies & Clinics, 2013, 13(2):172–173. doi:10.11655/zgywylc2013.02.010.
[18]王军, 徐阳, 袁向科, 等. 实验性糖尿病鼠大血管病变TGF-β1和CTGF的表达及中药的干预作用[J]. 天津中医药, 2012,29(3):266–269.Wang J, Xu Y, Yuan XK, et al. Expression of TGF-β1 and CTGF in rats with experimental diabetic macroangiopathy and intervention role of traditional Chinese medicine[J]. Tianjin Journal of Traditional Chinese Medicine, 2012, 29(3):266–269.
[19]李荣清, 金冶宁. TGF-β1在放射性纤维化形成中的作用及其意义[J]. 中国癌症杂志, 2001, 11(3):267–269. doi:10.3969/j.issn.1007–3639.2001.03.028.Li RQ, Jin YY. Effect and significance of TGF-β1 in the process of radiation fibrosis[J]. China Oncology, 2001, 11(3):267–269.doi:10.3969/j.issn.1007–3639.2001.03.028.
[20]陈骧. 间歇压力对大鼠肝星状细胞I型胶原和TGF-β1表达影响的研究[D]. 重庆: 重庆大学, 2008.Chen X. The effect of intermittent pressure on expression of type I collagen and TGF-β1 in rat hepatic stellate cells in vitro[D].Chongqing: Chongqing University, 2008.
[21]齐艳荣. 紫杉醇的制备[J]. 科技致富向导, 2011, (18):142-.Qi YR. Paclitaxel preparation[J]. Keji Zhifu Xiangdao, 2011,(18):142.
[22]姜志军, 谢朝辉, 丁柏英, 等. 紫杉醇、顺铂、四氢叶酸、氟尿嘧啶治疗晚期胃癌近期疗效观察[J]. 中国高新技术企业, 2007,(6):58. doi:10.3969/j.issn.1009–2374.2007.06.035.Jiang ZJ, Xie ZH, Ding BY, et al. Ef fi cacy observation of paclitaxel,cis-platinum, tetrahydrofolic acid and fl uorouracil in treatment of advanced gastric cancer[J]. China High-Tech Enterprises, 2007,(6):58. doi:10.3969/j.issn.1009–2374.2007.06.035.
[23]王淑芳. 紫杉醇致过敏性休克不良反应1例[J]. 中国民康医学,2009, 21(7):封3. doi:10.3969/j.issn.1672–0369.2009.07.075.Wang SF. Paclitaxelal indeced lergic shock: a report of one case[J].Medical Journal of Chinese People's Health, 2009, 21(7):封3.doi:10.3969/j.issn.1672–0369.2009.07.075.
[24]郭惠玲. 紫杉醇抑制原代培养人视网膜色素上皮细胞增殖的实验研究[D]. 长春: 吉林大学, 2004.Guo HL. Inhibition of taxol on proliferation of cultured human retinal pigment epithelial cells[D]. Changchun: Jilin University,2004.
[25]解艺佳. Notch2在细胞分裂阻滞后命运调控中的功能研究[D]. 合肥: 中国科学技术大学, 2015.Xie YJ. A research on the function of Notch2 in the determination of cell fate after mitotic arrest[D]. Hefei: University of Science and Technology of China, 2015.

