血清肿瘤标志物联合检测在胃癌腹膜转移诊断中的应用价值分析
李冬冬,陈磊,胡春华,项洪刚
(上海交通大学医学院附属新华医院 普通外科,上海 200092)
胃癌是消化道系统中常见的具有高度异质性的恶性肿瘤,预后相对较差,其在我国癌症中的发病率和病死率均居前列,手术是其主要治疗方法[1-2]。但由于胃癌早期缺乏明显特异性的临床表现,难以早期发现和诊疗,故而临床上的大多病例初诊时已发展至进展期或者晚期,甚至有相当部分的患者出现远处转移,丧失手术治疗的机会[3-4]。腹膜转移属于胃癌的远处转移,常见的诊断方法如内镜检查和影像学检查(B超检查、腹部CT检查等)可为胃癌腹膜转移提供辅助诊断,但其存在患者依从性较差、敏感度较低、费用较高等问题[5-8]。因此,寻求一种相对简单、便捷且可能提前诊断胃癌腹膜转移的方法显得尤为重要。相关研究已证实,血清肿瘤标志物的表达与胃癌的分化、浸润和转移相关。本研究拟通过Logistic回归及ROC曲线探讨联合检测血清肿瘤标志物CEA和CA19-9、CA125、CA724、CA211、CA242在胃癌腹膜转移诊断中的应用价值。
1 资料与方法
1.1 一般资料
回顾性随机抽选2015年12月—2016年12月于我院普外科收治诊疗的8 9例胃癌患者为研究对象。所有入选患者术前均已行胃镜活检取材并病理证实为胃癌,同时排除并存其他系统肿瘤以及可引起CE A、C A 1 9-9、CA12 5、CA724、CA211、CA242指标异常改变的其他疾病。患者术前均未行化疗、放疗及免疫治疗,且都具有完整的病历资料。所有研究对象均签署知情同意书并经医院伦理委员会审查批准。根据术中探查情况及最终术后病理报告,将89例胃癌患者有无胃癌腹膜转移分为转移组(1 7例)和无转移组(7 2例)。转移组中,男15例,女2例;年龄39~77岁,平均年龄为(60.5±11.2)岁。无转移组中,男46例,女26例;年龄35~85岁,平均年龄为(62.6±11.7)岁。
1.2 检测方法
所有患者均于入院后次日清晨空腹状态下完成静脉血采样约4 mL,置于真空采集管中混匀,室温下静置后进行血清分离,随后将血样置于-20 ℃冰箱保存备用。采用AX-SYM全自动免疫分析仪(雅培,美国)及该公司提供的配套试剂进行检测。所有检测均严格按照相关操作说明进行。CEA正常值上限为10 ng/mL,CA19-9正常值上限为39 U/mL,CA125正常值上限为35 U/mL,CA724正常值上限为6.9 U/mL,CA211正常值上限为3.3 ng/mL,CA242正常值上限为15 IU/mL。上述各项肿瘤标志物检测值超过正常值上限即为阳性。
1.3 统计学处理
研究中所涉及到的数据均采用SPSS 22.0统计学软件进行分析处理,用单样本K-S检验进行数据的正态性检验;符合正态分布计量资料以均数±标准差()表示,采用t检验;计数资料采用χ2检验;运用逐Logistic回归法(P>0.10剔除)和强制选入Logistic回归法建立回归方程式;对新变量Y1、Y2及各单项指标进行ROC曲线分析,手工Z检验比较曲线下面积差异;P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者临床病理资料的比较
转移组和无转移组患者在年龄、性别、肿瘤部位、是否有淋巴结转移方面差异无统计学意义(均P>0.05);在浸润深度、分化程度、肿瘤大小、是否有腹水方面差异有统计学意义(均P<0.05)(表1)。
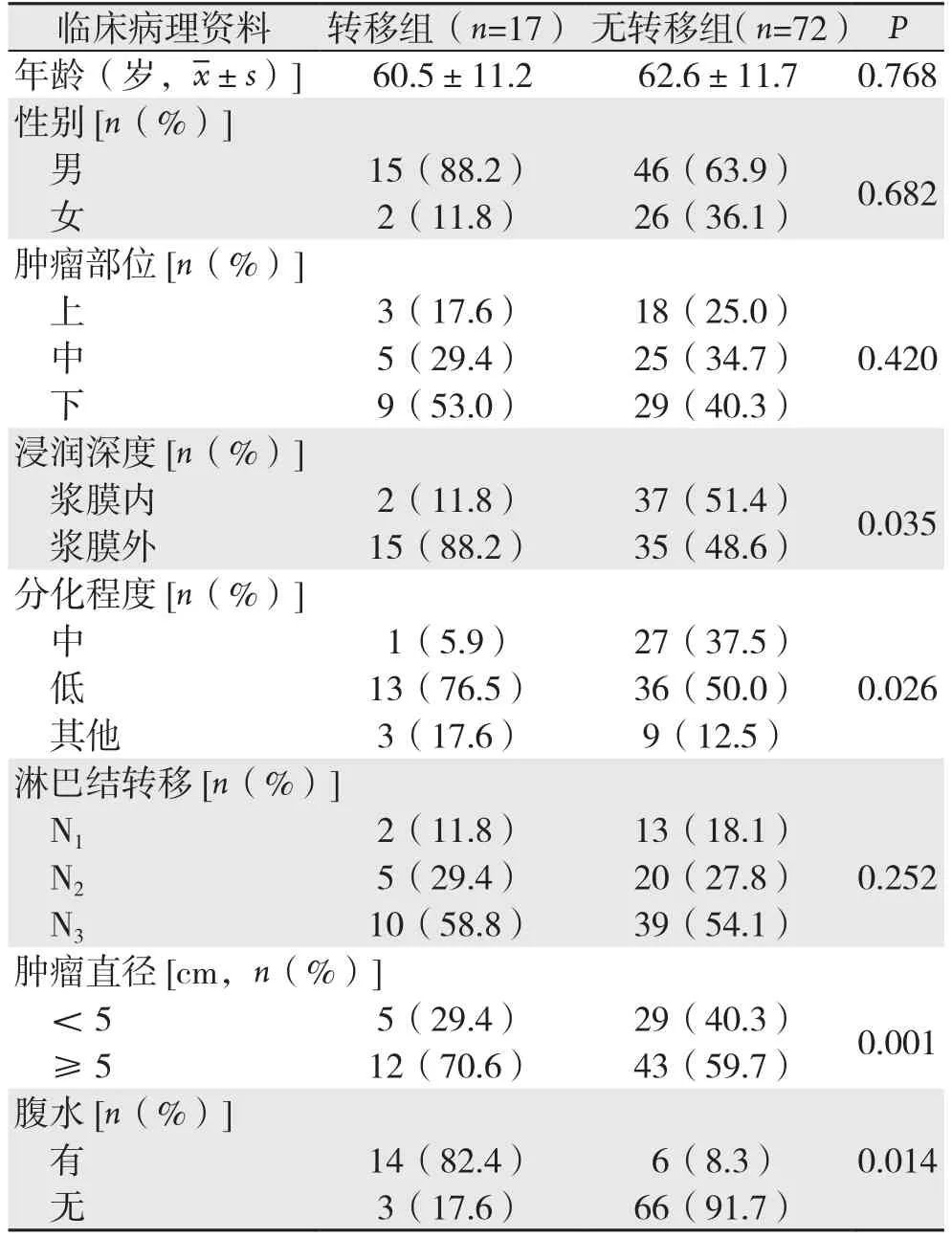
表1 两组患者临床病理资料的比较Table 1 Comparison of the clinicopathologic data between the two groups of patients
2.2 两组血清肿瘤标志物表达水平的检测结果
转移组和无转移组血清肿瘤标志物CEA、CA19-9、CA125、CA724、CA211和CA242检测值经单样本K-S检验均为非正态分布,故而检测结果用中位数和数据范围[M(范围)]表示(表2)。
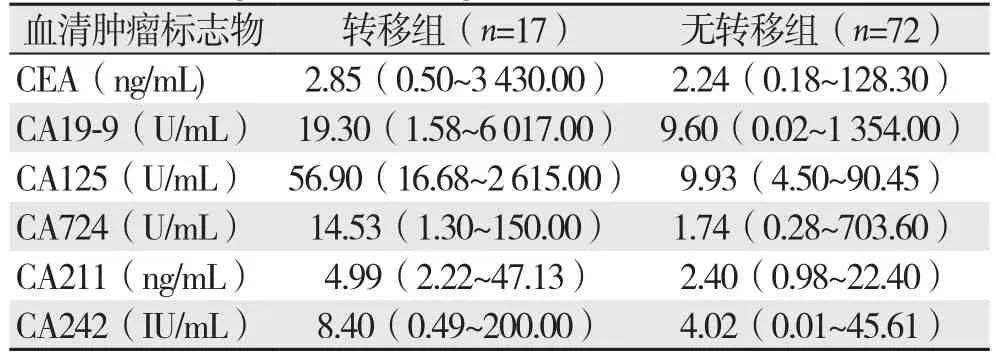
表2 两组血清肿瘤标志物的检测结果[M(范围)]Table 2 Results of the detection of the tumor markers in the two groups [M (range)]
2.3 血清肿瘤标志物的阳性检出率
转移组CA125、CA724、CA211的阳性检出率高于无转移组,组间差异均有统计学意义(均P<0.05);两组CEA、CA19-9、CA242阳性检出率无统计学差异(均P>0.05)(表3)。
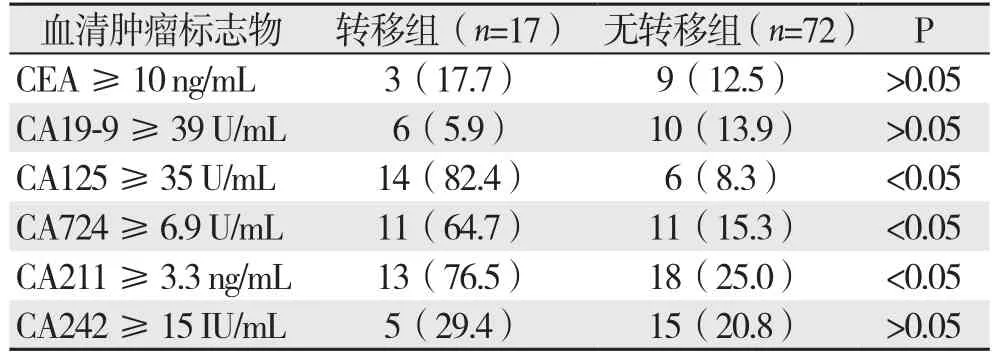
表3 两组血清肿瘤标志物的阳性检出率比较[n(%)]Table 3 Comparison of the positive detection rates of the tumor markers between the two groups [n (%)]
2.4 转移组与无转移组各血清肿瘤标志物的Logistic回归分析与ROC曲线
经逐步Logistic回归分析CEA(P=0.509)、CA19-9(P=0.288)、CA242(P=0.425)被剔除(P>0.10),筛选出有意义的变量为CA125、CA724和CA211(表4)。6种肿瘤标志物单独检测时,CA125的AUC最大,与其他5项指标单独检测的差异均有统计学意义(均P>0.05);联合检测时,逐步Logistic回归筛选的CA125、CA724、CA211联合与强制选入Logistic回归的CEA、CA19-9、CA125、CA724、CA211、CA242联合的AUC均大于各单项检测的AUC,且差异有统计学意义(均P<0.05),但两者间AUC差异无统计学意义(0.964vs.0.949,P=0.866)(表5)(图1)。
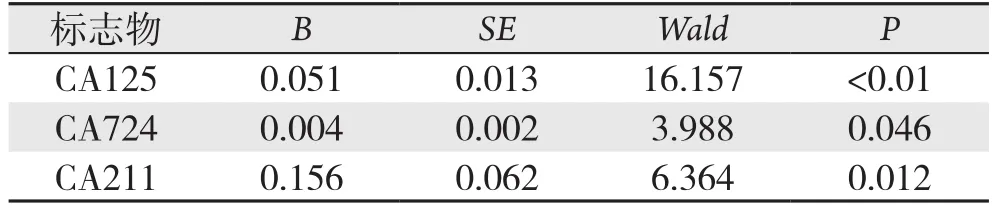
表4 3种肿瘤标志物逐步Logistic回归分析结果Table 4 Results of stepwise Logistic regression for the three tumor markers
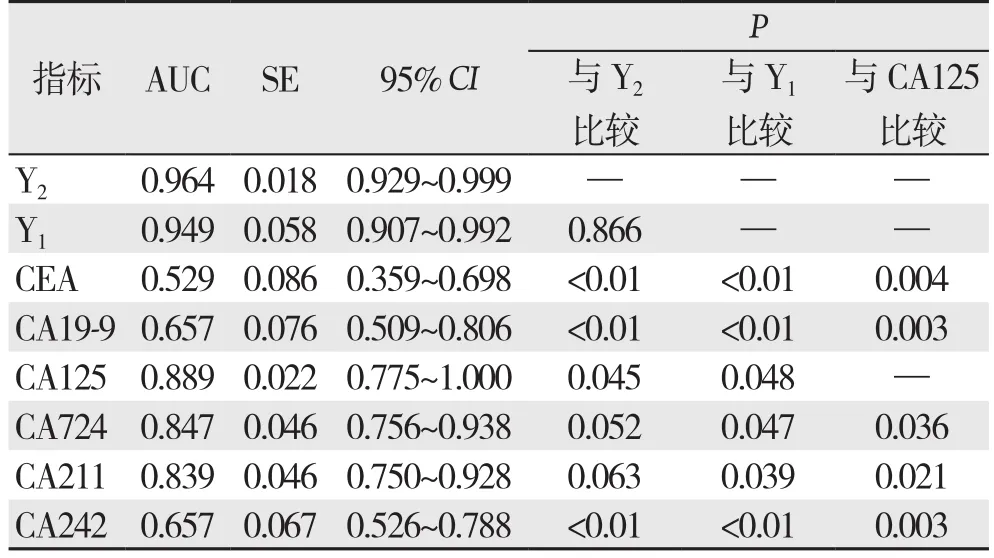
表5 6种肿瘤标志物检测的AUCTable 5 The AUCs of the detection of the six tumor markers

图1 6种肿瘤标志物检测的ROC曲线Figure 1 ROC curves of the detection of the six tumor markers
3 讨 论
胃癌腹膜转移的确切机制尚不明确,目前较为公认的是“种子-土壤”学说,即胃癌细胞由原发病灶浸润出浆膜面形成脱落的“种子”,继而这些具有高侵袭和转移活力的癌细胞在各种因子的作用下黏附于腹腔脏器或网膜的表面并进一步着床形成转移性癌结节[9]。本研究也提示腹膜转移的因素与胃癌原发肿瘤病灶的大小、浸润深度及分化程度相关。
现有相关研究[10-12]已证实血清肿瘤标志物的检测对消化道系统肿瘤的诊断、预后有积极意义。CA125是1983年由Bast等[13]从上皮性卵巢癌抗原检测出可被单克隆抗体OC125结合的一种糖蛋白,最常见于卵巢肿瘤患者的血清中,主要与卵巢癌的诊断和术后监测复发、转移相关;近来有报道[14]提示,胃癌腹膜转移患者中血清CA125水平也可升高,且腹水阳性患者的血清CA125阳性率明显高于腹水阴性的患者,它可用以评价实体瘤的治疗效果及监测复发或转移。CA724是一种由CC49和B72.3两株单抗识别的粘蛋白样的高分子量糖蛋白,在各种消化道肿瘤及卵巢癌均可产生其异常升高,但同时也有相关报道[15-16]认为CA724对于胃癌的检测特异性较高,在胃癌患者中其异常升高者的比例可将近50%,且CA724水平与胃癌的临床分期呈正相关;CA211是细胞白蛋白19(CK19)片段,相关组织病理学研究[17]表明,其在肺癌组织中表达显著,但其特异性不高,在其他系统肿瘤中亦可相应表达升高。而本研究也同样证实了在单独检测6种肿瘤标志物时,CA125的AUC最大为0.889,与其他5项指标单独检测的差异有统计学意义(P>0.05),这提示高度怀疑胃恶性肿瘤伴发腹膜转移的患者术前检测血清CA125可提供必要的辅助诊断。国内严超等[18]报道了单中心大宗病例关于术前检测血清CA125预测胃癌腹膜转移;而周鹏等[19]也同样提出了CA125对胃癌患者发生腹膜转移及预后具有预测价值。同时,本研究也表明在胃癌腹膜转移患者中,联合检测CA125、CA724和CA211的AUC大于任何检测单一肿瘤标志物的AUC,且差异具有统计学意义(P<0.05),提示联合检测CA125、CA724和CA211可为临床中胃癌腹膜转移的鉴别诊断提供有效的参考。而相关研究也认为联合检测血清肿瘤标志物可提高诊断胃癌发生腹膜转移的效能[14,20-25]。但与此同时,本研究也发现行6种肿瘤联合检测对鉴别胃癌腹膜转移的必要性不大,且现实临床中检测费时且患者花费较高,因此临床医生应注意个体化差异,视具体情况而定。
胃癌是具有高度异质性的恶性消化道肿瘤,任何一种术前单一的辅助检测手段都难以达到腹膜转移的最确切的鉴别,但尝试相对无创且灵敏度较高的血清生化检测可为临床诊断胃癌腹膜转移提供一种思路和参考。
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics,2017 [J].CA Cancer J Clin,2017,67(1):7–30.doi:10.3322/caac.21387.
[2]左婷婷,郑荣寿,曾红梅,等.中国胃癌流行病学现状[J].中国肿瘤临床,2017,44(1):52–58.doi:10.3969/j.issn.1000–8179.2017.01.881.Zuo TT,Zheng RS,Zeng HM,et al.Epidemiology of stomach cancer in China[J].Chinese Journal of Clinical Oncology,2017,44(1):52–58.doi:10.3969/j.issn.1000–8179.2017.01.881.
[3]Li P,Lin X,Zhang JR,et al.The expression of presenilin 1 enhances carcinogenesis and metastasis in gastric cancer[J].Oncotarget,2016,7(9):10650–10662.doi:10.18632/oncotarget.7298.
[4]Xu M,Zhou H,Zhang C,et al.Adam17 promotes epithelialmesenchymal transition via TGF-beta/smad pathway in gastric carcinoma cells[J].Int J Oncol,2016,49(6):2520–2528.doi:10.3892/ijo.2016.3744.
[5]王哲方,陈力.胃癌腹膜转移治疗现状[J].中华胃肠外科杂志,2015,18(2):194–197.doi:10.3760/cma.j.issn.1671–0274.2015.02.025.Wang ZF,Chen L.Present status of treatment in peritoneal metastasis of gastric cancer[J].Chinese Journal of Gastrointestinal Surgery,2015,18(2):194–197.doi:10.3760/cma.j.issn.1671–0274.2015.02.025.
[6]林良庆,林建昌,魏敏,等.胃癌腹膜转移的研究进展[J].江西医药,2015,50(11):1296–1298.doi:10.3969/j.issn.1006–2238.2015.11.068.Lin LQ,Lin JC,Wei M,et al.Research progress of gastric cancer peritoneal metastasis[J].Jiangxi Medical Journal,2015,50(11):1296–1298.doi:10.3969/j.issn.1006–2238.2015.11.068.
[7]严超,朱正纲,燕敏,等.多排CT对胃癌腹膜转移术前预测的单中心大宗病例研究[J].中华胃肠外科杂志,2010,13(2):106–110.doi:10.3760/cma.j.issn.1671–0274.2010.02.008.Yan C,Zhu ZG,Yan M,et al.Value of multidetector-row CT in the preoperative prediction of peritoneal metastasis from gastric cancer:a single-center and large-scale study[J].Chinese Journal of Gastrointestinal Surgery,2010,13(2):106–110.doi:10.3760/cma.j.issn.1671–0274.2010.02.008.
[8]杨秋蒙,坂东悦郎,川村泰一,等.PET-CT诊断胃癌腹膜转移的临床价值[J].上海交通大学学报:医学版,2007,27(5):573–576.doi:10.3969/j.issn.1674–8115.2007.05.024.Yang QM,Bandou E,Kawamura T,et al.Clinical value of PET-CT in diagnosing peritoneal metastasis of gastric cancer[J].Journal of Shanghai Jiaotong University:Medical Science,2007,27(5):573–576.doi:10.3969/j.issn.1674–8115.2007.05.024.
[9]朱正纲.胃癌腹膜转移综合治疗的若干进展[J].中华实验外科杂志,2015,32(9):2039–2041.doi:10.3760/cma.j.issn.1001–9030.2015.09.001.Zhu ZG.Several advances in integrated treatment of gastric cancer peritoneal metastasis[J].Chinese Journal of Experimental Surgery,2015,32(9):2039–2041.doi:10.3760/cma.j.issn.1001–9030.2015.09.001.
[10]Shimada H,Noie T,Ohashi M,et al.Clinical signi fi cance of serum tumor markers for gastric cancer:A systematic review of literature by the task force of the japanese gastric cancer association[J].Gastric Cancer,2014,17(1):26–33.doi:10.1007/s10120–013–0259–5.
[11]Yamamoto M,Baba H,Kakeji Y,et al.Prognostic signi fi cance of tumor markers in peritoneal lavage in advanced gastric cancer [J].Oncology,2004,67(1):19–26.
[12]杨小波,邹亮.肿瘤标志物在胃癌治疗及预后判断应用中的研究进展[J].中国普通外科杂志,2013,22(10):1334–1337.doi:10.7659/j.issn.1005–6947.2013.10.020.Yang XB,Zou L.Application of tumor markers in treatment and prognostic evaluation of stomach cancer:recent advances[J].Chinese Journal of General Surgery,2013,22(10):1334–1337.doi:10.7659/j.issn.1005–6947.2013.10.020.
[13]Bast RC Jr,Klug TL,St John E,et al.A radioimmunoassay using a monoclonal antibody to monitor the course of epithelial ovarian cance[J].N Engl J Med,1983,309(15):883–887.
[14]孙立秋,崔海,崔演,等.血清CEA、CA125及CA72–4在胃癌腹膜转移中的临床意义[J].中国癌症杂志,2017,27(3):191–196.doi:10.19401/j.cnki.1007–3639.2017.03.005.Sun LQ,Cui H,Cui Y,et al.Clinical significance of serum CEA,CA125 and CA72–4 in gastric carcinoma with peritoneal metastasis[J].China Oncology,2017,27(3):191–196.doi:10.19401/j.cnki.1007–3639.2017.03.005.
[15]王轶.胃癌病程分期与血清CA724、CA242及CEA水平关系探讨[J].放射免疫学杂志,2006,19(3):225–226.doi:10.3969/j.issn.1008–9810.2006.03.044.Wang Y.Relations of gastric cancer stage with serum levels of CA724,CA242 and CEA[J].Journal of Radioimmunology,2006,19(3):225–226.doi:10.3969/j.issn.1008–9810.2006.03.044.
[16]Tsai MM,Wang CS,Tsai CY,et al.Potential prognostic,diagnostic and therapeutic markers for human gastric cancer[J].World J Gastroenterol,2014,20(38):13791–13803.doi:10.3748/wjg.v20.i38.13791.
[17]Chen X,Zhou H,Chen R,et al.Development of a multimarker assay for differential diagnosis of benign and malignant pelvic masses[J].Clin Chim Acta,2015,440:57–63.doi:10.1016/j.cca.2014.11.013.
[18]严超,朱正纲,燕敏,等.术前血清CA125预测胃癌腹膜转移的单中心大样本临床研究 [J].外科理论与实践,2014,19(1):26–29.Yan C,Zhu ZG,Yan M,et al.Value of pre-operative serum CA125 level in predicting the peritoneal metastasis of gastric cancer: a single-centerand large-scale study[J].Journal of Surgery Concepts&Practice,2014,19(1):26–29.
[19]周鹏,曲辉,史惠文,等.血清糖类抗原125对胃癌腹膜转移及其预后的预测价值[J].中华胃肠外科杂志,2014,17(10):1027–1030.doi:10.3760/cma.j.issn.1671–0274.2014.10.017.Zhou P,Qu H,Shi HW,et al.Predictive value of CA125 in peritoneal metastasis and prognosis of patients with gastric carcinoma[J].Chinese Journal of Gastrointestinal Surgery,2014,17(10):1027–1030.doi:10.3760/cma.j.issn.1671–0274.2014.10.017.
[20]徐巧玲,尤徐阳,吴娜静,等.临床病理学分析结合CEA、CA19-9与CA125检测对诊断胃癌术后腹膜转移的意义[J].标记免疫分析与临床,2016,23(11):1321–1326.doi:10.11748/bjmy.issn.1006–1703.2016.11.024.Xu QL,You XY,Wu NJ,et al.The analysis of clinicopathologic features and CEA,CA19-9 and CA125 levels of peritoneal metastasis in postoperative gastric cancer patients[J].Labeled Immunoassays and Clinical Medicine,2016,23(11):1321–1326.doi:10.11748/bjmy.issn.1006–1703.2016.11.024.
[21]徐兵.癌胚抗原和糖类抗原19-9联合检测与Ⅳ期胃癌腹膜转移的相关性[J].中国老年学杂志,2013,33(22):5741–5742.doi:10.3969/j.issn.1005–9202.2013.22.125.Xu B.Correlation of combined detection of carcino-embryonic antigen and carbohydrate antigen 19-9 and peritoneal metastasis from IV stage gastric cancer[J].Chinese Journal of Gerontology,2013,33(22):5741–5742.doi:10.3969/j.issn.1005–9202.2013.22.125.
[22]Ohi M,Mori K,Toiyama Y,et al.Preoperative prediction of peritoneal metastasis in gastric cancer as an indicator for neoadjuvant treatment [J].Anticancer Res,2015,35(6):3511–3518.
[23]徐明星,李曼,彭波,等.肿瘤标志物联检在胃癌早期诊断临床应用研究[J].中国实验诊断学,2014,18(6):899–902.Xu MX,Li M,Peng B,et al.The research on the clinical application of tumor markers combined detection in the early diagnosis of gastric cancer[J].Chinese Journal of Laboratory Diagnosis,2014,18(6):899–902.
[24]谢海涛.肿瘤标志物CA724、CA19–9、CA242、CEA联合检测在老年胃癌诊断中的应用[J].中国老年学杂志,2017,37(1):127–129.doi:10.3969/j.issn.1005–9202.2017.01.056.Xie HT.Application of combined detection of the tumor marker CA724,CA19–9,CA242 and CEA in elderly patients with gastric cancer[J].Chinese Journal of Gerontology,2017,37(1):127–129.doi:10.3969/j.issn.1005–9202.2017.01.056.
[25]张晓梅.肿瘤标志物联合检测诊断胃癌的临床价值研究[J].当代医学,2017,23(1):53–54.doi:10.3969/j.issn.1009–4393.2017.01.030.Zhang XM.Clinical value of combined detection of tumor markers in diagnosis of gastric cancer[J].Contemporary Medicine,2017,23(1):53–54.doi:10.3969/j.issn.1009–4393.2017.01.030.

