胃癌细胞中miR-455-3p的表达及其对增殖和凋亡的影响
夏茜,李晖,吴杰
(华中科技大学同济医学院附属武汉市中心医院 消化内科,湖北 武汉430000)
胃癌是严重威胁人类健康的恶性肿瘤,其致死率高居癌症相关死因的第2位[1]。我国是胃癌高发区,发病率高居所有恶性肿瘤之首,死于胃癌的人数约占所有肿瘤致死人数的25%[2]。尽管近年来胃癌的治疗取得了很大进步,但胃癌的总体预后仍不理想。miRNA是一类内源性的非编码RNA,其长度大约在20个核苷酸,通过与3'端或5'端的非翻译区结合对mRNA进行调控,影响编码蛋白的表达,进而调节着细胞增殖等过程[2-5]。许多研究[6-9]表明肿瘤的发生与miRNA的异常表达密切相关。miR-455-3p被报道在结肠癌、食管癌及乳腺癌中参与调控增殖、凋亡、侵袭及转移等肿瘤生物学过程[10-12]。然而目前尚无关于miR-455-3p在胃癌细胞系中的表达及对胃癌增殖和凋亡的影响的报道,本研究旨在探讨miR-455-3p在胃癌中的表达情况及对胃癌细胞增殖和凋亡的影响。
1 材料与方法
1.1 材料
正常胃黏膜上皮细胞系RGM-1及5种胃癌细胞系(AGS、Hs746T、MGC-803、SGC-7901、BSG-823)均购自武汉大学医学实验中心,DMEM培养基、TRIzol均购自美国Invitrogen公司,caspase-3、caspase-8、caspase-9活性检测试剂盒购自碧云天生物科技有限公司,p27 kip1蛋白、p21及GAPDH一抗均购自美国Santa Cruze公司,实验所需的二抗购自美国BD公司,miR-455-3P模拟物及阴性对照序列均由上海吉玛生物科技有限公司合成。
1.2 细胞培养分组及转染
正常胃黏膜上皮细胞系RGM-1及5种胃癌细胞系均加入至DMEM培养基,在37 ℃、5%CO2培养箱中培养。利用lipofectamine 2000分别将AGS细胞系转染miR-455-3p模拟物和miR-455-3p阴性对照序列,miR-455-3p模拟物序列引物的正义链为:5'-GCA GUC CAU GGG CAU AUA CAC-3',反义链为:5'-GUG UAU AUG CCC AUG GAC UGC UU-3';阴性对照序列为随机序列,正义链为:5'-UUC UCC GAA CGU GUC ACG UTT-3',反义链为:5'-ACG UGA CAC GUU CGG AGA ATT-3',转染浓度为300 nmol/mL孔,将两组细胞培养24 h后行后续实验。
1.3 RNA 提取与 qRT-PCR
按TRIzol reagent说明书从miR-455-3p模拟物组和阴性对照组细胞中提取总RNA,并采用NanoDrop1000分光光度计(美国Thermo Scientific公司)测定RNA浓度,利用荧光定量PCR系统(美国Applied Biosystems)测定。所采用的引物序列如下:miR-455-3p序列(PUBMED号:MIMAT0004784):5'-GCA GUC CAU GGG CAU AUA CAC-3',使用2-ΔΔCt方法定量,内参选择为U6小核RNA,并计算miR-455-3p的相对表达量。
1.4 细胞增殖能力检测
采用CCK8法,将miR-455-3p模拟物组与阴性对照组两组细胞消化成单细胞悬液,以2×103个/孔将两组细胞种植于96孔板上,每孔培养基体积200 µL,经分别培养0、1、2、3、4 d后,每孔加入20 µL CCK-8溶液,继续培养1 h后,在450 nm波长下,用酶标仪测定各孔吸光值,以时间为横坐标,吸光值为纵坐标绘制细胞增殖曲线。
1.5 细胞凋亡检测
采用流式细胞术,用Annexin V/PI 染色检测,将miR-455-3p模拟物组和阴性对照组两组细胞消化成单细胞悬液后,PBS清洗2次,并使用结合缓冲液重悬,加入相应比例的Annexin V抗体,避光染色10 min后加入适量PBS溶液以及PI染料,流式细胞仪检测Annexin V阳性细胞比例来确定细胞凋亡的变化。
1.6 蛋白表达检测
采用Western blot法测定p27 kip1和p21蛋白的表达量,培养24 h后,收集miR-455-3p模拟物组和阴性对照组细胞,裂解后,提取总蛋白,以每孔20 μg蛋白量上样,浓缩胶100 V 30 min,分离胶60 V 1 h,转膜,加入p27 kip1和p21一抗,浓度为1:200,4 ℃孵育过夜,PBS漂洗,加入二抗,浓度为1:1 000,显影液曝光,以GAPDH为内参,测定条带灰度值,实验重复3次,取平均值,以目的蛋白测定值与GAPDH的比值作为目标蛋白的相对表达量。
1.7 caspase 酶活性检测
依据caspase活性检测试剂盒说明书,将miR-455-3p模拟物组和阴性对照组细胞消化成单细胞悬液,1 000r/min低速离心5 min,收集2×103个细胞,裂解细胞,分别加入caspase酶活性检测试剂盒,在405 nm下用分光光度计测量两组吸光度。
1.8 统计学处理
统计学处理采用SPSS 20.0软件分析,用均数±标准差()表示计量资料,采用t检验行组间比较,P<0.05为差异有统计学意义。
2 结 果
2.1 miR-455-3p在胃癌细胞系中的表达情况
qRT-PCR示:miR-455-3p在胃癌细胞系AGS中相对表达量为0.10±0.03,Hs746T中为0.45±0.04,MGC-803中为0.25±0.03,SGC7901中为0.30±0.07,BSG823为0.26±0.03,正常胃黏膜上皮细胞系RGM-1相对表达量为1.0±0.03,miR-455-3p在5种胃癌细胞系中的相对表达量明显低于RGM-1细胞系(均P<0.05)(图1)。

图1 miR-455-3p在胃癌细胞系及正常胃黏膜上皮细胞系中的表达 与RGM-1细胞比较,1)P<0.01;2)P<0.001Figure 1 Expressions of miR-455-3p in normal gastric mucous cell line and different types of gastric cancer cell lines 1) P<0.01;2) P<0.001 vs. RGM-1 cells
2.2 miR-455-3p过表达对胃癌细胞增殖的影响
miR-455-3p模拟物组与阴性对照组比较,在转染后0、1、2、3、4 d的OD 450 nm值分别为[(0.29±0.03)vs.(0.27±0.04),P>0.05],[(0.43±0.08)vs.(0.75±0.10),P<0.05],[(0.69±0.09vs.(1.57±0.25),P<0.05],[(1.13±0.15)vs.(2.23±0.19),P<0.01],[(1.72±0.20)vs.(3.48±0.27),P<0.001](图2)。

图2 miR-455-3p模拟物组和阴性对照组增殖曲线的比较与阴性对照比较,1)P<0.05;2)P<0.01;3)P<0.001Figure 2 Comparison of the proliferation curves of miR-455-3p mimics group and negative control group 1) P<0.05;2) P<0.01;3) P<0.001 vs. negative control group
2.3 miR-455-3p过表达对胃癌细胞凋亡的影响
转染48 h后,流式细胞术示,miR-455-3p模拟物组细胞凋亡率为(21.33±1.20)%,阴性对照组为(1.46±0.14)%,miR-455-3p模拟物组细胞凋亡率明显高于阴性对照组(P<0.001)(图3)。

图3 miR-455-3p模拟物组和阴性对照组凋亡情况比较 A:流式细胞术示两组的凋亡情况;B:两组凋亡率比较Figure 3 Comparison of apoptosis of miR-455-3p mimics group and negative control group A:Apoptosis examined by flow cytometer;B:Comparison of the apoptosis rates between the two groups
2.4 miR-455-3p 过表达对 p27 kip1 和 p21 蛋白表达的影响
Western blot检测细胞周期相关蛋白p27 kip1和p21蛋白,发现miR-455-3p模拟物组p27 kip1表达量明显高于阴性对照组[(3.1±0.27)vs.1.0,P<0.01];miR-455-3p模拟物组p21表达量与阴性对照组差异无统计学意义[(1.1±0.05)vs.1.0,P>0.05](图4)。

图4 miR-455-3p模拟物组与阴性对照组P27 kip1与P21表达情况Figure 4 Protein expressions of P27 kip1 and P21 in miR-455-3p mimics group and negative control group
2.5 miR-455-3p过表达对caspase蛋白活性的影响
以阴性对照组为参照,miR-455-3p模拟物组caspase-8相对活性为0.95±0.07、caspase-9相对活性为2.1±0.15、caspase-3相对活性为3.4±0.3,后两项差异有统计学意义(均P<0.05)(图5)。
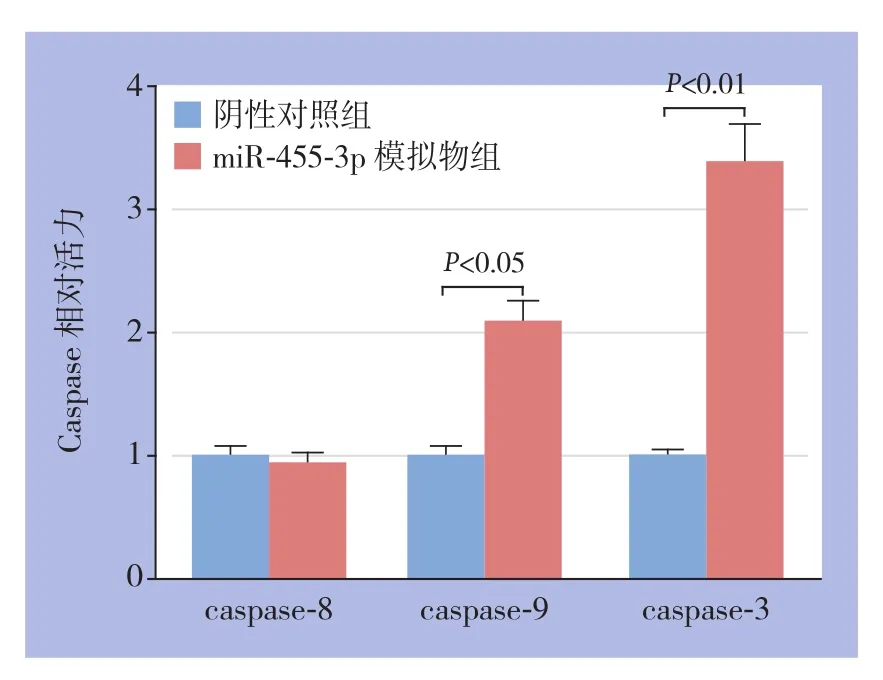
图5 miR-455-3p模拟物组与阴性对照组caspase酶活性比较Figure 5 Comparison of activities of caspase enzymes of miR-455-3p mimics group and negative control group
3 讨 论
胃癌的发生及发展是受到包括miRNA在内的众多基因参与及调控的结果[13]。miRNA已成为胃癌研究领域的热点,其在胃癌的发生发展中可起促癌或者抑癌作用[13]。Zhang等[14]报道miR-21在人胃癌细胞及组织中表达增加,且miR-21高表达能显著促进人胃癌细胞株增殖与侵袭能力。Katada等[15]分析了42 个未分化胃癌及邻近正常胃组织的miRNA表达谱,发现miR-34b、miR-34c、miR-128a、miR-20b及miR-150在未分化胃癌中的表达水平显著升高,且miR-20b 及miR-150高表达的患者生存率低,反之在未分化胃癌中miR-128b、miR-129 及miR-148 表达水平明显下调;miR-27a的表达水平与淋巴结转移显著相关。Motoyama等[16]发现let-7家族的表达水平与高迁移率族蛋白A2呈负相关,且是影响胃癌预后的独立因子。Tie等[17]证实了miR-218与Robo1蛋白的表达负相关,miR-218低表达可激活Robo1-Slit通路并诱发肿瘤转移,而过表达的miR-218在体外可抑制肿瘤细胞侵袭,并认为miR-218可作为胃癌靶向治疗的候选基因。Guo等[18]发现过表达miR-331-3p可以调控靶基因转录因子E2F1进而抑制肿瘤细胞增殖。
在结肠癌细胞系中,过表达miR-455-3p可抑制细胞增殖,并诱导凋亡,起抑癌基因的作用[10]。在三阴性乳腺癌中,过表达miR-455-3p通过靶向作用于抑癌基因EI24,而促进迁移和侵袭[11]。在食管鳞癌中,miR-455-3p通过靶向FAM83F抑制细胞增殖和侵袭[12]。本文研究了miR-455-3p对胃癌增殖的影响,并初步探寻了其机制,相对于正常胃细胞系,miR-455-3p在5种胃癌细胞系中的表达量均显著地下调;miR-455-3p的过表达能够显著抑制胃癌细胞系AGS的增殖,这表明miR-455-3p可能在胃癌细胞中发挥着抑癌基因的作用。
p27 kip1是一种热稳定蛋白,又称激酶抑制蛋白1(kip1),是能够结合细胞周期蛋白-周期素依赖激酶2复合体的一种多肽分子,p27 kip1与肿瘤的发生及发展关系密切,具有负性调节细胞增殖能力的作用,许多研究[19-24]证实p27 kip1的表达水平随着肿瘤恶性程度的增高而降低。通过发挥细胞周期的负性调控作用,p27 kip1抑制细胞周期素E、D等G1期激酶复合物,阻止细胞从G1期进入S期,防止细胞出现异常增殖和分化;当 p27 kip1表达水平下降时,这种细胞周期阻滞作用便会减弱,导致细胞出现异常增殖和分化,促进肿瘤生成、浸润及进展[20-21]。本研究进一步通过Western blot检测了miR-455-3p模拟物组和阴性对照组p27 KIP1和p21蛋白的相对表达量,发现miR-455-3p模拟物组p27 kip1表达量显著高于阴性对照组,这与miR-455-3p模拟物组抑制增殖的作用相一致,可能通过抑制细胞周期素E、D等G1期激酶复合物,阻止细胞从G1期进入S期[20-21]。而p21在两组间表达差异无统计学意义。
进一步,本研究发现过表达m i R-4 5 5-3 p能促进胃癌细胞系A G S的凋亡,并显著增加caspase-9、caspase-3的活力,这说明miR-455-3p的表达上调可能通过增加caspase-9、caspase-3的活力而促进胃癌细胞凋亡,而miR-455-3p表达上调对于p21蛋白的水平及caspase-8活力影响不大。caspase-3是细胞凋亡途径中的重要调控因子,caspase-9、caspase-3均为内源性途径(线粒体途径)凋亡的重要组成部分。作为caspase系统下游的重要成员,caspase-3的激活是bax诱导的细胞凋亡所必需的步骤,并且caspase-3与Bcl-2、Bax等关系密切并相互作用调控细胞凋亡[25]。黄斌等[25]研究发现靶向治疗后的胃癌组织caspase-3水平明显上调,并且与正常组织相比较,胃癌细胞及组织的caspase-3水平明显下调,这说明caspase-3水平与肿瘤恶性程度可能呈负相关。本研究结论与黄斌等[25]的结果一致,说明了miR-455-3p可能通过上调caspase-9、caspase-3的表达水平进而促进胃癌细胞凋亡。同时我们的结果也表明了miR-455-3p有望成为胃癌治疗的新靶点及突破口。
当然,本研究也存在一些不足之处,比如miR-455-3p的下游靶基因尚需要通过双荧光素酶实验验证,miR-455-3p在动物体内的作用如何也需要进一步研究。
总之,本研究证明了miR-455-3p在胃癌细胞中呈低表达水平,miR-455-3p表达上调能够通过上调p27 kip1表达水平抑制胃癌细胞增殖并通过上调caspase-9、caspase-3的表达水平而促进胃癌细胞凋亡,这为深入揭示胃癌的发病机制提供了新的视点,且可能作为一个新的治疗靶点。
[1]Rugge M,Fassan M,Graham DY.Epidemiology of gastric cancer[M].Berlin:In Gastric Cancer,Springer International Publishing,2015:23–34.
[2]Forman D,Burley VJ.Gastric cancer:global pattern of the disease and an overview of environmental risk factors[J].Best Pract Res Clin Gastroenterol,2006,20(4):633–649.
[3]Xiao C,Rajewsky K.MicroRNA control in the immune system:basic principles[J].Cell,2009,136(1):26–36.doi:10.1016/j.cell.2008.12.027.
[4]Flynt AS,Lai EC.Biological principles of microRNA-mediated regulation:shared themes amid diversity[J].Nat Rev Genet,2008,9(11):831–842.doi:10.1038/nrg2455.
[5]Carthew RW,Sontheimer EJ.Origins and mechanisms of miRNAs and siRNAs[J].Cell,2009,136(4):642–655.doi:10.1016/j.cell.2009.01.035.
[6]Garzon R,Calin GA,Croce CM.MicroRNAs in cancer[J].Annu Rev Med,2009,60:167–79.doi:10.1146/annurev.med.59.053006.104707.
[7]Wang Y,Russell I,Chen C.MicroRNA and stem cell regulation[J].Curr Opin Mol Ther,2009,11(3):292–298.
[8]Negrini M,Nicoloso MS,Calin GA.MicroRNAs and cancer—new paradigms in molecular oncology[J].Curr Opin Cell Biol,2009,21(3):470–479.doi:10.1016/j.ceb.2009.03.002.
[9]李立平,吴炜景,赵亚刚.microRNA与胃癌的研究进展[J].中华肿瘤防治杂志,2013,20(4):312–316.Li LP,Wu WJ,Zhao YG.Research progress in microRNA and gastric carcinoma[J].Chinese Journal of Cancer Prevention and Treatment,2013,20(4):312–316.
[10]Zheng J,Lin Z,Zhang L,et al.MicroRNA-455–3p inhibits tumor cell proliferation and induces apoptosis in HCT116 human colon cancer cells[J].Med Sci Monit,2016,22:4431–4437.
[11]Li Z,Meng Q,Pan A,et al.MicroRNA-455–3p promotes invasion and migration in triple negative breast cancer by targeting tumor suppressor EI24[J].Oncotarget,2017,8(12):19455–19466.doi:10.18632/oncotarget.14307.
[12]Yang H,Wei Y N,Zhou J,et al.MiR-455–3p acts as a prognostic marker and inhibits the proliferation and invasion of esophageal squamous cell carcinoma by targeting FAM83F[J].Eur Rev Med Pharmacol Sci,2017,21(14):3200–3206.
[13]汪胜利,陶厚权.microRNA 与胃癌研究进展[J].肿瘤学杂志,2011,17(4):263–266.Wang SL,Tao HQ.Research Progress in the Relationship between microRNA and Gastric Cancer[J].Journal of Chinese Oncology,2011,17(4):263–266.
[14]Zhang Z,Li Z,Gao C,et al.miR-21 plays a pivotal role in gastric cancer pathogenesis and progression[J].Lab Invest,2008,88(12):1358–1366.doi:10.1038/labinvest.2008.94.
[15]Katada T,Ishiguro H,Kuwabara Y,et al.microRNA expression profile in undifferentiated gastric cancer[J].Int J Oncol,2009,34(2):537–542.
[16]Motoyama K,Inoue H,Nakamura Y,et al.Clinical signi fi cance of high mobility group A2 in human gastric cancer and its relationship to let-7 microRNA family[J].Clin Cancer Res,2008,14(8):2334–2340.doi:10.1158/1078–0432.CCR-07–4667.
[17]Tie J,Pan Y,Zhao L,et al.MiR-218 inhibits invasion and metastasis of gastric cancer by targeting the Robo1 receptor[J].P PLoS Genet,2010,6(3):e1000879.doi:10.1371/journal.pgen.1000879.
[18]Guo X,Guo L,Ji J,et al.miRNA-331–3p directly targets E2F1 and induces growth arrest in human gastric cancer[J].Biochem Biophys Res Commun,2010,398(1):1–6.doi:10.1016/j.bbrc.2010.05.082.
[19]苏钰清,王献明,赵军苍,等.cyclinA和p27kip1在脑胶质瘤中的表达变化及意义[J].山东医药,2012,52(33):22–24.Su YQ,Wang XM,Zhao JC,et al.Expressions of cyclinA and p27kip1 in human brain gliomas[J].Shandong Medical Journal,2012,52(33):22–24.
[20]杨常春,王穗暖,张一,等.胶质瘤组织中CTGF mRNA和p27 kip1 mRNA的表达及意义[J].山东医药,2012,52(26):42–44.doi:10.3969/j.issn.1002–266X.2012.26.016.Yang CC,Wang SN,Zhang Y,et al.The mRNA expressions of CTGF and p27 kip1 glioma tissue and their significance[J].Shandong Medical Journal,2012,52(26):42–44.doi:10.3969/j.issn.1002–266X.2012.26.016.
[21]韩新华,田薇,施公胜,等.胶质瘤组织中EGFR、p27kip1的表达变化及意义[J].山东医药,2010,50(30):6–8.doi:10.3969/j.issn.1002–266X.2010.30.004.Han XH,Tian W,Shi GS,et al.Significance and expressions of EGFR and p27kip1 in the glioma[J].Shandong Medical Journal,2010,50(30):6–8.doi:10.3969/j.issn.1002–266X.2010.30.004.
[22]王琼,贺玉娟,刘玮,等.三阴乳腺癌组织中p27、survivin的表达及临床意义[J].山东医药,2012,52(35):11–13.doi:10.3969/j.issn.1002–266X.2012.35.004.Wang Q,He YJ,Liu W,et al.Expression of p27,survivin in triple negative breast carcinoma and its clinic signi fi cance[J].Shandong Medical Journal,2012,52(35):11–13.doi:10.3969/j.issn.1002–266X.2012.35.004.
[23]周彦明,李玉民,朱有全,等.cyclin E和p27kip1蛋白在胆囊癌组织中的表达及其意义[J].中国普外基础与临床杂志,2004,11(2):148–150.doi:10.3969/j.issn.1007–9424.2004.02.020.Zhou YM,Li YM,Zhu YQ,et al.Expression and Signi fi cance of Cyclin E and p27kip1 in Gallbladder Carcinoma[J].Chinese Journal of Bases and Clinics in General Surgery,2004,11(2):148–150.doi:10.3969/j.issn.1007–9424.2004.02.020.
[24]姚宏亮,杨竹林,李永国,等.胃癌及癌旁组织中SKP2和p27蛋白表达及相互关系研究[J].中国普外基础与临床杂志,2007,14(3):308–311.doi:10.3969/j.issn.1007–9424.2007.03.018.Yao HL,Yang ZL,Li YG,et al.Expressions of S-Phase Kinase-Associated Protein 2 and p27 Protein in Gastric Carcinoma and Pericancerous Tissues[J].Chinese Journal of Bases and Clinics in General Surgery,2007,14(3):308–311.doi:10.3969/j.issn.1007–9424.2007.03.018.
[25]黄斌,李昂,张波,等.纳米炭吸附5-FU淋巴靶向化疗对胃癌组织及转移淋巴结bcl-2、bax及caspase-3表达的影响[J].中国普外基础与临床杂志,2009,16(1):18–22.Huang B,Li A,Zhang B,et al.Effect of Lymph Node-Targeted Chemotherapy with Carbon Nanoparticles Absorbing 5-Fluorouracil on Expressions of bcl-2,bax and Caspase-3 in Gastric Cancer Tissues and Metastatic Lymph Nodes[J].Chinese Journal of Bases and Clinics in General Surgery,2009,16(1):18–22.

