应用新型用药理念治疗奶牛临床型乳房炎的效果评估
高 健
(中国农业大学,北京 100193)
应用新型用药理念治疗奶牛临床型乳房炎的效果评估
高 健
(中国农业大学,北京 100193)
[编者按] 奶牛乳房炎在世界范围内的发病率都很高,也是牛场中造成经济损失最大的疾病之一。在临床上对于乳房炎的治疗,国内目前最常见的治疗理念是使用抗生素,一直到临床症状消失。然而这是否就是最经济最有效的治疗方法呢?本刊携手勃林格殷格翰公司,开设“勃林格乳房炎”专栏,从乳房炎发病原理、传统抗生素治疗原理、新型药物的治疗理念及镇痛抗炎原理等方面层层剖析,力图解答这一疑问。勃林格殷格翰(Boehringer-Ingelheim)是一家致力于人类生物制药化学和动物健康产品的医药公司,也是世界上最大的私有制药企业,在全球设立了5个研发中心,拥有4万7千多名员工,并致力于独立的基础性研究,2016年与梅里亚公司合并,目前勃林格已跻身全球第二大动保企业。借助勃林格优秀团队的智慧力量,相信该专栏会帮助我们的奶牛养殖者破除乳房炎治疗旧传统,树立新理念,迎来中国奶业的新春天。
国内针对临床型乳房炎的治疗理念是“使用抗生素,一直到临床症状消失,过抗后返回牛群”,但这种理念并不合理,因为临床症状的消失需要经历炎症反应消除、组织修复等过程,一般需要5~7d,这会增加抗生素用量及费用、延长休药期、增加弃奶损失。针对奶牛临床型乳房炎,本试验分别应用新型治疗理念与国内传统理念进行治疗效果对比,在临床治愈率、治愈天数、细菌学治愈率、治疗成本和复发率方面进行比较,为临床型乳房炎治疗提供新思路。
临床型乳房炎;抗生素;新型;治疗理念
奶牛乳房炎在世界范围内的发病率都很高,也是牛场中造成经济损失最大的疾病之一[1]。 乳房炎造成的经济损失主要包括治疗药费、弃奶损失、产奶量下降损失、牛奶品质下降损失、淘汰费用等。对于临床型乳房炎来说,治疗费用和弃奶损失容易被牧场兽医察觉和统计,这也是主要损失。有研究显示,临床型乳房炎治愈后,奶牛的产奶量迟迟不能恢复,造成巨大的隐性损失[2]。另外,乳房炎即使治愈后,也会造成不同程度的繁殖障碍[3,4]。无论是奶产量损失还是繁殖障碍,都可归因于巨噬细胞和乳腺上皮细胞在识别外源性刺激物后产生的炎症介质引发的炎症反应[5],严重时导致乳汁发生异常、乳房出现红肿热痛。炎症介质是伤害乳腺组织的直接杀手,摧毁乳腺上皮细胞[6]。另外,炎症介质也可以直接影响卵泡的发育周期和卵巢的功能[7]。
针对临床型乳房炎治疗,国内目前最常见的治疗理念是“使用抗生素,一直到临床症状消失,过抗后返回牛群”。这种治疗理念并不合理,因为抗生素只杀灭病原菌,而非直接消除炎症反应。在大部分新发病例中,若抗生素具备杀菌作用(敏感),乳腺组织内分散能力好、并在用药时保持作用部位达到MIC以上浓度,则能够在2~3d内彻底杀灭细菌[8]。而临床症状的消失需要经历炎症反应消除、组织修复的过程,一般需要5~7d。
治疗乳房炎时,若临床症状消失后才停止抗生素使用,那么这时乳房内的细菌是否早已经被杀灭?如果细菌已经被杀灭,但因炎症反应没有消失而继续用抗生素治疗,则无法达到缩短症状消失天数的目的,而且还会增加抗生素费用、弃奶费用、兽医精力。在这种情况下,需要使用非甾体抗炎药来缓解临床症状,增加临床治愈率[9]。最新研究显示,在治疗临床型乳房炎时配合使用美洛昔康注射液(非甾体抗炎药的一种),还可以提升细菌学治愈率和改善治愈后繁殖性能[10]。
针对奶牛临床型乳房炎,本试验分别应用新型治疗理念(所有病例均使用2支优孢欣+15mL美洛昔康注射液,不考虑临床症状是否消失)与国内传统临床治疗理念(使用抗生素治疗到临床症状完全消失)进行治疗效果对比,在临床治愈率、治愈天数、细菌学治愈率、治疗成本和复发率方面进行差异比较,为临床型乳房炎治疗提供新思路。
1 材料与方法
1.1 药品
优孢欣、美洛昔康注射液、进口头孢噻呋乳房灌注剂。
1.2 牛群信息
北方地区某大型牧场,每日挤奶3次,有详细的病例记录,可追溯每头牛的病史、胎次、用药方案等信息。牧场拥有实验室,可鉴别常见的革兰氏阳性菌、革兰氏阴性菌以及常见的乳房炎致病菌。泌乳牛乳房炎月发病率为2.32%。
1.3 病例筛选标准
在过去的30d没有临床型乳房炎病史;30d内没有因其他疾病使用过抗生素;治疗前,患牛仅有一个乳区患有临床型乳房炎;仅有乳汁或乳房发生异常的一、二级临床型乳房炎。
1.4 试验动物及分组依据上述标准,共筛选出111个临床型乳房炎病例,其中66个病例归为试验组,45个病例归为对照组。具体治疗方案见表1。
1.5 治疗前信息收集
1.5.1 记录发病特征

表1 两组治疗方案
在进行治疗前对所有被选病例进行病原菌的细菌学检测并完整记录以下内容:牛号、胎次、泌乳天数、患病乳区、临床症状(进行乳房炎分级)。
1.5.2 检测临床型乳房炎病原菌
无菌采样后4℃送往化验室,应用相应的检测方法检测常见的临床型乳房炎病原菌。
1.6 临床治愈判定
乳房炎发生后的第11天,对所有牛只进行临床治疗效果评估。若临床症状消失,判定为临床治愈。若治疗过程中出现症状加重等情况,兽医可自行更换其他治疗方案,更换方案后,此病例判定为治疗失败。
1.7 细菌学治愈判定
对临床治愈病例,于乳房炎发病后第14~21天,收集曾患病乳区的奶样,进行细菌培养,确认细菌学治愈情况,同时测定乳体细胞数。在治疗前后的两次病原菌检测中,若同一头牛的同一乳区均未发现相同病原菌,则判定为细菌学治愈。
1.8 复发率统计
统计治愈后21d内同一乳区再次发生乳房炎的病例数,以此计算复发率。
1.9 统计分析
采用SPSS 22.0软件对试验组和对照组的症状消失天数、弃奶天数、体细胞数、用药成本等进行t检验或方差分析。
体细胞评分公式:SCS=Log2(SCC/100,000)+3。
2 结果
2.1 总治愈率
依据试验制定的标准,试验组治愈牛52头,失败牛11头,其他原因3头;对照组治愈牛34头,失败牛9头,其他原因2头。统计后可得出结论,两组的临床治愈率分别为79%和76%,失败率17%和20%(图1),虽然对照组略低,但没有统计学差异(P>0.05)。

图1 治愈率对比
2.2 临床症状消失天数
如图2所示,试验组的临床症状平均消失天数为3.88±2.06d,对照组的临床症状消失天数为4.65±2.65d,两组结果之间有统计学差异(P<0.05)。

图2 临床症状平均消失天数对比
由图3可以看出,按照天数来分别统计治愈率。在试验组中,前4d治愈38例,占比73.1%,其中有34个病例的临床症状在治疗后2~4d内消失。在对照组中,前5d治愈23例,占比67.4%,其中17个病例的临床症状在治疗后3~5d内消失,占比50%。将两组结果结合来看,共有64个病例在发病5d内临床症状消失,占比74.4%。
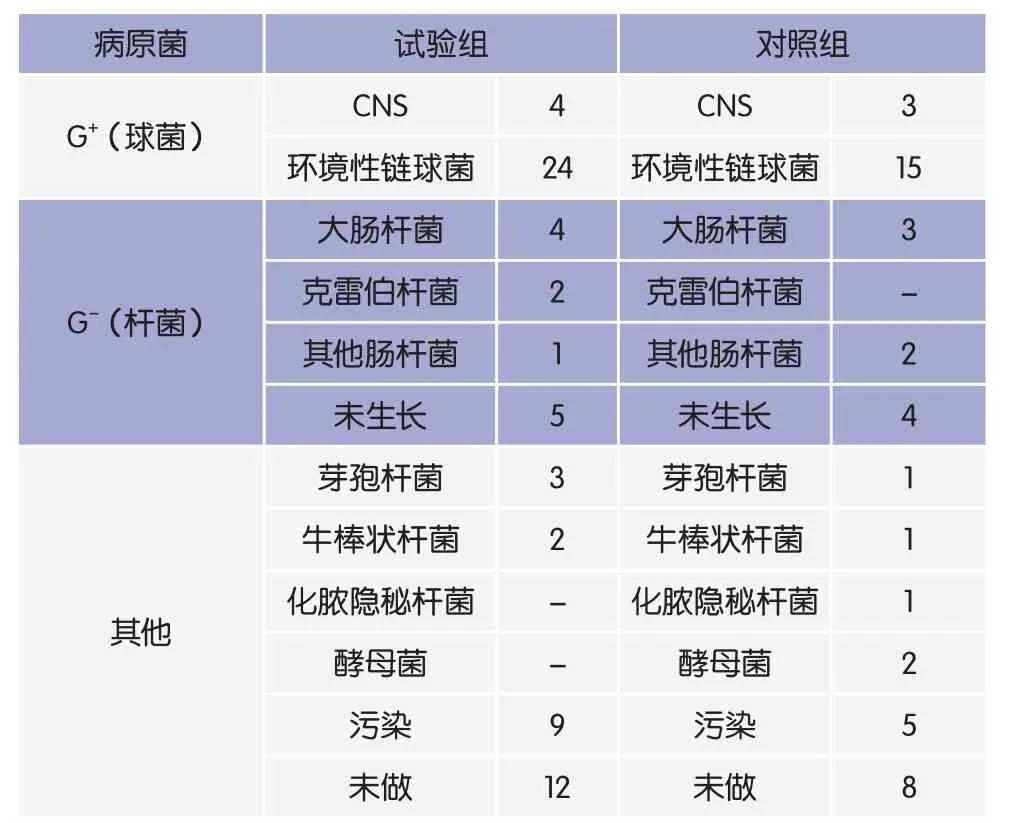
表2 临床型乳房炎病原菌检出情况
2.3 临床型乳房炎病原菌分布
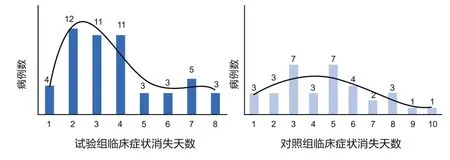
图3 临床症状消失天数分布情况
由表2可以看出,试验组检测了54份临床型乳房炎样品,检测比例81.8%;对照组检测了37份样品,检测比例82.2%。在试验组和对照组中革兰氏阳性球菌占比分别是51.9%和48.6%,革兰氏阴性杆菌(包括未生长)比例分别是22.2%和24.3%。镜检发现,两组间引发临床型乳房炎的病原菌结构相似。牧场中临床型乳房炎病原菌以革兰氏阳性球菌,尤其是环境性链球菌为主。
2.4 临床型乳房炎治愈率
如图4所示,在由革兰氏阳性球菌引发的临床型乳房炎中,试验组的治愈率为79%,对照组的治愈率为67%,两者之间有统计学差异(P<0.05)。虽然对照组中有部分病例未进行统计(占6%,是由于在试验期间混群或其他原因未持续用试验方案治疗,并非兽医主动更改治疗方案),结果也说明试验组的方案对于革兰氏阳性球菌引起的临床型乳房炎可能具有更好的治疗效果。在由革兰氏阳性球菌引发的临床型乳房炎中,两组方案的治愈率分别为83%和78%,无统计学差异。另外,在由其他原因引发的临床型乳房炎中,两组方案的治愈率分别为77%和83%,无统计学差异(P>0.05)。
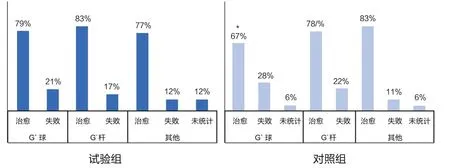
图4 不同病原菌型临床型乳房炎治的愈率对比
2.5 乳房炎临床症状消失天数
在试验组中,由G+(球菌)、G-(杆菌)和其他原因引发的临床型乳房炎的临床症状消失天数分别为4.41±2.06d、4.1±2.28d和3±1.49d;而在对照组中,相对应的症状消失天数分别为5.25±2.39d、4.71±2.21d和4.13±2.42d(图 5)。两组数据均具有统计学差异(P<0.05),由此可看出,无论在治疗G+(球菌)、G-(杆菌)或其他原因引发的乳房炎,试验组中的病例临床治愈天数均较对照组少。另外,无论是试验组或对照组,由G+(球菌)引发的乳房炎临床治愈天数均比G-(杆菌)多(P>0.05)。

图5 不同病原菌型临床型乳房炎的临床症状消失天数对比
2.6 细菌学治愈率
由于各种原因,最终试验组中有35个病例可统计细菌学治愈率,对照组中可统计24个病例。在治疗14~21d后,试验组中28个病例的乳汁检测时未发现与治疗前相同的病原菌,2个病例发现相同病原菌(1个为链球菌,1个为大肠杆菌);对照组中15个病例的乳汁检测时未发现相同病原菌,1个病例发现相同病原菌,为链球菌。由于采样污染、未采样等原因,共有13个病例不能确定是否为细菌学治愈,为了便于统计,在本研究中,将所有不能确定的病例归为细菌学未治愈率(图 6)。
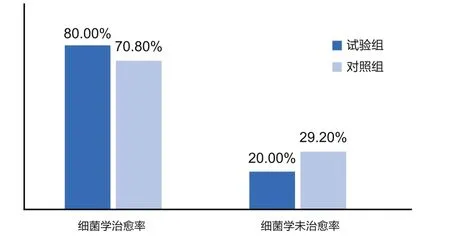
图6 试验组和对照组细菌学治愈率对比
体细胞数检测结果显示,若以<20万个/mL体细胞数为乳区炎症完全恢复的标准,试验组有10个乳区在治疗14~21d后,炎症完全消失,占比28.6%;对照组有6个乳区炎症完全消失,占比为25%(图7)。治愈乳区在治疗后14~21d期间,试验组和对照组的乳汁平均体细胞线性评分(SCS)分别为5.6±2.1和5.8±1.9,换算成体细胞数分别为60.6±5.4万个/mL和69.6±4.7万个/mL。这两组数据在试验组和对照组中无统计学差异(P>0.05)。

图7 试验组和对照组临床治愈后体细胞数恢复状况
2.7 复发率
依据乳房炎治愈后同一乳区21d内再次发生临床型乳房炎的判断标准,试验组中,52个治愈病例中有3个复发,复发率为5.8%;对照组中,34个治愈病例中有2 个复发,复发率为5.9%。两组的临床型乳房炎复发率差异不显著。
2.8 乳房炎经济损失
从奶牛离开大群进入乳房炎治疗圈开始至奶牛治愈后回到大群,统计离群天数(= 弃奶天数)。试验组可明确统计离群天数的病例为30例,平均6.8±2.2d;对照组病例数为18例,平均8.4±2.0d,两者间差异明显(图 8)。

图8 试验组和对照组的平均弃奶天数对比
将乳房炎治疗过程中造成的经济损失按照治疗费用和弃奶损失两部分进行统计。治疗过程中使用的商业化产品均按照市场指导价格计算,原料奶价格按照4元/kg计算,该牧场的日平均单产按照40kg/d计算。如图9所示,试验组中包含30个可统计病例,总用药费用为45元/支×60支+180元/次×30次=8100元,总弃奶费用为4元/kg×40kg/d×204d=32640元,平均每个病例造成的治疗损失为 270元,弃奶损失1088元,总损失1358元;对照组包含19个可统计比例,总用药费用为38元/支×98支+180元/次×19次=7144元,总弃奶费用为4元/kg×40kg/d×159d=25440元,平均每个病例造成的治疗损失为376元,弃奶损失1339元,总损失1715元。

图9 两组临床型乳房炎治疗过程中的经济损失
3 讨论
3.1 临床治愈率和症状恢复天数
一般来说,临床治愈率和症状恢复天数是兽医和牧场最为关注的两项指标,因为它们最容易统计,也最容易评估。正常情况下,牧场应该有两种乳房炎治疗方案,非特殊病原菌感染情况下,首选方案治愈率(不换药情况下)应达到75%~80%。在本试验中,并没有彻底界定必须坚持治疗固定天数后才能换药,而是完全根据兽医的灵活判断,得到的治愈率更客观、更符合牧场实际治疗情况;并且更改方案的病例在坚持原方案情况下一定会失败,因此得到的是“最低治愈率”。从结果可以看出,无论是使用优孢欣+美洛昔康注射液还是使用进口头孢噻呋乳房灌注剂+美洛昔康注射液,其治愈率都接近了80%,虽然优孢欣方案的临床治愈率稍高(79%),但统计学差异不显著。但是在优孢欣治疗组,临床症状平均恢复天数(3.88d)比进口头孢噻呋乳房灌注剂治疗组短(4.65d)。临床症状消失时间实际上等同于剧烈炎症反应消除时间。这个时间的长短与细菌的数量、毒力、乳房内免疫力、乳腺组织修复能力等都有一定关系。另外,如果抗生素载体使用不当,治疗次数过多,进入到乳房的抗生素药物也会刺激乳腺,出现非感染性炎症。在本试验中,笔者猜想试验组药物对细菌的杀灭速度较对照组药物快。另外,因为限制了优孢欣的使用次数,在能够充分杀灭细菌的情况下,没有过多的外源性刺激引发乳腺炎症,因此临床症状消失天数缩短。通过恢复天数的差异可以反推细菌学治愈情况。优孢欣治疗组2~4d症状消失的病例占比较高,而进口头孢噻呋乳房灌注剂治疗组有一半的病例在3~5d恢复。总的来说,两个治疗组共有3/4病例的临床症状在5d内消失,比已经报道的症状消失天数较短[11]。这可能是由于在两组治疗方案中均配合使用了美洛昔康的原因。美洛昔康是一种非甾体抗炎药,研究证实,治疗乳房炎时配合使用美洛昔康,可以加快症状消除的速度,同时,美洛昔康的使用对治愈后繁殖性能的改善有着明显的作用[10, 12]。
3.2 引起临床型乳房炎的主要因素是病原菌感染
引起乳房炎的病原菌种类繁多,但在引发的临床型乳房炎病例中,最主要的病原菌是革兰氏阳性球菌(21%~71%)、革兰氏阴性杆菌(15%~36%),另外有相当一部分临床病例不能分离出病原菌(22%~47%)[13]。勃林格奶牛团队2015年对国内进行了乳房炎病原菌流行病学调查,发现引起临床型乳房炎的革兰氏阳性球菌比例达40%,革兰氏阴性杆菌比例为35%,其他细菌感染比例为10%,无生长比例为15%。在本试验中,病例以革兰氏阳性球菌(链球菌)为主,占比约50%,另外还有占比约20%的革兰氏阴性杆菌。这主要是因为前面所述的数据主要来源于多个牧场的流行病学调查,而本试验病原菌数据来源于单一牧场,严格说来不算是流行病学数据,感染病原菌占比可认为属于正常。由试验结果可以看出,优孢欣组治疗革兰氏阳性球菌引发的乳房炎的治愈率(79%)比进口头孢噻呋乳房灌注剂组高(67%)。由于进口头孢噻呋乳房灌注剂组有部分病例(6%)因为各种原因未列入统计,但并不影响比较结果。笔者认为原因为:(1)优孢欣中的头孢氨苄属于头孢一代抗生素,其对革兰氏阳性球菌的杀灭作用强于头孢三代抗生素;(2)头孢氨苄在体内的代谢产物脱乙酰头孢氨苄对革兰氏阳性球菌的杀灭作用增强,而头孢噻呋的代谢产物脱呋喃甲酰头孢噻呋对革兰氏阳性球菌的活性减弱[8]。但无论是优孢欣组还是进口头孢噻呋乳房灌注剂组,对革兰氏阳性球菌性乳房炎的治愈率均低于阴性杆菌性乳房炎,并且治疗时间也比革兰氏阴性杆菌长。这可能是由于使用了美洛昔康注射液,对阴性杆菌内毒素引发的剧烈炎症反应进行了较好的控制。同时,牧场应该对革兰氏阳性球菌的乳房炎多加关注,因为已经有报道显示,革兰氏阳性球菌引发的临床型乳房炎细菌学治愈率比大肠杆菌性乳房炎低——如果杀菌不彻底,可能转化为慢性的亚临床乳房炎,也可能再次复发为临床型乳房炎[14]。另外,在本牧场中,革兰氏阳性球菌性乳房炎的治疗成本相对较高。
3.3 细菌学治愈率
细菌学治愈率可以判断一个牧场内现行的抗生素治疗方案是否真正有效[15,16]。一般在治疗后14~21d,检测临床症状消失病例的乳汁是否存在相同病原菌,如果为阴性则为细菌学治愈。需要把临床治愈和细菌学治愈分割来看:当临床治愈,而细菌学没有治愈时,会存在以下隐患:细菌在乳房内反复经历“大多数被杀灭→伺机繁殖增多”的过程,表现为同一乳区反复发病,形成慢性病例;乳房内细菌未被彻底杀灭的奶牛混入牛群,会对其他牛造成感染隐患;临床型乳房炎转归为隐性乳房炎,这种情况增多时会导致大罐奶体细胞数升高。在本试验中,优孢欣和进口头孢噻呋乳房灌注剂治疗组的细菌学治愈率分别为80%和70.8%。但由于很多样品不能统计(14.3%、25%),本着严谨保守的分析原则,在本研究中,笔者将不能确定是否达到细菌学治愈的病例归入细菌学未治愈组,因此两组的“最低细菌学治愈率”分别是80%和70.8%。另外,两组牛在治愈后的一段时间(5~21d),其乳区体细胞数依然处于比较高的状态(60.6±5.4万个/mL和69.6±4.7万个/mL),只有约1/4的乳区恢复至健康状态(<20万个/mL)。Scott已经证明,临床型乳房炎配合美洛昔康注射液治疗可以降低乳区体细胞数[12],因此推测,若没有使用美洛昔康注射液,体细胞数可能会更高。这可能是由于乳腺组织的炎症反应恢复是一个缓慢的过程,临床症状消失只是肉眼可见的剧烈炎症反应程度降低,变成隐性炎症,体细胞数恢复至正常仍需要较长时间。因此,在治疗乳房炎时,对炎症的控制不能忽视。如果牧场中临床型乳房炎发病多,体细胞数恢复时间过长,可能会引起大罐奶中体细胞数升高。
3.4 经济学损失
乳房炎给牧场带来的经济损失十分巨大,包括产量下降、弃奶、药费、淘汰、繁殖障碍、人工成本等。通常,一例临床型乳房炎会使用抗生素来进行治疗(严重病例需要配合抗炎药和全身疗法),在治疗期间其产奶不能作为商品奶进行出售。药费和弃奶损失是临床型乳房炎发生后最直接的损失,也最容易统计。因此,在本研究中,笔者对这部分经济损失进行了直接的计算和对比。所在牧场泌乳牛平均产量可以达到40kg/d,按照原料奶市场价4元/kg计算,乳房炎离群期间每天的弃奶损失可达到160元。从图9中可以看出,与抗生素的费用相比(在本试验中,所用抗生素的市价均较昂贵,同时加入了美洛昔康费用),弃奶费用是更大的一项损失。根据现在常规使用的治疗理念,等到临床症状消失停止抗生素使用后,还需要再经历2~3d的休药期后才能回群,这部分弃奶费用是巨大的。而试验组使用的方案为不等临床症状消失即停止使用抗生素,除了在保证相似或者更好的治疗效果基础上,将“休药期”变为“症状消失等待期”,除了能够减少抗生素费用,更有意义的是减少了所占比例更高的弃奶费用。综上所述,新乳房炎治疗理念能够带来巨大的经济价值。
[1] Halasa, T., et al. Economic effects of bovine mastitis and mastitis management: a review[J]. Vet Q, 2007, 29(1):18-31.
[2] Grohn, Y.T., et al. Effect of pathogen-specific clinical mastitis on milk yield in dairy cows[J]. J Dairy Sci, 2004, 87(10):3358-74.
[3] Ahmadzadeh, A., et al. Effect of clinical mastitis and other diseases on reproductive performance of Holstein cows[J]. Anim Reprod Sci, 2009, 112(3-4):273-82.
[4] Boujenane, I., J. El Aimani, and K. By. Effects of clinical mastitis on reproductive and milk performance of Holstein cows in Morocco[J]. Trop Anim Health Prod, 2015, 47(1):207-11.
[5] Ballou, M.A.Growth and Development Symposium: Inflammation: Role in the etiology and pathophysiology of clinical mastitis in dairy cows[J]. J Anim Sci, 2012, 90(5):1466-78.
[6] Lippolis, J.D. Immunological signaling networks: integrating the body's immune response[J]. J Anim Sci, 2008, 86(14 Suppl):E53-63.
[7] Giri, S.N., et al. Effects of endotoxin infusion on circulating levels of eicosanoids, progesterone, cortisol, glucose and lactic acid, and abortion in pregnant cows[J]. Vet Microbiol, 1990, 21(3):211-31.
[8] Schukken, Y.H., et al. Noninferiority trial comparing a firstgeneration cephalosporin with a third-generation cephalosporin in the treatment of nonsevere clinical mastitis in dairy cows[J]. J Dairy Sci, 2013, 96(10):6763-74.
[9] Burvenich, C., et al. Severity of E. coli mastitis is mainly determined by cow factors[J]. Vet Res, 2003, 34(5):521-64.
[10] McDougall, S., et al. Addition of meloxicam to the treatment of clinical mastitis improves subsequent reproductive performance[J].J Dairy Sci, 2016, 99(3):2026-42.
[11] Bradley, A.J. and M.J. Green. Factors affecting cure when treating bovine clinical mastitis with cephalosporin-based intramammary preparations[J]. J Dairy Sci, 2009, 92(5):1941- 53.
[12] McDougall, S., M.A. Bryan, and R.M. Tiddy, Effect of treatment with the nonsteroidal antiinflammatory meloxicam on milk production, somatic cell count, probability of re- treatment, and culling of dairy cows with mild clinical mastitis[J]. J Dairy Sci, 2009, 92(9):4421-31.
[13] Ruegg, P.L. Risks, realities, and responsibilities associated with mastitis treatments, in Meeting of the National Mastitis Council[J].2014: Ghent, Belgium.
[14] Morin, D.E., R.D. Shanks, and G.C. McCoy. Comparison of antibiotic administration in conjunction with supportive measures versus supportive measures alone for treatment of dairy cows with clinical mastitis[J]. J Am Vet Med Assoc, 1998, 213(5):676-84.
[15] Gundelach, Y., et al. Risk factors associated with bacteriological cure, new infection, and incidence of clinical mastitis after dry cow therapy with three different antibiotics[J]. J Vet Sci, 2011, 12(3):227-33.
[16] Sol, J., et al., Factors associated with cure after therapy of clinical mastitis caused by Staphylococcus aureus[J]. J Dairy Sci, 2000, 83(2):278-84.
S858.23
A
1004-4264(2017)02-0062-06
10.19305/j.cnki.11-3009/s.2017.02.015
2016-12-01

