钠离子对洋葱细胞程序性死亡的诱导
赵锦慧+周琳
摘要:对洋葱进行活化培养,探讨钠离子不同诱导浓度与时间对洋葱鳞茎内表皮细胞程序性死亡的影响。结果表明:随着钠离子诱导浓度的升高及诱导时间的延长,细胞形状和结构均会发生不同程度的变化,细胞凋亡数目增加,细胞中丙二醛含量上升,且细胞凋亡率及丙二醛含量在不同处理间均差异显著。说明钠离子在一定诱导浓度与时间下,对洋葱鳞茎内表皮细胞形态、结构、细胞凋亡率、丙二醛含量均有不同程度的影响。
关键词:钠离子;洋葱;细胞程序性死亡;细胞凋亡率;丙二醛
中图分类号: Q942 文献标志码: A
文章编号:1002-1302(2016)11-0189-02
20世纪90年代初国际上才把细胞程序性死亡(PCD)概念引入到植物学,随后有关研究遍布植物发育生物学、植物生理学等各个领域[1-5]。PCD和细胞凋亡意义相同,均属于细胞生理性死亡,它贯穿高等植物生长发育的一生,具有重要的生命意义。
中国每年的农作物和瓜果蔬菜都会受到各种逆境因子不同程度的影响,因此对植物的抗逆性机制及调控进行研究,既有理论意义又有实际应用价值。盐胁迫是植物经常遇到的逆境之一,Katsuhara研究发现盐胁迫诱导的大麦根部细胞凋亡表现出典型的凋亡特征[6],揭示了根部细胞凋亡可能是植物抗盐胁迫的一种生理机制。本试验选用洋葱鳞茎内表皮作为材料,对钠离子不同诱导浓度及诱导时间下洋葱细胞程序性死亡现象进行研究,主要观察凋亡细胞在形态学上发生的变化,并统计细胞凋亡率及测定细胞中丙二醛含量。旨在探索钠离子不同处理浓度及处理时间诱导洋葱细胞程序性死亡的效果。
1 材料与方法
1.1 试验材料
市售隔年洋葱。
1.2 试剂
0.1、0.3、0.5、0.7 mol/L氯化钠溶液、PBS缓冲液、改良苯酚品红染液、10%三氯乙酸、0.6%硫代巴比妥酸等。
1.3 试验方法
1.3.1 洋葱的预处理 取隔年洋葱,室温下于清水中培养 2~3 d,每天换水,直到露出幼嫩的白根,表明洋葱已被活化。
1.3.2 细胞程序性死亡观察 取活化后的洋葱鳞茎,切取约1 cm2的内表皮若干,分成3组进行处理。第1组是正对照,在PBS缓冲液中处理1 h;第2组是钠离子诱导组,分别用0.1、0.3、0.5、0.7 mol/L NaCl诱导1、4 h;第3组是负对照,在沸水中处理5 min。各组处理结束后,将洋葱鳞茎内表皮用改良苯酚品红染液染色10~15 min,染色完成后制成玻片标本,光学显微镜下观察细胞形态变化。选择染色效果好、背景干净、细胞分散良好的视野进行拍照,并对凋亡细胞进行计数统计。细胞凋亡率=凋亡细胞数/视野中观察的细胞总数×100%。每个处理观察3个玻片标本,细胞凋亡率用3个视野统计的平均值表示。
1.3.3 丙二醛(MDA)含量的测定 参照刘萍等的方法[7],用硫代巴比妥酸法测定细胞中丙二醛(MDA)含量,测定时设置3个重复,最终含量用平均值表示。
1.3.4 数据统计分析 采用Excel 2003对实验数据进行作图,运用SPSS 16.0统计软件,在95%水平上进行One-Way ANOVA分析处理间差异显著性。
2 结果与分析
2.1 对照组细胞形态结构观察
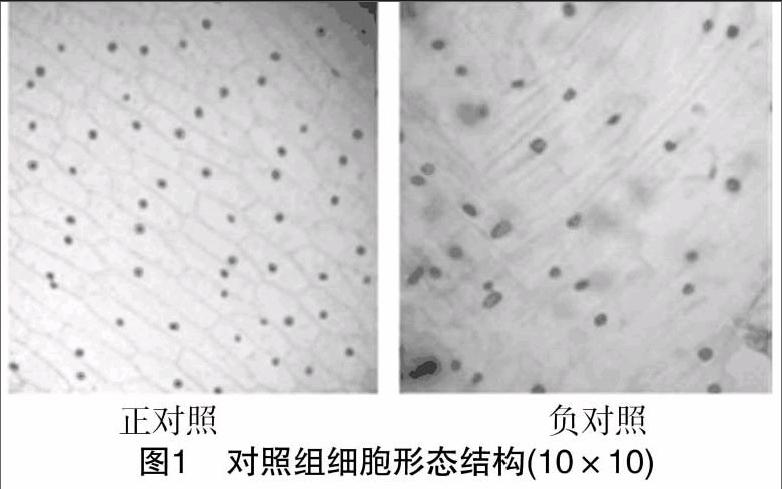
图1显示,正对照组细胞轮廓清晰,细胞之间的界限分明,细胞膜完整无损,细胞质透明,背景干净,细胞核呈球形。负对照组细胞轮廓及细胞之间的界限消失,细胞膜、细胞壁完全裂解,部分细胞核也发生裂解并且其形状和位置均发生一定变化,细胞质内出现碎末状物质,背景不干净,细胞不能保持结构的完整。
2.2 不同浓度钠离子诱导1 h后细胞程序性死亡观察
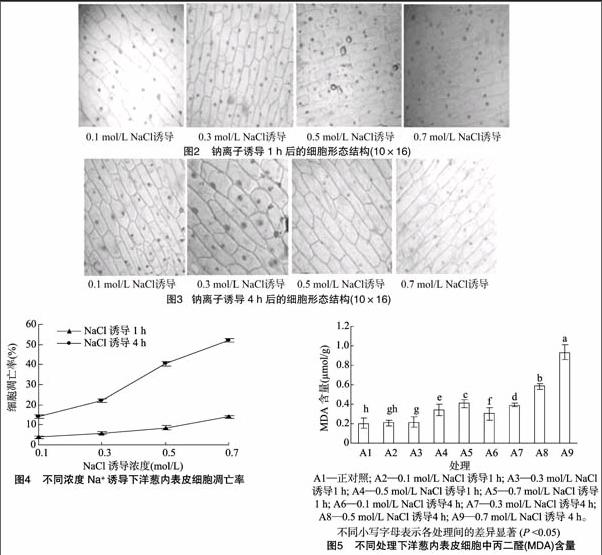
图2显示,不同浓度Na+诱导1 h后,随着Na+浓度的增加,细胞轮廓及细胞之间的界限逐渐模糊,质壁分离程度加深,形状及位置发生变化的细胞核增多,细胞质内出现的碎末状或块状物质越来越多,细胞背景不干净。
2.3 不同浓度钠离子诱导4 h后细胞程序性死亡观察
图3显示,不同浓度Na+诱导4 h后,细胞形态特征发生了更明显的变化,部分细胞的细胞膜已经破裂,细胞核轮廓模糊,着色变浅,细胞质壁分离现象更明显,细胞质内块状或碎末状物质更多,细胞背景极不干净。
2.4 不同浓度钠离子诱导下洋葱内表皮细胞凋亡情况
图4显示,随着Na+诱导浓度的增加及诱导时间的延长,细胞凋亡率呈上升趋势,并且各处理间差异显著。这说明不同浓度的Na+诱导不同时间对细胞的生命活动产生了不同程度的影响。
2.5 不同处理下洋葱鳞茎内表皮细胞中丙二醛(MDA)含量的变化
MDA是脂质过氧化物的代谢产物,其生物活性强,化学性质稳定,它的含量可以间接反映氧自由基对植物细胞的损伤程度。图5显示,Na+诱导组丙二醛含量均高于正对照组,并且A3~A9与A1间均表现出显著差异。同样诱导濃度下,随着诱导时间的延长,MDA含量快速增加;同样诱导时间下,随着诱导浓度的增加,诱导时间短时MDA含量增加幅度小,诱导时间长时MDA含量增加幅度大。这说明一定浓度的Na+作用一定时间,会对植物细胞造成明显伤害,并且Na+诱导时间对丙二醛的产生影响更大。
3 结论与讨论
本研究结果表明,正对照组细胞轮廓清晰,形态正常,结构完整;负对照组细胞轮廓消失,形态和结构均发生明显变化,细胞不能保持完整;Na+诱导组细胞轮廓发生变化,细胞质壁出现不同程度的分离,细胞核、细胞质、细胞膜等细胞结构发生不同程度的变化,Na+诱导浓度和时间与细胞凋亡率及细胞中丙二醛含量成正比。
NaCl之所以能够诱导细胞程序性死亡,其可能机制是:(1)细胞程序性死亡需要大量的ATP,而线粒体是能不断产生ATP的一种重要的细胞器,位于线粒体外膜上的受体可以被NaCl刺激,导致膜通透性孔不断保持开放状态,最终使得线粒体的膜通透性增强,使细胞色素C、一些凋亡诱导因子等被释放,从而加快细胞程序性死亡。(2)Na+浓度升高时,膜质过氧化物会在细胞内形成,这会破坏细胞膜上钙离子与钠离子的相对平衡状态,造成细胞膜上的Ca2+被Na+替换掉,从而改变Ca2+的流向,使得Ca2+由细胞内向细胞外流动,最终导致细胞膜的透性增强,使细胞内的某些凋亡诱导因子等物质被释放,进而加快细胞程序性死亡。(3)Na+浓度越高,细胞发生质壁分离的程度越高, 达到一定程度后会导致细胞内液泡裂解,然后液泡中的酸性水解酶等就会被释放出来,它的释放可以使细胞内的细胞核、高尔基体、核糖体、细胞膜、线粒体等被分解,细胞结构发生明显改变后诱发了细胞程序性死亡的发生[7-9]。
目前对PCD有关的基因、PCD 的调节途径、各信号分子的调节机理以及信号分子之间的关系等均获得了一些了解。但是对洋葱内表皮细胞发生PCD时,相关酶和蛋白质之间是怎样联系并发挥作用的还有待进一步研究。
参考文献:
[1]Greenberg J T,Guo A,Klessig D F,et al. Programmed cell death in plants:a pathogen-triggered response activated coordinately with multiple defense functions[J]. Cell,1994,77:551-563.
[2]Mccabe P F,Levine A,Mejjer P J,et al. A programmed cell death pathway activated in carrot cell cultured at low cell density[J]. Plant J,1997,12:267-280.
[3]Pennell R I,Lamb C. Programmed cell death in plants[J]. Plant Cell,1997,9:1157-1168.
[4]Yen C H,Yang C H. Evidence for programmed cell death during leaf senescence in plants[J]. Plant Cell Physiol,1998,39:922-927.
[5]Xu Y,Hanson M R. Programmed cell death during pollination-induced petal senescence in petunia[J]. Plant Physiol,2000,122:1323-1333.
[6]Katsuhara M. Apoptosis-like cell death in barley roots under salt stress[J]. Plant Cell Physiol,1997,38:1091-1093.
[7]劉 萍,李明军. 植物生理学实验技术[M]. 北京:科学出版社,2007:150-152.
[8]肖 军,高 杰. 高等植物细胞凋亡的诱因及生物学意义[J]. 山东农业大学学报,2008,39(1):125-128.
[9]李云霞,程晓霞,代小梅,等. 植物在逆境胁迫中的细胞程序性死亡[J]. 生物技术通报,2009(4):7-11.

