桃甲基化敏感扩增多态性MSAP技术体系的建立
蔡志翔+沈志军+严娟
摘要:为建立适合桃的甲基化敏感扩增多态性(methylation sensitive amplification polymorphism,简称MSAP)反应体系,以桃PCM-1R、PCM-1G为材料,对MSAP技术中的关键因素进行优化。结果表明,500 ng基因组DNA用EcoRⅠ、HapⅡ或MspⅠ各10 U(0.5 μL,2 000 U/mL),37 ℃保温12 h,即可酶切完全;25 μL选择性扩增体系中,含有2 μL 10倍稀释的预扩增产物、各1 μL上下游引物、2.5 μL 10×Taq buffer、2.5 μL dNTP mix(各0.2 mmol/L)、2.5 μL 25 mmol/L MgCl2、0.25 μL Taq DNA聚合酶。在该体系下选用256对引物对桃叶片进行甲基化模式分析,经筛选获得23对扩增条带清晰、重复性好的引物,PCM-1R、PCM-1G总甲基化率分别为28.0%、25.7%。
关键词:桃;DNA甲基化;MSAP;体系优化
中图分类号: S188;S662.101 文献标志码: A
文章编号:1002-1302(2016)11-0043-03
DNA甲基化是真核细胞基因组主要的修饰方式之一,DNA甲基化特别是胞嘧啶甲基化具有表观遗传效应和突变效应,与基因表达调控、细胞分化、基因组印记、性染色体失活及细胞记忆等生物学过程密切相关[1-4]。1995年,Vos等首次将随机扩增多态性与限制性内切酶片段长度多态性2种分子标记有机结合[5],建立了扩增片段长度多态性分析技术。1997年,Gonzalgo等已经尝试用随机引物和对甲基化敏感不同的同裂酶HpaⅡ、MspⅠ来进行甲基化分析[3]。Xiong等于1999年首次证明甲基化敏感扩增多态性(methylation sensitive amplification polymorphism,简称MSAP)是一种可靠的检测植物DNA甲基化的方法[6],它操作相对便捷,可检测出样品DNA中大量甲基化位点,因多态性高、引物设计简单等优点而被广泛应用。目前,MSAP方法在脐橙[7]、萝卜[8]、杂交籼稻[9]、橡胶树[10]、苹果[11]等多种植物中都有应用,但在桃的相关研究中尚未见应用报道。PCM-1R(叶片紫红色)、PCM-1G(叶片绿色)为PCM-1(叶片紫红-绿杂色)的无性繁殖后代植株,本研究以这2个植株为试验材料,建立桃MSAP体系,并进行引物筛选,以期为进一步研究桃DNA甲基化奠定基础。
1 材料与方法
1.1 试验材料
PCM-1R、PCM-1G,由国家果树种质南京桃资源圃提供。
1.2 仪器与试剂
主要仪器有Biometra T-Gradient PCR仪、Eppendorf 5810R冷冻离心机、BioRad电泳仪等。
主要试剂:EcoRⅠ、MspⅠ、HpaⅡ,New England BioLabs;Taq DNA聚合酶,Thermo Scientific;其他试剂为国产或进口分析纯。接头及引物由英潍捷基公司合成,详见表1。
1.3 试验方法
1.3.1 桃叶片DNA提取 桃叶片DNA提取参照王富荣等改良CTAB法[12]。
1.3.2 桃MSAP双酶切体系优化 20 μL体系:500 ng模板DNA,2 μL 10×NEB Buffer(EcoRⅠ/MspⅠ使用NEB4,EcoRⅠ/HpaⅡ使用NEB1),内切酶EcoRⅠ/MspⅠ或HpaⅡ用量分为1、5、10、20 U 4种,用去离子水补足体积至20 μL。体系混匀后置于Biometra T-Gradient PCR仪上,分别于37 ℃温育4、8、12、16、20 h,80 ℃失活20 min,取5 μL用1%琼脂糖凝胶电泳检测酶切效果,筛选出最佳酶切时间、最佳内切酶用量。
接头连接后进行预扩增。25 μL预扩增体系:2.5 μL 10×Taq buffer,2.5 μL dNTP mix(各0.2 mmol/L),0.5 μmol/L 预扩增引物E+A、H/M+T,2 μL模板DNA(连接产物稀释10倍),2.5 μL 25 mmol/L MgCl2,0.25 μL 5 U/μL Taq DNA 聚合酶,用去离子水补足至25 μL。扩增程序:95 ℃ 3 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,36个循环;72 ℃ 15 min。
1.3.3 桃MSAP选择性扩增及引物的筛选 采用E+A**/H/M+T**引物组合。分别将预扩增产物稀释5、10、20、50倍,对选择性扩增模板浓度进行优化。反应体系与预扩增反应体系相同,扩增程序:95 ℃ 3 min,95 ℃ 30 s,65 ℃ 30 s(每次循环降低0.7 ℃),72 ℃ 1 min,共13个循環;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,共23个循环;72 ℃延伸15 min。
用优化后的体系对E+A**、H/M+T**共256对引物进行筛选。产物用2.0%琼脂糖凝胶电泳检测扩增效果。
1.3.4 聚丙烯酰胺凝胶电泳及银染 选择性扩增产物经 2.0%琼脂糖凝胶电泳检测后,95 ℃变性10 min,用8%聚丙烯酰胺凝胶电泳;银染参照梁宏伟等的方法[13]。
2 结果与分析
2.1 基因组DNA
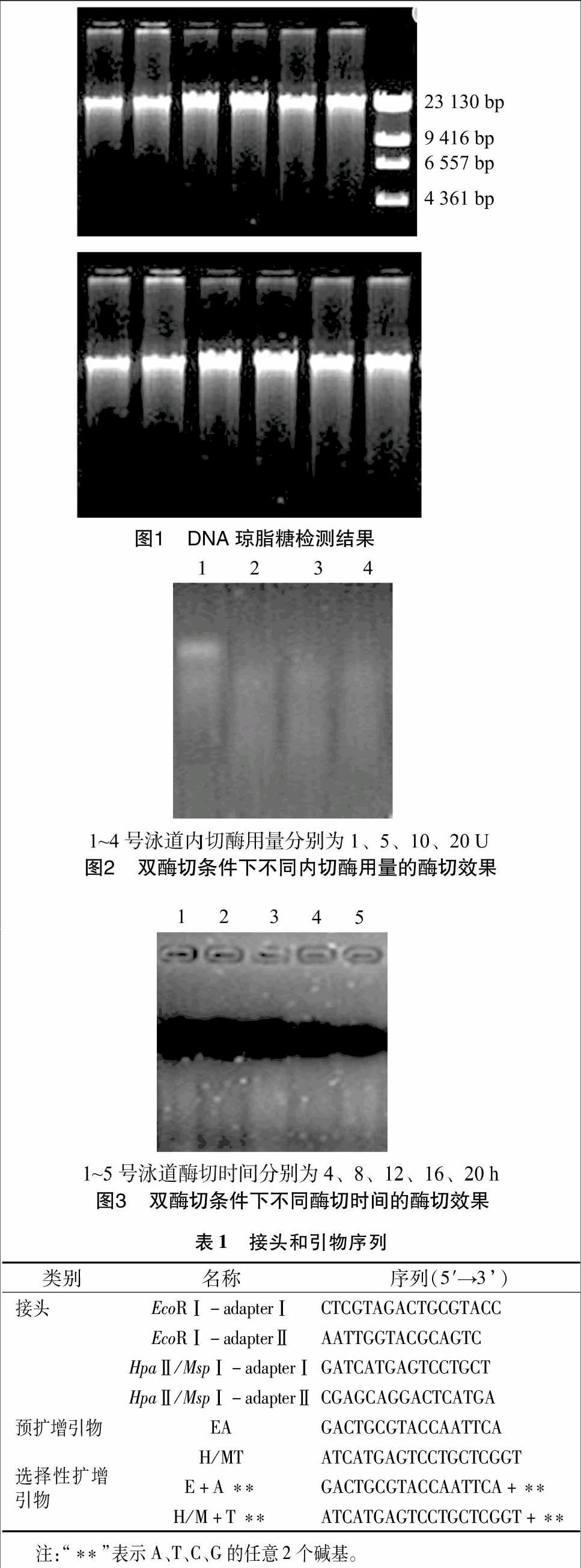
琼脂糖凝胶电泳结果显示,所提基因组DNA主带清晰(图1)。经紫外分光光度测定,结果显示D260 nm/D280 nm值在1.7~1.9范围内,说明DNA纯度高,蛋白质、多糖及酚类含量极少,满足MSAP分析对DNA的要求。
2.2 桃MSAP双酶切体系优化
基因組DNA经不同用量的内切酶双酶切,再用1%琼脂糖凝胶电泳检测,结果见图2。由结果可知,对于20 μL体系、500 ng 模板DNA,1 U内切酶用量酶切不完全,5、10、20 U内切酶用量目测酶切完全,条带差异不大。由于即使极少量的不完全酶切也会影响后续试验,因此为彻底排除不完全酶切对后续试验的影响且尽可能节约酶用量,对于20 μL体系,500 ng模板DNA选用10 U内切酶。
基因组DNA经不同酶切时间酶切,1%琼脂糖电泳检测结果显示,对于20 μL体系、500 ng模板DNA、10 U内切酶用量条件,不同酶切时间的效果表现为,酶切时间为4 h时,酶切不完全,8、12、16、20 h基本酶切充分且无明显差异(图3),为在保证酶切完全的前提下节省酶切时间,选择酶切时间为12 h。
2.3 桃MSAP选择性扩增体系优化
选择性扩增产物于变性聚丙烯酰胺凝胶上电泳,结果表明,以20倍稀释DNA为模板扩增条带更清晰,且小分子量条带较易分辨,因此确定使用20倍稀释的预扩增产物为模板进行选择性扩增。
2.4 聚丙烯酰胺凝胶电泳结果初步分析
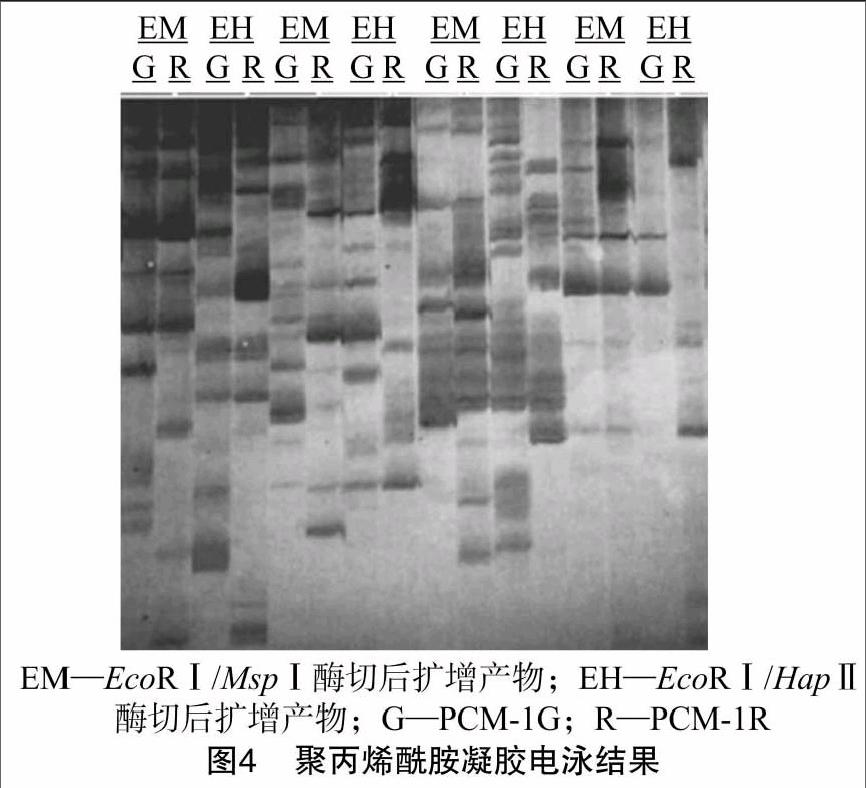
用256对MSAP选择性扩增引物对桃PCM-1R、PCM-1G 的叶片DNA样品进行全基因组甲基化分析,筛选出23对条带清晰、丰富且重复性好的引物组合(图4)。扩增出 200~1 000 bp的位点397个,其中PCM-1R、PCM-1G半甲基化位点分别为44、38个,分别占全部位点的11.1%、9.6%;全甲基化位点分别为67、64个,分别占全部位点的16.9%、16.1%;总甲基化率分别为28.0%、25.7%,PCM-1R略高于PCM-1G。
3 结论与讨论
DNA在含有多糖、酚类和蛋白质的情况下容易造成酶切失败,体现在聚丙烯酰胺凝胶电泳胶版上端大分子片段多且背景加深[14],因此高质量的DNA是MSAP成功的基础。一般来说,十二烷基硫酸钠(SDS)法提取的DNA会有较多的多糖,使DNA呈胶冻状,而CTAB法提取纯化可基本除去多糖。桃叶片中糖及酚类物质含量较多,因此本试验采用王富荣等改良CTAB法提取基因组DNA[12],虽然产量略低,但有效去除了蛋白质、多糖及酚类杂质,保证了DNA的质量。
限制性内切酶单位定义:在合适的温度下,完全消化 1 μg DNA底物所需的酶量定义为1个单位(1 U)。在这个单位定义中,有几个不确定因素:首先是底物,不同的酶单位定义选择的底物可能不同;其次是限制性内切酶在底物DNA上酶切位点的个数。酶单位定义要求完全消化,底物上某个酶的酶切位点数量的多少,直接影响该酶的单位定义。因而在进行酶切时,用1 U酶消化1 μg DNA的通常做法是很不科学的,这也导致在实际工作中,要进行多次试验才能确定最合适的酶切条件。
研究表明,由于MSAP使用的同裂酶只能识别“CCGG/GGCC”位点的胞嘧啶甲基化,而不能对“CCGG/GGCC”位点以外的胞嘧啶甲基化进行修饰,获得的结果与基因组中实际的甲基化水平可能存在差异[15]。但由于约90%的甲基化修饰位于“CpG”二核苷酸或“CpNpG”三核苷酸重复区内,因此多数研究者认为“CCGG/GGCC”位点的甲基化修饰比例能够客观反映植物基因组甲基化修饰水平[16]。
不同物种或同一物种的不同生长时期、不同生长环境DNA甲基化水平有很大的差异,如脐橙甲基化率为4.7%~15.0%[7],苹果甲基化率为16.28%~21.77%[11],半夏多倍体复合体甲基化率为54%~58%[17],不同生态区同一基因型烟草甲基化率相差5.78百分点[18]。本试验中的PCM-1R、PCM-1G均为3年生植株,且种植于同一田块,基本上可以排除生长环境与树龄对试验结果的影响。
参考文献:
[1]Rossi V,Motto M,Pellegrini L. Analysis of the methylation pattern of the maize opaque-2 (O2) promoter and in vitro binding studies indicate that the O2 B-Zip protein and other endosperm factors can bind to methylated target sequences[J]. Journal of Biological Chemistry,1997,272(21):13758-13765.
[2]Jablonka E,Lamb M J. The changing concept of epigenetics[J]. Annals of the New York Academy of Sciences,2002,981(981):82-96.
[3]Gonzalgo M L,Jones P A. Mutagenic and epigenetic effects of DNA methylation[J]. Mutation Research,1997,386(2):107-118.
[4]Tariq M,Paszkowski J. DNA and histone methylation in plants[J]. Trends in Genetics,2004,20(6):244-251.
[5]Vos P,Hogers R,Bleeker M,et al. AFLP:a new technique for DNA fingerprinting[J]. Nucleic Acids Research,1995,23(21):4407-4414.
[6]Xiong L Z,Xu C G,Saghai-Maroof M A,et al. Patterns of cytosine methylation in an elite rice hybrid and its parental lines,detected by a methylation-sensitive amplification polymorphism technique[J]. Molecular and General Genetics,1999,261(3):439-446.
[7]洪 柳,邓秀新. 应用MSAP技术对脐橙品种进行DNA甲基化分析[J]. 中国农业科学,2005,38(11):2301-2307.
[8]柳李旺,宋贤勇,龚义勤,等. 萝卜MSAP体系优化与抽薹过程中MSAP分析[J]. 江苏农业科学,2006(6):203-206.
[9]彭 海,江光怀,张 静,等. 中国杂交籼稻DNA甲基化多样性与遗传稳定性[J]. 中国科学:生命科学,2014,44(1):45-53.
[10]吴春太,李维国,黄华孙. 橡胶树MSAP反应体系的建立及其对无性系DNA的甲基化分析[J]. 广东农业科学,2011,38(9):141-144.
[11]吕晓婷,赵春梅,王爱华,等. 苹果MSAP技术体系的优化及其應用[J]. 中国农学通报,2012,28(22):287-292.
[12]王富荣,赵剑波,章 镇,等. 适于AFLP分析用的桃成熟叶片DNA提取方法[J]. 果树学报,2006,23(4):638-641.
[13]梁宏伟,王长忠,李 忠,等. 聚丙烯酰胺凝胶快速、高效银染方法的建立[J]. 遗传,2008,30(10):1379-1382.
[14]曹喜兵,赵改丽,范国强. 泡桐MSAP体系建立及引物筛选[J]. 河南农业大学学报,2012,46(5):535-541.
[15]McClelland M,Nelson M,Raschke E. Effect of site-specific modification on restriction endonucleases and DNA modification methyltransferases[J]. Nucleic Acids Research,1994,22(17):3640-3659.
[16]Reyna-López G E,Simpson J,Ruiz-Herrera J. Differences in DNA methylation patterns are detectable during the dimorphic transition of fungi by amplification of restriction polymorphisms[J]. Molecular and General Genetics,1997,253(6):703-710.
[17]薛 梅,陈成彬,陈 力,等. 半夏多倍体复合体基因组DNA甲基化状态的MSAP分析[J]. 中草药,2008,39(11):1713-1716.
[18]李 辉,孙焕良,李德芳. 不同生态区同一基因型烤烟表观遗传的MSAP分析[J]. 华北农学报,2013,28(1):32-36.

