微生物发酵法制备1,3-丙二醇的研究进展
杨 云 殷 冉 裴建军
(南京林业大学 化学工程学院,江苏 南京 210037)
1,3-丙二醇(1,3-propanedio,简称1,3-PDO)是一种重要的化工原料[1],可用于油墨、印染、涂料、化妆品、食品、润滑油和药物等方面的生产。此外,1,3-PDO 还可以作为单体合成聚酯、聚醚、聚氨酯和杂环化合物等,如1,3-PDO与对苯甲酸发生聚合反应可生成极具发展前途的新型聚酯高分子材料聚对苯二甲酸丙二酯(PTT)。
1,3-PDO的生产方法主要有化学合成法和微生物发酵法,目前实现工业化生产的主要是化学合成法,主要包括丙烯醛水合加氢法和环氧乙烷羰基化法。但该方法存在设备投资大、工艺要求严格、产品提取难度大、副产物多、三废处理成本高、原料不可再生等诸多问题。以葡萄糖或甘油为底物,通过微生物发酵法制备1,3-PDO具有反应条件温和、操作简单、选择性好、转化率高、副产物少、原料可再生、绿色环保等优点,已成为本产品制备领域中研究的热点和发展的趋势[2]。本文从发酵菌种、发酵工艺、1,3-丙二醇代谢中关键酶和制备1,3-丙二醇基因工程菌等几个方面对发酵法生产1,3-丙二醇的国内外研究现状进行了综述。
1 生产1,3-丙二醇的发酵菌种
目前从自然界中发现的能够生产1,3-PDO的微生物菌种都是细菌,主要集中在肠杆菌科、乳杆菌属和梭菌属。肠道细菌中主要有肺炎克雷伯氏菌(Klebsiellaneumoniae)、产气克雷伯氏菌(Klebsiellaaerogenes)、弗氏柠檬菌(Citrobacterfreundii)和成团肠杆菌(Enterobaeteragglomerans);乳杆菌属的包括短乳杆菌(Lactobacillibrevis)和布氏乳杆菌(Lactobacillibuchneri);梭菌属主要包括丁酸梭状芽孢杆菌(Clostridiabutyricum)和巴氏梭状芽孢杆菌(Clostridiapasteuianu)。肺炎克雷伯氏菌、丁酸梭状芽孢杆菌和弗氏柠檬菌因具有较高的甘油、1,3-PDO耐受力以及较高的底物转化率和生产强度,是目前研究较多的三种菌种[3]。肺炎克雷伯氏菌是一种革兰氏阴性菌,具有兼性厌氧特性。丁酸梭菌是一种严格厌氧菌,对高温、干燥等环境具有较强抵抗力,主要存在于土壤、海水和淡水的沉积物以及人和家畜的肠道内。这些野生型菌株都只能以甘油为唯一碳源和供能物质,经过代谢后,除生成目的产物1,3-PDO外,还能产生乙醇、乙酸、丁酸、2,3-丁二醇、乳酸、玻拍酸等副产物。由于底物、产物及副产物都能抑制菌体的生长,因此,筛选获得对底物、产物和副产物耐受能力强的1,3-丙二醇发酵优良菌种是该方面研究的重要内容之一[4]。
对1,3-丙二醇生产菌种的研究,除了从自然界中分离、筛选野生菌并利用物理化学手段对其进行诱变育种以外,还包括基因工程菌的构建[5]。基因工程菌的构建主要是基于进一步提高1,3-PDO的产量、降低制备成本,利用基因工程手段对野生菌进行改造;或对本身不能进行甘油和1,3-PDO代谢生产的其他菌种进行改造,使之具有生产目的产物的能力;或基于合成生物学的技术与方法,将合成1,3-丙二醇关键酶整合到新的宿主细胞中。
2 微生物发酵法生产1,3-丙二醇的工艺
在甘油发酵产1,3-PDO过程中,对发酵条件进行优化,可以达到提高1,3-PDO产量和底物转化率,减少底物甘油、产物1,3-PDO和其它副产物对细胞生长的抑制作用的目的。吴斌等人优化了丁酸梭菌利用甘油厌氧发酵制备1,3-丙二醇的碳源、氮源等营养条件[6]。在最佳条件下,发酵50 h可产1,3-丙二醇40.7 g/L,甘油摩尔转化率达68%。冷桂华等人利用克雷伯氏菌以甘油为底物发酵生产1,3-丙二醇,通过对甘油初始浓度、pH、温度、通气策略等发酵条件的优化,1,3-PDO的产量可达57.63 g /L[7]。王晓楠等人在微氧条件下,考察了肺炎克雷伯氏菌发酵生产1,3-PDO过程中丙酮酸、柠檬酸对发酵的影响[8]。结果表明,培养基中添加一定量的丙酮酸对菌体生长和1,3-丙二醇合成具有一定的促进作用,而加入一定量的柠檬酸对菌体生长和1,3-丙二醇的合成有抑制作用。
微生物生产过程中,不同的发酵方式,对菌株代谢流及其产量会有较大的影响。目前,1,3-PDO生产的发酵方式主要有批次发酵、连续发酵、固定化和混合菌发酵等。分批发酵可以得到较高的1,3-PDO浓度,但是底物利用率和生产强度相对较低、产物抑制强烈。连续发酵可以大大提高生产强度,同时降低产物抑制作用,然而由于稀释效应导致产物浓度较低。Wilkens等利用丁酸梭菌为菌种,以精甘油为原料进行补料批式发酵生产1,3-PD,其产物浓度和生产强度分别达到93.9 g/L 和3.3 g/L/h[9]。贺璐等采用单级连续发酵、二级连续发酵和三级连续发酵制备1,3-PDO,其中二级连续发酵是较优的方式,1,3-PDO生产强度达到1.89 g/L/h[10]。Gungormusler以粗甘油为原料,以不锈钢丝作为固定化载体,固定化发酵生产1,3-PDO生产强度达到4.8 g/L/h[11]。
3 1,3-丙二醇代谢中关键酶及代谢途径
甘油转化1,3-PD 过程的关键酶有:甘油脱水酶、1,3-丙二醇脱氢酶、甘油脱氢酶(GDH)、2-羟基丙酮激酶(DHAK)和丙酮酸脱氢酶系(PDH)等。
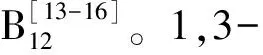
甘油代谢为1,3-PDO主要是在二羟丙酮操纵子(dha)调控下进行,代谢分为还原和氧化两条支路[24,25]。(1)还原途径:在维生素B12存在下(丁酸梭杆菌除外),甘油脱水酶将甘油转化为3-羟基丙醛;在还原力NADH2存在下,1,3-丙二醇氧化还原酶催化3-HPA生成1,3-PDO。还原途径消耗氧化途径产生的NADH2,使微生物细胞内达到平衡。(2)氧化途径:以NAD+为辅酶,甘油在甘油脱氢酶(GDH)催化下生成2-羟基丙酮(DHA);DHA在ATP及2-羟基丙酮激酶(DHAK)作用下磷酸化为二羟基丙酮磷酸( DHAP);DHAP进一步生成丙酮酸,然后通过乙酰CoA进入三羧酸循环或生成其它小分子醇、酸等代谢产物。氧化途径产生ATP和还原力NADH2。
4 制备1,3-丙二醇基因工程菌的构建
野生菌或传统菌发酵法生产1,3-PDO的产量低、转化率低,生产成本高,要得到高产量、高产率和高转化率的菌株,利用基因工程方法构建基因工程菌株是一种有效途径。基因工程菌的构建主要有5种方案[26]。(1)强化还原途径中限速酶(如甘油脱水酶)的表达或阻断副产物代谢途径,并克隆表达编码甘油脱水酶再激活因子的基因;(2)将1,3-PDO产生菌的相关基因克隆到E.coli等基因工程菌中;(3)将生产1,3-PDO的dhaB、dhaT基因克隆到甘油生产菌中;(4)将甘油生产菌的相关基因DAR1,GPP2克隆到1,3-PDO生产菌中;(5)将1,3-PDO的dhaB、dhaT 基因和甘油生产菌的DAR1,GPP2基因都克隆到E.coli等基因工程菌中。
4.1 代谢途径中无益副产物产生基因的去除
要实现甘油的高效转化,有效策略或举措就是在维持菌体正常代谢的前提下,打破正常次级代谢途径,达到抑制或阻断氧化途径中某些代谢支路、增加还原途径代谢流量的目的。乙醇、乙酸、乳酸和2,3-丁二醇是1,3-PDO发酵中主要副产物,减少发酵过程中副产物的积累就能降低这些副产物对细胞生长产生的抑制作用。陈利飞等通过敲除克雷伯氏菌产乳酸代谢途径中的关键酶乳酸脱氢酶基因(ldhA),使得乳酸产量由原来的10.16 g/L 降为0.49 g/L,而1,3-PDO的产量和甘油转化率分别提高了8.79%和5.33%[27]。2,3-丁二醇与产物的沸点接近,增加了获得高纯1,3-PDO产品分离的难度。乙酰乳酸合酶缺陷的克雷伯氏菌突变株由于在甘油代谢中存在缺陷无法生产1,3-丙二醇或2,3-丁二醇[28],Lee等将Zymomonasmobilis的丙酮酸脱羧酶(pdc)和醛脱氢酶(aldB)基因引入乙酰乳酸合酶缺陷的克雷伯氏菌突变株中[29],实现了异源表达,有效恢复了突变株的甘油代谢,实现了2,3-丁二醇产量的最小化,同时强化了1,3-PDO的生产。
4.2 以甘油为底物发酵制备1,3-PDO的基因工程菌构建
以甘油为底物发酵生产1,3-PDO的合成途径中,还原力NADH的不足是引起中间代谢产物3-羟基丙醛累积的关键因素,从而会抑制甘油代谢途径关键酶甘油脱水酶的活性,对菌体也有一定的毒害作用,结果将严重影响1,3-丙二醇产量[30]。江南大学方慧英等人以大肠杆菌和克雷伯氏菌DNA为模板克隆得到yqhD(1,3-丙二醇氧化还原酶同工酶)和dhaB、dhaT基因[31],构建双启动子表达载体pEtac-dhaB-tac-yqhD及表达载体pUC-tac-dhaT,并在E.coliBL21中实现了共表达。她们创制的具有双质粒系统的新型重组大肠杆菌可利用两种辅酶(NADH、NADPH)将甘油转化为1,3-PDO,有效解决了合成途径中还原力不足这一技术瓶颈。
4.3 以葡萄糖为底物直接发酵制备1,3-PDO的基因工程菌构建
利用葡萄糖生产1,3-PDO最有效、最经济的方法是将葡萄糖转化为甘油与甘油转化为1,3-PDO两个反应整合到同一菌株中。实现这一过程可以采用的技术手段包括:(1)在1,3-PDO产生菌中表达甘油产生途径的基因。在甘油产生菌中,3-磷酸甘油酯酶催化3-磷酸甘油为甘油。由于其底物3-磷酸甘油是微生物脂类合成代谢的中间产物,因此,在1,3-PDO产生菌中表达此酶,能将葡萄糖代谢和1,3-PDO合成途径联系起来。(2)在甘油产生菌中表达1,3-PDO产生途径的基因,如在酿酒酵母中表达dhaB和dhaT基因。但由于真核和原核表达系统的差异,要求在酿酒酵母中构建全新的dhaB和dhaT。(3)在既不产生甘油又不产生1,3-PDO的微生物中表达上述两种基因。虽然天然大肠杆菌既不能产生甘油也不能产生1,3-PDO,但该方法的优势是不需克服甘油代谢途径和1,3-PDO代谢途径中的调控机制[32]。
5 结论与展望
1,3-PDO的微生物发酵法具有广阔的研发前景。近年来,国内外通过对微生物法生产1,3-PDO的发酵菌种、发酵工艺、1,3-PDO代谢中关键酶和制备1,3-PDO的基因工程菌构建等方面开展了大量研究,并取得了重大的进展和可喜的成果,但一些关键技术还需进一步突破,而且,目前的研究多集中在实验室阶段,工业化放大仍然存在着一些技术瓶颈。因此,今后的研究可以从以下几个方面重点入手:(1)将传统育种与基因改造相结合,筛选出对底物和产物耐受性好、产量高的优异菌种。(2)通过代谢工程、分子生物学等手段强化还原途径中限速酶的表达以及阻断副产物代谢途径,进一步提高转化率。(3)引入新技术、新手段对发酵过程进行精准调控,使菌种的优良特性达到最大限度的发挥。(4)利用合成生物学的技术与方法,基于生物合成1,3-PDO的基本规律,人工设计并构建新型、高效生物制造1,3-PDO的超级细胞。(5)基于合理、经济、高效的原则,对发酵法生产1,3-PDO整个过程的技术体系进行优化和集成创新。相信随着基础研究和现代生物技术的快速发展,微生物法生产1,3-PDO将会取得更大的突破性成果,实现具有显著竞争优势的产业化生产及其规模化应用。
[1] Saxena RK, Anand P, Saran S., et al. Microbial production of 1,3-propanediol: Recent developments and emerging opportunities[J]. Biotechnol Adv, 2009, 27( 6):895~913.
[2] 赵红英,程可可,向波涛 等. 微生物发酵法生产1,3-丙二醇[J]. 精细与专用化学品, 2002, 10(13):21~23.
[3] 王剑锋,刘海军,修志龙 等. 生物转化生产1,3-丙二醇的研究进展[J]. 化学通报, 2001, 10:621~625.
[4] 张文斗,孟冬冬,王瑞明 等. 微生物法生产1,3-丙二醇的研究进展[J]. 齐鲁工业大学学报, 2011, 25(4):11~14.
[5] Nakamura CE, Whited GM. Metabolic engineering for the microbial production of 1,3-propanediol[J]. Curr Opin Biotechnol, 2003, 14( 5): 454~459.
[6] 吴斌,何冰芳,孙志浩 等. 丁酸梭杆菌发酵甘油制备1, 3-丙二醇的研究[J]. 工业微生物, 2004, 34(1):21~25.
[7] 冷桂华,王瑞君,孙万里. 生物催化合成1,3-丙二醇工艺的研究[J]. 食品工业科技, 2011, 12:136~138.
[8] 王晓楠,王凤寰,吴家鑫 等. 丙酮酸对肺炎克雷伯氏菌微氧发酵甘油产1, 3-丙二醇的影响[J]. 生物加工过程, 2010, 8(3):23~27.
[9] Wilkens E, Ringel A K, Hortig D., et al. High-level production of 1,3-propanediol from crude glycerol by Clostridium butyricum AKR102a[J]. Appl Microbiol Biotechnol, 2012, 93(3):1 057~1 063.
[10] 贺璐,赵雪冰,孙燕 等. Klebsiella pneumonia连续发酵生产1,3-丙二醇的工艺优化[J].食品与发酵工业, 2012, 38(8):23~28.
[11] Gungormusler M, Gonen C, Azbar N. Effect of cell immobilization on the production of 1,3-propanediol[J]. New Biotechnol, 2013, 30(6):623~628.
[12] 纂文涛,修志龙. 甘油歧化生产1,3-丙二醇过程的代谢和基因调控机理研究进展[J].中国生物工程杂志, 2003, 23(2):64~65.
[13] Yamanishi M, Yunoki M, Tobimatsu T. The cyrstal sturcutre of coenzyme B12-dependent glycerol dehydratase in complex with cobalamin and propane-l,2-diol[J]. Eur J Biochem, 2002, 269:4 484~4 494.
[14] 杨仲丽,方柏山,余劲聪 等. 辅酶依赖型和不依赖型甘油脱水酶的比较[J]. 华侨大学学报(自然科学版), 2010, 31(5):542~547.
[15] Liao DI, Dotson G, Turner Jr I., et al. Crystal structure of substrate free form of glycerol dehydratase[J]. In-org Biochem, 2003, 93(1-2): 84~91.
[16] O.Brien JR, Raynaud C, Croux C., et al. Insight into the mechanism of the B12-independent glycerol dehydratase from Clostridium butyricum: preliminary biochemical and structural characterization[J]. Biochemistry, 2004, 43(16):4 635~4 645.
[17] 张晓梅,唐雪明,诸葛斌 等. 编码 1,3-丙二醇氧化还原酶同工酶基因 yqhD 的克隆与高效表达[J]. 食品与生物技术学报, 2006, 25(4):77~80.
[18] Zhang XM, Li Y, Zhuge B., et al. Optimization of 1,3-propanediol production by novel recombinant Escherichia coli using response surface methodology[J]. J Chem Technol Biot, 2006, 81:1 075~1 078.
[19] Zhang XM, Li Y, Zhuge B., et al. Construction of novel recombinant Escherichia coli capable of producing 1,3-propanediol and optimization of fermentation parameters by statistical design[J]. World J Microb Biot, 2006, 22(9):945~952.
[20] Malaoui H, Marczak R. Purification and characterization of the 1-3-propanediol dehydrogenase of Clostridium butyricum E5[J]. Enzyme Microb Tech, 2000, 27(6): 399~405.
[21] Ruzheinikov SN, Burke J, Sedelnikova S., et al. Glycerol dehydrogenase. structure, specificity, and mechanism of a family III polyol dehydrogenase[J]. Structure, 2001, 9(9):789~802.
[22] 陈宏文, 聂金峰, 方柏山.克雷伯杆菌1 ,3-丙二醇氧化还原酶的分离纯化及其酶学性质[J],华侨大学学报(自然科学版),2009,30( 1) : 62~66.
[23] 吴家鑫,张国栋,齐鹏 等.微生物法生产1,3-丙二醇的代谢及关键酶研究进展[J],化学通报, 2014 ,77 (12 ):1 171~1 175.
[24] Chen HW, Fang B, Hu ZD. Optimization of process parameters for key enzymes accumulation of l,3-propanediol production from Klebsiella pneumoniae[J]. Biochem Eng J, 2005, 25(l):47~53.
[25] 田平芳,谭天伟. Progress in metabolism and crucial enzymes of glycerol conversion to 1, 3-propanediol[J]. 生物工程学报, 2007, 23(2):201~205.
[26] 黄志华,杜晨宇,王宝光 等. 微生物法生产1 ,3-丙二醇的基因工程研究进展[J].生物加工过程, 2006, 4(2):1~6.
[27] 陈利飞,李猛,马春玲 等. 克雷伯氏菌产1,3-丙二醇ldhA 基因缺失菌株的构建[J]. 生物技术通报, 2015, 31(3):121~126.
[28] Da SG, Mack M, Contiero J. Glycerol:a promising and abundant carbon source for industrial microbiology[J]. Biotechnol Adv, 2009, 27(1):30~39.
[29] Lee SM, Hong WK, Heo WY., et al. Enhancement of 1,3-propanediol production by expression of pyruvate decarboxylase and aldehyde dehydrogenase from Zymomonas mobilis in the acetolactate-synthase-deficient mutant of Klebsiella pneumoniae[J]. J Ind Microbiol Biot, 2014, 41(8):1 259~1 266.
[30] Colin T, Bones A, Moulin G. Inhibition of Clostridium butyricum by 1,3-propanediol and diols during glycerol fermentation [J]. Appl Microbiol Biotechnol, 2000, 54: 201~205.
[31] 方慧英,张成,诸葛斌 等. 产1,3-丙二醇新型基因工程菌的构建[J]. 应用与环境生物学报, 2009, 15(5):708~712.
[32] 马正,饶志明,沈微 等. 一步法产1, 3-丙二醇酿酒酵母基因工程菌的构建[J]. 微生物学报, 2007, 47(4):598-603.

