多排CT评价局部进展期食管鳞癌新辅助化疗后再分期及疗效
史燕杰,陈 颖,李晓婷,王之龙,孙应实
北京大学肿瘤医院暨北京市肿瘤防治研究所医学影像科恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142
·论 著·
多排CT评价局部进展期食管鳞癌新辅助化疗后再分期及疗效
史燕杰,陈 颖,李晓婷,王之龙,孙应实
北京大学肿瘤医院暨北京市肿瘤防治研究所医学影像科恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142
目的评估多排CT对食管鳞癌术前新辅助化疗后再分期的准确性,分析CT对食管癌疗效评价和预后判断的可行性。方法回顾性分析2005年9月至2011年12月在北京肿瘤医院就诊的接受新辅助化疗及手术的135例食管鳞癌患者的临床资料,由2名医师采用CT对新辅助化疗前后的病灶行TN分期,并评价CT肿瘤退缩分级(TRG)和病理TRG。根据术前CT TN分期分为治疗有效(T0- 2N0)、无效(T3- 4N+)和疗效不确定(T3- 4N0或T0- 2N+)3组,比较各组间的生存差异。结果以术后病理T和N分期为金标准,2名医生采用CT诊断治疗后T和N分期的总体准确率分别为50%、54%(κ=0.718,P<0.001)和59%、56%(κ=0.753,P<0.001),一致性均较好。CT诊断TRG的整体准确率仅为27%。生存曲线显示,病理TRG与总生存有显著关联(χ2=8.13,P=0.04),随分级增高,生存变差;CT预测的TRG与总生存无显著关联(χ2=1.17,P=0.286),但表现出分级增高,生存变差的趋势。135例患者中,19 例(14.07%)有效,46例(34.07%)无效,70例(50.37%)疗效不确定。有效组、不确定组和无效组的总生存率分别为71.5%、47.3%和18.5%,其中有效组高于不确定组(χ2=1.518,P=0.63)和无效组(χ2=12.04,P=0.0016),不确定组明显高于无效组(χ2=14.468,P=0.0003)。结论CT对食管癌新辅助化疗后再分期准确性不高。CT TN再分期对评估食管癌新辅助化疗疗效及预测预后有一定的临床应用价值。
多排CT;胸部;肿瘤疗效评估;食管
ActaAcadMedSin,2017,39(1):133-139
局部进展期食管癌患者行术前新辅助放、化疗联合手术治疗能提高其生存期,改善预后[1- 3]。多排CT是临床无创评价食管癌新辅助治疗后分期及疗效的常用手段[4- 6]。然而,由于CT不能区分食管癌新辅助治疗后炎症、纤维化与残留肿瘤组织,因此对食管癌新辅助治疗后再分期的准确性不高。研究显示,CT对食管癌新辅助治疗后疗效评估的敏感度和特异度分别为27%~55%和50%~91%[4,7]。依据CT T分期判断食管癌新辅助治疗后疗效的效能欠佳,CT的主要优势在于判断治疗后转移淋巴结的大小变化[8]。本研究评估了多排CT TN再分期评价新辅助化疗疗效和预后的临床应用价值,以期为今后的临床应用提供参考。
对象和方法
对象2005年9月至2011年12月在北京肿瘤医院就诊的食管鳞癌患者135例,其中,男103例,女32例,平均年龄(59.2±8.3)岁(42~75岁);上段食管癌37例,中段食管癌55例,下段食管癌43例。入选标准:(1)患者接受治疗前经纤维胃镜活检,病理确诊为食管鳞癌;(2)患者接受新辅助化疗;(3)化疗前后均行胸部增强CT检查;(4)化疗前CT分期为T1- 2N+M0或T3- 4aN-/++M0;(5)化疗后患者接受手术切除。排除标准:(1)术后病理为食管腺癌、小细胞癌、混合癌或其他疾病;(2)术前接受过除标准化疗外其他治疗(如放疗);(3)化疗前后影像资料遗失或图像无法满足准确测量;(4)食管多原发癌;(5)手术后30 d内死亡。本研究经北京肿瘤医院伦理委员会批准,并豁免知情同意书。
检查方法采用GE Lightspeed VCT扫描,一次憋气扫描完成,从胸廓入口至肺底,管电压120~140 kV,管电流300 mA,准直64×1.25 mm,螺距1.5∶1。增强扫描使用高压注射器经肘静脉团注非离子型碘对比剂(100 ml Iopromide,Schering,3 ml/s),注药后55 s扫描。原始图像传至AW 4.2影像工作站后处理,重建层厚5 mm,行多平面重建(multiplanar reconstruction,MPR)获得冠状位及矢状位图像。
多排CT评估食管癌分期由2名有经验的影像科医生独立盲法评价新辅助治疗前后的CT图像。
测量指标:食管癌管壁最厚处的厚度,如果管腔闭塞,测量病灶最大径/2;测量所见淋巴结的短径。
分期标准:(1)CT-T0:食管壁增厚<5 mm,无明确纵隔侵犯。(2)CT-T1- 2:食管壁增厚至少5~10 mm,无明确纵隔侵犯。(3)CT-T3:管壁增厚超过10 mm,伴纵隔受侵,邻近组织结构未受侵。(4)CT-T4a:病灶侵犯胸膜、心包及膈肌;T4b为病灶侵犯主动脉、椎体及气管[4]。
转移淋巴结判断标准:锁骨上区淋巴结短径≥5 mm;纵隔及腹部淋巴结短径≥10 mm[9- 11]。
肿瘤退缩分级的影像学评价2名医师参考实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST),比较患者治疗前后CT测量的厚度变化,分成TRG1~4评价肿瘤治疗疗效,分歧较大时引入第3名高年资医生进行仲裁。具体为:(1)肿瘤退缩分级(tumor regression grade,TRG) 1:完全缓解,CT未见食管壁增厚,食管外膜面光滑;(2)TRG2:部分缓解,肿瘤最大径减少至少为50%;(3)TRG3:稳定,肿瘤直径减少小于50%,增加小于25%;(4)TRG 4:进展,病灶增加大于25%[12- 13]。
MDCT TN再分期评价食管癌新辅助化疗后的疗效并判断预后治疗前所有患者CT分期为T1- 2N+或T3- 4aN-/+期,根据患者术前CT的TN分期结果,将T0- 2N0患者评价为治疗有效,T3- 4N+患者评价为治疗无效,其他患者(T3- 4N0或T0- 2N+)认为疗效不确定,计算3组间的生存是否有统计学差异。
新辅助化疗方案新辅助化疗采用含铂二药联合方案:紫杉醇175 mg/m2,d1;顺铂75 mg/m2,d1~d3;21 d为1周期,行1~4个周期。化疗结束后1~2周,患者接受根治性食管癌切除术,术式为胸腹两切口或颈胸腹三切口食管癌切除术,加区域淋巴结清扫。
手术与病理学疗效评价1名有经验的病理科医生重新复阅病理切片对肿瘤病理分级。该医师光学显微镜下观察食管癌手术标本,对食管癌进行T分期。病理TRG分为4级:(1)TRG 1级:未见肿瘤细胞残余;(2)TRG 2级:残余肿瘤比例为1%~10%;(3)TRG 3级:残余肿瘤比例为11%~50%,纤维结构完整;(4)TRG 4、5级:残余肿瘤比例为51%~100%,纤维结构不完整[14]。该病理科医师判断切除淋巴结是否为转移。
患者随访患者自手术后开始2年内每3个月随访1次;随后每半年时间随访1次,持续3年;然后每年随访1次至死亡。记录患者的死亡时间、原因。本研究结局事件为肿瘤相关死亡,其他原因造成的死亡计作患者失访。计算随访时间从化疗后CT检查日期至患者死亡日期,或至最近一次随访日期,记录患者的总生存时间。患者随访日期至2014年6月1日。
统计学处理采用SPSS 22.0统计软件,观察者间一致性行Kappa检验,κ≥0.81表示吻合度优,κ=0.61~0.80为良,κ=0.41~0.60为一般,κ≤0.40为差;生存曲线计算采用Kaplan-Meier 乘积极限法,组间生存时间的比较采用log-rank检验,P<0.05为差异有统计学意义。
结 果
多排CT对食管癌新辅助化疗后再分期的诊断效能以术后病理T分期为金标准,2名医生采用CT诊断T分期的总体准确率分别为50%(68/135)和54%(73/135)(表1),一致性较好(κ=0.718,P<0.001)。观察者1诊断T0、T1- 2、T3及T4a分期的敏感度为21%、42%、69%和50%,特异度为100%、96%、46%和84%,阳性预测值为100%、88%、44%和54%,阴性预测值为89%、74%、70%和94%,准确性为89%、78%、52%和81%。观察者2诊断T0、T1- 2、T3及T4a分期的敏感度为42%、55%、54%和57%,特异度为100%、93%、54%和85%,阳性预测值为100%、79%、47%和58%,阴性预测值为91%、75%、71%和94%,准确性为92%、76%、59%和82%。以术后病理N分期为金标准,2名医生采用CT诊断N分期的总体准确率分别为59%(79/135)和56%(76/135)(表2),一致性较好(κ=0.753,P<0.001);观察者1诊断淋巴结转移的敏感度、特异度、阳性预测值、阴性预测值和准确性分别为81%、56%、48%、78%和59%,观察者2分别为85%、39%、48%、76%和56%。
食管癌新辅助治疗后TRG及其与预后的关系CT诊断TRG的整体准确率仅为27%(37/135)。生存曲线显示,病理TRG与总生存有显著关联(χ2=8.13,P=0.04),随分级增高,生存变差(图1)。CT预测的TRG与总生存无显著关联(χ2=1.17,P=0.286),但表现出分级增高,生存变差的趋势(图2)。
CT TN再分期评价食管癌新辅助治疗后疗效和判断患者预后根据食管癌新辅助治疗后CT TN分期结果,135例患者中,19 例(14.07%)为有效(T0- 2N0),46例(34.07%)无效(T3- 4N+),70例(50.37%)疗效不确定(T3- 4N0或T0- 2N+)。生存曲线显示,有效组、不确定组和无效组的总生存率分别为71.5%、47.3%和18.5%,其中有效组高于不确定组(χ2=1.518,P=0.63)和无效组(χ2=12.04,P=0.0016),不确定组明显高于无效组(χ2=14.468,P=0.0003)(图3)。
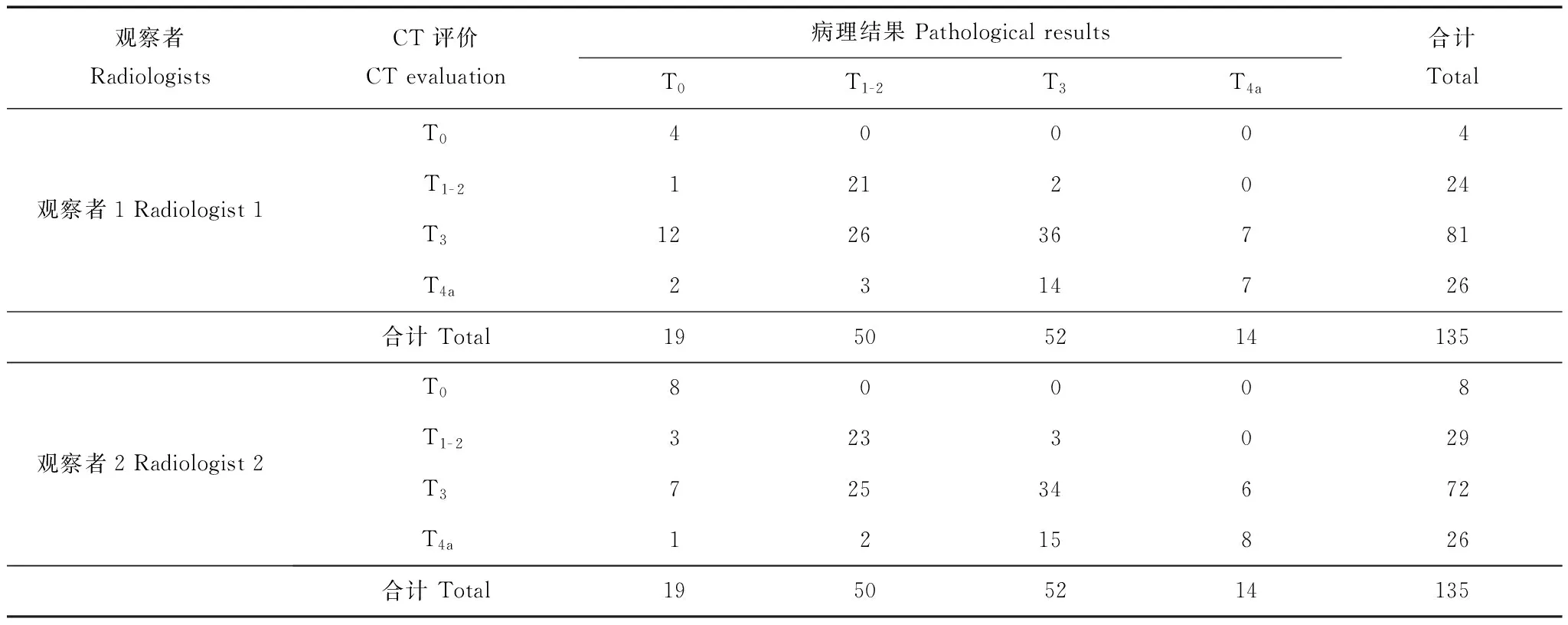
表1 食管癌新辅助化疗后CT诊断T分期与病理T分期对照Table 1 Post-therapeutic T staging of CT comparing with pathological results
T:肿瘤分期
T:tumor stage

表2 食管癌新辅助化疗后CT诊断N分期与病理N分期对照Table 2 Post-therapeutic N staging of CT comparing to pathological results
N:淋巴结分期
N:nodal stage
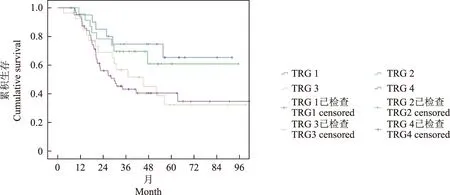
TRG:肿瘤退缩分级
TRG:tumor regression grade
图1 不同病理诊断TRG的135例食管鳞癌患者新辅助化疗后的Kaplan-Meier生存曲线
Fig 1 Kaplan-Meier survival curve in 135 patients with esophageal squamous carcinoma after neoadjuvant chemotherapy by pathological TRG
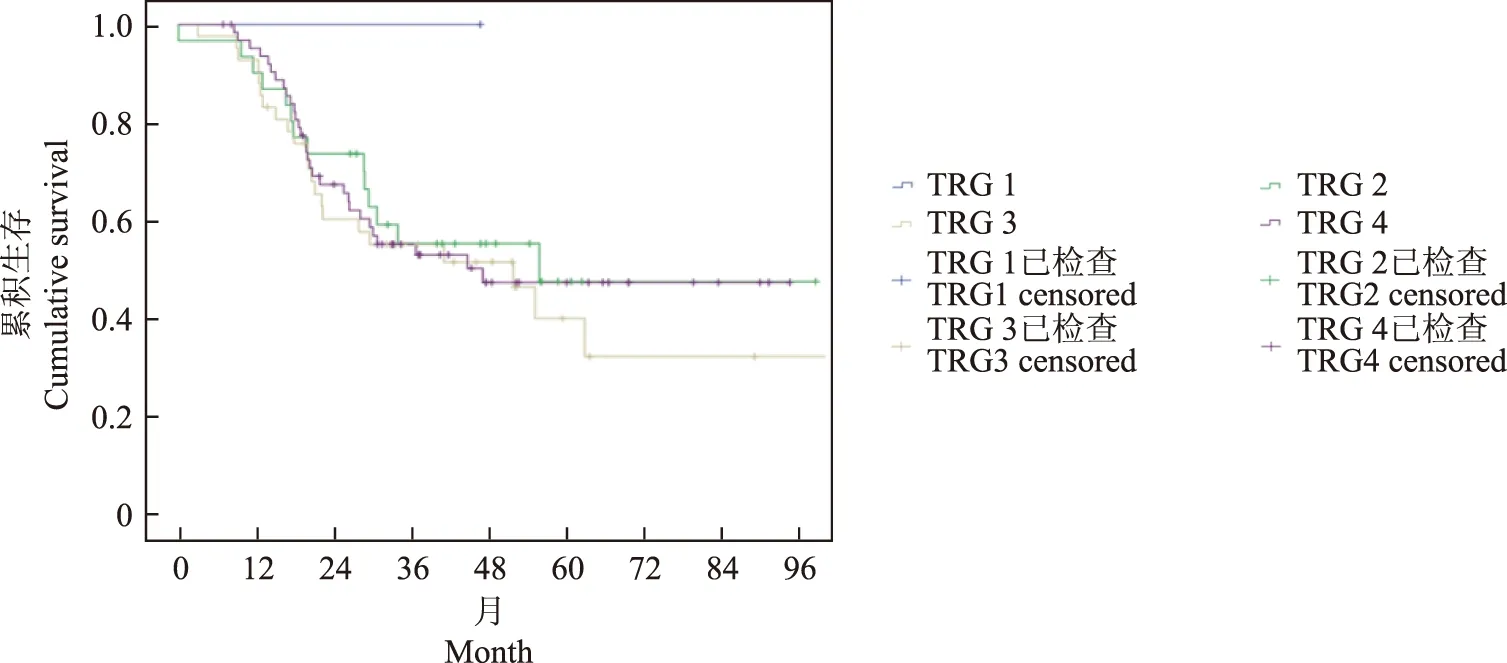
图2 不同CT TRG的135例食管鳞癌患者新辅助化疗后的Kaplan-Meier生存曲线
Fig 2 Kaplan-Meier survival curve in 135 patients with esophageal squamous carcinoma after neoadjuvant chemotherapy by CT TRG
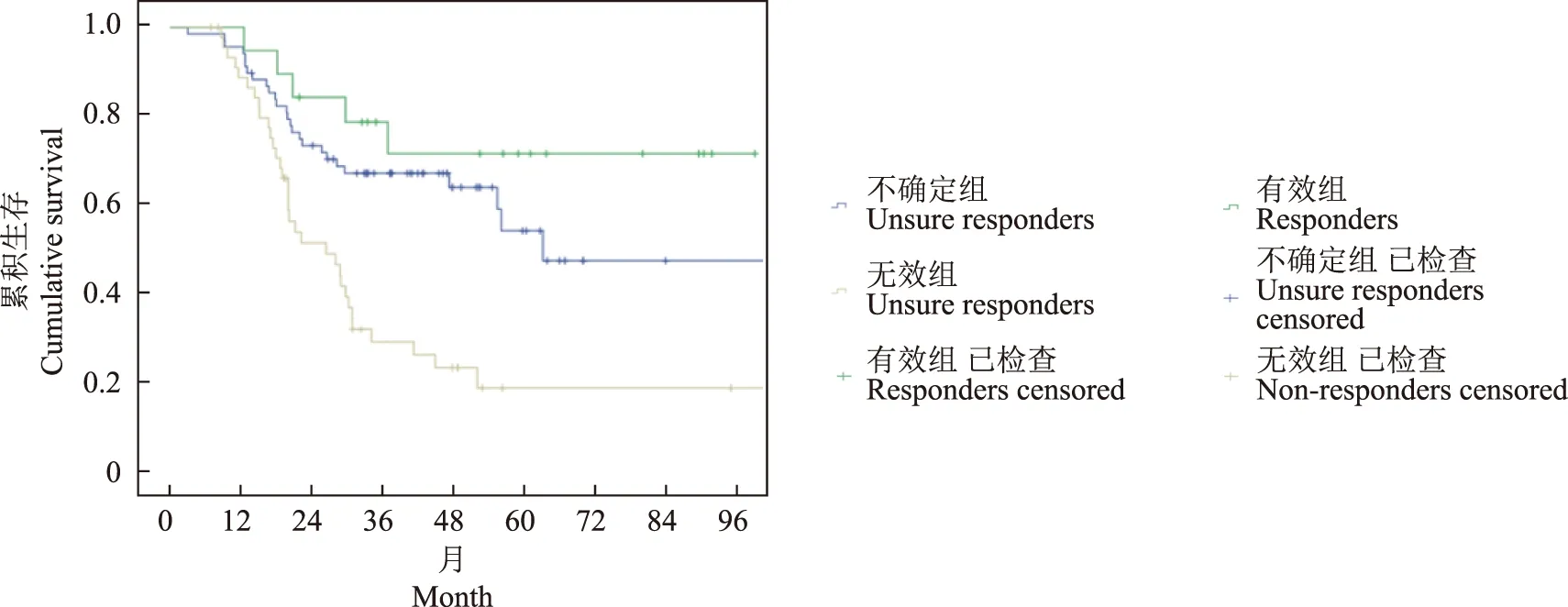
图3 不同CT TN再分期的135例食管鳞癌患者新辅助化疗后的Kaplan-Meier生存曲线
Fig 3 Kaplan-Meier survival curve in 135 patients with esophageal squamous carcinoma after neoadjuvant chemotherapy by tumor and nodal staging from CT
讨 论
术前新辅助治疗是局部进展期食管癌较为合理的治疗方式。食管癌主要包括鳞癌和腺癌两种病理类型,食管鳞癌行术前新辅助放化疗或化疗的总体生存高于腺癌,从新辅助放化疗中受益更多,应该对食管鳞癌及腺癌分别研究[15]。以往关于食管癌新辅助放化疗后再分期和疗效评价的研究,研究病例同时包括食管鳞癌和腺癌,以腺癌较多[4- 6]。本研究纳入135例行术前新辅助化疗食管鳞癌患者,更有利于探讨CT对食管鳞癌新辅助化疗后疗效评价的价值。
以往研究显示,多排螺旋CT对食管癌新辅助治疗后再分期的准确性不高,约为34.0%~57.6%[4,6,16],其原因主要为:(1)多层螺旋CT不能很好的显示食管壁分层结构,对T1- 3判断敏感性及特异性不高[9];(2)食管癌新辅助治疗后,一些点状残余病灶位于食管壁深层结构,病理判断为T2或T3,而影像学仅表现为食管壁轻度增厚,判断为T1- 2[17];(3)多排螺旋CT不能很好地鉴别新辅助放化疗后残留肿瘤组织、炎症反应及瘢痕组织[18]。本研究结果显示,两名观察者对食管癌新辅助化疗后T分期准确性分别为50%和54%,N分期的准确性分别为59%和56%,与以往研究结果相似。
Konieczny等[4]研究显示,CT预测TRG的准确性仅为8%。Cerfolio等[5]研究发现,CT预测病理完全缓解的准确性为71%,低于PET/CT诊断效能(89%)。本研究结果显示,与病理TRG对照,CT TRG评估食管癌新辅助化疗疗效准确性不高,且CT预测的TRG与总生存无显著关联。推测CT预测TRG准确性较低的原因可能为CT主要是通过测量治疗前后病灶厚度变化来判断肿瘤疗效,而新辅助治疗后肿瘤退缩常伴有内部炎症及纤维化,可表现为肿瘤厚度无变化,导致CT评估食管癌化疗疗效准确性不高[18]。
术前新辅助治疗后应用增强CT筛选出对新辅助治疗有效和无效的食管癌患者对临床治疗方案的制定更有意义;无效患者不能从新辅助治疗中受益,需要接受手术或改变放化疗方案,而有效患者可以继续行新辅助治疗,如果能达到完全缓解可以避免不必要的手术[17,19]。单纯依据CT T分期或病灶大小变化判断食管癌新辅助治疗后疗效的效果欠佳。而CT在判断治疗后转移淋巴结大小变化方面有一定的优势[8]。本研究根据食管癌新辅助治疗后的多排CT TN分期,对食管癌术前新辅助化疗疗效进行评估,结果显示有效组与无效组患者占48%,即CT能对近一半的食管癌患者进行较准确的评效。有效组、无效组及不确定组3组间的生存有明显性差异,提示CT TN再分期能够预测食管癌患者新辅助治疗后的总生存,在食管癌疗效评价中有一定的临床应用价值。
本研究的局限性在于:(1)增强CT测量的食管癌厚度没有与手术病理大体标本做比较;(2)为单中心回顾性研究;(3)本研究中CT对约52%患者(T3- 4N0或T0- 2N+)新辅助化疗效果无法做出准确的评价,针对这部分患者能否结合MRI、超声内镜或PET-CT来提高其疗效评估的准确性,是我们今后研究需要进一步解决的问题。
综上,本研究结果显示,CT对食管鳞癌术前新辅助化疗后再分期准确性不高,但CT TN再分期对评估食管癌新辅助化疗疗效有一定的临床意义,对食管鳞癌患者术前新辅助化疗后总生存有一定的预测价值。
[1]Sjoquist KM,Burmeister BH,Smithers BM,et al. Survival after neoadjuvant chemotherapy or chemoradiotherapy for resectable oesophageal carcinoma:an updated meta-analysis[J]. Lancet Oncol,2011,12(7):681- 692.
[2]Napier KJ,Scheerer M,Misra S. Esophageal cancer:a review of epidemiology,pathogenesis,staging workup and treatment modalities[J]. World J Gastrointest Oncol,2014,6 (5):112- 120.
[3]Medical Research Council Oesophageal Cancer Working Group. Surgical resection with or without preoperative chemotherapy in oesophageal cancer:a randomised controlled trial[J]. Lancet,2002,359(9319):1727- 1733.
[4]Konieczny A,Meyer P,Schnider A,et al. Accuracy of multidetector-row CT for restaging after neoadjuvant treatment in patients with oesophageal cancer[J]. Eur Radiol,2013,23(9):2492- 2502.
[5]Cerfolio RJ,Bryant AS,Ohja B,et al. The accuracy of endoscopic ultrasonography with fine-needle aspiration,integrated positron emission tomography with computed tomography,and computed tomography in restaging patients with esophageal cancer after neoadjuvant chemoradiotherapy[J]. J Thorac Cardiovasc Surg,2005,129(6):1232- 1241.
[6]Westerterp M,van Westreenen HL,Reitsma JB,et al. Esophageal cancer:CT,endoscopic US,and FDG PET for assessment of response to neoadjuvant therapy—systematic review[J]. Radiology,2005,236(3):841- 851.
[7]Griffin Y. Esophageal cancer:role of imaging in primary staging and response assessment post neoadjuvant therapy[J]. Semin Ultrasound CT MR,2016,37(4):339- 351.
[8]Chang WL,Wang WL,Chung TJ,et al. Response evaluation with endoscopic ultrasound and computed tomography in esophageal squamous cell carcinoma treated by definitive chemoradiotherapy[J]. J Gastroenterol Hepatol,2015,30(3):463- 469.
[9]Hong SJ,Kim TJ,Nam KB,et al. New TNM staging system for esophageal cancer:what chest radiologists need to know[J]. Radiographics,2014,34(6):1722- 1740.
[10]Dorfman RE,Alpern MB,Gross BH,et al. Upper abdominal lymph nodes:criteria for normal size determined with CT[J]. Radiology,1991,180(2):319- 322.
[11]Fultz PJ,Feins RH,Strang JG,et al. Detection and diagnosis of nonpalpable supraclavicular lymph nodes in lung cancer at CT and US[J]. Radiology,2002,222(1):245- 251.
[12]Therasse P,Arbuck SG,Eisenhauer EA,et al. New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer,National Cancer Institute of United States,National Cancer Institute of Canada[J]. J Natl Cancer Inst,2000,92(3):205- 216.
[13]Jones DR,Parker LA Jr,Detterbeck FC,et al. Inadequacy of computed tomography in assessing patients with esophageal carcinoma after induction chemoradiotherapy[J]. Cancer,1999,85(5):1026- 1032.
[14]Mandard AM,Dalibard F,Mandard JC,et al. Pathologic assessment of tumor regression after preoperative chemoradiotherapy of esophageal carcinoma[J]. Cancer,1994,73(11):2680- 2686.
[15]Lin D,Leichman L. The current status of neoadjuvant therapy for esophageal cancer[J]. Semin Thorac Cardiovasc Surg,2014,26(2):102- 109.
[16]Sloof GW. Response monitoring of neoadjuvant therapy using CT,EUS,and FDG-PET[J]. Best Pract Res Clin Gastroenterol,2006,20(5):941- 957.
[17]Griffin JM,Reed CE,Denlinger CE. Utility of restaging endoscopic ultrasound after neoadjuvant therapy for esophageal cancer[J]. Ann Thorac Surg,2012,93(6):1855- 1859.
[18]Kim TJ,Kim HY,Lee KW,et al. Multimodality assessment of esophageal cancer:preoperative staging and monitoring of response to therapy[J]. Radiographics,2009,29(2):403- 421.
[19]Castoro C,Scarpa M,Cagol M,et al. Complete clinical response after neoadjuvant chemoradiotherapy for squamous cell cancer of the thoracic oesophagus:Is surgery always necessary[J]. J Gastrointest Surg,2013,17(8):1375- 1381.
Multidetector CT for Restaging Locally Advanced Esophageal Squamous Cell Carcinoma and Assessing Therapeutic Response to Neoadjuvant Chemotherapy
SHI Yanjie,CHEN Ying,LI Xiaoting,WANG Zhilong,SUN Yingshi
Key Laboratory of Carcinognenesis and Translational Research of Ministry of Education,Department of Radiology,Peking University Cancer Hospital & Institute,Beijing 100142,China
SUN Yingshi Tel:010- 88196822,E-mail:sys27@163.com
Objective To assess the diagnostic accuracy of multidetector CT (MDCT) for restaging of patients with esophageal squamous cell carcinoma (SCC) after neoadjuvant chemotherapy and determine the feasibility of CT for assessing the treatment response and evaluating the prognosis. Methods Totally 135 patients with esophageal SCC who had received neoadjuvant treatment and surgery in Beijing Cancer Hospital from September 2005 to December 2011 were enrolled in this study. TN staging was performed using CT for lesions before and after neoadjuvant treatment by two radiologists,and the tumor regression grade (TRG) and pathological TRG were also assessed. Based on preoperative CT TN restaging results,the patients were defined as responders with T0- 2N0after therapy,non- responders with T3- 4N+,and patients with undefined response (T3- 4N0or T0- 2N+). Results The accuracy of T and N restaging using CT was 50%,54% (κ=0.718,P<0.001) and 59%,56% (κ=0.753,P<0.001) by two radiologists,respectively. TRG from CT was predicted correctly in 27% of patients. Pathological TRG was an accurate predictor of survival (χ2=8.13,P=0.04). There was no significant trend toward better survival for lower CT TRG (χ2=1.17,P=0.286). Among 135 patients with esophageal cancer,19 patients(14.07%) were responders ,46 patients(34.07%) were non-responders,and 70 patients (50.37%)were patients with undefined response . The overall survival rates of responders,non-responders and patients with undefined response were 71.5%,47.3%,and 18.5%,respectively. The overall survival of responders was better than that of patients with undefined response (χ2=1.518,P=0.63) and non-responders(χ2=12.04,P=0.0016),but the overall survival of patients with undefined response was better than that of non-responders (χ2=14.468,P=0.0003). Conclusions MDCT restaging after neoadjuvant treatment can not accurately predict pathological stage in esophageal SCC. The CT T and N restaging has certain clinical value in assessing the response to neoadjuvant chemotherapy in patients with esophageal cancer and predicting the prognosis.
multidetector CT;thorax;tumor response;esophagus
国家自然科学基金(81471640、81371715)Supported by the National Natural Sciences Foundation of China (81471640,81371715)
孙应实 电话:010- 88196822,电子邮件:sys27@163.com
R445.3
A
1000- 503X(2017)01- 0133- 07
10.3881/j.issn.1000- 503X.2017.01.022
2016- 11- 04)

