高原不同海拔暴露对肺通气功能及代偿能力的影响
胡明冬 李琦 贺斌峰 王丹 刘刚 徐静 刘双林 王关嵩 黄岚 徐剑铖
·论著·
高原不同海拔暴露对肺通气功能及代偿能力的影响
胡明冬 李琦 贺斌峰 王丹 刘刚 徐静 刘双林 王关嵩 黄岚 徐剑铖
目的探讨急性暴露不同海拔的平原人群肺通气功能的变化情况以及潜在的机制。 方法从急进高原的某部官兵中筛选出100例未出现急性高原病的受试者,对其在平原(300 m)、海拔3 700 m和4 100 m的高原地区分别进行肺通气功能检测、6 min步行试验和采集空腹血,利用ELISA检测血浆低氧诱导因子-1α(HIF-1α)和内皮素-1(ET-1)的水平,连续监测法检测血浆血管紧张素转换酶(ACE)的活性。对不同海拔高度受试者用力肺活量(FVC)和6 min行走距离进行相关性分析。结果海拔3 700 m和4 200 m时受试者的FVC、6 min行走的距离显著低于在平原时(P<0.05),并且在4 200 m时受试者的FVC和6 min行走的距离较在3 700 m也显著降低(P<0.05);在4 200 m时受试者的FEV1、6 min步行试验后呼吸频显著高于在平原(300 m)时(P<0.05)。受试者在海拔300 m和3 700 m之间以及在海拔300 m和4 200 m之间FVC的改变量和6 min行走距离的该变量呈正相关。海拔3 700 m和4 200 m时受试者的ET-1显著高于在平原(300 m)时(P<0.05),并且在4 200 m时受试者的血浆ET-1水平较在3 700 m也显著升高(P<0.05);在4 200 m和3 700 m时受试者的HIF-1α水平和ACE活性著高于在平原(300 m)时(P<0.05)。结论急性暴露高海拔的环境使肺通气功能下降,并伴随心肺代偿能力的下降,其可能是由于肺间质少量的液体储留所致。
急性低氧暴露; 肺通气功能; 6 min步行试验
高原环境对肺通气功能的影响,过去也有研究。但是这些研究要么基于低压氧舱的模拟环境,要么用登山者的数据或受试者在承担体力劳动的情况下采集的数据[1-4]。显然,模拟的高原环境只能模拟出高原环境下的缺氧和低气压,但这二者并不能全面反应出高原环境的真实情况。用登山者作的研究也不能排除运动对肺通气功能的影响,运动医学的研究已经表明运动后肺间质有轻微的液体储留,这将影响到肺通气功能,因此用登山运动员的数据可能导致结果的偏差[5-7]。为了更好的理解急性暴露的高原环境下对肺通气功能的变化,本研究对急进高原的受试者在不同海拔高度的肺通气功能和心肺代偿能力进行监测,以期探明急性低氧暴露对肺功能的影响以及可能的机制。
对象与方法
一、研究对象
筛选某部从低海拔急进拉萨的干部战士100名,均为男性,年龄18~35岁,平均年龄25.1岁。进高原前行常规体检正常,在低海拔地区可正常参加强体力劳动。受试者24 h内急进至海拔3 700 m高原,停留1 d后到达海拔4 200 m驻训地。受试者在急性高原暴露中均未发生急性高原病,如高原肺水肿和高原脑水肿。
二、研究方法
1. 肺通气功能检测:利用便携式肺功能检测仪S-980A Ⅲ按照操作要求检测肺通气功能指标FVC、FEV1、FEV1%和FEV1/FVC。受试者按照要求进行3次通气功能检测,记录最佳值。
2. 6 min步行试验(6 minute walking test, 6MWT):在平坦的地面划出一段长达30.5 m的直线距离,两端各置一椅作为标志。受试者在其间往返走动,步履缓急由患者根据自己的体能决定。在旁监测的人员每 2 min报时一次。6 min步行完成后计算受试者的移动距离,并评估呼吸频率和经皮检测SaO2。
3. 受试者血浆的采集和保存:采集受试者在不同海拔高度时空腹静脉血(肝素抗凝),以离心半径8 cm 4 000 r/min离心10 min,吸出上层血浆,标记后保存于-80°冰箱,统一进行检测。
4. ELISA检测血浆低氧诱导因子1α (hypoxia inducible factor-1α, HIF-1α)和内皮素-1(endothelin-1, ET-1)水平,人血浆HIF-1α、ET-1水平ELISA检测试剂盒购自美国R&D公司。血浆HIF-1α、ET-1检测简要步骤如下:将50 μl血浆和100 μl配置好的各个浓度标准液分别加入样品孔中,室温孵育1 h;弃去液体后洗涤3次,加入检测抗体,室温孵育1 h;洗板后加入酶标抗体,室温孵育20 min,再加入显色剂后避光室温孵育15 min,加入终止剂后,在酶标仪450 nm处检测各个样本的吸光度值,并换算成浓度。
5. 连续监测法检测血浆血管紧张素转换酶(angiotensin converting enzyme, ACE)的活性,血浆ACE活性检测试剂盒购自南京建成生物工程研究所。检测简要步骤:125 μl血浆、标准品和双蒸水分别加入1 ml工作液中,37 ℃孵育180 s后,340 nm波长连续测定300 s,计算ΔA/min,以空白孔调零,计算ACE活力。
三、统计学方法
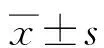
结 果
一、急性高原暴露对肺通气功能的影响
对100例受试者在不同海拔高度的肺通气功能进行检测,发现受试者在300 m、3 700 m和4 200 m时的FVC分别为(4.50±0.31)L、(4.12±0.27)L、(3.89±0.16) L,FEV1分别为(3.56±0.28) L、(3.42±0.32)L、(3.29±0.32)L,FEV1%分别为(75.6±2)%、(77.4±3)%、(76.7±2.4)%,FEV1/ FVC分别为(84.90±3.00)%、(85.2±2.8)%、(84.5±2.6)%。统计分析显示,FVC随着海拔高度的升高而逐渐下降,海拔3 700 m和4 200 m时受试者的FVC显著低于在平原(300 m)时(P<0.05),并且在4 200 m时受试者的FVC较在3 700 m也显著降低(P<0.05);当在4 200 m时受试者的FEV1著低于在平原(300 m)时(P<0.05),但在4 200 m和3 700 m时的FEV1无显著差异(P>0.05);FEV1%和FEV1/FVC在三个海拔间均无显著差异(P>0.05),见图1。
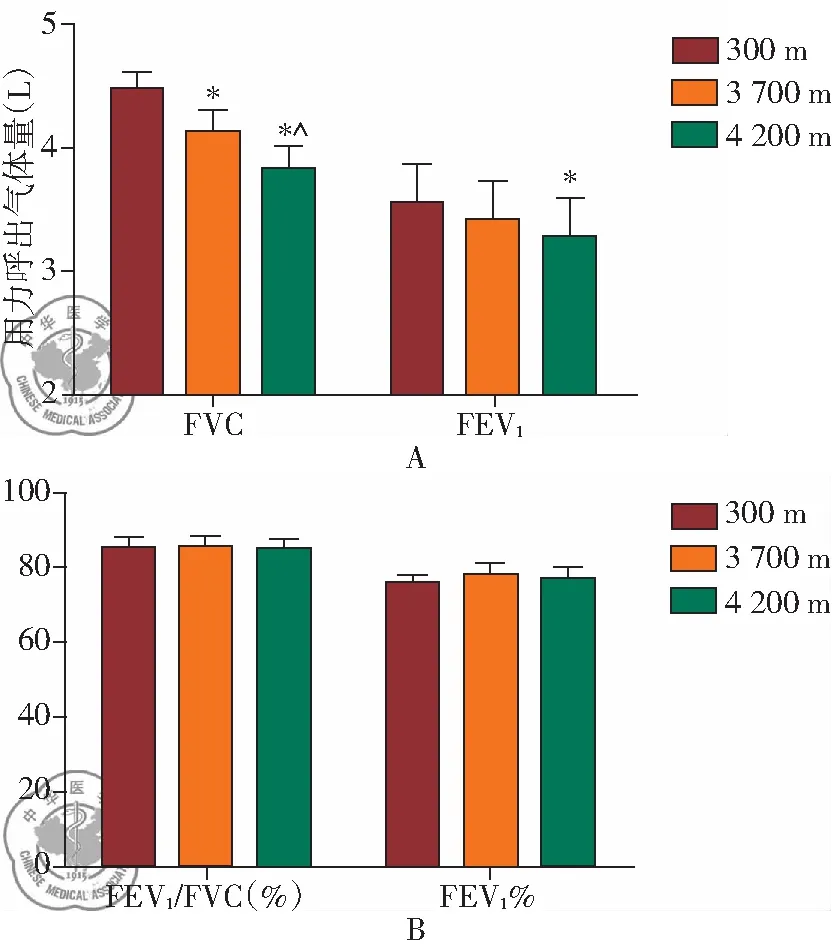
图1 不同海拔对肺功能的影响;注:*: 与在海拔3 700 m时测量值比较,P<0.05;^:与在海拔300 m时测量值比较,P<0.05
二、急性高原暴露对肺代偿能力的影响
对100例受试者在不同海拔高度进行6MWT检测,见表1,发现受试者在行走距离随着海拔的升高而显著下降。受试者在海拔3 700 m和4 200 m时6 min行走的距离显著低于在平原时(P<0.05),并且在海拔4 200 m时受试者行走的距离较在海拔3 700 m时明显缩短(P<0.05)。同样,受试者在海拔3 700 m和4 200 m时6MWT测试后呼吸频率、SaO2均显著低于在平原时(P<0.05),但受试者在海拔3 700 m和4 200 m时呼吸频率、SaO2无显著差异(P>0.05)。
此外,对不同海拔间的行走距离之差和FVC的变化量进行相关性分析,发现在海拔300 m和3 700 m时以及在海拔300 m和4 200 m以及3 700 m和4 200 m之间时FVC间的改变量和6 min行走距离的该变量呈正相关,既随着海拔升高,FVC的下降可能导致肺代偿能力下降,见表2。
三、急性高原暴露对对受试者血浆不同海拔受试者血浆HIF-1α、ET-1和ACE的水平
对100例受试者在不同海拔高度血浆中HIF-1α、ET-1和ACE的水平进行检测,见图2,结果显示,受试者在300 m、3 700 m和4 200 m时的血浆HIF-1α水平分别为(42.12±4.76)pg/L、(103.49±7.34) pg/L、(105.34±3.76) pg/L,血浆ET-1水平分别为(30.34±2.85)ng/L、(51.45±6.45)ng/L、(59.29±5.12) ng/L,血浆ACE活性分别为(34.21±6.34)U/L、(64.54±4.45)U/L、(65.34±5.35) U/L。统计分析发现,血浆ET-1水平随着海拔的升高而显著升高:海拔3 700 m和4 200 m时受试者的ET-1显著高于在平原(300 m)时(P<0.05),并且在4 200 m时受试者的血浆ET-1水平较在3 700 m也显著升高(P<0.05);在4 200 m和3 700 m时受试者的HIF-1α水平和ACE活性著高于在平原(300 m)时(P<0.05),但在4 200 m和3 700 m时的两者均无显著差异(P>0.05)。

表1 受试者在不同海拔6MWT后的生理参数
注:a与在海拔300 m时测量值比较,P<0.05;b:与在海拔300 m米时测量值比较,P<0.05
讨 论
本研究发现受试者急性暴露于高原,其肺功能和6 min行走的距离随着海拔的升高和显著降低,并且两者的降低程度呈正相关,提示肺功能降低直接影响了受试者的活动能力。此外,本研究发现急性暴露于高原的受试者血浆中HIF-1α、ET-1和ACE显著升高,说明肺上皮和血管功能有一定的损伤。因此,推测肺上皮和血管功能的紊乱,导致FVC的降低,进而影响了受试者的活动能力。

表2 不同海拔6 min步行试验行走距离和FVC改变量的相关性分析
注:变化1:受试者在海拔300 m和3 700 m测量值的改变量;变化2:受试者在海拔3 700 m和4 200 m测量值的改变量;变化3:受试者在海拔300 m和4 200 m测量值的改变量;a: 试验行走距离和FVC改变量有显著相关性,P<0.05
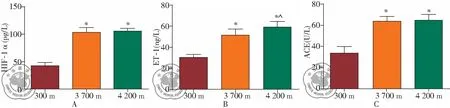
图2 不同海拔对受试者血浆不同海拔受试者血浆HIF-1α、ET-1和ACE的水平;注:*: 与在海拔3 700 m米时测量值比较,P<0.05;^:与在海拔300 m米时测量值比较,P<0.05
研究表明在急性暴露于高高海拔地区,肺通气功能FVC显著下降,可能是由肺间质液体潴留所造成。1974年,Hales和Kazemi等[8]发现轻微的甚至连临床也不能检测到的肺水肿也会导致肺通气功能的下降。随后1979, Maron等[9]在研究长跑运动员肺通气功能的变化时发现经过长跑运动后肺通气功能也在下降,并且这种下降是伴随闭合气量的增加,闭合气量的增加就是由于肺间质液体储留导致的小气道过早闭合而产生的。对于高原暴露是否会导致肺间质液体的潴留,这一问题一直吸引了很多学者的关注,并且进行了很多的探索。Kronenberg等[10]发现了高原暴露能提高肺动脉的压力并引起肺泡的血气交换功能障碍,因为后者的发现,他首次提出了高原暴露可能引起肺间质液体潴留的。Grissom等[11]也发现了高原暴露后导致肺泡—动脉氧分压差增大的现象,他也把这一现象归结于肺间质液体潴留的发生。Welsh等[12]在一个模拟的高原环境下首次观察到了肺间质液体潴留的现象,并且也发现了通气血流比值失调的现象,这一发现后来被很多的学者所观察到。George等[13]发现在一群高原旅游的人群中,有17%的人发生了肺部X线能够检测到的液体潴留。Marlowe等[14]用肺泡灌洗的方法也发现了高原暴露导致肺间质液体潴留的证据。Pratali等[15]用胸部超声的方法同样也发现了液体在肺间质潴留的证据。
此外,除了肺间质液体储留外呼吸肌疲劳也可能是肺通气功能下降的原因之一。Deboeck等[16]观察到能代表呼吸肌功能的MIP等指标的下降,并且它们的下降与FVC的下降存在明显的相关关系。Sharma等[17]也观察到了这一现象。但是如果呼吸肌功能的下降是导致肺通气功能下降的主要原因的话,那么在高原环境下就可以观察到剩余气量的增加,二氧化碳的潴留等现象,但是包括Welsh等[12]的研究都没有观察到以上的现象,并且就算在运动的过程中也没有观察到以上的现象。因此呼吸肌功能的变化是否是肺通气功能变化的主要原因还有待进一步研究。
对于高原暴露为什么会引起肺间质的液体潴留,目前的具体机制还不是很清楚,可能和以下的原因有关:肺循环血量的增加、肺毛细血管压力的升高[25]及基因、缺氧等因素有对肺上皮细胞钠通道的影响[18]。我们的研究发现,急性高原暴露使血浆中HIF-1α、ET-1显著升高。ET-1是有效的血管收缩剂[19]。研究表明,在低氧暴露下血管中HIF-1α表达显著升高,从而上调ET-1的表达[20]。有研究指出急性低氧暴露可导致肺和血浆中ET-1的水平升高,并且其升高水平与肺损伤情况相平行[21]。同样,本研究还观察到ACE在急性暴露中明显升高。ACE属含锌金属蛋白酶类,主要由血管上皮细胞合成,表达局限于肺、肾血管系 统和脑、小肠、胃和肺泡巨噬细胞。其是肾素-血管紧张素-醛固酮系统(rein-angiotensin-aldosterone-system,RAAS)的一个重要部分,是机体中一种强的缩血管活性物质[22]。当机体进行高原,受到低氧刺激后,激活RAAS系统,上调ACE的水平,进而使血管紧张素增多,促进水钠潴留和血管渗透压增高,使肺间质的出现液体潴留[23-28]。因此,推测在低氧暴露下机体肺血管功能尚处在代偿期时,仅会有少量的肺间质液体潴留,其并引起肺水肿等严重高原病的出现,但已经对肺通气功能产生影响。因此,连续监测肺功能可用于判断受试者在高原的适应情况,既肺通气功能改善可视为受试者对高原的适应,而肺通气功能的显著降低则可能意味着高原的不适应或不完全适应,应警惕急性高原病的发生。
综上所述,受试者急进高原可导致肺通气功能的显著下降,并且伴随着受试者行动能力的降低,可能是由于低氧导致肺血管的功能紊乱,出现少量的肺间质液体潴留所致。其确切机制仍需进一步研究。
1 Macnab AJ, Vachon J, Susak LE, et al. In-flight stabilization of oxygen saturation by control of altitude for severe respiratory insufficiency[J]. Aviat Space Environ Med, 1990, 61(9): 829-832.
2 Connolly DM, D′Oyly TJ, McGown AS, et al. Lung volumes, pulmonary ventilation, and hypoxia following rapid decompression to 60,000 ft (18,288 m)[J]. Aviat Space Environ Med, 2013, 84(6): 551-559.
3 Compte-Torrero L, Botella de MJ, de Diego-Damia A, et al. Changes in spirometric parameters and arterial oxygen saturation during a mountain ascent to over 3000 meters[J]. Arch Bronconeumol, 2005, 41(10): 547-552.
4 Montserrat JM, Ricard T, Mateu M, et al. Respiratory response to chemical stimuli and exercise capacity under conditions of acute hypoxia in elite mountain climbers[J]. Rev Esp Fisiol, 1991, 47(4): 193-199.
5 Pingitore A, Garbella E, Piaggi P, et al. Early subclinical increase in pulmonary water content in athletes performing sustained heavy exercise at sea level: ultrasound lung comet-tail evidence[J]. Am J Physiol Heart Circ Physiol, 2011, 301(5): H2161-H2167.
6 Thompson EB, Farrow L, Hunt JE, et al. Brachial artery characteristics and micro-vascular filtration capacity in rock climbers[J]. Eur J Sport Sci, 2015, 15(4): 296-304.
7 Wong EK, Ng GY. Strength profiles of shoulder rotators in healthy sport climbers and nonclimbers[J]. J Athl Train, 2009, 44(5): 527-530.
8 Hales CA, Kazemi H. Hypoxic vascular response of the lung: effect of aminophylline and epinephrine[J]. Am Rev Respir Dis, 1974, 110(2): 126-132.
9 Maron MB, Hamilton LH, Maksud MG. Alterations in pulmonary function consequent to competitive marathon running[J]. Med Sci Sports, 1979, 11(3): 244-249.
10 Kronenberg RS, Safar P, Leej, et al. Pulmonary artery pressure and alveolar gas exchange in man during acclimatization to 12,470 ft[J]. J Clin Invest, 1971, 50(4): 827-837.
11 Grissom CK, Weaver LK, Clemmer TP, et al. Theoretical advantage of oxygen treatment for combat casualties during medical evacuation at high altitude[J]. J Trauma, 2006, 61(2): 461-467.
12 Welsh CH, Wagner PD, Reeves JT, et al. Operation Everest. Ⅱ: Spirometric and radiographic changes in acclimatized humans at simulated high altitudes[J]. Am Rev Respir Dis, 1993,147(5):1239-1244.
13 Cremona G, Asnaghi R, Baderna P, et al. Pulmonary extravascular fluid accumulation in recreational climbers: a prospective study[J]. Lancet, 2002, 359(9303): 303-309.
14 Muza SR, Jackson R, Rock PB, et al. Interaction of chemical defense clothing and high terrestrial altitudes on lift/carry and marksmanship performance[J]. Aviat Space Environ Med, 2000, 71(7): 668-677.
15 Pratali L, Cavana M, Sicari R, et al. Frequent subclinical high-altitude pulmonary edema detected by chest sonography as ultrasound lung comets in recreational climbers[J]. Crit Care Med, 2010, 38(9): 1818-1823.
16 Deboeck G, Moraine JJ, Naeije R. Respiratory muscle strength may explain hypoxia-induced decrease in vital capacity[J]. Med Sci Sports Exerc, 2005, 37(5): 754-758.
17 Sharma S, Brown B. Spirometry and respiratory muscle function during ascent to higher altitudes[J]. Lung, 2007, 185(2): 113-121.
18 Dunham-Snary KJ, Danchen W, Sykes EA, et al. Hypoxic pulmonary vasoconstriction: from molecular mechanisms to medicine[J]. Chest, 2016, doi: 10.1016/j.chest.2016.09.001.
19 Endo A, Ayusawa M, Minato M, et al. Endogenous nitric oxide and endothelin-1 in persistent pulmonary hypertension of the newborn[J]. Eur J Pediatr, 2001, 160(4): 217-222.
20 Hu R, Dai A, Tan S. Hypoxia-inducible factor 1 alpha upregulates the expression of inducible nitric oxide synthase gene in pulmonary arteries of hyposic rat[J]. Chin Med J (Engl), 2002, 115(12): 1833-1837.
21 Droma Y, Hayano T, Takabayashi Y, et al. Endothelin-1 and interleukin-8 in high altitude pulmonary oedema[J]. Eur Respir J, 1996, 9(9): 1947-1949.
22 Bernardi S, Michelli A, Zuolo G, et al. Update on RAAS Modulation for the treatment of diabetic cardiovascular disease[J]. J Diabetes Res, 2016,2016: 8917578.
23 Masschelein E, Puype J, Broos S, et al. A genetic predisposition score associates with reduced aerobic capacity in response to acute normobaric hypoxia in lowlanders[J]. High Alt Med Biol, 2015, 16(1): 34-42.
24 Favier R, Spielvogel H, Desplanches D, et al. Maximal exercise performance in chronic hypoxia and acute normoxia in high-altitude natives[J]. J Appl Physiol, 1995, 78(5): 1868-1874.
25 Brutsaert TD. Population genetic aspects and phenotypic plasticity of ventilatory responses in high altitude natives[J]. Respir Physiol Neurobiol, 2007, 158(2-3): 151-160.
26 Calbet JA, Rdegran G, Boushel R, et al. On the mechanisms that limit oxygen uptake during exercise in acute and chronic hypoxia: role of muscle mass[J]. J Physiol, 2009, 587(2): 477-490.
27 Masschelein E, Van Thienen R, Thomis M, et al. High twin resemblance for sensitivity to hypoxia[J]. Med Sci Sports Exerc, 2015, 47(1): 74-81.
28 Hennis PJ, O′Doherty AF, Levett DZ, et al. Genetic factors associated with exercise performance in atmospheric hypoxia[J]. Sports Med, 2015, 45(5): 745-761.
(本文编辑:黄红稷)
胡明冬,李琦,贺斌峰,等. 高原不同海拔暴露对肺通气功能及代偿能力的影响[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(1): 10-14.
Study on pulmonary ventilation function and it′s compensation in different high altitude
HuMingdong,LiQi,HeBinfeng,WangDan,LiuGang,XuJing,LiuShuanglin,WangGuansong,HuangLan,XuJiancheng.
ArmyInstituteofRespiratoryDiseases,DepartmentofRespiratoryMedicine,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,China
XuJiancheng,Email:xqxjc@163.com
Objective To study the change of pulmonary ventilation function of plainsman in different high altitude and potential mechanism. Method One hundreds subjects was rapidly elevated to high altitude 3 700 m and then 4 200 m from sea level (300 m). They had not suffered with acute mountain illness. The pulmonary ventilation function and 6 minute walking test (6MWT) of subjects were evaluated and their fasting blood samples had been collected in different altitudes. The plasma hypoxia inducible factor-1α(HIF-1α) and endothelin-1(ET-1) levels were detected by ELISA, and the activity of plasma angiotensin converting enzyme(ACE) had been measured by continuous monitoring method. The correlation of the change of forced vital capacity(FVC) and 6 min walk distance(6MWD) among different altitude was analyzed by Pearson analysis. Result The FVC and 6MWD of subjects in 3 700 m and 4 200 m were significant decreased, compared with in sea levels (P<0.05). And the FVC and 6MWD of subjects in 4 200 m was lower than in 3 700 m (P<0.05). The FEV1and respiratory rate was high in 4 200 m than in 300 m (P<0.05). The change of FVC and 6MWD between 300 m and 3 700 m or 4 200 m was notable positive correlation (P<0.05). Compared to plasma ET-1 levels of subjects in sea levels, they were elevated in 3 700 m and 4 200 m (P<0.05) and the levels of ET-1 were higher in 4 200 m than in 3 700 m (P<0.05). The levels of plasma HIF-1α and activity of ACE of subjects was significant higher in 4 200 m and 3 700 m than in sea levels (P<0.05). Conclusions Pulmonary ventilation function and it′s compensation descend when subjects rapidly expose at high altitude, which might due to a small amount of pulmonary interstitial fluid retention.
Acute hypoxia exposure; Pulmonary ventilation function; 6 minute walking test
10.3877/cma.j.issn.1674-6902.2017.01.003
国家卫生部卫生行业科研专项项目(201002012) 军队青年培养项目资助(13QNP114)
400037 重庆,第三军医大学新桥医院呼吸内科·全军呼吸内科研究所
徐剑铖,Email: xqxjc@163.com
R563
A
2016-10-26)

