盐度及pH突变对大竹蛏稚贝抗氧化酶活力的影响
高杉,周遵春,董颖,曹琛,王摆,姜北,张乾,匡少华,郝咏芳
(1.辽宁省海洋水产科学研究院辽宁省海洋水产分子生物学重点实验室,辽宁大连116023;2.营口市水产科学研究所,辽宁营口115000)
盐度及pH突变对大竹蛏稚贝抗氧化酶活力的影响
高杉1,周遵春1,董颖1,曹琛2,王摆1,姜北1,张乾2,匡少华2,郝咏芳2
(1.辽宁省海洋水产科学研究院辽宁省海洋水产分子生物学重点实验室,辽宁大连116023;2.营口市水产科学研究所,辽宁营口115000)
为了解盐度、pH对大竹蛏Solen grandis稚贝抗氧化酶活力的影响,在不同盐度 (15、20、30、35) 和pH(7.0、7.5、8.5、9.0)突变下,分别在0、4、12、24、48、72、96 h测定了壳长为 (1.33±0.10) cm大竹蛏稚贝超氧化物歧化酶 (SOD)和过氧化氢酶 (CAT)活力的变化。结果表明:盐度20组12、24 h及盐度30组24 h,大竹蛏稚贝SOD活力显著高于对照组 (盐度25)(P<0.05),盐度20组4、12 h和盐度30组12、24 h时,大竹蛏稚贝CAT活力显著高于对照组 (P<0.05),48~96 h时,盐度20、盐度30组的两种抗氧化酶活力逐渐恢复至对照组水平;盐度15、35组48~96 h时,大竹蛏稚贝的SOD和CAT活力显著高于对照组 (P<0.05),pH 7.5、pH 8.5组12~96 h时,大竹蛏稚贝的SOD和CAT活力显著高于对照组 (pH 8.0)(P<0.05)(除pH 8.5组48 h外);pH 7.0、pH 9.0组12~96 h时,其SOD活力显著高于对照组 (P<0.05),pH 7.0和pH 9.0组72 h和96 h时,CAT活力显著低于对照组 (P<0.05)。研究表明:盐度和pH突变对大竹蛏稚贝SOD和CAT活力均有影响,大竹蛏稚贝对盐度20和盐度30突变有一定适应性;盐度15、盐度35和pH 7.5、pH 8.5突变后,大竹蛏稚贝长时间处于氧化应激状态;pH 7.0和pH 9.0突变可能会造成大竹蛏稚贝细胞氧化损伤;生产实践中,大竹蛏稚贝培育的盐度和pH范围分别控制在20~30和7.5~8.5较为合适。
大竹蛏;盐度;pH;超氧化物歧化酶;过氧化氢酶
活性氧 (reactive oxygen species,ROS)由需氧生物的有氧代谢而产生,主要生成于线粒体内的活性中间体[1],对许多生物进程均发挥着重要作用[2]。生物体内生理低水平的活性氧作为细胞内信号分子参与了多项生理生化过程,如细胞的增殖、分化和凋亡[3],免疫[4]以及对细菌的刺激进行防卫等[5];过量的活性氧会使生物体受到氧化胁迫,从而使细胞的生物膜、蛋白质、核酸等受到损伤,致使细胞功能出现障碍[6]。需氧生物发达的抗氧化系统可以减少生物体受氧化胁迫的伤害[7],超氧化物歧化酶 (SOD)和过氧化氢酶(CAT)均是重要的抗氧化酶,并广泛存在于需氧和耐氧生物体内[8],SOD是抗氧化反应第一道防御屏障,可使O-2·转化为H2O2和O2,从而清除O-2·[9];再由CAT将H2O2分解为H2O和O2,从而消除H2O2对机体造成的氧化危害[10]。
盐度和pH是水产养殖过程中重要的环境因子[11-12],养殖环境的突变会使水产动物机体受到氧化胁迫而引起氧化应激[13],同时影响机体的抗氧化酶活力,如大菱鲆Scophthalmus maximus幼鱼肝脏和鳃的抗氧化酶活力会随着盐度的改变而发生适应性变化[14];高盐度 (24和30)对暗纹东方鲀Takifugu obscurus肝脏中抗氧化酶活力产生显著影响[15];缢蛏Sinonovacula constrzcta肝胰脏中SOD、CAT酶活力在盐度骤变初期均显著升高[16];pH变化对厚壳贻贝Mytilus coruscus鳃和消化腺中SOD和CAT酶活力均有显著影响[17];脊尾白虾Palaemon carinicauda鳃、肝胰腺、肌肉和血淋巴中CAT活力在pH胁迫下呈先升高后降低的趋势[12]。有研究表明,通过测定CAT、SOD等酶活力,可以了解细胞受到氧化应激的损伤情况[18],生物体的抗氧化酶系统也可评估pH对生物体的胁迫效应[12]。
大竹蛏Solen grandis隶属于软体动物门Mollusca、双壳纲Bivavalvia、异齿亚纲Heterodonta、帘蛤目Veneroida、竹蛏科Solenidae、竹蛏属Solen,在中国、菲律宾、泰国、日本、朝鲜、韩国等沿海均有分布。大竹蛏个体大、味道鲜、营养丰富,是中国重要的经济贝类。近年来,由于辽宁沿海大竹蛏的种质资源缺乏,因此,加快大竹蛏人工育苗推广及增殖放流的进程,恢复海区种质资源已势在必行。目前,有关大竹蛏群体遗传多样性、人工育苗等方面研究已有一些报道[19-21],但环境突变后大竹蛏抗氧化酶活力的变化尚未见报道。本试验中,研究了盐度和pH突变对大竹蛏稚贝SOD、CAT抗氧化酶活力的影响,旨在了解不同盐度和pH突变下大竹蛏稚贝抗氧化酶的变化及适应情况,为大竹蛏的人工繁育和增殖放流提供理论依据。
1 材料与方法
1.1 材料
试验用大竹蛏稚贝由辽宁省营口市海洋水产科学研究所2014年在营口市现代科技产业园区基地人工繁育获得,壳长为 (1.33±0.10)cm,培育水温为24~26℃,盐度为24~27,pH为8.0~8.2。暂养期间持续充气,每天投喂金藻、扁藻等单胞藻混合液两次,投饵后水体中藻类细胞密度为1.0× 105cells/mL,每天换水1次,换水量为1/2。
总蛋白定量、总超氧化物歧化酶、过氧化氢酶试剂盒均购自南京建成生物工程研究所。
1.2 方法
1.2.1 试验设计 试验用塑料水槽为60 cm×40 cm×40 cm,预先铺设4 cm厚的底泥。试验设置4个盐度组 (15、20、30、35)和4个pH组 (7.0、7.5、8.5、9.0),分别记为S15、S20、S30、S35 组,pH 7.0、pH 7.5、pH 8.5、pH 9.0组。盐度由自然海水通过加入曝气的自来水或盐卤调节, pH用1 mol/L HCl或1 mol/L NaOH调节,对照组为自然海水,盐度为25、pH为8.0,记为 S25、pH 8.0组,无需另配。对照组和每个盐度组、pH组各设3个平行。试验开始时,向各平行组投放300粒健康大竹蛏稚贝,分别于0、4、12、24、48、72、96 h取样,在各时间点上从每个平行组随机取20粒稚贝。试验期间保持充气,每天投饵两次,换水1次,换水量为1/3。
1.2.2 样品处理 将各平行组的20粒大竹蛏稚贝小心去壳后混在一起,准确称重,按体质量(g)∶体积 (mL)=1∶9的比例加入生理盐水,冰浴条件下匀浆,4℃条件下以2500 g离心10 min,取上清液。所得样品迅速放入液氮中冷冻后,于超低温冰箱 (-80℃)中保存待测。
1.2.3 指标测定 使用总蛋白定量试剂盒 (BCA 法)测定组织中蛋白含量,使用总超氧化物歧化酶 (SOD)试剂盒 (WST-1法)测定组织中总SOD活力,使用过氧化氢酶 (CAT)试剂盒 (可见光法)测定组织中CAT活力,相应操作、计算均严格按照说明书进行。SOD活力单位定义为:每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的 SOD量为一个 SOD活力单位(U)。CAT活力单位定义为:每毫克组织蛋白每秒分解1 μmol的H2O2的量为一个CAT活力单位(U)。每个样品均重复测定4次,取其平均值。
1.3 数据处理
采用SPSS 16.0软件对试验结果进行单因素方差分析 (One-Way ANOVA)及Duncan多重比较,显著性水平设为0.05。
2 结果与分析
2.1 盐度突变对大竹蛏稚贝SOD活力的影响
从图1可见:盐度15组大竹蛏稚贝SOD活力在4~96 h均显著高于对照组(盐度25)(P<0.05);盐度20组SOD活力呈先升高后降低趋势,在试验24 h出现峰值,其中在12、24 h SOD活力显著高于对照组 (P<0.05);盐度30组SOD活力在24 h显著高于对照组 (P<0.05),大竹蛏稚贝受盐度20和盐度30突变后48~96 h,SOD活力与对照组无显著性差异 (P>0.05);盐度35组SOD活力在0~24 h与对照组无显著性差异 (P>0.05),在48~96 h显著高于对照组 (P<0.05),在4~24、72、96 h均显著低于盐度15组 (P<0.05)。
2.2 盐度突变对大竹蛏稚贝CAT活力的影响
从图1还可见:盐度15组大竹蛏稚贝CAT活力在4~96 h均显著高于对照组 (P<0.05);盐度20和30组CAT活力均呈先升高后降低再升高的趋势,均在12 h达到最高值,其中盐度20组CAT活力在4、12 h显著高于对照组 (P<0.05),在其他时间点与对照组无显著性差异 (P>0.05),盐度30组CAT活力在12、24 h显著高于对照组 (P<0.05),在其他时间点与对照组无显著性差异 (P>0.05);盐度35组CAT活力在0~12 h与对照组无显著性差异 (P>0.05),在24~96 h显著高于对照组 (P<0.05),在4~24、72、96 h显著低于盐度15组 (P<0.05)。
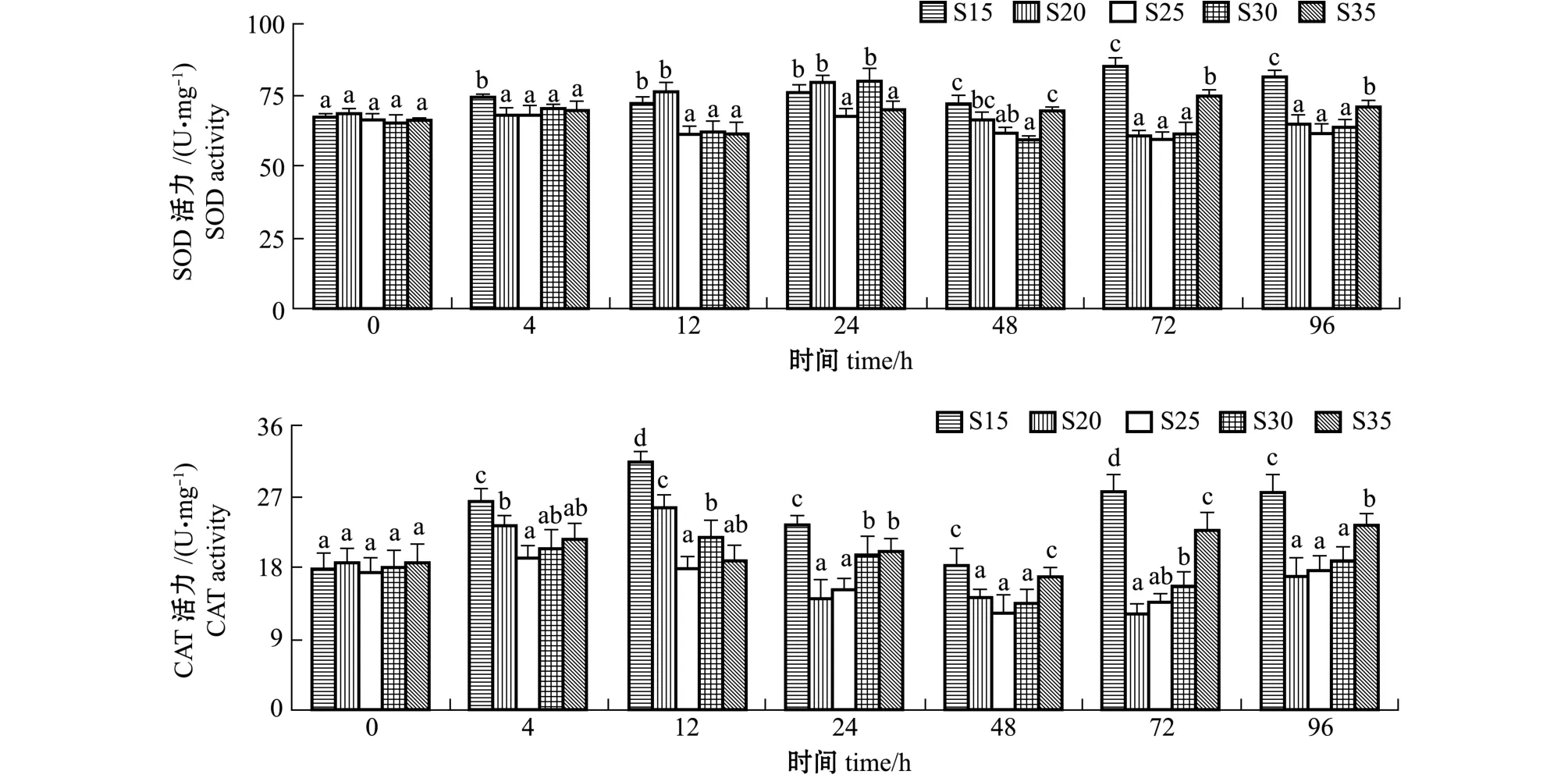
图1 盐度对大竹蛏SOD、CAT活力的影响Fig.1 Effects of salinity on superoxide dismutase(SOD)and catalase(CAT)activities in razor clam Solen grandis
2.3 pH突变对大竹蛏稚贝SOD活力的影响
从图2可见:pH 7.0和pH 7.5组大竹蛏稚贝SOD活力均呈先升高后降低的趋势,在4~96 h两组均显著高于对照组 (pH 8.0) (P<0.05);pH 8.5组SOD活力在0、4、48 h与对照组无显著性差异 (P>0.05),在其他时间点均显著高于对照组(P<0.05);pH 9.0组SOD活力在0、4 h与对照组无显著性差异 (P>0.05),在其他时间点均显著高于对照组 (P<0.05)。
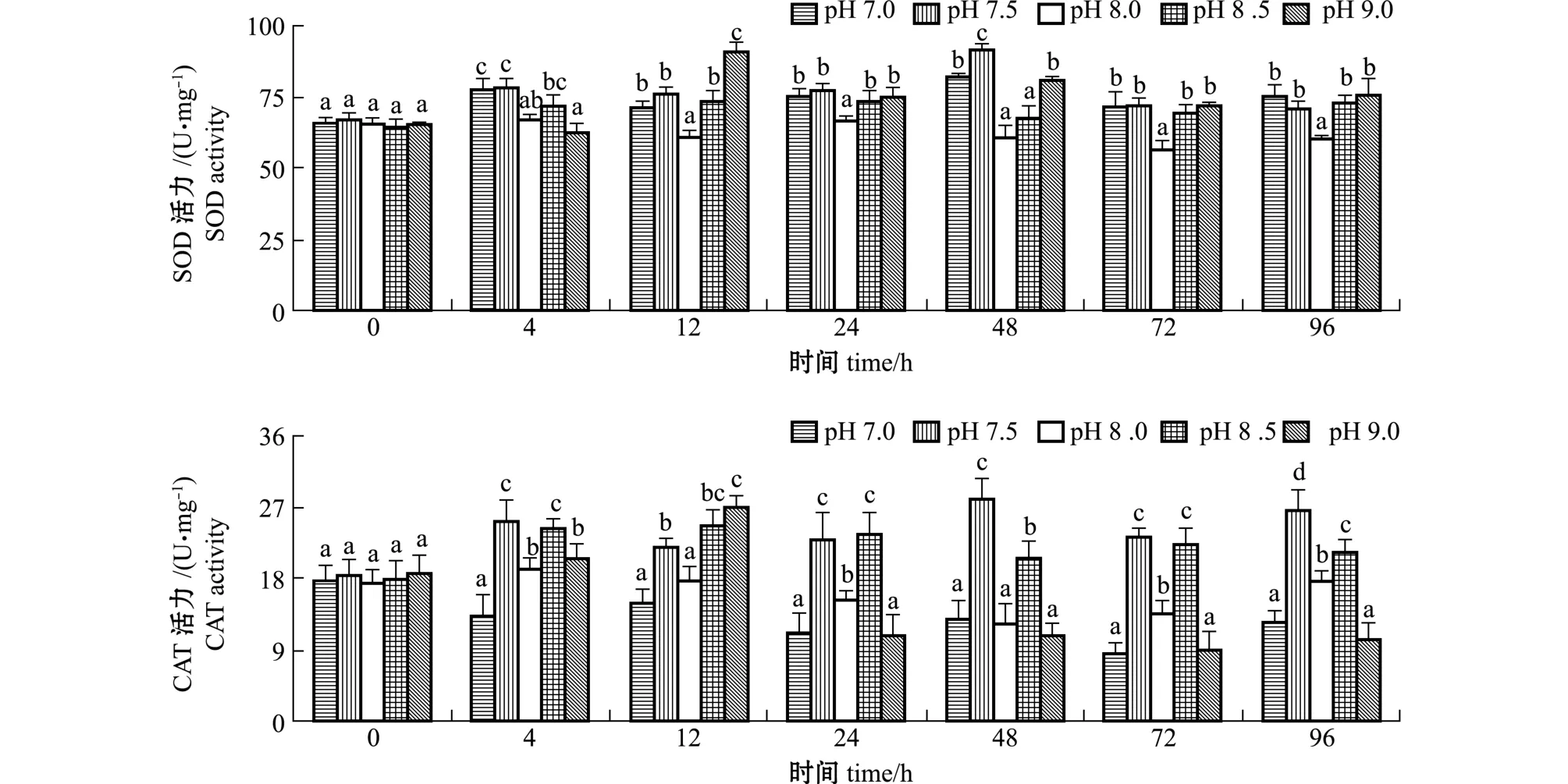
图2 pH对大竹蛏SOD、CAT活力的影响Fig.2 Effects of pH on SOD and CAT activities in razor clam Solen grandis
2.4 pH突变对大竹蛏稚贝CAT活力的影响
从图2还可见:大竹蛏稚贝pH 7.0组CAT活力在4、24、72、96 h显著低于对照组 (P<0.05);pH 7.5和pH 8.5组CAT活力在4~96 h均显著高于对照组 (P<0.05);pH 9.0组CAT活力呈先升高后降低趋势,在12 h显著高于对照组(P<0.05),在24、72、96 h显著低于对照组 (P<0.05),在 0、4、48 h与对照组无显著性差异(P>0.05)。
3 讨论
3.1 盐度突变对大竹蛏稚贝SOD及CAT的影响
盐度是海水养殖环境的重要因子之一,影响着水生生物的生长、生理代谢、生殖发育、免疫防御等[22-23],盐度突变通常会改变生物体的渗透压,影响机体的生理活动[24],引起生理应激反应[25],并伴随着活性氧瞬间过量产生[26],诱发抗氧化酶活力的改变。Wang等[27]研究发现,不同盐度会使斑节对虾Penaeus monodon CAT活力发生变化,在盐度为2的条件下,斑节对虾稚虾肌肉组织中CAT活力在24 h显著升高,在盐度为20的条件下,斑节对虾早期幼体肌肉组织中CAT活力在24、48 h显著升高;在盐度渐变对虾夷扇贝Patinopecten yessoensis的影响试验中,盐度渐变后,虾夷扇贝血清中SOD活力短期内显著下降,随后逐渐恢复, CAT活力在2、96 h显著下降,其他时间保持稳定[28];在对三疣梭子蟹Portunus trituberculata的低盐胁迫试验中发现,半致死盐度胁迫48 h内,三疣梭子蟹各组织中 (肝胰腺、鳃、肌肉)SOD、CAT活力均呈下降趋势,且极显著低于对照组[29];许氏平鲉Sebastes schlegeli血液中SOD、CAT活力随海水盐度缓慢降低呈逐渐上升趋势,其中盐度5和盐度10组SOD活力显著高于对照组[30]。本试验中,盐度20和盐度30组中,大竹蛏稚贝SOD 和CAT活力在4~24 h均有先升高的趋势,其中SOD活力在24 h达到峰值,且显著高于对照组, CAT活力在12 h达到最高值,且显著高于对照组, 在48~96 h两组的SOD和CAT活力与对照组均无显著性差异。研究表明,大竹蛏稚贝可能受到盐度20和盐度30突变后在4~48 h内发生氧化应激,从而产生了大量的活性氧自由基,导致SOD和CAT活力短暂升高;在48~96 h SOD和CAT活力恢复至对照组水平,说明过量的自由基被逐渐清除。李子牛等[31]的研究结果与此类似,青蛤Cyclina sinensis抗氧化酶的波动基本于胁迫后的前24 h内完成,48 h后恢复到对照组水平。本研究中,盐度15和盐度35组中,大竹蛏稚贝SOD和CAT活力在试验后期48~96 h均显著高于对照组,表明在这两组盐度突变下,大竹蛏稚贝未能在短时间内消除活性氧自由基,从而处于胁迫状态,长期处于胁迫状态可能会导致机体受到氧化损伤。因此,盐度为20~30可能是大竹蛏稚贝生长发育比较适宜的盐度,陈爱华等[32]的研究同样发现,大竹蛏稚贝存活及生长的盐度适宜范围为20~32。盐度15组中大竹蛏稚贝SOD和CAT活力在4~24、72、96 h均显著高于盐度35组,这可能是大竹蛏稚贝对低盐的突变更为不适造成的。
3.2 pH突变对大竹蛏稚贝SOD及CAT的影响
pH也是水产养殖中的重要环境因子之一,酸雨、持续阴天、工业废水汇入、浮游生物种群的更替等均会造成水体中pH的改变,它不仅直接影响水生生物的代谢机能,严重时可能会导致水生生物血液中的酸碱平衡紊乱、血液离子调节机制丧失等[33],还会通过影响水体中硫化氢、氨氮和重金属离子等的存在形式,间接影响水生生物的生长、存活和免疫等[34-35]。Matozzo等[36]研究表明,在盐度为28的条件下,当pH由8.1渐变至7.7时,7 d后鸡帘蛤Chamelea gallina鳃组织SOD活力显著高于对照组;在盐度为34的条件下,当pH由8.1渐变至7.4时,7 d后鸡帘蛤消化腺组织CAT活力显著高于对照组。有研究发现,脊尾白虾对pH胁迫的适应性较强,受pH胁迫 (pH 6.5、pH 9.5) 3~24 h内抗氧化酶活力反馈性升高,并在清除体内多余的活性氧后逐渐恢复至对照组水平[12]。樊甄姣等[33]发现,栉孔扇贝Chlamys farreri受到较低pH胁迫时,扇贝血清中SOD和CAT活力升高,而当pH过低 (pH 7.0)时,两种抗氧化酶活力显著下降。本试验中也得到类似结果,大竹蛏稚贝受到pH 7.5、pH 8.5突变后,稚贝SOD和CAT活力在各时间点几乎均显著高于对照组 (除pH 8.5组SOD活力在4、48 h与对照组无显著性差异外), 96 h内未能恢复至对照组水平,表明大竹蛏稚贝受pH突变影响较大,短时间内未能消除氧化胁迫带来的伤害。pH 7.0和pH 9.0组对大竹蛏稚贝SOD活力的影响与pH 7.5和pH 8.5组结果相似,受到突变后大竹蛏稚贝长期处于应激状态。大竹蛏稚贝受pH 7.0突变后,CAT活力在4、24、72、96 h显著低于对照组,受pH 9.0突变后,CAT活力呈先升高后下降趋势,在72、96 h显著低于对照组,推测pH 7.0和pH 9.0突变可能已超出大竹蛏稚贝CAT的清除能力范围,细胞受到氧化损伤,致使CAT活力降低。
综上所述,盐度和pH突变均会影响大竹蛏稚贝SOD和CAT活力,激发大竹蛏稚贝抗氧化酶系统的功能。受到盐度20和盐度30突变时,大竹蛏稚贝机体可能会在突变后48 h内清除氧化应激所产生的活性氧,并逐渐恢复到正常水平;当受到盐度15、盐度35和 pH 7.5、pH 8.5突变后,大竹蛏稚贝SOD和CAT活力96 h内未能恢复至正常水平,而持续处于氧化应激状态;pH 7.0和pH 9.0可能超过了大竹蛏稚贝的耐受范围,细胞受到氧化损伤,导致CAT活力降低。因此,在大竹蛏人工育苗及养殖过程中,不仅要监测养殖水体的常规理化指标,更要加大对蓄水池或海区理化指标的监测力度,如遇突降暴雨等因素导致蓄水池或海区盐度和pH有较大变化时,要注意控制换水量,使换水后养殖水体盐度尽量控制在20~30,pH要严格控制在7.5~8.5。增殖放流同样要选择盐度和pH相近的海区,以免引起稚贝死亡。
[1] Guerra C,Zenteno-Savín T,Maeda-Martínez A N,et al.The effect of predator exposure and reproduction on oxidative stress parameters in the Catarina scallop Argopecten ventricosus[J].Comparative Biochemistry&Physiology Part A:Molecular&Integrative Physiology,2013,165(1):89-96.
[2] Lambeth J D.NOX enzymes and the biology of reactive oxygen [J].Nature Reviews Immunology,2004,4(3):181-189.
[3] Ghosh J,Myers C E.Inhibition of arachidonate 5-lipoxygenase triggers massive apoptosis in human prostate cancer cells[J].Proceedings of the National Academy of Sciences of the United States of America,1998,95(22):13182-13187.
[4] 尹光耀,尹玉芬,何雪芬,等.驻春丸对肾阳虚老年人免疫与内分泌功能的影响[J].中国中西医结合杂志,1995,15(10): 601-603.
[5] Lee Y J,Galoforo S S,Berns C M,et al.Glucose deprivation-induced cytotoxicity and alterations in mitogen-activated protein kinase activation are mediated by oxidative stress in multidrug-resistant human breast carcinoma cells[J].Journal of Biological Chemistry,1998,273(9):5294-5299.
[6] Barja G.Aging in vertebrates,and the effect of caloric restriction:a mitochondrial free radical production-DNA damage mechanism? [J].Biological Reviews,2004,79(2):235-251.
[7] Kim B M,Rhee J S,Park G S,et al.Cu/Zn-and Mn-superoxide dismutase(SOD)from the copepod Tigriopus japonicus:molecular cloning and expression in response to environmental pollutants[J]. Chemosphere,2011,84(10):1467-1475.
[8] 杨细兰.褶纹冠蚌过氧化氢酶基因克隆、原核表达及酶活性分析[D].南昌:南昌大学,2011.
[9] Fridovich I.Superoxide radical and superoxide dismutases[J].Annual Review of Biochemistry,1995,64(1):97-112.
[10] Ekanayake P M,De Zoysa M,Kang H S,et al.Cloning,characterization and tissue expression of disk abalone(Haliotis discus discus)catalase[J].Fish&Shellfish Immunology,2008,24(3): 267-278.
[11] 袁春营,崔青曼.盐度影响水产养殖动物生长发育的研究进展[J].水产科学,2004,23(5):41-42.
[12] 于天基,李健,李吉涛,等.pH胁迫对脊尾白虾抗氧化酶活力的影响[J].海洋科学,2015,39(5):47-53.
[13] Tomanek L,Zuzow M J,Ivanina A V,et al.Proteomic response to elevated PCO2level in eastern oysters,Crassostrea virginica:evidence for oxidative stress[J].Journal of Experimental Biology, 2011,214(11):1836-1844.
[14] 邓平平,施永梅,汪洋,等.盐度对长江刀鲚幼鱼非特异性免疫酶和消化酶活性的影响[J].大连海洋大学学报,2016,31 (5):533-537.
[15] 边平江,邱成功,徐善良,等.盐度对暗纹东方鲀生长、非特异性免疫和抗氧化酶活力的影响[J].水生生物学报,2014,38 (1):108-114.
[16] 吕昊泽,刘健,陈锦辉,等.盐度对缢蛏超氧化物歧化酶和过氧化氢酶活性的影响[J].海洋渔业,2013,35(4):474-478.
[17] Hu M H,Li L S,Sui Y M,et al.Effect of pH and temperature on antioxidant responses of the thick shell mussel Mytilus coruscus [J].Fish&Shellfish Immunology,2015,46(2):573-583.
[18] 杨丽娟,游育红.细胞受到氧化应激后损伤的检测方法[J].医学综述,2010,16(6):924-927.
[19] 张滔,刘相全,孙振兴,等.大竹蛏(Solen grandis)不同地理群体遗传多样性的AFLP分析[J].海洋与湖沼,2013,44(2): 525-530.
[20] 张志伟,陈爱华,张志勇,等.大竹蛏5个野生群体遗传多样性的微卫星分析[J].中国水产科学,2015,22(4):740-748.
[21] 宋贤亭,于瑞海,马培振,等.大竹蛏室内人工育苗技术研究[J].海洋湖沼通报,2015(4):56-60.
[22] Sarà G,Romano C,Widdows J,et al.Effect of salinity and temperature on feeding physiology and scope for growth of an invasive species(Brachidontes pharaonis-Mollusca:Bivalvia)within the Mediterranean sea[J].Journal of Experimental Marine Biology and Ecology,2008,363(1-2):130-136.
[23] 范德朋,潘鲁青,马甡,等.盐度和pH对缢蛏耗氧率及排氨率的影响[J].中国水产科学,2002,9(3):234-238.
[24] Pillai B R,Diwan A D.Effects of acute salinity stress on oxygen consumption and ammonia excretion rates of the marine shrimp Metapenaeus monoceros[J].Journal of Crustacean Biology,2002, 22(1):45-52.
[25] Choi C Y,An K W,An M I.Molecular characterization and mRNA expression of glutathione peroxidase and glutathione S-transferase during osmotic stress in olive flounder(Paralichthys olivaceus)[J].Comparative Biochemistry and Physiology Part A:Mo-lecular&Integrative Physiology,2008,149(3):330-337.
[26] Holmblad T,Söderhäll K.Cell adhesion molecules and antioxidative enzymes in a crustacean,possible role in immunity[J].Aquaculture,1999,172(1-2):111-123.
[27] Wang W N,Wu J,Su S J.Effects of salinity stress on antioxidant enzymes of Penaeus monodon of two different life stages[J].Comparative Biochemistry and Physiology Part C:Toxicology&Pharmacology,2008,148(4):466.
[28] 刘美剑,常亚青,杨芸菲,等.盐度渐变对虾夷扇贝(Patinopecten yessoensis)免疫指标的影响[J].中国农业科技导报, 2011,13(3):129-135.
[29] 周东,母昌考,宋微微,等.低盐胁迫对三疣梭子蟹组织中抗氧化酶和ATP酶活力的影响[J].生态科学,2014,33(4): 698-703.
[30] 王晓杰,张秀梅,李文涛.盐度胁迫对许氏平鲉血液免疫酶活力的影响[J].渔业科学进展,2005,26(6):17-21.
[31] 李子牛,林听听,么宗利,等.盐度对青蛤抗氧化酶活性及生长的影响[J].生态学杂志,2012,31(10):2625-2630.
[32] 陈爱华,姚国兴,张志伟,等.温度、盐度和底质对大竹蛏稚贝生长及存活的影响[J].热带海洋学报,2010,29(5):94-97.
[33] 樊甄姣,杨爱国,刘志鸿,等.pH对栉孔扇贝体内几种免疫因子的影响[J].中国水产科学,2006,13(4):650-654.
[34] 曾媛媛,艾春香,刘建国,等.pH胁迫对拟穴青蟹体内几种免疫因子的影响[J].厦门大学学报:自然科学版,2008,47(3): 413-418.
[35] 文春根,张丽红,胡宝庆,等.pH对背角无齿蚌(Anodonta woodiana)5种免疫因子的影响[J].南昌大学学报:理科版, 2009,33(2):172-176.
[36] Matozzo V,Chinellato A,Munari M,et al.Can the combination of decreased pH and increased temperature values induce oxidative stress in the clam Chamelea gallina and the mussel Mytilus galloprovincialis?[J].Marine Pollution Bulletin,2013,72(1):34-40.
Effects of changes in salinity and pH on antioxidant enzyme activity in juvenile razor clam Solen grandis
GAO Shan1,ZHOU Zun-chun1,DONG Ying1,CAO Chen2, WANG Bai1,JIANG Bei1,ZHANG Qian2,KUANG Shao-hua2,HAO Yong-fang2
(1.Liaoning Key Laboratory of Marine Fishery Molecular Biology,Liaoning Ocean and Fisheries Science Research Institute,Dalian 116023,China; 2.Fisheries Research Institute of Yingkou,Yingkou 115000,China)
Superoxide dismutase(SOD)and catalase(CAT)activities of juvenile razor clam Solen grandis with shell length of(1.33 cm±0.10 cm)were monitored at a salinity of 15,20,30 and 35 and pH of 7.0,7.5,8.5 and 9.0 for 0,4,12,24,48,72 and 96 h,respectively,in order to clarify the effects of salinity and pH on the antioxidant enzyme activities of juvenile razor clam.The results showed that there were significantly higher activities of SOD in the clam exposed to a salinity of 20 for 12 and 24 h and a salinity of 30 for 24 h than those in the control group(salinity 25)(P<0.05).However,there were significantly higher CAT activities in the clam exposed to a salinity of 20 for 4 and 12 h and a salinity of 30 for 12 and 24 h than those in the control group(salinity 25)(P<0.05),finally activities of both SOD and CAT being recovered to the control level in 48 h and 96 h.The razor clam exposed to a salinity of 15 and 35 from 48 h to 96 h had significantly higher SOD and CAT activities than those in controls(P<0.05)did.The razor clam exposed to pH 7.5 and pH 8.5 from 12 h to 96 h had significantly higher SOD and CAT activities than those in control group did(pH 8.0,except pH 8.5 in 48 h)(P<0.05).There was significantly higher SOD activity in the clam exposed to pH 7.0 and pH 9.0 than those in the control group at 12-96 h(P<0.05),the activities of CAT being significantly lower from 72 h to 96 h(P<0.05).The findings indicated that SOD and CAT activities in razor clam were affected by changes in salinity and pH,the razor clam being adaptable to sudden change in salinity within 20 and 30,and that the razor clam showed cellular oxidative damage induced by the pH 7.0 and pH 9.0 changes under the status of oxidative stress for a long period of exposure at a salinity of 15 and 35 and pH 7.5,and 8.5.The adaptive salinity and pH are suggested to should be kept in 20-30 and 7.5-8.5 for the culture of Solen grandis juveniles,respectively.
Solen grandis;salinity;pH;superoxide dismutase(SOD);catalase(CAT)
S968.3
A
10.16535/j.cnki.dlhyxb.2017.01.011
2095-1388(2017)01-0062-06
2016-04-18
现代农业产业技术体系建设专项 (nycytx-47);辽宁省科技计划项目 (2014203006);辽宁省海洋与渔业厅项目 (201301)
高杉 (1983—),男,助理研究员。E-mail:gs_7920@163.com
周遵春 (1967—),男,博士,研究员。E-mail:zunchunz@hotmail.com

