血管性血友病因子活性检测在病毒灭活冷沉淀质量控制中的应用
李庚娣,郑瑶玲,刘永梅,于 洋,曾凌晓,钟波婷
(深圳市宝安区中心血站,广东深圳518101)
血管性血友病因子活性检测在病毒灭活冷沉淀质量控制中的应用
李庚娣,郑瑶玲,刘永梅,于 洋,曾凌晓,钟波婷
(深圳市宝安区中心血站,广东深圳518101)
目的建立血管性血友病因子标准曲线,探讨在血管性血友病因子检测病毒灭活冷沉淀质量控制中的应用。方法将80袋200ml新鲜冰冻血浆在4℃血浆解冻箱溶解后平均分为两袋,每袋约100ml,分两组做实验研究,一组直接做成冷沉淀(对照组)留标本2ml,另一组做病毒灭活后做冷沉淀(实验组)留标本2ml,将标本急冻统一检测血管性血友病因子活性。结果80袋对照组血管性血友病因子(vWF)活性为262.40+22.35%;实验组血管性血友病因子(vWF)活性为211.72+16.32%。结论病毒灭活血浆做冷沉淀除了不稳定因子VIII及纤维蛋白原有不同程度降低外,血管性血友病因子活性降低的幅度大约为19%,也可作为一项监测病毒灭活冷沉淀的指标使用。
血管性血友病因子(vWF);病毒灭活;冷沉淀
冷沉淀是采用特定的方法将保存期内的新鲜冰冻血浆在1℃~6℃融化后,分离出大部分的血浆,并将剩余的冷不溶解物质在1h内速冻成固态的成分血[1]。也是临床常用重要的血液产品之一,除了常规的止血及凝血功能障碍的补充外,亦有外用的诸多功效如深度烧伤、皮肤和黏膜疾病、角膜疾病修复视力的作用[2]。冷沉淀主要含有Ⅷ因子、纤维蛋白原、血管性血友病因子(von Willebrand factor,vWF)、第XIII因子以及纤连蛋白等成分。冷沉淀中一个重要组成部分是血管性血友病因子(vWF)。输注冷沉淀是临床患者补充vWF的常见治疗手段。因此,冷沉淀中vWF含量应该值得重视[3]。特别是新鲜冰冻血浆经过病毒灭活工艺处理后制备的冷沉淀,vWF因子水平的影响,就值得研究。本文就选用vWF因子含量测定探讨病毒灭活冷沉淀的可行性,现报道如下。
1 资料及材料
1.1 标本来源及方法2015年11月-2016年6月按照GB18467《献血者健康检查要求》2011版[4],经体检征询及初筛检测合格后,并在严格控制采集时间规格为200ml新鲜冰冻血浆80袋。分四批进行,每批次20袋,将新鲜冰冻血浆在4℃血浆解冻箱溶解后平均分为两袋,每袋约100ml,分两组做实验研究,一组直接做成冷沉淀(对照组)留标本2ml,另一组做病毒灭活后做冷沉淀(实验组)留标本2ml,将标本急冻统一检测。
1.2 试剂材料及设备
1.2.1 制备设备及耗材血浆速冻机MBF21(卢森堡多美达),医用病毒灭活柜HDME-1A(上海输血技术),冰冻血浆解冻箱KJX-III(苏州),离心机6000i(德国贺利氏),一次性使用滤白采血袋(上海输血技术有限公司),一次性使用病毒灭活输血过滤器材(MBPF.04B上海输血技术有限公司)
1.2.2 检测试剂及设备人血管性血友病因子-酶联免疫法(上海酶联生物科技有限公司lot:201607,EXP:201701),TECAN洗板机(瑞士)、TECAN酶标仪(瑞士)。
1.3 vWF检测
1.3.1 检测原理vWF水平测定采用双抗体夹心法,用ELISA试剂盒严格按试剂盒说明书进行检测。
1.3.2 具体操作如下用标准品稀释液对标准品原液(800U/L)进行稀释,稀释成400U/L,200U/L,100U/L,50U/L,25U/L五个梯度,每个梯度做2孔检测OD值取均值进行标准曲线的建立。然后将稀释好的标准品按每孔50μl加两孔,在样品检测孔按40μl样品稀释液+10μl样品(样品最终稀释度为5倍),将标准品及待检样品加入包被有抗人vWF抗体的酶标板后,37℃孵育30min;洗板机洗板5次后,每孔中加入50μl辣根过氧化物酶标记的vWF抗体,37℃孵育30min;再次用洗板机洗板5次后,每孔加入50μl显色液A+50μl显色液B,37℃显色10min;每孔中加入50μl硫酸终止液终止反应;最后在酶标仪上450nm处,以空白孔调零,测定各孔吸光值。利用系列标准品绘制吸光值和浓度的标准曲线,根据标准曲线公式将样品孔的吸光值代入其中,计算出相应的vWF浓度(标准曲线的建立及样品浓度的计算均在Excel 2007中进行)。
1.4 统计学方法实验数据以均值±标准差(x±s)表示,两组样本比较采用双样本t检验。
2 结果
2.1 vWF标准曲线见图1。
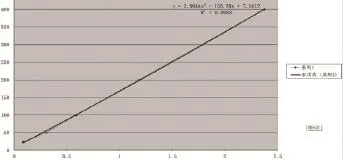
图1 vWF标准曲线
2.2 实验组和对照组结果
2.2.1 测得的VWF因子活性的结果为对照组262.40+20.35%,而配对的实验组结果为211.72+ 16.32%。具体见表1。
2.2.2 结果经两个配对样本的t检验,结果显示sig=0.000,小于0.05,差异有统计学意义,实验组和对照组之间有显著性差异。

表1 实验组和对照组VWF因子活性
3 讨论
该对照组的VWF因子活性检测结果为262.40+20.35%,姚根宏报道[3]的冷沉淀中VWF因子水平情况支持本实验结果。实验组结果为211.72+16.32%,对比对照组的结果显示,经统计学配对t检验处理后,显示有统计学差异。说明新鲜冰冻血浆经病毒灭活工艺处理后制备的冷沉淀,对vWF因子有显著性的影响,降低的幅度大约为19%。据文献报道,病毒灭活工艺对不稳定的凝血因子Ⅷ因子的降低约为30%,纤维蛋白原会影响更明显,并且会随着时间的推移,活性会下降明显;同时影响冷沉淀质量因素也有许多,制备冷沉淀的过程实际是对凝血因子的一种浓缩过程[5]。
两个配对样本的t检验结果显示sig=0.000,小于0.05,差异有统计学意义,实验组和对照组之间有显著性差异。也就是说病毒灭活血浆制备病毒灭活冷沉淀,测定血管性血友病因子可以作为一项指标作为病毒灭活冷沉淀的参考指标,有一定的实际意义。据上海血液中心邱颖婕等报道,为确保病毒灭活冷沉淀凝血因子的质量,不能对其进行亚甲蓝的滤除[6]。有文献报道,使用冷沉淀凝血因子制备仪对保证冷沉淀质量起了重要的作用,此设备值得在血站系统推广应用[7]。但由于VWF因子活性项目没有相关的质量标准,只能作为参考指标。
血管性血友病因子(von Willebrand factor,vWF)是由血管内皮细胞和骨髓巨核细胞合成的一种多结构域、多功能糖蛋白,在1期和2期止血中发挥重要作用[8-10]。通过对新鲜冰冻血浆病毒灭活病毒后制备冷沉淀对vWF因子活性的变化分析,间接反映了病毒灭活冷沉淀的质量水平,作为一项指标质量参考指标,有一定的实际意义。但还需加大实验标本数量及由于人血管性血友病因子检测试剂盒仅供科研使用,试剂的稳定性及准确性方面还有待深究。
[1]国家质量监督检验检疫总局.GB18469-2012.全血及成分血质量要求[S].2012.
[2]冯秋斌,王艳红,赵苏丹,等.病毒灭活冷沉淀的外用研究进展[J].河北医药,2015,1237(24):3792-3795.
[3]姚根宏.冷沉淀中血管性血友病因子含量测定及意义[J].中国输血杂志,2012,925(9):853-854.
[4]国家质量监督检验检疫总局.GB18467-2011.献血者健康检查要求[S].2011.
[5]易中梅,王红苹,李晨晨,等.全血手工制备浓缩血小板后的血浆再制备冷沉淀的质量评价[J].中国输血杂志,2013,26(2):117-120.
[6]章怿,邱颖婕,近魏名,等.冷沉淀制备时间对凝血因子的影响[J].临床输血与检验,2013,15(2):169-170.
[7]邱颖婕,徐忠,徐蓓,等.病毒灭活冷沉淀制备过程中滤除亚甲蓝对凝血因子的影响[J].临床输血与检验,2016,1016(4):413-415. [8]肖乐宇.冷沉淀凝血因子制备仪制备冷沉淀的质量评价[J].中国输血杂志,2016,29(1):96-97.
[9]李雪美,江淼,赵益明.血管性血友病因子的研究进展[J].中国实验血液学杂志,2013;21(3):801-804.
[10]张媛,郭智,何学鹏,等.血管性血友病因子研究进展[J].中华实用诊断与治疗杂志,2010,24(11):1045-1047.
R554+.1
A
1674-1129(2017)01-0122-02
10.3969/j.issn.1674-1129.2017.01.042
2016-10-10;
2016-11-24)
广东省深圳市宝安区科技计划社会公益(医疗卫生类)立项项目,立项编号为:2015322

