抗肺炎支原体IgG定性测定的室内质控物浓度的选择和批间连续质控延续方法的建立
孔评石
(江苏省第二中医院检验科,江苏南京210017)
·质量控制·
抗肺炎支原体IgG定性测定的室内质控物浓度的选择和批间连续质控延续方法的建立
孔评石
(江苏省第二中医院检验科,江苏南京210017)
目的建立抗肺炎支原体IgG定性测定的室内质控物浓度的选择方法和批间连续质控的延续方法。方法选择系列质控血清中S/CO值减去精密度测定中得到的3倍批间CV与该S/CO值的乘积仍大于1.0者用来监测试验重复性,选择S/CO处于1.5左右的质控血清以判断试剂盒测定下限的有效性。使用新旧两个批号试剂盒同时检测系列质控血清得到线性回归的直线方程,计算得到换算因子,用以将新批号试剂测定值换算至原批号试剂测定值,继续使用原质控图。结果通过实验能够选择合适浓度的质控物用以判断检测重复性和试剂盒测定下限的有效性。能够得到不同批号间质控测定的换算因子用以有效延续质控图。结论通过上述方法能够有效选择抗肺炎支原体IgG定性测定的室内质控物浓度,并建立批间连续质控的延续方法。
肺炎支原体;酶联免疫吸附试验;室内质控
室内质控是保证临床检验质量的基本要求,定量检测现通常采用Levey-Jennings质控图及Westgard质控法则进行室内控制。实际工作中不同的试剂生产厂家间或同一厂家不同批间的定性酶联免疫吸附实验(ELISA)测定试剂盒在检测同一份样本的吸光度值或S/CO值常会出现较大差异,导致试剂盒更换时室内质控无法继续,从而使得定性ELISA检测的室内质控成为难题[1,2]。通常定性ELISA检测的质控依赖试剂盒本身自带的阴性、阳性质控血清进行控制,但是因为试剂盒中设定的阳性对照物浓度较高,在监测试验测定下限变化时灵敏度不足,所以需要选用外部对照物,即靠近阴阳临界的弱阳性质控物来控制,但具体到各实验室的多种定性ELISA检测项目,究竟采用多少浓度的质控血清较为合适,有待建立指导规则;而对于用不同批号试剂进行连续的室内质控的问题,同样需要建立合适的规则来解决。
抗肺炎支原体IgG(MPG)检测是临床上诊断支原体肺炎的重要依据之一,本室开展的定性MPG检测为临床提供诊断支持。作为定性实验的MPGELISA检测同样面临着上述的质控上的难题,即试剂盒配套阳性质控浓度过高和更换试剂盒时质控数据需要修正的问题。实验室检测的准确性要求必须保障严格的质量控制,为此我们通过查证文献,结合试剂盒具体情况,建立了MPG-ELISA定性检测弱阳性质控物的选择方法及其室内质控在试剂不同批间连续进行的方法。
室内质控通过试剂盒检测系列质控血清,通常的ELISA测定批间变异(CV%)需控制在15%左右,以往的研究[3-6]表明可选择S/CO值减去在精密度测定中得到的3倍批间CV与该S/CO值的乘积(3SD)大于1.0的质控血清作为监测试验重复性的质控物使用,同时选择S/CO值处于1.5左右的质控血清用来判断试剂盒每次测定时检测下限的有效性。
同一质控物在不同批试剂的测定差异主要是由于测定下限及测定线性范围的差异所致。根据试剂盒对一定范围内低浓度样本检测结果呈线性相关的原理,研究表明[3-6]在更换试剂盒时,使用新旧试剂盒同时检测上述系列质控血清,根据线性回归得到直线方程,从而使新批号试剂盒检测结果(S/CO)在其检测线性范围内与旧批号结果之间(S/CO)得到一特定换算因子,从而可以顺利地将新批号试剂盒质控物测定值换算至原批号试剂测定值,即可继续沿用原质控图而不必重新开始,使批间质控延续的问题得到解决。
1 资料与方法
1.1 材料
1.1.1 MPG质控血清(含量分别为15,25,50,100,200IU/ml),购于广东亚辉龙生物技术有限公司,批号:201404-1。
1.1.2 MPG检测ELISA试剂盒为广东亚辉龙生物技术有限公司产品,试剂批号分别为201403-1和201405-2。
1.1.3 仪器美国BIO-RAD 680型酶标仪;BIORAD 1575型洗板机等。
1.2 方法
1.2.1 ELISA方法的精密度测定按MPG-ELISA试剂盒说明,按照NCCLS EP5文件[7]进行方法的精密度测定。
1.2.2 室内质控物浓度的确定首先用ELISA试剂盒测定上述系列MPG质控血清(4孔重复),从测定S/CO值与浓度之间的关系可拟得一线性回归直线方程y=ax+b。然后选择计算得到的S/CO值减去前述精密度测定中得到的3倍批间CV与该S/ CO值的乘积(3SD)仍大于1的质控物作为判断实验室测定重复性的质控物用;同时选择S/CO值在1.5左右的质控血清用以判断每次测定时试剂盒的测定下限的有效性。
1.2.3 不同批次MPG试剂盒间检测同一室内质控物在质控图上做图的延续:当更换新试剂盒时用新旧批号试剂盒同时测定上述系列质控血清及所选用室内质控血清,从系列质控血清的测定S/CO与其浓度之间的关系得到一新的线性回归直线方程y2=a2x2+b2。当上述选定MPG质控带入计算可得新试剂盒的y2与旧试剂盒试剂y1之间的换算关系。从而可将新批号试剂测定同一浓度质控血清所得的S/CO换算回旧试剂所测的S/CO值,即可仍在原图作图。
2 结果
2.1 测定方法的精密度见表1。
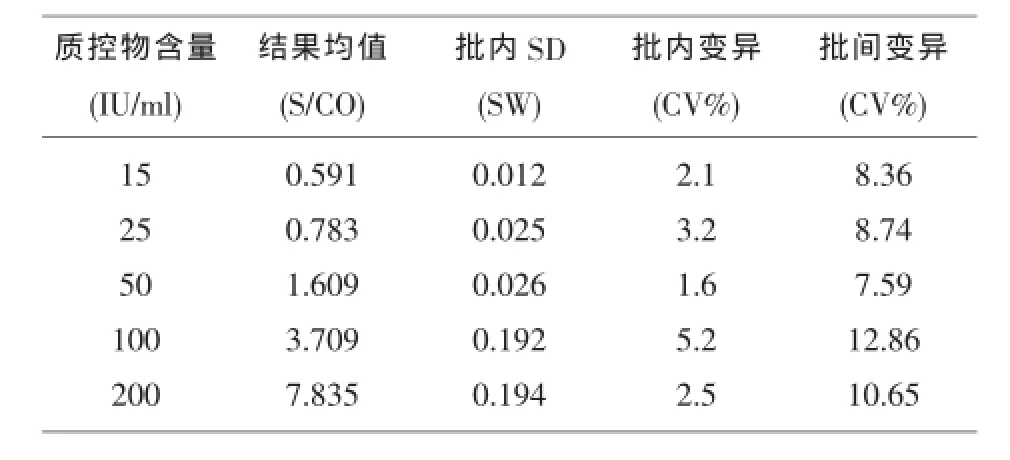
表1 MPG ELISA测定方法的精密度
2.2 MPG-ELISA室内质控物浓度的选择重复4孔测定上述系列(含量分别为0,15,25,50,100,200 IU/ml)质控血清所得结果及回归直线方程见表2。
为尽可能适应方法学的测定线性范围,以取前6个点所得回归直线的相关系数最好,从而得到直线方程y=0.0376x-0.1008,如图1。

表2 系列MPG质控血清测定结果(S/CO)及回归直戏方程

图1 质控物浓度与S/CO的直线回归
分别以血清浓度15、25、50、100、200IU/ml代入方程,计算S/CO值为0.463、0.839、1.779、3.659、7.419。选择其中S/CO大于1.0的三个控制物带入计算,根据前面精密度评价中50IU/ml质控物批间CV为7.59%,可知该质控物得值1.779-3×1.779× 7.59%=1.374,大于1.0,因此可作为室内质控使用。而100IU/ml和200IU/ml的质控物虽然能满足该方法测定线性范围的要求可以作为室内质控评价测定重复性使用,但二者离Cut-Off值距离更远一些。而50IU/ml质控物的S/CO值接近1.5,离Cut-Off值较近,兼具有判断试验重复性和检测下限两种功能,因而可以确定为较理想的定性质控浓度。2.3不同试剂盒间室内质控图作图的延续按照以上对系列质控血清精密度测定的评价数据可以拟合该批试剂的直线回归方程。在更换新试剂盒后按前述方法测定系列质控血清再次得到类似的回归直线方程,见表3。
两试剂前4点,5点或前6点的相关性均较好,故可取前6分别得回归直线方程y1=0.393x2-0.126(201403-1批)和y2=0.0376x1-0.1008 (201405-2批)。取质控物含量x=50IU/ml,得到y1= 1.834和y2=1.779,那么y2/y1=0.970,即作为新的试剂盒对室内质控物测定值(S/CO)与前一批试剂盒的换算因子,用新批号(201405-2批)试剂测值乘以该换算因子所得结果,即可在原质控图上延续作图。

表3 不同批号MPG试剂间回归直线方程的比较
3 讨论
临床实验室使用的诸多定性ELISA试剂盒自带的阴性、阳性对照物仅能监测其试验的有效性,而无法监测试验灵敏性和检测下限的变化,所以需要使用外部弱阳性质控血清进行室内质控,科学地选择质控物浓度以保证检验的准确性。通常要求ELISA测定的批间变异(CV)在15%左右,故可选择S/CO值减去精密度测定中得到的3倍批间CV与该S/CO值的乘积仍大于1的质控血清作为判断试验重复性的室内质控用,同时选择S/CO处于1.5左右的质控血清用以评价试剂盒测定下限的有效性。在本文的设计中我们通过计算得到了MPG质控物的批间变异和直线回归方程及相关系数,确定了50IU/ml作为该定性实验的质控物,同时兼具对检测下限的监控作用。在日常的MPG测定中其测值波动表明临界值附近的样品有可能被误判而出现假阳性、假阴性。因而必须通过以上规则合理的选择质控物浓度才能够更有效地监控试验的重复性及灵敏性,从而保证实验的准确性。
室内质量控制不仅用来监测实验的重复性,而且可以反映实验的准确度[3],因此室内质控是质量控制的核心。通常定性ELISA测定以S/CO比值表示结果,与定量测定结果的绝对浓度不同,S/CO只是相对的比值,因而同一浓度质控物在使用不同测定下限的厂家试剂盒或同一厂家但批号不同的试剂检测时其结果的差异可能发生较大变化[8],导致实验室使用的Levey-Jennings质控图对定性ELISA测定的质控难以不间断连续。为此诸多实验室通常采取Crubbs氏“即刻法”进行质控[9],但这种质控方法有其固有的缺陷,即受前3个测定值影响较大,导致出现原先在控的结果在经历20次后反溯回去又变为失控的现象,此外该方法无法呈现直观的质控图[10]。我们在工作中参考相关研究结果,确认同一质控物经不同批次试剂测定的差异主要是由于测定下限及测定线性范围的差异所致,以及根据试剂盒对一定范围内低浓度样本检测结果呈线性相关的原理,在更换新批次MPGELISA试剂盒时使用新旧两个批号试剂盒同时检测系列质控血清,通过拟合线性回归所得的直线方程,得到新、旧批号试剂盒检测结果(S/CO)在其检测线性范围内的换算因子,从而可以准确地将新试剂盒测定值换算至原试剂测定值,保持原质控图在批间延续。
[1]万腊根,鞠北华,李俊明.ELISA法检测HBsAg室内质控方法及结果分析[J].实验与检验医学,2009,27(4):354-356.
[2]杨亮,杜勇.ELISA室内质控累积均值建立质控图框架的应用探讨[J].中国输血杂志,2013,26(9):821-822.
[3]李金明,王露楠,徐锡霞,等.室内质量控制对乙型肝炎表面抗原测定准确度的影响[J].中华检验医学杂志,2001,24(3):255.
[4]Gray JJ,Wreghitt TG,McKee TA,et al.Internal quality assurance in a clinical virology laboratoryⅡ.Internal quality control[J].J Clin Pathol,1995,48:198-202.
[5]Green GA,Carey RN,Westgard JO,et al.Quality control for qualitative assays:quantitative QC procedure designed to assure analytical quality required for an ELISA of hepatitis B surface antigen[J]. Clin chem,1997,43:1618-1621.
[6]李金明.临床酶免疫测定技术[M].北京:人民军医出版社,2005:168.
[7]冯仁丰.临床检验质量管理技术基础[M].第2版.上海:上海科学技术文献出版社,2007:92-93.
[8]熊丽红,杨莉娜,郭新宇,等.第三代与第四代ELISA试剂检测抗HCV结果的差异性分析[J].实验与检验医学,2015,33(6):733-735.
[9]秦哓光.如何正确理解和使用“即刻性”质控法[J].中华检验医学杂志,2006,29(2):190-192.
[10]王玲玲,汪全民,董玲凤.探讨“即刻法”在ELISA室内质控应用中的局限性[J].实验与检验医学,2008,26(6):703-705.
R446.62,R375+.2
A
1674-1129(2017)01-0068-03
10.3969/j.issn.1674-1129.2017.01.020
2016-08-24;
2016-11-08)

