戊型肝炎病毒ORF3介导的IL-6及STAT3的表达
程态英,李晨阳,罗 云
(1、深圳市龙华区中心医院体检中心,广东深圳518109;2、深圳大学医学院,广东深圳518054)
戊型肝炎病毒ORF3介导的IL-6及STAT3的表达
程态英1,李晨阳2,罗 云1
(1、深圳市龙华区中心医院体检中心,广东深圳518109;2、深圳大学医学院,广东深圳518054)
目的戊型肝炎病毒ORF3蛋白在信号传导中的功能尚未确定,本研究对其是否激活STAT3分子及作用进行探讨。方法采用前期已构建的pEGFP-ORF3真核表达载体转染HepG2细胞;荧光定量PCR方法检测各组IL-6及STAT3的mRNA表达量;ELISA法检测各组上清中IL-6的分泌量;Western blot检测各组STAT3的蛋白表达。结果和对照组比较,转染I型和Ⅳ型ORF3真核表达质粒的HepG2细胞组IL-6以及STAT3 mRNA水平明显升高,培养上清中IL-6分泌增加,STAT3蛋白表达水平无显著性差异,但p-STAT3蛋白表达水平显著增加。结论HEV引起的病毒性肝炎中,ORF3介导的STAT3及IL-6起着重要的作用。
戊型肝炎病毒;开放阅读框3;信号转导和转录激活因子3;白介素6
戊型肝炎是由戊型肝炎病毒(Hepatitis E Virus,HEV)感染引起的肠道传染病;HEV是大多数发展中国家引起急性病毒肝炎的重要病原体之一,是一种人畜共患疾病[1~3]。HEV发现时间较晚,直至1989年才获正式命名;HEV是无包膜的单股正链RNA病毒,基因全长7.2~7.6kb,含3个开放阅读框(Open Reading Frames,ORFs)即ORF1、ORF2、ORF3。ORF1编码非结构蛋白,与病毒RNA复制及合成有关;ORF2是衣壳基因;ORF3基因片段长369 bp(5103~5472),位于病毒基因组3′端,与ORF1和ORF2都有部分的重叠,ORF3编码含123个氨基酸约14kD大小的蛋白,且ORF3的起始端含有Met密码子,可以独立编码多肽。ORF3蛋白的功能尚未确定,可能在信号转导及免疫应答方面起着非常重要的作用。
STAT蛋白家族是一组重要的信号通路分子,目前已发现7种STATs,以STAT3的研究最为深入[4]。研究表明HEV基因ORF2和ORF3部分序列所编码的蛋白能有效激发分泌IFN-γ的T细胞的免疫反应[5],且戊肝急性期IFN-γ、IL-4等细胞因子表达明显增高。这些细胞因子是否激活JAK/STAT3信号通路,及ORF3在激活JAK/STAT3中是否发挥作用目前都不知晓。因此,本研究将通过前期已构建pEGFP-ORF3真核表达载体,对HEV ORF3是否激活STAT3分子及作用进行研究。
1 材料与方法
1.1 材料及试剂前期构建载体的HEV病毒分离自患者粪便,经鉴定基因型分别为I型和Ⅳ型;pEGFP-N1载体、HepG2细胞等由本室保存。胎牛血清购自美国Hyclone公司;DAB显色试剂盒购自上海Beyotime生物技术研究所;Trizol试剂购于北京达科为公司;MMLV逆转录试剂盒购自Fermantas;qRT-PCR试剂购自BioRad;STAT3,p-STAT3抗体、内参和二抗均购自美国Cell Signaling Technology;IL-6 ELISA试剂盒购于美国R&D。
1.2 细胞培养及转染在含10%胎牛血清的DMEM培养基,5%CO2,37℃条件下培养HepG2细胞。采用脂质体转染细胞,转染前1d,以4×105细胞/孔接种对数生长期的HepG2细胞于6孔培养板中,37℃5%CO2孵箱中培养16h后细胞达到70%~80%融合。每种质粒DNA取2.0μg,在1.5ml Ep管中用Opti-MEM培养基稀释至总体积50μl。取3.0μl LipofectamineTM2000用Opti-MEM培养基稀释至总体积50μl,室温放置5min。将上述质粒DNA和脂质体混合,室温放置20min,用PBS及无血清和抗生素的DMEM培养基分别洗细胞1次。每孔加入无血清、无抗生素DMEM培养基0.4ml,将DNA/脂质体混合物分别加人到各孔,37℃、5%CO2培养。6h后换DMEM完全培养基,36h后收集细胞。
1.3 荧光定量PCR技术检测IL-6以及STAT3转录水平以未转染质粒和转染空载质粒为对照组,转染I型和Ⅳ型ORF3真核表达质粒的HepG2细胞为实验组1和实验组2,参照使用说明书用Trizol法抽提总RNA。将RNA样本用MMLV试剂盒逆转录合成cDNA,保存在-80℃。
并利用Primer2.0及Primer-Blast设计待测基因的引物(表1)用于qRT-PCR检测mRNA表达量。所采用的qRT-PCR体系为20μl,其中2×SYBR Premix 10μl,Primers 0.2μmol/L,cDNA 0.5μl;qRT-PCR循环条件如下:95℃变性2min,后以94℃变性15s,55℃退火15s,40个循环;采用△△Ct法计算各目的基因mRNA的表达变化。使用BioRad CFX manager 2.0分析不同感染状态下基因的差异表达情况。
1.4 ELISA检测各组上清中IL-6分泌水平收集各组上清液,-20℃保存,测定前置室温复融,混匀,4℃3000r/min离心5min,取上清液按ELISA试剂盒说明书进行操作,检测IL-6的表达。
1.5 Western Blot检测各组STAT3和p-STAT3蛋白表达用0.25%胰蛋白酶消化细胞,1000r/min离心10min收集细胞,超声粉碎后4℃12000r/min离心20min,取少量用Bradford法测定蛋白浓度。取25ug蛋白经100g/L SDS-聚丙烯酰胺凝胶电泳分离,将剪好大小的PVDF膜放入甲醇溶液中10s激活,然后将PVDF膜和厚滤纸一起浸入半干转缓冲液中,室温浸泡30min;参照蛋白Marker切取所需目的蛋白所在的分离胶,浸入半干转缓冲液中;采用恒压20V转膜;转移结束后加入封闭液(含5%脱脂奶粉的PBS-T溶液),平缓摇动的摇床平台上于室温温育1h,加入一抗,置于4℃摇床过夜。用辣根过氧化物酶标记的二抗检测蛋白表达。用成像系统进行光密度扫描,对扫描结果进行统计学处理。
1.6 统计学分析应用SPSS 14.0软件对数据进行统计分析,各组数据以均值±标准差(x±s)表示,多个样木均数比较采用单因素方差分析(组间两两比较用Bonferroni法),以P<0.05为差异有统计学意义。

表1 qRT-PCR引物序列
2 结果
2.1 各组IL-6以及STAT3转录水平未转染质粒和转染空载质粒两组对照组之间,IL-6以及STAT3转录水平无显著性差异(P>0.05,n=6)。转染I型和Ⅳ型ORF3真核表达质粒的HepG2细胞组和对照组相比较,IL-6以及STAT3 mRNA水平明显升高,差异具有统计学意义(P<0.05,n=6)(见图1)。
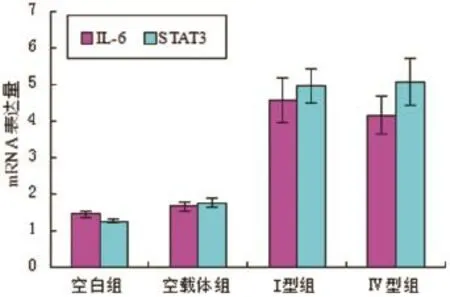
图1 各实验组IL-6以及STAT3 mRNA表达水平
2.2 各组IL-6分泌水平未转染质粒和转染空载质粒两组对照组之间,IL-6白介素分泌水平无显著性差异(P>0.05,n=6)。转染I型和Ⅳ型ORF3真核表达质粒的HepG2细胞组和对照组相比较,细胞培养上清中IL-6以分泌水平明显升高,差异具有统计学意义(P<0.05,n=6)(见图2)。
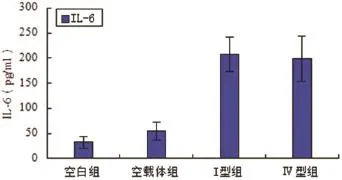
图2 各实验组IL-6分泌水平
2.3 各组STAT3和p-STAT3蛋白表达水平未转染质粒和转染空载质粒两组对照组之间,STAT3及p-STAT3蛋白表达水平无显著性差异(P>0.05,n= 6)。转染I型和Ⅳ型ORF3真核表达质粒的HepG2细胞组和对照组相比较,STAT3蛋白表达水平也无显著性差异(P>0.05,n=6),但p-STAT3蛋白表达水平存在显著性差异(P<0.05,n=6)(见图3)。
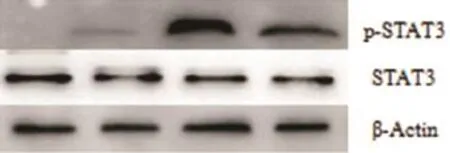
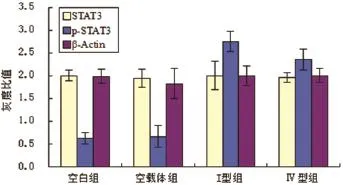
图3 各组STAT3/p-STAT3蛋白表达水平
3 讨论
HEV是大多数发展中国家引起急性病毒肝炎的重要病原体之一,人类在密切接触家禽或食用未经充分烹饪的动物内脏和肌肉后可以感染HEV[1,2]。近年来,随着社会经济发展,人民群众生活水平和卫生素养提高,以及疫苗的使用等原因,霍乱、甲肝等肠道传染病报告病例数呈逐年下降态势,但同为主要通过粪-口途径传播的戊肝疫情却一直呈缓慢上升态势。在我国成年人急性病毒性肝炎中戊肝已占首位,人畜共患已成为我国戊肝的主要传播模式[6-9]。同时,戊肝有与其他肝炎不同的流行特点,即重型病例多,易发生肝功能衰竭[10]。其发病机制可能与病毒直接损伤肝细胞和免疫损伤相关,但其具体致病机制不明。HEV含3个ORF,其中ORF3蛋白含有多个保守的结构域,C末端的脯氨酸丰富区存在可与SH3结构域结合的PXXP基序,可能通过激活信号通路,影响基因的转录速度和表达水平来调控细胞的生长及凋亡等多种过程[11,12]。杜丽等人研究了戊型肝炎病毒ORF3蛋白对于靶细胞MAPK磷酸化的影响,结果表明ORF3蛋白影响了HEK293细胞的p-Akt2、p-Aktpan、p-ERK1、p-ERF2、p-RSK1等MAPKs的磷酸化水平[13];许剑等人研究发现,基因Ⅰ型戊型肝炎病毒ORF3抑制TNF-α诱导的NF-κB信号传导[14]。周嘉嘉等人研究表明,丙型肝炎病毒核心蛋白通过活化STAT3通路促进肝癌细胞上皮间质转化[15]。这些研究均提示,ORF3在戊肝的发展中起着重要作用,而且和STAT3等信号通路相关。
STAT蛋白家族是一组可以被许多细胞因子、生长因子和其它刺激所激活的信号通路分子,以STAT3的研究最为深入[4]。STAT3是一种存在于细胞浆与酪氨酸磷酸化信号通道偶联的双功能蛋白。受到刺激后,STAT3在一个特定的酪氨酸位点(Tyr705)发生磷酸化,激活的STAT3形成同源或异源二聚体而转移至胞核,然后与特定的启动基因结合,如早期即刻基因c-fos和jun-B启动基因等[16,17]。IFN-γ、IL-6、IL-10的信号传导都需要STAT的参与,根据靶组织的不同,STAT3激活的结果可以是增殖、存活或者凋亡。IL-6家族的信号转导均主要依赖于STAT3,且均受细胞因子信号转导抑制分子3(suppressor of cytokine signaling 3,SOCS3)调控,但对SOCS3的调控敏感性不同[18]。我们本次研究发现,转染I型和Ⅳ型ORF3真核表达质粒的HepG2细胞组和对照组相比较,IL-6的mRNA及上清中表达水平均明显升高,STAT3的mRNA水平都较对照组增高,差异有显著性意义。说明IL-6及STAT3在ORF3引起的肝损伤中起着重要作用。但是在蛋白表达水平,空白对照组和实验对照组之间,STAT3及p-STAT3蛋白表达水平无显著性差异。转染I型和Ⅳ型ORF3真核表达质粒的HepG2细胞组和对照组相比较,STAT3蛋白表达水平也无显著性差异,但p-STAT3蛋白表达水平存在显著性差异,差异具有统计学意义。说明在ORF3引起的肝损伤中STAT3是通过磷酸化的方式发挥作用。
IL-6的信号转导主要依赖于STAT3的参与[19]。IL-6与其膜受体结合后,激活STAT3,使其二聚化进入核内启动多种基因转录活化,启动多种效应,包括细胞增殖反应、急性炎症反应以及细胞凋亡等。IL-6、STAT3在HBV及HCV等引起的急性肝炎中所起的作用有很多的报道[20,21],但IL-6在HEV引起的戊肝中的作用机制还不清楚。我们研究中发现,IL-6的mRNA及上清中表达水平均明显升高,和Pradip B.Devhare[22]等研究的结果相一致,但和Lei Q等研究结果不一致[23],分析可能的原因是:第一,IL-6在多种疾病及疾病的不同阶段表达不一致,与疾病的进展相关;第二,选择不同的细胞系对ORF3的表达产生影响;第三,Lei Q在实验前用LPS进行了共同刺激所引起;因此,IL-6在戊肝中的作用还需进一步研究。在HEV引起的戊肝中,推测可能是肝内IL-6的增加,引起STAT3的活化,活化的STAT3引起识别受体的进一步活化,通过一系列信号转导,引起IL-6表达增加,形成持续的肝脏损伤状态,是否存在这种正反馈循环,还需进一步验证。本文研究证明,在HEV引起的戊肝中,ORF3介导的STAT3及IL-6起着重要的作用,同时,ORF3、STAT3及IL-6可能会成为急性戊肝治疗的潜在靶点。本文将为进一步深入研究HEV的致病及防治机制提供了一个新的思路。
参考文献
[1]Montesano C,Giovanetti M,Ciotti M,et al.Hepatitis E Virus Circulation in Italy:Phylogenetic and Evolutionary Analysis[J].Hepat Mon,2016,16(3):e31951.
[2]Ram D,Manor Y,Gozlan Y,et al.Hepatitis E Virus Genotype 3 in Sewage and Genotype 1 in Acute Hepatitis Cases,Israel[J].Am J Trop Med Hyg,2016,95(1):216-220.
[3]栗陶钦.2013年-2014年大同煤矿集团健康体检者甲型肝炎IgM抗体、戊型肝炎IgM抗体检测结果分析[J].实验与检验医学,2016,34(1):111-112.
[4]Hu X,Ivashkiv LB.Cross-regulation of signaling pathways by interferon-gamma:implications for immune responses and autoimmune diseases[J].Immunity,2009,31(4):539-550.
[5]TW,JZ,Zj S,et al.Specific cellular immune responses in hepatitis E patients[J].Inter virology,2008,51(5):322-327.
[6]俞以内.基于时空分析的中国戊肝分布及其成因研究[D].杭州:浙江师范大学,2014.
[7]薛黎坚,王文明,王华,等.昆山市2005-2012年戊肝流行病学特征研究[J].现代预防医学,2014,41(10):1745-1747.
[8]周力,刘宇琼,王亮,等.戊肝流行病学特征及慢性化研究现状[J].中国卫生工程学,2013,12(04):345-348.
[9]吴集才,吴建英,张敏.景德镇市涉及公共卫生从业人员甲型、戊型肝炎病毒IgM抗体检测结果分析[J].实验与检验医学,2015,33 (01):115-116.
[10]Dalton HR,Bendall R,Ijaz S,et al.Hepatitis E:an emerging infection in developed countries[J].Lancet Infect Dis,2008,8(11):698-709.
[11]Wang C,Guo L,Yu D,et al.HEV-ORF3 Encoding Phosphoprotein Interacts With Hepsin[J].Hepat Mon,2014,14(1):e13902.
[12]Kar-Roy A,Korkaya H,Oberoi R,et al.The hepatitis E virus open reading frame 3 protein activates ERK through binding and inhibition of the MAPK phosphatase[J].J Biol Chem,2004,279(27):28345-28357.
[13]杜丽,成鹰,史巧芸,等.基因Ⅳ型戊型肝炎病毒ORF3对HEK293细胞MAPKs磷酸化的影响[J].动物医学进展,2014,35(4):46-48. [14]许剑.基因Ⅰ型戊型肝炎病毒ORF3抑制TNF-α诱导的核因子-κB信号机制研究[D].武汉:华中科技大学,2015.
[15]周嘉嘉,陈汝福,邓小耿,等.丙型肝炎病毒核心蛋白通过活化stat3通路促进肝癌细胞上皮间质转化的研究[J].中华普通外科学文献(电子版),2015,9(6):431-436.
[16]Gigante M,Diella S,Ranieri E.Targeting the JAK/STAT Pathway in Cytotoxic T lymphocytes(CTL)by Next Generation Sequencing (NGS)[J].Methods Mol Biol,2014,1186:253-268.
[17]El-Habr EA,Levidou G,Trigka EA,et al.Complex interactions between the components of the PI3K/AKT/mTOR pathway,and with components of MAPK,JAK/STAT and Notch-1 pathways,indicate their involvement in meningioma development[J].Virchows Arch,2014,465(4):473-485.
[18]Hong F,Jaruga B,Kim WH,et al.Opposing roles of STAT1 and STAT3 in T cell-mediated hepatitis:regulation by SOCS[J].J Clin Invest,2002,110(10):1503-1513.
[19]Gao B,Wang H,Lafdil F,et al.STAT proteins-key regulators of anti-viral responses,inflammation,and tumorigenesis in the liver[J]. J Hepatol,2012,57(2):430-441.
[20]Zhao LJ,He SF,Wang W,et al.Interferon alpha antagonizes STAT3 and SOCS3 signaling triggered by hepatitis C virus[J].Cytokine,2016,80:48-55.
[21]Li YX,Ren YL,Fu HJ,et al.Hepatitis B Virus Middle Protein Enhances IL-6 Production via p38 MAPK/NF-kappaB Pathways in an ER Stress-Dependent Manner[J].PLoS One,2016,11(7):e159089.
[22]Devhare PB,Chatterjee SN,Arankalle VA,et al.Analysis of antiviral response in human epithelial cells infected with hepatitis E virus [J].PLoS One,2013,8(5):e63793.
[23]Lei Q,Li L,Cai J,et al.ORF3 of Hepatitis E Virus Inhibits the Expression of Proinflammatory Cytokines and Chemotactic Factors in LPS-Stimulated Human PMA-THP1 Cells by Inhibiting NF-kappaB Pathway[J].Viral Immunol,2016,29(2):105-111.
Expression of STAT3 and IL-6 mediated by ORF3 of hepatitis E virus
CHENG Taiying,LI Chenyang,LUO Yun.1.Medical Examination Center,Longhua District Central Hospital,Shengzhen Guangdong 518109,China;2.Shenzhen University Health Science Center,Shengzhen Guangdong 518054,China.
Objective The functions of hepatitis E virus ORF3 protein in signal transduction has not been determined,this study was to investigate whether STAT3 molecule is activated and plays its role.MethodsThe eukaryotic expression vector EGFP-ORF3 which previously constructed was transfected into HepG2 cells;The lever of interleukin 6(IL-6)/signal transducers and activators of transduction 3(STAT3)transcription and cytokine IL-6 secretion in different groups was compared using qRTPCR and ELISA respectively.The protein expression of STAT3 was detected using Western blot.Results The lever of IL-6/ STAT3 transcription and IL-6 secretion in the experimental group was significantly higher than control.There was no significant difference in the expression of STAT3 protein levels,but a significant increase in p-STAT3.Conclusion Expression of STAT3 and IL-6 mediated by ORF3 of hepatitis E virus plays an important role in the E hepatitis.
Hepatitis E virus;ORF3;STAT3;IL-6
R446.62,R373.2
A
1674-1129(2017)01-0028-04
10.3969/j.issn.1674-1129.2017.01.008
2016-08-10;
2017-01-13)
深圳市卫生计生系统科研项目资助(20140613100)
程态英,1974年生,女,副主任检验师,医学学士,主要从事病原微生物感染检测及机制研究,TEL:0755-28011765。

