不同剂量酵母和腺嘌呤诱导大鼠痛风性肾病模型的建立比较
蓝伦礼,江 滨,刘梦楚,邹晓红,曹 骋,曾元儿,庞嘉颖
(广州中医药大学中药学院中药分析实验室,广州 510006)
研究报告
不同剂量酵母和腺嘌呤诱导大鼠痛风性肾病模型的建立比较
蓝伦礼,江 滨,刘梦楚,邹晓红,曹 骋,曾元儿,庞嘉颖
(广州中医药大学中药学院中药分析实验室,广州 510006)
目的 探讨不同剂量酵母、腺嘌呤和不同造模持续时间对大鼠痛风性肾病模型的影响。方法 模型组雄性SD大鼠用15 g/kg酵母粉和50 mg/kg、100 mg/kg腺嘌呤分别灌胃,同时分别设置8、10、22、48的造模天数。比较各组肾脏肥大指数的大小,检测大鼠肾功能,尿液指标的变化,肾皮质β-N-乙酰氨基葡萄糖苷酶(NAG)含量,肝脏黄嘌呤氧化酶(XOD)活性的变化,同时观察大鼠肾脏病理改变。并用免疫组化技术检测肾脏组织NGAL、OAT1和TIMP-1的表达。结果 随着模型组造模剂浓度的增加和造模时间的延长,肾脏病理改变越明显。100 mg/kg腺嘌呤和15g/kg酵母共同造模8 d,与正常对照组比较,该组肾脏病理组织变化明显,炎性细胞浸润肾小管上皮细胞肿胀,肾小管和肾小球结构未被破坏;肾脏肥大指数较正常对照组增大(P<0.01);与正常对照组比较,模型A组,B组、E组、F组肾功能下降(P<0.01),模型A组、B组、E组、F组大鼠的24 h尿量,尿蛋白含量增多(P<0.01)。模型E组大鼠肾组织NGAL、TIMP-1的表达高于正常组大鼠(P<0.01),OAT1的表达低于正常组大鼠(P<0.01)。结论 100 mg/kg腺嘌呤和15 g/kg酵母共同造模8 d为较理想的造模剂量和造模持续时间,痛风性肾病模型大鼠肾损伤受蛋白NGAL、TIMP-1和OAT1的影响。
痛风性肾病;酵母;腺嘌呤;肾功能
痛风性肾病,又称尿酸性肾病(uric acid nephropathy,UAN),是由于体内嘌呤代谢出现紊乱,使血中尿酸生成过多或肾脏排泄减少,导致血中尿酸呈过饱和状态,从而使尿酸结晶沉积于肾髓质、间质或远端集合管引起的肾损害[1]。UAN主要以腰酸痛、多尿、夜尿、尿血、尿结石、肾绞痛、水肿、高血压等临床症状为主。痛风性肾病属西方的一种常见病,发病率约为0.3%。随着人们生活方式的改变和饮食结构中高嘌呤食物的大量摄入,此病的发病率在逐年上升。随着病情的演进恶化,痛风性肾病最终导致肾衰竭的形成,欧洲透析移植协会报道终末期肾衰由痛风所致者占0.6~1.0%[2]。目前,中西医对痛风性肾病的研究还处于初级阶段,而建立与临床发病机制类似的动物模型是痛风性肾病药物的筛选和开发的关键,因此 ,在以往研究的基础上,参考现有的酵母法[3,4]、腺嘌呤法[5]及酵母联合腺嘌呤法[6]。从大鼠的一般状况、肾脏肥大系数,尿蛋白定量、肾功能指标、肾皮质N-乙酰-β-D-葡萄糖苷酶(N-acetyl-β-D-glucosaminidase,NAG)含量,肝脏黄嘌呤氧化酶 (xanthine oxidase, XO)活性,肾脏病理变化等方面,探讨痛风性肾病模型的改进方法。本实验通过多次灌胃酵母和腺嘌呤诱导大鼠痛风性肾病模型,皆在探讨不同剂量酵母、腺嘌呤和不同造模持续时间对大鼠痛风性肾病模型的影响,以寻找符合人类痛风性肾病发病机制理想的动物,以供痛风性肾病药物的筛选及药物作用机制研究。
1 材料
1.1 动物
SD大鼠57 只,2月龄,雄性。体重220~250 g,SPF级,来源于广州中医药大学实验动物中心[实验动物生产许可证号【SCXK(粤)2013-0020 NO.44005900002210】 饲养环境: SPF 级,每笼6 只,温度( 23 ± 2)℃,湿度(55±5)%,12 /12 h 光照黑暗循环(光照时间7:00~19:00)饲养地点:广州中医药大学实验动物中心SPF 级动物饲养房,实验单位使用许可证编号为【SYXK(粤)2013-0085】。
1.2 试剂
酵母提取粉(广东环凯微生物科技有限公司),批号3204100,规格400 g/瓶;腺嘌呤(Sigma公司),批号101498252,规格100 g/瓶。β-N-乙酰氨基葡萄糖苷酶(NAG)试剂盒,尿蛋白定量试剂盒,尿酸(UA)测试盒,尿素氮(BUN)测试盒,肌酐 (Cr) 测定试剂盒(肌氨酸氧化酶法),均购于南京建成生物公司。一抗:兔抗鼠OAT1(阴离子转运蛋白1抗体,Organic Anion Transporter)(批号:BA3402,博士德生物技术有限公司);一抗:兔抗鼠NAGL(脂质运载蛋白抗体,neutrophil gelatinase-associated lipocalin)(批号:BA3435,博士德生物技术有限公司);一抗:兔抗鼠TIMP-1(基质金属蛋白酶抑制剂-1,tissue inhibitor of metalloproteinase-1)(批号:BA3727,博士德生物技术有限公司);二抗:兔IgG免疫组化试剂盒(批号:SA1022,博士德生物技术有限公司);3,3’-diaminobenzidine tetrahydrochloride(DAB)(批号:AR1022,博士德生物技术有限公司提供)。
1.3 仪器
电子天平JJ300(双杰测试仪器厂);分析天平AEG220(岛津制作所);KQ-300DE型超声波清洗仪器(昆山市超声仪器有限公司);BK-DM500型数码生物显微镜(重庆奥特);Leica RM2015型切片机(德国徕卡公司)。

表1 实验分组及造模方案
2 方法
2.1 试剂的配制
以蒸馏水为溶剂酵母粉配成1.5 g/mL的酵母混悬液;腺嘌呤配制成50 mg/mL和100 mg/mL的混悬液。
2.2 建模与实验分组
将SD大鼠适应性喂养1 周,随机分为正常对照组9 只和模型组48 只,正常对照组给予等体积的蒸馏水灌服,模型组随机分配为6 组,分别为A、B、C、D、E、F组,造模期间,两组动物自由饮水,喂饲相同质量的饲料,每天观察大鼠的状态(表1)。
2.3 检测指标
各组大鼠分别于造模结束前一日,收集24 h尿液,测定24 h尿量及尿蛋白含量。各组大鼠分别于造模结束前一日,禁食不禁水24 h,称量大鼠体重(BW),以20%乌拉坦溶液腹腔注射,麻醉大鼠,解剖后腹主动脉取血,静置离心后取血清并于全自动生化仪上测定尿酸值、尿素氮和肌酐。分离双肾,记录双肾总重(KW),
按公式肾脏肥大指数(KHI):KHI=(KW/BW)×103
计算肾脏肥大指数。甲醛固定24 h后制备病理切片。全肾组织以4%多聚甲醛固定,常规石蜡包埋,行5 μm连续切片,HE染色,光镜下观察肾小管、肾小球以及肾脏病理改变和炎症细胞浸润情况。取肾皮质匀浆后,按照试剂盒说明书测定各组大鼠肾皮质N-乙酰-β-D-葡萄糖苷酶(N-acetyl-β-D-glucosaminidase, NAG)含量;取1 g肝脏制备成肝匀浆,用HPLC法检测肝脏黄嘌呤含量,评价大鼠肝脏黄嘌呤氧化酶活性。
2.4 免疫组织化学染色观察大鼠肾组织蛋白NGAL、TIMP-1、OAT1的表达
选定最适宜模型组大鼠的肾脏组织运用免疫组化法检测大鼠肾组织蛋白NGAL、TIMP-1、OAT1的表达。
2.5 统计学方法
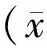
3 实验结果
3.1 各组大鼠一般情况比较
实验过程中每日观察各组大鼠,与正常对照组相比,模型A组大鼠随着造模时间的增加,尤其在造模第36天后(即加入腺嘌呤联合造模时)其活动严重减少,弓背蜷缩、体毛疏松、多尿、泄泻,至造模结束,上述症状愈发明显;在造模第8天(酵母和腺嘌呤联合造模的第3天,B组大鼠饮食量开始减少,多尿,且所在鼠笼的垫料较潮湿;C组大鼠的饮食,饮水,体毛及精神状态无明显异常现象;D组大鼠的饮食,饮水,体毛及精神状态无明显异常现象;在酵母和腺嘌呤联合造模的第3天后,E组大鼠采食减少,E组大鼠所在鼠笼的垫料较湿;在酵母和腺嘌呤联合造模的第3天后,F组大鼠,饮食减少,多尿,所在鼠笼的垫料较湿。
3.2 各组大鼠肾脏肥大指数比较

与正常对照组比较**P<0.01, *P<0.05图1 各组大鼠肾脏肥大指数比较Note: Compared with the normal control group, *P<0.05, **P<0.01.Fig.1 Comparison of kidney hypertrophy indexes in all groups
由图1可知,与正常对照组大鼠相比,模型A组、B组、E组、F组大鼠的肾脏肥大系数明显增大 (P<0.01),模型A组增加最明显,模型B组次之,随着造模剂量和造模天数的增加,肾脏肥大系数逐渐增大;模型C组和模型D组大鼠的肾脏肥大系数增大不明显,差异无统计学意义(P>0.05)。

Tab.2 Comparison of kidney hypertrophy


组别Groups例数Cases肾脏肥大指数均值MeanvalueofKHIP值Pvalue正常对照组Normalcontrolgroup967924±07457模型A组ModelgroupA6158595±19772∗∗0000模型B组ModelgroupB12117187±17937∗∗0000模型C组ModelgroupC674518±070860448模型D组ModelgroupD681745±173290115模型E组ModelgroupE1288571±21587∗∗0006模型F组ModelgroupF697396±11655∗∗0001
注:与正常对照组相比,*P<0.05,**P<0.01
Note: Compared with the normal group,*P<0.05,**P<0.01.
由表2所示,与正常对照组大鼠相比,模型A组、B组、E组、F组大鼠的肾脏肥大系数明显增大 (P<0.01),模型C组和模型D组大鼠的肾脏肥大系数增大不明显,差异无统计学意义(P>0.05)。
3.3 各组大鼠肾功能比较
由表3可知,与正常对照组比较,模型A组,B组、E组、F组大鼠的血清尿酸水平上升明显(P<0.01),模型C组和模型D组大鼠的血清尿酸水平上升不明显,差异无统计学意义(P>0.05)。与正常对照组比较,模型A组,B组、E组、F组大鼠的血清尿素氮值上升明显(P<0.01),模型C组和模型D组大鼠的血清尿素氮上升不明显,差异无统计学意义(P>0.05)。与正常对照组比较,模型A组,B组、E组、F组大鼠的血清肌酐值上升均明显(P<0.01),模型C组和模型D组大鼠的血清肌酐值上升不明显,差异无统计学意义(P>0.05)。
由表4可知,与正常对照组比较,模型A组,B组、D组、E组、F组大鼠的24 h尿量增多(P<0.01),模型C组大鼠的24 h尿量增多 (P<0.05)。与正常对照组比较,模型A组、B组、E组、F组大鼠的尿PH值降低(P<0.01),模型C组和模型D组大鼠的尿pH值降低不明显,差异无统计学意义(P>0.05)。与正常对照组比较,模型A组、B组、E组、F组大鼠的24 h尿蛋白含量增多(P<0.01),模型C组和模型D组大鼠的24 h尿蛋白含量增多不明显,差异无统计学意义(P>0.05)。
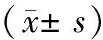
表3 各组大鼠肾功能比较
注:与正常对照组相比,*P<0.05,**P<0.01。
Note:Compared with the normal group,*P<0.05,**P<0.01.
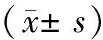
表4 各组大鼠尿液指标比较
注:与正常对照组相比,*P<0.05,**P<0.01。
Note: Compared with the normal group,*P<0.05,**P<0.01.

Tab.5 Comparison of the liver xanthine oxidase


分组Groups例数(Case)黄嘌呤含量(μg/g)Xanthinecontent(μg/g)正常对照组Normalcontrolgroup918402±4822模型A组ModelgroupA632454±5196∗∗模型B组ModelgroupB1227715±4645∗∗模型C组ModelgroupC621373±3959模型D组ModelgroupD624259±2067∗模型E组ModelgroupE1226832±5226∗∗模型F组ModelgroupF627117±2130∗∗
注:与正常对照组相比,*P<0.05,**P<0.01。
Note: Compared with the normal group,*P<0.05,**P<0.01.
表6 各组大鼠肾皮质β-N-乙酰氨基葡萄糖苷酶
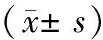
Tab.6 Comparison of the NAG content in
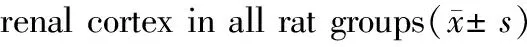
组别Groups例数CasesN⁃乙酰⁃β⁃D⁃葡萄糖苷(U/gprot))NAG(U/gprot))正常对照组Normalcontrolgroup915920±2859模型A组ModelgroupA623641±3499∗∗模型B组ModelgroupB1221331±2910∗∗模型C组ModelgroupC616880±3586模型D组ModelgroupD620350±2564∗模型E组ModelgroupE1220930±5664∗∗模型F组ModelgroupF621733±2972∗∗
注:与正常对照组相比,*P<0.05,**P<0.01。
Note: Compared with the normal control group,*P<0.05,**P<0.01.
3.4 各组大鼠肝脏黄嘌呤氧化酶活性比较
由表5可知,与正常对照组大鼠相比,模型A组、B组、E组、F组大鼠的肝脏黄嘌呤含量显著增加(P<0.01),模型D组大鼠的肝脏黄嘌呤含量增加,差异具有统计学意义(P<0.05)。
3.5 各组大鼠肾皮质NAG含量比较
由表6可知,与正常对照组大鼠相比,模型A组、B组、E组、F组大鼠的肾皮质NAG含量升高明显(P<0.01),模型D组大鼠肾皮质NAG含量升高(P<0.05)模型C组大鼠肾皮质NAG含量有升高趋势,但无统计学意义(P>0.05)。
3.7 肾脏病理学检查
3.7.1 肉眼观察:正常对照组的大鼠肾脏表面呈浅褐色,无其他明显病变,皮髓质交界清楚。模型A组大鼠的肾脏颜色为褐色,肾脏体积明显变大,含有密布乳白色的颗粒,形成白色的斑纹,髓质和锥体有大量白色向外辐射状射线,切面皮髓质有充血和水肿,皮髓质交界清楚。模型B组大鼠肾脏为褐色,白色颗粒较多,髓质和锥体存在向外辐射状的白色射线,程度较重,髓皮质交界清楚。模型C、D组大鼠肾脏较深,其外观与正常对照组对照几乎无异,皮髓质交界清楚。模型E、F组大鼠肾脏的外观相近,为深褐色,有少量乳白色颗粒,髓质和锥体有少量向外辐射的白色射线,髓皮质交界清楚。
3.7.2 显微观察:
3.7.2.1 肾脏 HE染色:切取肾脏,苏木素-伊红(HE)染色作病理切片,分别置于100倍(图2)和400倍(图3)进行肾脏病理形态学观察,观察各组大鼠肾脏损伤程度。镜下观察结果显示:正常对照组大鼠肾皮质中可清晰看见肾小球、肾小管、肾小囊和致密斑等结构,结构未见明显病理改变。
模型 A组大鼠肾脏肾皮质中的肾小球结构毁坏,肾小管上皮细胞肿胀明显,且有大量上皮细胞发生坏死,细胞核与细胞脱离,部分肾小管呈囊性扩张,肾小管管腔中和周围可见大量炎性细胞浸润,间质可见纤维组织增生。可见红棕色的尿酸盐结晶。
模型 B组大鼠肾脏的皮质中肾小管发生明显的坏死,部分肾小管上皮细胞肿胀明显,管中可见坏死的上皮细胞和炎性细胞形成的脓团,坏死的面积较模型A组少,间质中可见明显的炎性细胞浸润,未见尿酸盐结晶。
模型 C组大鼠肾脏肾皮质中可见肾小球及周围肾小管,肾间质中血管以及肾小球部分充血,其它病理改变不明显。
模型 D组大鼠肾脏局部区域可见肾小管成囊状扩张和上皮细胞扁平化,间质中可见炎性细胞浸润,肾间质中血管以及肾小球内的充血更为严重。
模型 E组大鼠肾脏肾小管上皮细胞肿胀,可见腔中有坏死的上皮细胞和炎性细胞,管腔扩张明显,同时伴有上皮细胞扁平化,肾小球萎缩或充血。
模型F组大鼠肾脏肾小管上皮细胞肿胀,部分坏死明显,可见腔中炎性细胞和坏死的上皮细胞,上皮细胞与其细胞核分离,管腔扩张明显,同时伴有上皮细胞扁平化,间质中可见炎性细胞浸润。
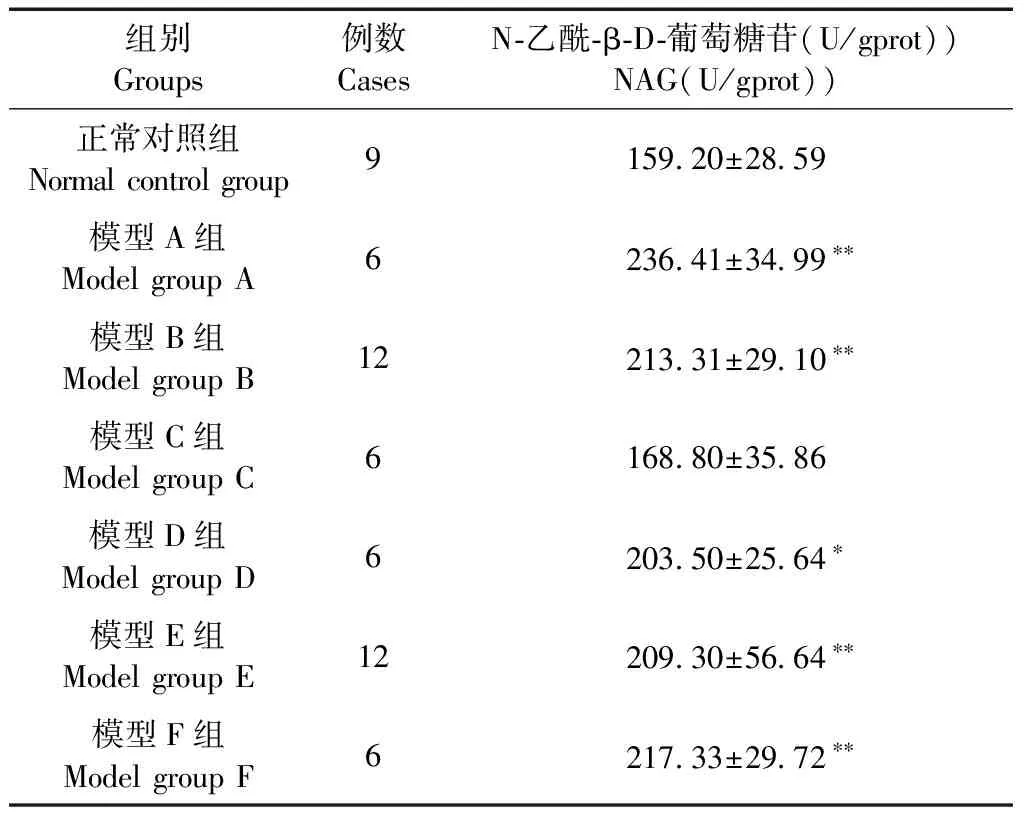
3.7.2.2 大鼠肾脏组织免疫组化结果比较:由图4、图5得知,在正常对照组组中,肾脏组织切片仅见极少部分的肾小管上皮细胞胞浆中表达蛋白NGAL,模型E组肾小管上皮细胞胞浆NGAL的表达明显高于正常对照组(P<0.01)。
由图6、图7得知,在正常对照组组中,肾脏组织切片肾小管上皮细胞胞浆表达蛋白OAT1,模型E组肾小管上皮细胞胞浆中蛋白OAT1的表达明显低于正常对照组(P<0.01)。
由图8、图9得知,在正常对照组组中,肾脏组织切片仅见极少部分的肾小管上皮细胞胞浆表达蛋白TIMP-1,模型E组肾小管上皮细胞胞浆TIMP-1的表达明显高于正常对照组(P<0.01)。
由表7可知,在正常组大鼠中,肾脏组织切片仅见极少部分的肾小管上皮细胞表达NGAL、TIMP-1,模型E组肾脏组织的蛋白NGAL、TIMP-1 A值大于正常组(P<0.01);模型E组肾脏组织的蛋白OAT1的A值明显低于正常组(P<0.01)。
4 结论
模型A组、B组、F组大鼠肾功能及尿液指标与正常对照组大鼠比较,差异均有显著性意义(P<0.01)。模型A组和B组,造模时间最长,肾小球、肾小管损伤严重,肾脏结构不同程度损坏,已造成不可逆肾脏衰竭模型,模型F组大鼠肾脏有较大面积的肾小管上皮细胞坏死,模型过重。模型C组和D组,与正常对照组比较,差异无统计学意义(P>0.05),模型过轻,均不利于防治痛风性肾病药物的筛选和评价。模型E组在肾功能,肾脏肥大指数都与正常对照组差异有统计学意义,且在肾脏病理变化上主要为肾小管受累,肾小球未受损伤,总体肾脏病变适中,符合药物筛选的疾病模型,因此模型E组为较理想的大鼠痛风性肾病模型。免疫组化结果表明,模型组大鼠肾组织NGAL、TIMP-1表达明显高于正常组,模型组大鼠肾组织OAT1的表达则明显低于正常组大鼠。

表7 两组大鼠肾脏免疫组化检测结果比较± s)
注:与正常对照组相比,*P<0.05,**P<0.01。
Note: Compared with the normal control group,*P<0.05,**P<0.01.

A.正常组(Normal control group) B. 模型A组(Model group A) C. 模型B组(Model group B) D. 模型C组(Model group C) E. 模型D组(Model group D) F.模型E组(Model groupE) G. 模型F组(Model Fgroup)图2 各组大鼠肾脏病理组织改变(HE染色,标尺=20 μm)Fig.2 The renal pathological changes in the rat groups. (HE staining, Bar=20 μm)

肾小球(Glomerulus, G),肾小囊(Bowman capsule, BC),致密斑(Macula densa, MD),肾小管(Rental tubule, RT)A.正常组(Normal control group) B. 模型A组(Model group A)C. 模型B组(Model group B) D. 模型C组(Model group C) E. 模型D组(Model group D)F.模型E组(Model group E) G. 模型F组(Model group F)
图3 各组大鼠肾脏病理组织改变(HE染色,标尺=20 μm)
Fig.3 The renal pathological changes in the rat groups (HE staining,Bar=20 μm)

正常对照组(Normal control group) 模型E组(Model E group)图4 两组大鼠肾脏组织NGAL的表达,(免疫组化标尺=20 μm)Fig.4 Expression of NGAL in the kidney tissue of the two rat groups, ( Immunohistochemical staining, Bar=20 μm)

图5 两组大鼠肾脏NGAL阳性表达的A值比较Fig.5 Comparison of kidney NGAL positive expression in the two rat groups

图7 两组大鼠肾脏OAT1阳性表达的A值比较Fig.7 Comparison of the kidney OAT1 positive expression in the two rat groups
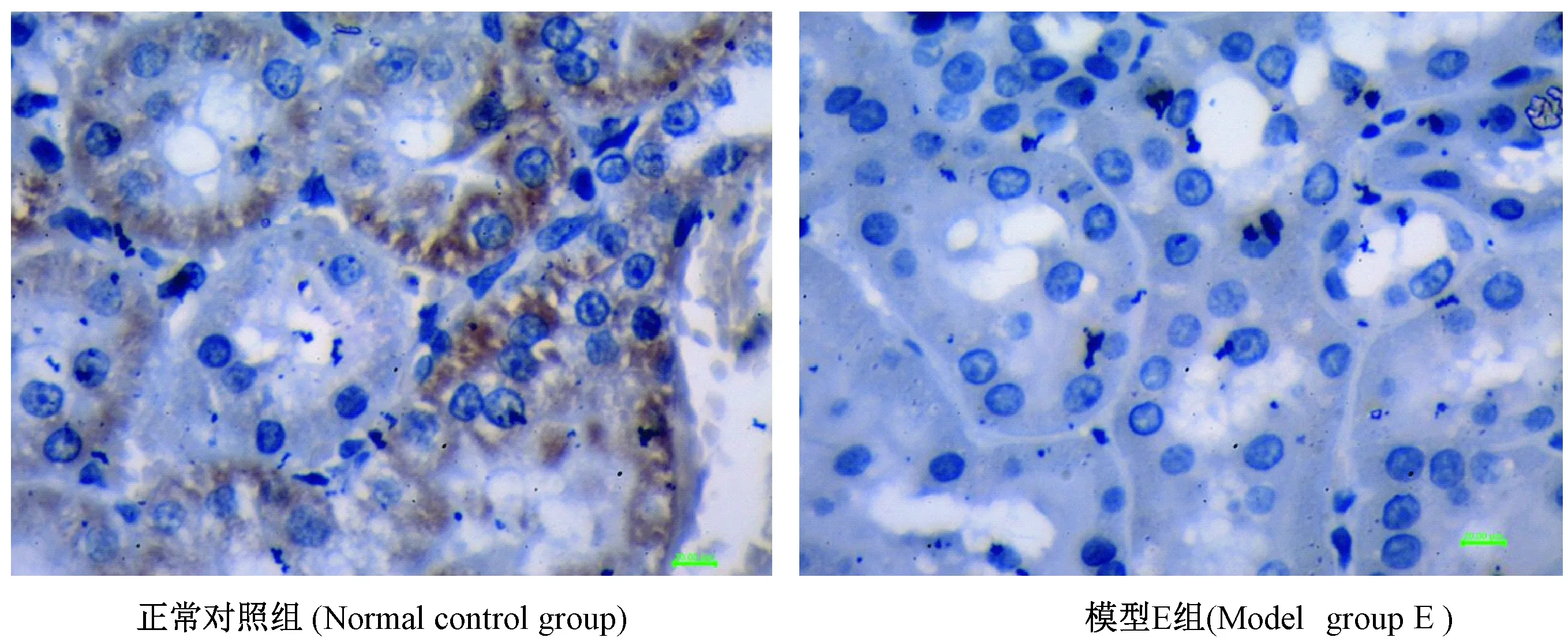
正常对照组 (Normal control group) 模型E组(Model E group)图6 两组大鼠肾脏组织OAT1的表达,(免疫组化,标尺=20 μm)Fig.6 Expression of kidney tissue OAT1 in the two rat groups. (Immunohistochemical staining, Bar=20 μm)

正常对照组 模型E组(Model group E)图8 两组大鼠肾脏组织TIMP-1的表达,免疫组化(标尺=20 μm)Fig.8 Expression of TIMP-1 in the kidney tissues two rat groups. Immunohistochemical staining. Bar=20 μm.
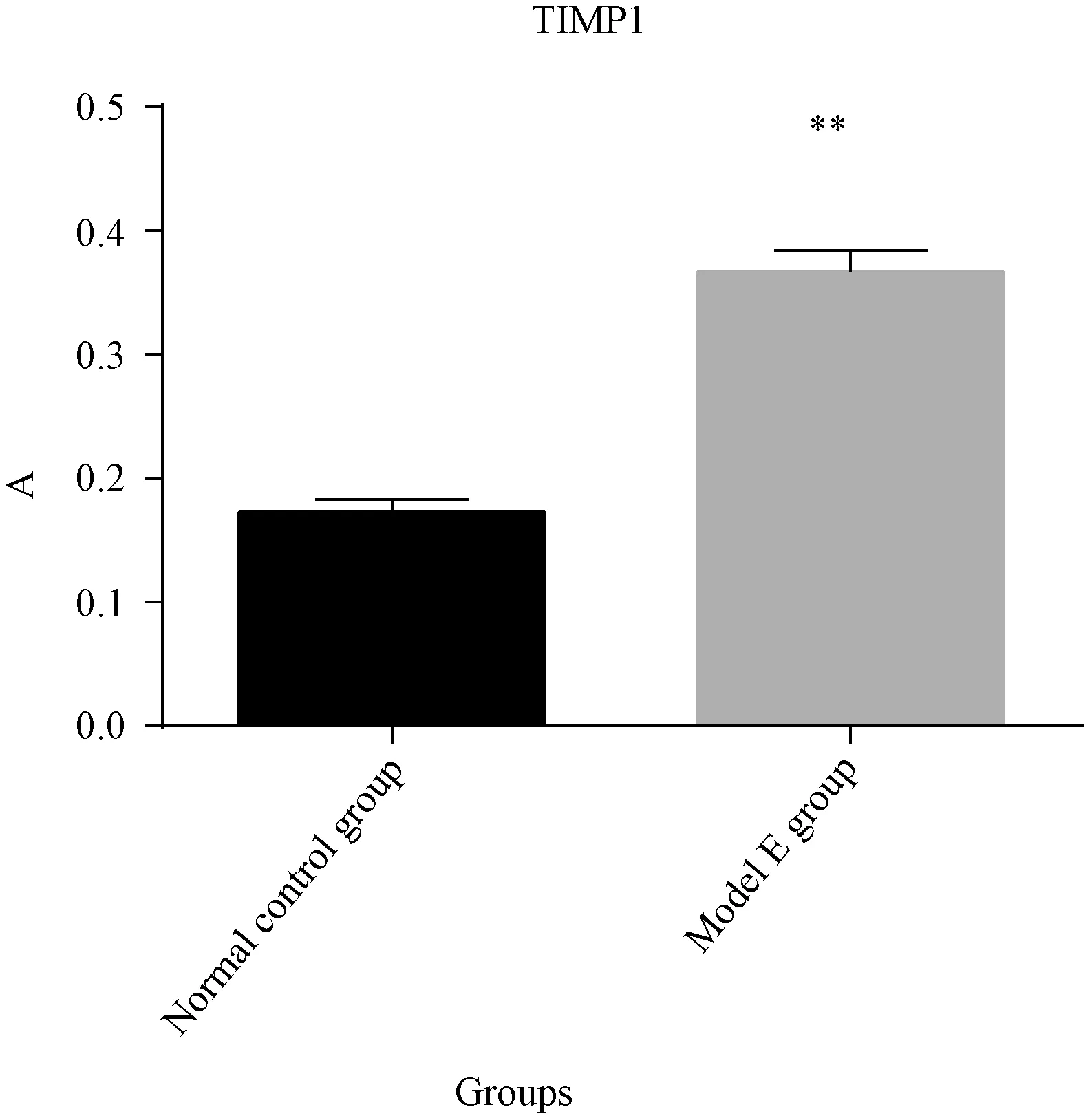
图9 两组大鼠肾脏TIMP-1阳性表达的A值比较Fig.9 Comparison of TIMP-1 positive expression in Ridoey tissues of the two rat groups
5 讨论
痛风性肾病指因血清尿酸升高而导致的肾损害,复制大鼠痛风性肾病模型的意义在于筛选防治痛风性肾病的药物和研究药物作用的相关机制。实验中采用灌服酵母和腺嘌呤的方法,观察大鼠肾脏肥大指数、肾组织病理学改变、肾功能变化,旨在探寻该模型中大鼠肾脏损伤的适宜程度,为实验研究选择痛风性肾病损伤的动物模型提供依据。
痛风性肾病的发生与长期喜食肥甘厚醇之品及体肥和湿气重相关,是仅次于痛风性关节炎的一种较常见的原发性痛风临床类型[7]。由于啮齿类、哺乳类动物体内尿酸代谢与人类差别较大,其体内的尿酸酶将尿酸分解为尿囊素排出体外,体内蓄积很少,也不会在组织内沉积造成损害。因此,将啮齿、哺乳类动物造成动物模痛风性肾病模型较困难,即使造模成功,在其验证、评估药物作用部位及机制或进行高尿酸血症发生机理研究时,均存在难以确定的药物作用环节[8],因此应检测与肾损伤相关的指标来综合评价模型的成功与否。
高剂量的酵母干扰机体正常的嘌呤代谢,导致体内嘌呤代谢紊乱,诱发高尿酸血症。研究中有以单纯酵母制作痛风性肾病的动物模型[9]。此方法符合人类原发性痛风性肾病的发病机制。异常高浓度的腺嘌呤在黄嘌呤氧化酶的作用下转变为极难溶于水的2,8-二羟基腺嘌呤,沉积于肾小管,引起肾小管阻塞,进而导致血清尿酸、肌酐、尿素氮显著上升[9]。林若勤等[5]单纯以腺嘌呤灌服法造成准确的以肾小管损坏为主, 并见肾间质、肾小动脉病变的SD大鼠模型, 类似于人类的痛风性肾病所致的肾脏继发性病理基本变化。本实验采用联合酵母和腺嘌呤法复制痛风性肾病模型,既有原发性因素,又有继发性因素,更接近于人类痛风性肾病的发病机制。
肾脏肥大系数结合肾脏表面及内部的肉眼观察结果,可初步分析实验大鼠肾脏的损伤程度。模型E组中β-N-乙酰氨基葡萄糖苷酶(NAG)升高主要见于各种肾实质性疾患引起的肾小管损伤,其升高程度与肾小管损伤程度呈正比[10]。实验中通过病理切片观察,发现痛风性肾病引起肾脏损伤主要为肾皮质中肾小管上皮细胞肿胀,导致肾小管功能受损,因此通过检测肾皮质NAG含量的高低评价模型的严重程度较为客观。
大量的临床研究证明,血清尿酸水平的升高与各种代谢疾病,包括痛风、高血压、动脉粥样硬化、慢性肾脏疾病和代谢综合征密切相关[11]。当肾脏的肾小球滤过率下降至正常值的50%,血清尿素氮(BUN)才明显增高,故以BUN来判断早期肾小球的功能损伤并不灵敏。但在大量摄入高蛋白高嘌呤食物和消化道出血烧伤,严重感染,使用糖皮质激素均可导致血尿素氮水平的升高[12]。酵母属于高蛋白高嘌呤食物,大剂量酵母灌服大鼠,可导致BUN水平的升高,因此以BUN评价此模型的严重程度。临床上测定肌酐水平主要用于评价肾脏功能的变化,有助于鉴别肾脏功能是否有改善或是处于潜在的衰竭状态。血清中肌酐的测定对晚期肾脏疾病的鉴别诊断有重要作用[13]。
长期以来研究者认为,蛋白尿作为肾小球疾病最常见的临床表现之一,可能仅反映肾小球损伤的程度[14]。但随着研究的深入,蛋白尿作为众多肾小球疾病的共同特点,不仅是肾小球损伤的指标,长期大量的蛋白尿还可引起肾小管上皮细胞和间质的损伤,进而损害肾小球功能,促使疾病恶化。肾小管间质损害是与长期大量蛋白尿伴随。目前较一致的观点认为,蛋白尿是通过引起肾小管间质损害而影响肾脏疾病的进展[15]。本次实验测定了各组大鼠的24 h尿蛋白含量,模型A、B组的24 h尿蛋白含量显著升高,说明肾小球受损。而模型E、F组含量较模型A、B组低,结合病理结果分析为肾小管受损。
尿酸升高可促进中性粒细胞脱颗粒释放中性粒细胞明胶酶相关脂质运载蛋白(NGAL),尿酸盐结晶可以刺激肾小管上皮细胞合成 NGAL,加速肾脏损伤,NGAL是尿酸性肾病导致的慢性肾损伤疾病中的早期标志物[16]。通过免疫组化结果发现,模型组大鼠肾小管上皮细胞胞浆中NGAL蛋白的表达明显高于正常组,表明痛风性肾病大鼠肾脏的损伤受NGAL分泌的影响。 TIMP-1 主要在肾脏局部发挥特异性抑制作用,TIMP-1的表达失衡可促进肾脏纤维化的进程,是致纤维化的重要环节[17]。模型组大鼠肾小管上皮细胞胞浆中TIMP-1蛋白量的表达明显多于正常组,说明TIMP-1蛋白的表达影响着痛风性肾病大鼠肾间质纤维化的进程。有学者提出OAT1在尿酸盐分泌的第一步,即从管周间隙摄取尿酸盐入肾小管上皮细胞中起重要作用,OAT1的缺陷会引起血尿酸水平的升高,参与肾近曲小管对尿酸盐的转运[18]。模型组大鼠肾小管OAT1呈低表达和无表达,痛风性肾病中尿酸转运蛋白OAT1其关键调控作用,其分泌的减少影响了痛风性肾病的疾病进程。
研制疾病的动物模型要重视模型的病变程度应符合于疾病的基本病理, 病理程度过轻或过重, 都不利于疾病的动物实验研究和药物的筛选。本实验所得的模型E组,即100 mg/kg腺嘌呤和15 g/kg酵母共同造模8d诱导的大鼠痛风性肾病模型准确达到符合痛风性肾病的基本病理要求,即肾脏病理主要集中在肾小管, 并累及肾间质、肾小动脉,以尿酸盐结晶所引发的肾小管炎性变形态学病理过程变化,一般症状类似于人类痛风性肾病的症状,肾功能指标和相关酶的活性符合痛风性肾病的生化变化。痛风性肾病肾损伤受NGAL、TIMP-1和尿酸转运蛋白OAT1的调控。
[1] 李顺民. 现代肾脏病学 [M]. 北京: 中国医药科技出版社,2004: 25.
[2] Alexander So A, Thorens B. Uric acid transport and disease [J]. J Clin Invest, 2010, 120(6): 1791-1799.
[3] Chen GL, Wei W, Xu SY. Effect and mechanism of total saponin of Dioscorea on animal experimental hyperuricemia.[J]. Am J Chin Med, 2006, 34(1): 77-85.
[4] Kou Y, Li Y, Ma H, et al. Uric acid lowering effect of Tibetan medicine RuPeng 15 powder in animal models of hyperuricemia [J]. J Tradit Chin Med 2016, 36: 205-210.
[5] 林若勤, 高尤亮, 杨朝阳, 等. 腺嘌呤制作尿酸性肾小管损害SD大鼠模型的研究 [J]. 中国医药指南, 2012, 36: 66-68.
[6] 李俊, 胡家才. 大黄对尿酸性肾病大鼠肾脏CTGF和HGF的影响 [J]. 中国中西医结合肾病杂志, 2010, 11(9): 761-764
[7] 牟科媛. 痛风性肾病中医治法方药与现代医学病理药理探析 [J]. 辽宁中医药大学学报, 2014,16(5): 11-13.
[8] 刘文波. 高尿酸血症动物模型的建立及抗痛风中药的筛选 [D]. 山东大学, 2008. 22-25.
[9] 何立群, 聂永红, 邹士林. 新型尿酸性肾病动物模型的建立 [J]. 上海实验动物科学, 2001, 21(1): 22-25.
[10] 肖静, 何立群, 高建东, 等. 腺嘌呤与氢化可的松大鼠肾阳虚模型造模方法比较 [J]. 中国比较医学杂志, 2008, 18(3): 77-80.
[11] Kuo CF, Luo SF, See LC, et al. Hyperuricaemia and accelerated reduction in renal function [J]. Scand J Rheumatol. 2011, 40(2): 116-121.
[12] Al-Naamani K, Alzadjali N, Barkun AN, et al. Does blood urea nitrogen level predict severity and high-risk endoscopic lesions in patients with nonvariceal upper gastrointestinal bleeding?[J]. Can J Gastroenterol, 2008, 22(4): 399-403.
[13] 董书清. 血清肌酐、尿素氮的检测值及其比值与肾脏损害的探讨 [J]. 中国医药指南, 2011, 36: 136-137.
[14] Zoja C, Morigi M, Remuzzi Z. Proteinuria and phenotypic change of proximal tubular cells [J]. JASN, 2003, 14(Suppl 1): S36-S41.
[15] Cravedi P, Remuzzi Z. Pathophysiology of proteinuria and its value as an outcome measure in chronic kidney disease [J]. Br J Clin Pharmacol, 2013, 76(4): 516-523.
[16] Paragas N, Qiu A, Hollmen M, et al. NGAL-siderocalin in kidney disease [J].Biochim Biophys Acta,2012,1823( 9): 1451-1458.
[17] 梁亮, 崔长乐, 何学红. 参芪泄浊饮对腺嘌呤肾间质纤维化模型大鼠肾组织MMP-9、TIMP-1基因表达的影响 [J]. 辽宁中医杂志, 2015, 42(1): 190-193.
[18] 朱立然, 陈光亮. 尿酸转运蛋白研究进展 [J]. 中国临床药理学与治疗学, 2012, 17(11): 1289-1294.
Comparison of the establishment of rat model of gouty nephropathy induced by yeast and adenine
LAN Lun-li, JIANG Bin, LIU Meng-chu, ZOU Xiao-hong, CAO Chen, ZENG Yuan-er, Pang Jia-ying
(Laboratory of Traditional Chinese Medicine Analysis, College of Traditional Chinese Medicine, Guangzhou University of Chinese Medicine, Guangzhou 510006, China)
Objective To explore the effect of yeast and adenine administration in different doses and different duration on the establishment of rat models of gouty nephropathy. Methods Fifty-seven healthy male 2 months old Dawley rats (220-250 g) were used in this study. The rats of model groups were gavaged with 15 g/kg yeast and 50 mg/kg or 100 mg/kg adenine, for different number of days. The kidney hypertrophy index, kidney function, urine indexes, liver xanthine oxidase activity, N-acetyl-β-D-glucosaminidase (NAG) content in the renal cortex, and the renal histology were detected. The pathological changes of renal tissue were examined along with detection of the expression of NGAL, OAT1 and TIMP-1 by immunohistochemical staining. Results The renal pathological changes were more obvious with the increasing yeast and adenine doses and time of modeling. Compared with the normal group, the renal histological changes in the group administered with 100 mg/kg adenine and 15 g/kg yeast for 8 days showed apparent inflammatory cell infiltration and swelling of tubular epithelial cells, but there was not destruction of renal tubules and glomerular structures, showing a significant difference between the model and normal groups (P< 0.01). Compared with that of the normal control group, kidney function was significantly decreased in the model groups A, B, E, and F (P< 0.01). Compared with the normal control group, the 24 h urine volume and content of urinary protein were significantly increased in the model groups A, B, E, and F (P<0.01), and the expressions of protein OAT1 were significantly reduced in the renal tubules, while expressions of NGA, TIMP-1 were increased in the model group E (P<0.01). Conclusions Administration of adenine at a dose of 100 mg/kg and yeast at 15 g/kg for 8 days is an ideal procedure for the establishment of a rat model of gouty nephropathy. The renal alterations of this rat model of gouty nephropathy are affected by the changes of expressions of NGAL, TIMP-1 and OAT1 protein expressions.
Gouty nephropathy; Yeast; Adenine; Kidney; Rat
南药研究协同创新中心专项基金(2011)。
蓝伦礼,博士研究生,研究方向:中药质量分析。E-mail: lanlunli@yeah.net。
江滨,教授,研究方向:中药质量分析。E-mail: gzjiangbin@hotmail.com。
R-33
A
1671-7856(2017) 02-0033-11
10.3969.j.issn.1671-7856. 2017.02.007
2016-11-16

