迟缓爱德华氏菌感染和疫苗免疫后牙鲆的血细胞数量变化*
甄梦晓, 邢 婧, 绳秀珍, 唐小千, 战文斌
(中国海洋大学水产学院水产动物病害与免疫学研究室,山东 青岛 266003)
迟缓爱德华氏菌感染和疫苗免疫后牙鲆的血细胞数量变化*
甄梦晓, 邢 婧**, 绳秀珍, 唐小千, 战文斌
(中国海洋大学水产学院水产动物病害与免疫学研究室,山东 青岛 266003)
重组表达了牙鲆(Paralichthysolivaceus)T淋巴细胞表面标志分子CD3的蛋白,制备出其兔多克隆抗体(多抗),采用免疫双荧光流式细胞术,观察外周血白细胞中的T、B淋巴细胞并计算其比例。分别向牙鲆腹腔内注射107CFU/mL的迟缓爱德华氏菌和其灭活疫苗, 于0、1、3、5、7、9、14、21和28天后抽取外周血,用抗红细胞单抗的流式细胞术测定红细胞和白细胞的比例和浓度,提取外周血白细胞,用流式细胞术测定T、B淋巴细胞的比例。研究显示,CD3多抗和IgM单抗分别识别T、B淋巴细胞,二抗体无交叉反应,白细胞中T细胞占(7.49±1.5)%、B细胞占(14.64±1.8)%。感染和免疫后,牙鲆外周血红细胞浓度变化不显著,为(2.9±0.45)×109cells/mL。感染组,白细胞浓度第3天显著上升,第14天达到最大值(4.7±1.7)×108cells/mL;T细胞比例第1天显著上升,第9天达到最大值(24.3±1.28)%;B细胞比例第1天显著升高,第21天达到最大值(40.9±1.52)%。免疫组,白细胞浓度第3天显著上升,第14天达最大值(7.1±1.8)×108cells/mL;T细胞比例第5天显著上升,第9天达最大值(20.5±1.12)%;B细胞比例第1天显著上升,第21天达到最大值(39.3±1.55)%。对照组,白细胞浓度为(6.9±1.6)×107cells/mL,T细胞比例为(8.05±1.38)%,B细胞比例为(13.77±1.56)%。研究结果表明,感染和免疫后牙鲆白细胞浓度、T、B细胞的比例均显著升高,感染组T、B细胞比例显著高于免疫组。本研究结果为血细胞作为牙鲆健康评估指标提供了数据资料。
牙鲆;感染;免疫;迟缓爱德华氏菌;T淋巴细胞;B淋巴细胞
牙鲆(Paralichthysolivaceus)血细胞直接参与机体非特异性免疫和特异性免疫应答,在机体疾病的防御和防治中发挥着重要作用[1-2]。尤其外周血中的白细胞或T、B淋巴细胞的数量变化,能够反映机体的整体免疫状态[3],研究表明,在鱼体被细菌感染引发炎症反应时,白细胞数量会显著升高[4-5]。因此,在鱼体被病原侵染后,监测白细胞和淋巴细胞的数量变化可作为研究其机体免疫动态及感染进程的方法之一[6-7]。
关于鱼类血细胞数量的研究,经常采用Giemsa或Wright染色方法,分类计数各类细胞数量[8]或血细胞分析仪直接计数[9]。由于T、B淋巴细胞表面存在特异性的标志分子,T细胞表面受体(TCR)和表面分子CD3是T细胞进行抗原识别最重要的一对复合体[10-14],哺乳动物对T细胞的检测是通过抗CD3分子的单抗对T淋巴细胞进行分类计数;B细胞的表面受体(BCR)由细胞膜免疫球蛋白(SmIg)和Igα(CD79a)/Igβ(CD79b)异源二聚体组成[15-18],通常利用抗IgM分子的单抗和抗CD79a/CD79b分子的抗体来检测B淋巴细胞的数量。利用淋巴细胞表面标志物的抗体对相应淋巴细胞类型进行标记,应用流式细胞术测定淋巴细胞比例[6,19,21],具有特异性高,检测方便等优势。牙鲆中,应用鼠抗牙鲆IgM单抗标记B淋巴细胞测定牙鲆外周血中IgM+B细胞的比例[19];圆鳍鱼中,利用IgM单抗测定外周血中IgM+B细胞的比例约为41%[20];河豚中,利用鼠抗CD8α的多抗测定河豚外周血中CD8α+T细胞的比例[21]。
本实验室前期已研制出抗牙鲆IgM的单抗[19]和抗牙鲆红细胞单抗[22]。本文研制出兔抗CD3多抗,采用腹腔注射迟缓爱德华氏菌(Edwardsiellatarda)和其灭活疫苗,应用抗牙鲆红细胞单抗的流式细胞术测定牙鲆外周血中红细胞数量比例,并计算白细胞的数量;应用兔抗牙鲆CD3多抗和鼠抗牙鲆IgM单抗的流式细胞术检测白细胞中T、B淋巴细胞比例变化,以期为牙鲆健康评估指标的研究提供数据资料。
1 材料与方法
1.1 实验动物
牙鲆购自于山东日照某养殖场,体长为15 cm左右,体重为20~50 g,750尾,实验前于水箱中暂养1周,水温20~23 ℃,连续充气。
新西兰兔购于青岛某实验动物中心,实验前于实验室养殖兔房室温暂养1~2周。
1.2 牙鲆外周血的抽取、白细胞及cDNA的提取
采用尾静脉抽血,抗凝剂(50 mL RPMI-1640,加入0.0067 g肝素钠和0.5 g 牛血清白蛋白)与外周血按2∶1比例混合,置于10 mL离心管中。用微量移液器吸取10 μL血细胞悬液,用PBS稀释200倍,用于吉姆萨染色和流式细胞术。
采用percoll梯度离心法提取牙鲆外周血白细胞。抽取的外周血样品静置1 h后,以100g4 ℃离心10 min,收集上清;用过滤除菌的新生牛血清润洗无菌离心管壁,用移液器吸去血清,缓慢加入3 mL的1.070 g/cm3的Percoll应用液,再用移液器沿管壁缓慢加入3 mL的1.020 g/cm3的Percoll应用液,制备Percoll不连续梯度,再用移液器缓慢加入3 mL收集的外周血离心上清,以840g转速于4 ℃离心30 min;收集Percoll梯度界面上的细胞,用无菌PBS重悬,并以680g转速于4 ℃离心6 min,重复洗3次,最后收集的沉淀即为白细胞。
此时,一部分白细胞用于提取mRNA,反转录得到cDNA,作为CD3基因扩增的模板;将另一部分白细胞重悬,浓度调整至106cells/mL,用于吉姆萨染色和流式细胞术。
1.3 牙鲆CD3胞外区蛋白重组表达和兔多抗的制备
根据GenBank公布的牙鲆CD3ε序列(GenBank: AB044572.1),对应其胞外区序列,设计特异性引物[13](见表1),以得到的cDNA为模板,PCR扩增出大小为534 bp的单一目的条带,PCR产物经回收纯化,送检测序。将测序正确的目的基因连接到pET-30a表达载体上,转化到感受态大肠杆菌BL21中,得到重组表达菌。将重组表达菌接种到含0.1% 氨苄抗生素的500 mL LB液体培养基中,37 ℃恒温培养4~6 h,然后加入终浓度为1.0 mmol/L IPTG诱导表达12 h后,离心,收集菌体,SDS-PAGE验证CD3重组表达菌的诱导表达结果;再用含尿素2 mol/mL的50 mL Binding buffer(2 mol/L 尿素,0.5 mol/L NaCl,20 mmol/L Na3PO4,30 mmol/L 咪唑,调整pH至7.4)重悬菌体,于冰浴中超声破碎30 min;最后用镍琼脂糖亲和层析柱(HisTrapTMHP 5mL购于GE生命科学公司)纯化,得到重组蛋白。将蛋白透析并冻干浓缩,PBS溶解,利用Bradford蛋白浓度测定试剂盒(购于索莱宝公司)测定浓度,调至1 mg/mL,用于免疫新西兰兔。
兔多抗的制备:第一周基础免疫,纯化的CD3重组蛋白样品与弗氏完全佐剂1∶1混匀,皮下多点注射新西兰兔,每点0.2 mL;第三周蛋白悬液与弗氏不完全佐剂1∶1混匀加强免疫;接下来2周再加强免疫2次,耳缘静脉注射蛋白悬液0.2 mL,无佐剂;第六周对新西兰兔进行心脏采血,血液于室温放置2 h,4 ℃过夜,以8 000g离心10 min,取上清,分装后-80 ℃保存,备用。通过ELISA测定兔抗血清效价为64 000,稀释500倍使用。Western-Blot检测CD3重组蛋白与兔多抗的结合。

表1 引物列表
1.4 单克隆抗体
鼠抗牙鲆红细胞单抗[22]和鼠抗牙鲆IgM单抗[19]由实验室前期制备,本论文中应用2株单抗的腹水,效价200 000,使用时按1∶1 000稀释。
1.5 迟缓爱德华氏菌
迟缓爱德华氏菌由本实验室保种培养,将保种的迟缓爱德华氏菌接种到灭菌的BHI液体培养基中,28 ℃培养24 h后,离心,收集菌体,一部分用无菌PBS重悬,以比浊仪测定浓度,PBS调整至以1×107CFU/mL,用于感染实验;另一部分菌体以4%福尔马林(V/V)重悬,28 ℃灭活48 h后,离心,收集灭活菌体,PBS重悬,接种到BHI固体培养基培养24 h,无菌体生长,则以比浊仪测定浓度,PBS调整至1×107CFU/mL为灭活疫苗,用于免疫实验。
1.6 感染和免疫实验
在鱼类细菌感染或疫苗免疫相关研究中,通常采用腹腔注射每20 g鱼体重1 mL 1×107CFU/mL菌体或疫苗,由于本文中选用的迟缓爱德华氏菌是一种对牙鲆致病性较强的病原菌,为不使实验过程中出现注射过量病原引起应激死亡等情况,并结合前期预实验,故选择每尾牙鲆注射200 μL的活菌液或灭活疫苗。将750尾牙鲆随机分为3组,每组250尾,感染组每尾注射迟缓爱德华氏菌液200 μL,免疫组每尾注射200 μL灭活疫苗,对照组注射200 μL PBS。每组分别于注射后第0、1、3、5、7、9、14、21和28天随机选取20尾牙鲆抽取外周血、提取白细胞,用于流式细胞术检测。
1.7 免疫双荧光和流式细胞术
将提取的白细胞样品300 μL加入离心管,20%牛血清白蛋白封闭2 h,PBS洗3次,每次5 min;加入等体积比例混合的鼠抗牙鲆IgM单抗和兔抗牙鲆CD3多抗为第一抗体,37 ℃孵育1 h,PBS洗3次,每次5 min;再以FITC标记的羊抗鼠IgG(购于美国Sigma公司)和Cy5标记的羊抗兔IgG(购于博奥森生物技术公司)的混合抗体为第二抗体,37 ℃孵育30 min,PBS洗3次,每次5 min。此时用移液枪吸取白细胞悬液20 μL滴于载玻片上,避光沉降30 min,弃去上清;加4%多聚甲醛固定10 min,PBS洗3次,每次5 min;加20 μL DAPI染液(4,6-联脒-2-苯基吲哚,细胞核染色剂),室温静置15 min;PBS洗3次,每次5 min;室温干燥,甘油封片,于荧光显微镜(Olympus,日本)下观察T、B淋巴细胞并拍照;余下部分用于上样流式细胞仪检测。上样时对照有3组:①以PBS代替一抗,标记FITC和Cy5的混合抗体为二抗;②以鼠抗牙鲆IgM单抗为一抗,以FITC标记的羊抗鼠IgG为二抗;③兔抗牙鲆CD3多抗为一抗,Cy5标记的羊抗兔IgG为二抗。本实验重复3次。上样流式时先通过前向角(FSC)/侧向角(SSC)的散点图射门细胞群,然后通过FL1/SSC和FL1/FL4检测荧光阳性细胞群(FL1为绿色荧光通道,FL4为红色荧光通道)。
测定外周血细胞时,以300 μL稀释600倍的外周血细胞为抗原,鼠抗牙鲆红细胞单抗为一抗,FITC标记的羊抗鼠IgG为二抗,对照组以PBS代替一抗。
1.8 吉姆萨染色
取上样流式细胞术的牙鲆外周血细胞20 μL和提取的白细胞20 μL滴于载玻片上,沉降30 min,弃去上清,加4%多聚甲醛固定10 min,PBS洗3次,每次5 min,进行吉姆萨染色,显微镜下观察血细胞形态并拍照。
1.9 数据分析
实验所得数据均以平均值±标准差表示,用SPSS 19.0统计软件进行方差分析和Duncan多重比较,当P<0.01时差异显著,利用Origin 8.5进行制图。
2 结果
2.1 牙鲆CD3分子蛋白的重组表达和兔多抗的制备
经诱导的重组CD3大肠杆菌的全菌蛋白中出现了一条相对分子量约为27 kDa的蛋白条带,符合预期结果;未诱导的重组菌中没有出现相对应大小的条带;纯化后蛋白条带单一(见图1 A)。Western-Blot结果显示,在27 kDa处有单一蛋白条带显色(见图1 B)。结果表明,制得的多抗能够与重组CD3蛋白特异性结合。
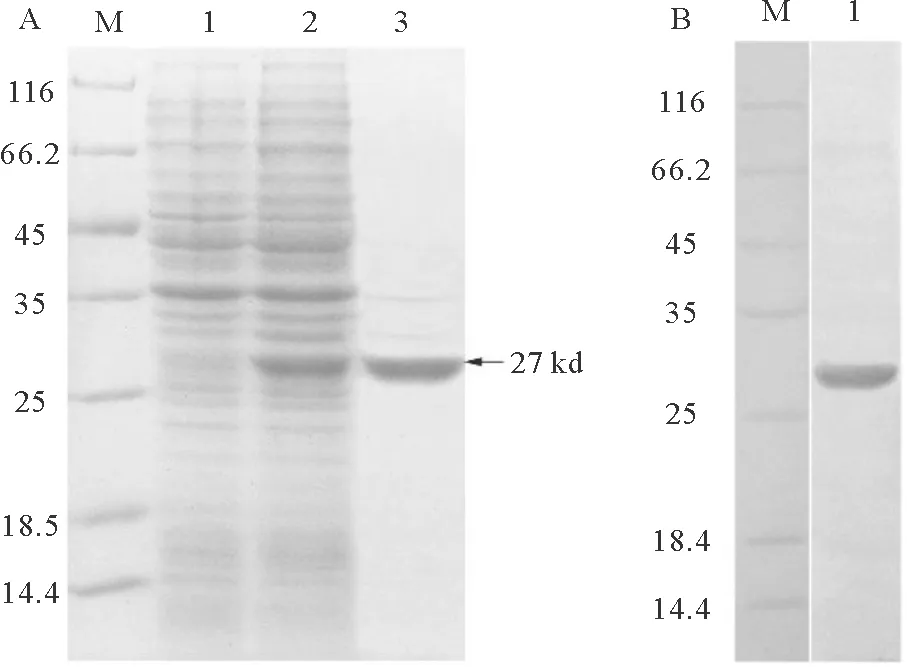
(图A中:M,标准分子量蛋白;1,未诱导重组菌体总蛋白;2,诱导后重组菌体总蛋白;3,纯化后的重组蛋白。图B中:M,标准分子量蛋白;1,纯化的CD3重组蛋白。Fig.A: M: Marker; 1: Total protein from uninduced BL21 containing recombinant protein; 2: Total proteins from induced BL21containing recombinant protein; 3: Purified CD3 recombinant protein. Fig.B: M: Marker; 1: Purified CD3 recombinant protein.)
图1 牙鲆CD3蛋白重组表达的SDS-PAGE(A)及CD3重组蛋白与兔多抗的Western-Blot(B)
Fig.1 SDS-PAGE analysis of recombinant CD3 protein expression(A) and CD3 recombinant protein with rabbit anti-CD3 polyclonal antibodies in Western-Blot (B)
2.2 免疫双荧光
荧光显微镜下,一部分白细胞呈现明显的绿色荧光为FITC标记的IgM+细胞,同一视野下还有一部分白细胞呈现出明显的红色荧光为Cy5标记的CD3+细胞,并且IgM+细胞与CD3+细胞之间无交叉;没有荧光信号的细胞为IgM-/CD3-白细胞(见图2)。结果表明,鼠抗IgM单抗和兔抗CD3多抗分别能够特异性识别B淋巴细胞和T淋巴细胞,并且无交叉反应。

(1:荧光显微镜下鼠抗IgM单抗与牙鲆白细胞间接免疫荧光结果;2:荧光显微镜同一视野下兔抗CD3多抗与牙鲆白细胞间接免疫荧光结果;3:荧光显微镜同一视野下牙鲆白细胞DAPI核染色结果;4:图1、2和3的合成图;标尺=10 μm。1: The indirect immunofluorescence double-staining result of mouse anti-IgM mab specifically reacted with the leukocytes ofParalichthysolivaceusunder the fluorescence microscope; 2: The indirect immunofluorescence double-staining result of rabbit anti-CD3 recombinant protein polyclonal antibodies specifically reacted with the peripheral leukocytes ofParalichthysolivaceusunder the fluorescence microscope in the same vision; 3: Leukocytes ofParalichthysolivaceusnuclear staining with DAPI under the fluorescence microscope in the same vision; 4: Composite image of image 1, 2 and 3.(bar=10 μm).)
图2 鼠抗IgM单抗和兔抗CD3多抗与牙鲆白细胞的免疫双荧光染色
Fig.2 Mouse anti-IgM mab and rabbit anti-CD3 recombinant protein polyclonal antibodies specifically reacted with the leukocytes of Paralichthys olivaceus by indirect immunofluorescence double-staining
2.3 外周血细胞吉姆萨染色结果
吉姆萨染色显示,牙鲆外周血中多为红细胞,有少量白细胞。牙鲆红细胞大小为8~9 μm,呈椭圆形,核圆形,胞核染色呈深蓝色,胞质无颗粒,染成红色(见图3-1)。提取的白细胞大部分为淋巴细胞,其次是血栓细胞,还有少量单核细胞,粒细胞较少。淋巴细胞大小为3~4 μm,呈圆形或不规则圆形,胞核呈椭圆或马蹄形,位于中央,核染深蓝色,胞质淡蓝紫色;血栓细胞大小为5~6 μm,呈纺锤形或泪滴状,胞核大,卵圆形位于中央,核染深蓝色,胞质浅紫色;单核细胞大小为6~7 μm,呈球形,胞核呈肾形或马蹄形,位于一侧或中央,核染深蓝色,胞质蓝紫色或淡紫色(见图3-2)。
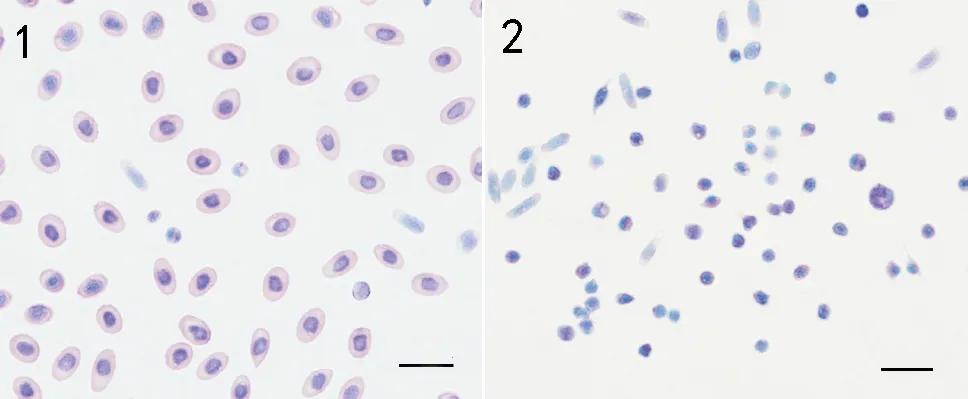
(1:外周血全血细胞;2:提取的白细胞;标尺=10 μm。1: The PBL cells ; 2: The leukocytes.(bar=10 μm).)
图3 牙鲆外周血全血细胞和白细胞吉姆萨染色结果
Fig.3 the peripheral blood ( PBL) cells and the leukocytes ofParalichthysolivaceusstained with Gimesa
2.4 感染和免疫后牙鲆外周血细胞浓度的变化
牙鲆红细胞单抗的流式细胞术,FSC/SSC的流式散点图显示,牙鲆外周血细胞为一群细胞(见图4 A);FL1/SSC的流式散点图结果显示,外周血细胞分为2群,绿色的FITC标记阳性一群为红细胞比例为(90±1.9)%,另一群阴性细胞为白细胞比例占(9.2±1.2)%(见图4 B)。按照抽取血液体积稀释比例计算,对照组,牙鲆外周血中红细胞浓度为(2.8±0.62)×109cells/mL;迟缓爱德华氏菌感染和免疫后,红细胞比例(90±2.6)%和浓度(2.9±0.45)×109cells/mL,与对照组差异不显著。感染和免疫后,白细胞浓度均显著高于对照组。感染组,外周血中白细胞浓度于第3天开始显著上升,此时白细胞浓度为(1.9±1.5)×108cells/mL,对照组为(6.9±2.2)×107cells/mL;直到第14天达到最大值,此时白细胞浓度为(4.7±1.7)×108cells/mL,对照组为(6.9±1.6)×107cells/mL;随后开始下降,第28天时白细胞浓度降至对照组水平为(5.0±1.7)×107cells/mL。免疫组,外周血中白细胞浓度同样于第3天开始显著上升,此时白细胞浓度为(1.9±0.6)×108cells/mL,

(A:牙鲆外周血细胞散点图;B:红细胞荧光散点图。A:FSC/SSC dot plot in FCM;B:FL1/SSC scatter plot of red cells fluorescent in FCM with gated cells.)
图4 应用红细胞单抗检测牙鲆外周血细胞的流式细胞术结果
Fig.4 Flow cytometry analysis of the PBL cells by using Mab against red blood cells

(图中不同字母表示同一时间点不同处理间差异显著,P<0.01。Different letters meant significant differences at 0.01 levels among treatments at the same time point,P<0.01.)
图5 感染和免疫后牙鲆外周血中白细胞总浓度的变化结果
Fig.5 Variation of concentration of leukocytes in PBL fromParalichthysolivaceusafter infected or immunized
对照组为(6.9±2.2)×107cells/mL;第14天达到最大值,此时白细胞浓度为(7.1±1.8)×108cells/mL,对照组为(6.9±1.6)×107cells/mL;第28天降至(1.6±1.7)×108cells/mL,对照组为(5.0±1.7)×107cells/mL(见图5)。
2.5 感染和免疫后牙鲆外周血T、B淋巴细胞数量的变化
牙鲆外周血白细胞流式散点图显示,红色部分表示Cy5标记阳性的T细胞比例,绿色部分表示FITC标记阳性的IgM+B细胞比例,两者无交叉(见图6)。感染组的T淋巴细胞比例第1天就开始显著上升,此时T淋巴细胞比例为(9.8±0.8)%,对照组为(8.2±0.9)%;第9天达到最大值,此时T淋巴细胞比例为(24.3±1.28)%,对照组为(8.5±1.38)%;随后逐渐降低,至第28天时,感染组降至(12.8±1.3)%,对照组为(7.7±1.68)%。免疫组T淋巴细胞比例从第1天也有上升,但第5天才开始显著上升,此时T淋巴细胞比例为(12.1±1.5)%,对照组为(7.4±1.6)%;第9天达到最大值,此时T淋巴细胞比例为(20.5±1.12)%,对照组为(8.5±1.38)%;随后逐渐降低,至第28天时,免疫组降至(10.9±0.5)%,对照组为(7.7±1.68)%(见图7)。
感染组IgM+B淋巴细胞比例自第1天起显著高于对照组,此时IgM+B细胞比例为(19.3±1.63)%,对照组为(14.3±1.05)%;于第21天达到最大值,此时IgM+B细胞比例为(40.9±1.52)%,对照组为(13.77±1.56)%;在第28天时IgM+B细胞比例有所降低,为(32.1±1.26)%,对照组为(16.02±1.79)%。免疫组IgM+B细胞比例也从第1天开始显著升高,此时IgM+B细胞比例为(18.6±0.86)%,对照组为(14.3±1.05)%;于第21天达到最大值,此时IgM+B细胞比例为(39.3±1.55)%,对照组为(13.77±1.56)%;第28天时降低为(30.9±1.62)%,对照组为(16.02±1.79)%(见图8)。
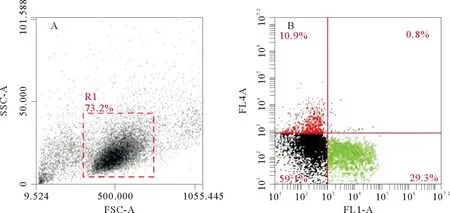
(A:FSC/SSC散点图;B:FL1/FL4双荧光散点图。A:FSC/SSC dot plot in FACS;B:FL1/FL4 scatter plot of double fluorescent in FACS with gated cells.)
图6 应用IgM单抗和CD3多抗检测牙鲆外周血白细胞的流式细胞术结果
Fig.6 Flow cytometry analysis of the leukocytes by using Mab against IgM and Pab against CD3

(图中不同字母表示同一时间点不同处理间差异显著,P<0.01。Different letters meant significant differences at 0.01 levels among treatments at the same time point,P<0.01.)
图7 感染和免疫后牙鲆外周血白细胞中T细胞比例变化结果
Fig.7 Variation of T cells percentage in PBL leukocytes in FACS after infected or immunized
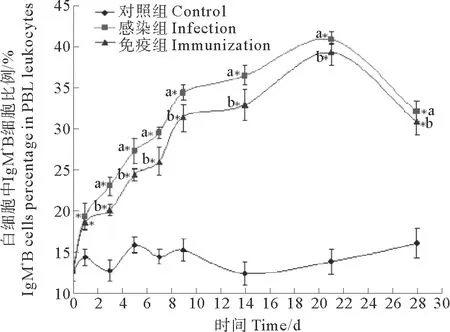
(图中不同字母表示同一时间点不同处理间差异显著,P<0.01。Different letters meant significant differences at 0.01 levels among treatments at the same time point,P<0.01.)
图8 感染和免疫后牙鲆外周血白细胞中IgM+B细胞比例变化结果
Fig.8 Variation of IgM+B cells percentage in PBL leukocytes in FACS after infected or immunized
结果表明,感染和免疫后的牙鲆T、B淋巴细胞比例均比对照组显著升高,并且感染组在免疫应答过程中外周血T、B淋巴细胞比例变化趋势显著高于免疫组,T细胞和IgM+B细胞的数量与病原感染或刺激显著相关。
3 讨论
本文根据已发表的牙鲆T细胞表面标志分子CD3的基因序列,重组表达出CD3蛋白,并制备了兔抗CD3多抗。应用兔抗CD3多抗和鼠抗IgM单抗的免疫双荧光技术,荧光显微镜下观察到CD3+T细胞和IgM+B细胞之间无交叉,说明CD3多抗和IgM单抗能够特异性地识别牙鲆的T、B淋巴细胞。
由于牙鲆的外周血细胞在流式细胞仪中不能根据细胞大小和颗粒度(即FSC/SSC)分为不同的细胞群,所以论文选择应用牙鲆的红细胞单抗的流式细胞术来检测外周血细胞。本文应用牙鲆红细胞单抗、IgM单抗和兔抗CD3多抗的流式细胞术研究了牙鲆在感染和免疫迟缓爱德华氏菌后外周血细胞及T、B淋巴细胞的的数量变化。结果发现,感染和免疫后,牙鲆外周血红细胞数量无显著变化,而白细胞的数量在鱼体分别受到2种刺激后均呈现显著升高的趋势,在14天后又逐渐降低至接近正常水平。这与Köllner[23]以嗜水气单胞菌灭活疫苗注射虹鳟(Oncorhynchusmykiss)和单红[24]给南方鲇注射嗜水气单胞菌灭活疫苗后,外周血的白细胞数量显著升高的研究结果相似。这是因为在受到病菌或疫苗刺激的炎症初期,非特异性免疫的防御使得各类具有吞噬作用的白细胞大量增殖[23],包括单核细胞、中性粒细胞,以抵御病菌感染,增强鱼体抗病力,随后鱼体逐渐以特异性免疫为主,具有吞噬作用的白细胞数量减少,T、B淋巴细胞增殖导致比例上升。本论文的实验结果也证明了这一点,牙鲆在感染和免疫后T、B淋巴细胞比例均显著升高,直到第9天T细胞比例达到最大值,这与雏鸡感染艾美尔球虫后外周血T细胞比例在第7天达到最大值相似[26]。在感染和免疫后的第21天,IgM+B淋巴细胞比例达到最大值,是因为在病原侵入过程中,鱼体要通过淋巴细胞的增殖和免疫球蛋白的增多,来抵抗病原菌的刺激[23-25]。T、B淋巴细胞比例的变化过程中,感染组均显著高于免疫组,这可能是由于活菌被注射入鱼体内后,在适宜的温度下迅速增殖,给予机体持续刺激,使鱼体的免疫应答比免疫组更强。
有关鱼类免疫恢复期的研究目前根据鱼种类的不同有差异,有研究表明,全菌灭活疫苗免疫中华倒刺鲃(SpinibarbussinensisBleeker)后,外周血中白细胞数量第4~7天达到峰值,于第28天降低至对照水平;外周血中淋巴细胞的百分比于第21天到达峰值随后下降,于第35天下降至对照水平[25];南方鲇(Silurusmeridionalis)[24]、斑点叉尾鮰(Ictaluruspunctatus)[34]等鱼类的免疫相关实验中也得到类似结果,鱼类在28天左右达到对照水平;牙鲆浸泡免疫的爱德华氏菌灭活疫苗6周内,其外周血白细胞中IgM+B细胞比例亦出现先升高后降低[35],并且浸泡疫苗浓度低时间短的先在第4周达到峰值,浸泡浓度高时间长的在第5周达到峰值。本文实验中牙鲆在感染或免疫后,外周血中白细胞数量、T、B淋巴细胞的比例于第28天时虽有降低,仍显著高于对照水平。这可能与免疫或感染时菌的浓度有关,或者是牙鲆本身免疫恢复期稍长,后续实验会延长至其恢复对照水平为止。
在高等动物中,根据各种类型淋巴细胞的数量变化范围能够判断其处于感染或健康状态[33]。而在鱼类作为变温动物,水温、盐度、pH值等均是影响鱼类生理指标的关键因素,研究表明,在注射嗜水气单胞菌灭活疫苗(实验水温为13 ℃左右)后第2天,南方鲇外周血白细胞数量在第4~28天有显著上升[24]。在注射爱德华氏菌灭活疫苗(实验水温为25 ℃左右)后第2天,斑点叉尾鮰外周血白细胞数量在第4~14天有显著上升[34]。结合本文实验结果,在感染或免疫后(温度为20~23 ℃)第3~28天时,牙鲆外周血白细胞、T、B淋巴细胞的数量或比例均已显著高于对照组。并且在研究牙鲆外周血白细胞数量时,观察到血栓细胞的数量也有着较为明显的变化,可能与牙鲆的免疫应答也有着重要关系。有报道利用血栓细胞单抗分离出鲤鱼的血栓细胞[27],并做了一系列相关研究,但血栓细胞的数量是否能作为评估指标还需要进一步研究。要探究鱼类淋巴细胞与生理状态的关系还需要掌握鱼体与环境因子、病原感染等相关性的详细数据来确定。
在鱼类机体受刺激后外周血T细胞数量的研究还不全面,大多数研究以基因水平变化为主。研究表明抗B淋巴细胞的有效抗体较多,抗鱼类T淋巴细胞的有效抗体相对较少,这可能跟T细胞表面缺少可结合的受体有关[28]。然而,随着T淋巴细胞表面标志的发现,抗表面标志物的抗体开始被应用于细胞类群的鉴别,如CD4+T细胞和CD8+T细胞的分类研究也越来越多[21,29-30]。研究表明,T细胞表面的CD4和CD8分子不能同时表达于同一细胞,识别外源性抗原的细胞为CD4+的Th细胞,识别内源性抗原的细胞为CD8+的细胞毒性T细胞[21,29-30]。临床上,CD4+T细胞与CD8+T细胞的比值是评估机体健康的重要指标,如北京地区健康成人CD3+细胞阳性率50.7%~86.0%,CD4+细胞阳性率23.3%~50.2%,CD8+细胞阳性率12.5%~36.9%,CD4/CD8比值为0.80~2.74[31]。牙鲆的T细胞表面标志CD4、CD8已经被克隆表达出来,开始应用于牙鲆免疫相关的研究[32]。
4 结语
本研究制备了牙鲆T淋巴细胞表面标志物CD3的多克隆抗体,主要采用流式细胞术对爱德华氏菌感染和灭活疫苗免疫后牙鲆外周血细胞的数量进行了检测。此研究方法较常规染色计数细胞的方法更为特异和准确,在鱼类血细胞数量尤其是牙鲆淋巴细胞数量的研究上有重要意义。研究结果显示,在感染和免疫后牙鲆外周血白细胞数量、T、B淋巴细胞的比例均呈现先显著上升后逐渐降低的趋势,并且感染组T、B淋巴细胞比例显著高于免疫组。为进一步地探究牙鲆T淋巴细胞亚群可否作为评估指标,本实验室已经着手做了关于牙鲆T淋巴细胞亚群的表面分子CD4、CD8的相关工作,以期为牙鲆健康评估体系提供更全面的数据参考。
[1] Castillo A, Razquin B, Villena A J, et al. Thymic barriers to antigen entry during the posthatching development of the thymus of rainbow trout,Oncorhynchusmykiss[J]. Fish Shellfish Immunol, 1998, 8:157-170.
[2] Dalmo R A, Ingebrigtsen K, Bogwald J. Non specific defence mechanisms in fish, with particular reference to the reticuloendothelial system [J]. J Fish Dis, 1997, 20: 241-273.
[3] 王炜, 刘换新, 王德文. 电磁辐射对SD大鼠外周血白细胞数量、血清免疫球蛋白及TNF-α水平的影响[J]. 中国体视学与图像分析, 2013, 18(1): 79-84. Wang W, Liu H X, Wang W D. Effects of electromagnetic radiation on the peripheral blood count and subtypes and levels of serum of TNF-α, sIgA and sIgG [J]. China stereology and image analysis, 2013, 18(1): 79-84.
[4] 秦玉广, 陈秀丽, 朱永安. 细菌性鱼病研究现状与展望[J]. 井冈山大学学报, 2010, 31(3): 49-57. Qin Y G, Chen X L, Zhu Y A. Advances on bacterial fish disease research [J]. Journal of Jinggangshan University, 2010, 31(3): 49-57.
[5] Ellis A E. The function of teleost fish lymphocytes in relation to inflammation[J]. International Journal of Tissue Reactions, 1986, 8(4): 263-270.
[6] 王冬雪. 炎性肌病外周血淋巴细胞亚群的临床研究及T淋巴细胞致病机制的初步探讨[D]. 北京: 北京协和医学院中国医学科学院, 2012. Wang D X. Peripheral Blood Lymphocytes Subgroup of the Inflammatory Myopathies Patient and Clinical Research and T Lymphocyte of the Pathogenic Mechanism of the Preliminary Discussion [D]. Beijing: Peking Union Medical College & Chinese Academy of Medical Sciences, 2012.
[7] Khanolkar A, Fuller M J, Zajac A J. T cell responses to viral infections[J]. Immunologic Research, 2002, 26: 309-321.
[8] 臧坤, 徐永江, 柳学周. 两种养殖条件下牙鲆的血液生理生化指标比较分析[J]. 渔业科学进展, 2013, 34(5): 36-42. Zang K, Xu Y J, Liu X Z. Comparative analysis of blood physiological and biochemical characteristics between pond and indoor tank-culture of Japanese flounderParalichthysolivaceus[J]. Progress in Fishery Sciences, 2013, 34(5): 36-42.
[9] 董晓煜, 张秀梅, 张沛东. 溶解氧与养殖密度对褐牙鲆幼鱼血细胞数量及血红蛋白含量影响的研究[J]. 海洋水产研究, 2008, 29(6): 40-46. Dong X Y, Zhang X M, Zhang P D. Study on the effect of dissolved oxygen stocking density on blood cell count and haemoglobin concentration in juvenile Japanese flounderParalichthysolivaceus[J]. Marine Fisheries Research, 2008, 29(6): 40-46.
[10] Araki K, Suetake H, Kikuchi K, et al. Characterization and expression analysis of CD3varepsilon and CD3gamma/delta in fugu, Takifugu rubripes[J].Immunogenetics, 2005, 57: 158-163.
[11] Liu Y, Moore, L Koppang E O, et al. Characterization of the CD3zeta, CD3gammadelta and CD3epsilon subunits of the T cell receptor complex inAtlanticsalmon[J]. Developmental and Comparative Immunology, 2008, 32: 26-35.
[12] Overgard A C, Hordvik I, Nerland A H, et al. Cloning and expression analysis of Atlantic halibut (Hippoglossushippoglossus) CD3 genes[J]. Fish & Shellfish Immunology, 2009, 27: 707-713.
[13] Park C I, Hirono I, Enomoto J, et al. Cloning of Japanese flounderParalichthysolivaceusCD3 cDNA and gene, and analysis of its expression[J]. Immunogenetics, 2001, 53: 130-135.
[14] Shang N, Sun X F, Hu W, et al. Molecular cloning and characterization of commoncarp (CyprinuscarpioL.)TCRgamma and CD3gamma/delta chains[J]. Fish & Shellfish Immunology, 2008, 24: 412-425.
[15] Hombach J, Tsubata T, Leclercq L, et al. Molecular components of the B-cells antigen receptor complex of the IgM class[J]. Nature, 1990, 343: 760-762.
[16] Van Noesel C J, van Lier R A, Cordell J L, et al. The membrane IgM-associated heterodimer on human B cells is a newly defined B cell antigen that contains the protein product of the mb-1 gene[J]. Immunology, 1991, 146: 3881-3888.
[17] Van Noesel C J, Brost J, De Vries E F, et al. Identification of two distinct phosphoproteins as components of the human B cell antigen receptor complex[J]. Immunology, 1990, 20: 2789-2793.
[18] Clark M R, Friedrich R J, Campbell K S, et al. Human pre-B and B cell membrane mu-chains are noncovalently associated with a disulfide-linked complex containing a product of the B29 gene[J]. Immunology, 1992, 149: 2857-2862.
[19] Li Qiang, Zhan Wenbin, Xing Jing, et al. Production, characterisation and applicability of monoclonal antibodies to immunoglobulin of Japanese flounder (Paralichthysolivaceus)[J].Fish & Shellfish Immunology, 2007, 23: 982-990.
[20] Anita Ronneseth, Dawit B. Ghebretnsae, Heidrun I, et al. Functional characterization of IgM+ B cells and adaptive immunity in lumpfish (CyclopteruslumpusL.)[J]. Developmental and Comparative Immunology, 2015, 52: 132-143.
[21] Kyosuke Arakia, Kanako Akatsu, Hiroaki Suetake, et al. Characterization of CD8+ leukocytes in fugu (Takifugurubripes) with antiserum against fugu CD8α[J]. Developmental and Comparative Immunology, 2008, 32: 850-858.
[22] 邢婧, 战文斌, 曾晓华, 等. 牙鲆(Paralichthysolivaceus)红细胞单克隆抗体与五种养殖鱼类血细胞的交叉反应[J]. 海洋与湖沼, 2005, 36(2): 123-129. Xing J, Zhan W B, Zeng X H, et al. Cross reaction of monoclonal antibodies against flounderParalichthysolivaceuswith blood cells of five other fish species [J]. Oceanologia et Limnologia Sinica, 2005, 36(2): 123-129.
[23] Köllner B, Kotterba G.Temperature dependent activation of leucocyte populations of rainbow trout,Oncorhynchusmykiss, after intraperitoneal immunization withAeromonassalmonicida[J]. Fish & Shellfish Immunology, 2002, 12: 35-48.
[24] 单红, 张其中, 刘强平, 等. 灭活菌苗免疫的南方鲇外周血液细胞免疫指标的变化[J]. 中国水产科学, 2005, 12(3): 275-280. Shan H, Zhang Q Z, Liu Q P, et al. Changes of immunity index in blood of southern catfish, Silurus meridionalis, immunized by formalin-killedAeromonashydrophila[J]. Journal of Fishery Sciences of China, 2005, 12(3): 275-280.
[25] 罗芬, 张其中, 冯汉茹, 等. 灭活菌苗免疫的中华倒刺鲃外周血免疫指标的变化[J]. 水产学报, 2010, 34(4): 626-634. Luo F, Zhang Q Z, Feng H R, et al. Changes of immune parameters in periphery blood of Spinibarbus sinensis bleeker immunized with formalin-killed Aeromonas hydrophila [J]. Journal of Fisheries of China, 2010, 34(4): 626-634.
[26] 程金科, 段嘉树, 张海玲. 雏鸡感染E.maxima球虫后淋巴组织与外周血T 细胞变化的观察[J]. 中国畜禽传染病, 1994, 78(5): 48-54. Cheng J K, Duan J S, Zhang H L. Observation of lymphoid tissue and peripheral blood T cells in the chicks infected with coccidiaE.maxima[J]. China's Livestock and Poultry Infectious Diseases, 1994, 78(5): 48-54.
[27] Chihaya Nakayasu, Tomoyasu Yoshitomi, Takeshi Oyamatsu, et al. Separation of carp (CyprinuscarpioL.) thrombocytes by using a monoclonal antibody, and their aggregation by collagen[J]. Veterinary Immunology and Immunopathology, 1997, 57: 337-346.
[28] Secombes C J, Van Groningen J J,Egberts E. Separation of lymphocyte subpopulations in carpCyprinuscarpioL. by monoclonal antibodies: immunohistochemical studies[J]. Immunology, 1983, 48(1): 165-175.
[29] Castro R, Bernard D, Lefranc M P, et al. T cell diversity and TCR repertoires in teleost fish[J]. Fish & Shellfish Immunology, 2011, 31(5): 644-654.
[30] Toda H, Saito Y, Koike T, et al. Conservation of characteristics and functions of CD4 positive lymphocytes in a teleost fish[J]. Developmental and Comparative Immunology, 2011, 35(6): 650-660.
[31] 韩呈武,于雪莹,王丽娜, 等. 北京地区健康成人外周血T淋巴细胞亚群的参考范围[J].临床检验杂志, 2009, 27(5): 390-392. Han C W, Yu X Y, Wang L N, et al. The reference range of T lymphocyte subsets of peripheral blood in healthy adults in Peking area [J]. Chinese Journal of Clinical Laboratory Science, 2009, 27(5): 390-392.
[32] Goshi Kato, Kana Goto, Ikuyo Akune, et al. CD4 and CD8 homologues in Japanese flounder,Paralichthysolivaceus: Differences in the expressions and localizations of CD4-1, CD4-2, CD8α and CD8β[J]. Developmental and Comparative Immunology, 2013, 39: 293-301.
[33] 贾东平, 王孟良, 周杰, 等. 牛的血细胞数量检查与疾病[J]. 黑龙江畜牧兽医, 1997, 2(16): 27-30. Jia D P, Wang M L, Zhou J, et al. Blood cells count inspection and disease of cattle [J]. Heilongjiang Journal of Animal Science and Veterinary Medicine, 1997, 2(16): 27-30.
[34] 王荣华, 刘小燕, 曾令兵, 等. 鮰爱德华氏菌灭活疫苗免疫后斑点叉尾鮰外周血免疫指标的变化[J]. 水产学杂志, 2014, 27(4): 38-45. Wang R H, Liu X Y, Zeng L B, et al. Immune parameters in periphery blood of channel catfish infected with formalin-killedEdwardsiellaictaluri[J]. Chinese Journal of Fisheries, 2014, 27(4): 38-45.
[35] Du Y, Tang X Q, Sheng X Z, et al. Immune response of flounder (Paralichthys olivaceus) was associated with the concentration of inactivatedEdwardsiellatardaandimmersiontime[J].VeterinaryImmunologyandImmunopathology, 2015, 167: 44-50.
责任编辑 朱宝象
Numerical Change of Peripheral Blood Cells of Flounder (Paralichthys olivaceus) After Edwardsiellatarda Infection and Vaccination
ZHEN Meng-Xiao, XING Jing, SHENG Xiu-Zhen, TANG Xiao-Qian, ZHAN Wen-Bin
(Laboratory of Pathology and Immunology of Aquatic Animals, Ocean University of China, Qingdao 266003, China)
Fish blood cells involve in the process of immune response and anti-infection. The leukocytes, especially T and B lymphocytes, play important roles in fish immunity, and in the meantime, the number of blood cells or lymphocytes vary during the physiologic processes. In this study, the variation of peripheral blood cells of flounder (Paralichthysolivaceus) afterEdwardsiellatardainfection and vaccination was determined. Our primary research has produced anti-erythrocytes monoclonal antibody (Mab) and anti-immunoglobulin (IgM) Mab, respectively. In this study, the CD3 molecule was cloned and its recombined protein was expressed, and then rabbit anti-CD3 polyclonal antibody (RaPoCD3-Pab) was produced. T and B lymphocytes in peripheral blood (PBL) cells were observed and counted by flow cytometry (FCM) using RaPoCD3-Pab and IgM Mab, respetively. Flounder was intraperitoneally injected with 1×107CFU/mLEdwardsiellatarda, its inactivated vaccine and PBS, respectively. The PBL was collected on days 0, 1, 3, 5, 7, 9, 14, 21 and 28 post injection, respectively. Erythrocytes and leukocytes were analyzed by double fluorescent FCM using Mab against erythrocytes of flounder, and T and B lymphocytes were counted by double fluorescent FCM with RaPoCD3-Pab and IgM Mab. The result showed that the RaPoCD3-Pab and IgM Mab specifically recognized T and B lymphocytes, which were labeled by red or green fluorescence, respectively, and no cross reaction was detected. The T cells were in percentage of (7.49±1.5)% and B cells were (14.64±1.8)% in leukocytes. After infection or vaccination, the concentration of erythrocytes had no significant variation (P<0.01, ANOVA) during the whole experiment compared with the control group, keeping at (2.9±0.45)×109cells/mL in PBL. The leukocyte concentration in control group maintained at (6.9±1.6)×107cells/mL, the proportion of T cells was (8.05±1.38)%, the proportion of B cells was (13.77±1.56)%. In the infection group, the concentration of leukocyte increased significantly on the 3rdday, then reached the peak at (4.7±1.7)×108cells/mL on the 14thday. The proportion of T cells rose immediately on the 1stday, then reached the maximum of (24.3±1.28)% on the 9thday. The proportion of B cells increased on the 1stday, and reached the peak (40.9±1.52) % on the 21stday (P<0.01, ANOVA). In the vaccination group, the leukocyte concentration increased significantly on the 3rdday, then reached the peak of (7.1±1.8)×108cells/mL on the 14thday. The proportion of T cells rose significantly since the 5thday, then reached the maximum of (20.5±1.12)% on the 9thday. The proportion of B cells increased on the 1stday, and reached the peak of (39.3±1.55)% on the 21stday (P<0.01, ANOVA). The results indicated that leukocyte concentration, the proportion of T and B cells in PBL increased significantly before the 21thday after infection and vaccination, leukocyte concentration kept rising during a period of 3-14 days, T cells percentage rose till the 9thday, B cells percentage climbed up till the 21thday, the proportions of T and B cells in PBL increased significantly after infection and vaccination, especially on the 1stday. The counts of leukocytes or the percentage of T and B cells varied with the infection or vaccination process, which might be potential indexes for fish physiologic processes.
Paralichthysolivaceus; infection; vaccination;Edwardsiellatarda; T lymphocyte; B lymphocyte
国家重点基础研究发展计划项目(2012CB114406);国家自然科学基金项目(31172429,31302216)资助 Support by National Program on Key Basic Research Project (2012CB114406); National Natural Science Foundation of China (31172429,31302216)
2016-03-02;
2016-05-06
甄梦晓(1989-),女,硕士生,主要从事水产动物病害与免疫学研究。E-mail:zhenxiah2009@163.com
** 通讯作者:E-mail:xingjing@ouc.edu.cn
S941.4;S91
A
1672-5174(2017)03-034-09
10.16441/j.cnki.hdxb.20160053
甄梦晓, 邢婧, 绳秀珍, 等. 迟缓爱德华氏菌感染和疫苗免疫后牙鲆的血细胞数量变化[J].中国海洋大学学报(自然科学版),2017, 47(3): 34-42.
ZHEN Meng-Xiao, XING Jing, SHENG Xiu-Zhen, et al. Numerical change of peripheral blood cells of flounder (Paralichthysolivaceus) afterEdwardsiellatardainfection and vaccination [J].Periodical of Ocean University of China, 2017, 47(3): 34-42.

