干露时长及温度对魁蚶幼贝潜沙行为及呼吸代谢的影响*
刘旭绪, 张秀梅, 覃乐政, 李文涛
(中国海洋大学水产学院,山东 青岛 266003)
干露时长及温度对魁蚶幼贝潜沙行为及呼吸代谢的影响*
刘旭绪, 张秀梅**, 覃乐政, 李文涛
(中国海洋大学水产学院,山东 青岛 266003)
为优化魁蚶苗种的运输策略,提高在底播增殖过程中苗种的存活率。本实验于 10、15和20 ℃ 3个温度条件下,分别对魁蚶 (Anadarabroughtonii) 幼贝进行不同时长(2 、4 、8 、16 和24 h) 的干露,研究了干露条件对魁蚶幼贝潜沙行为和呼吸代谢的影响。研究显示,相同干露时长内,魁蚶幼贝在 15 ℃时的失水率最高;幼贝的潜沙能力随干露时长的增加和干露温度的升高呈减弱趋势,具体表现为在一定时间内完成潜沙的魁蚶比例减小和完成潜沙的速度减慢。在 10 ℃条件下,干露幼贝再次入水后的潜沙行为恢复较快,20 ℃时干露 24 h 后,幼贝基本丧失潜沙能力,在 12 h 的观察期内未出现完成潜沙的个体。同时,干露导致魁蚶幼贝出现显著的氧债和氨氮积累,干露后再次入水的魁蚶幼贝的耗氧率和氨氮排泄率显著高于对照组水平。相同干露时长内,随着干露温度的升高,魁蚶耗氧率的峰值显著增加,耗氧率的波动幅度更加剧烈,且在短时间内难以恢复至对照组水平。综合分析认为,魁蚶应对干露的能力较弱,在底播苗种运输过程中,相较于 15和 20 ℃,10 ℃的运输温度更好,同时运输时间不宜超过 8 h。
魁蚶;干露;温度;潜沙行为; 幼贝; 呼吸代谢; 时长
魁蚶 (Anadarabroughtonii) 隶属于软体动物门(Mollusca)双壳纲 (Bivalvia)蚶目(Arcoida)蚶科 (Arcidae),分布于日本、朝鲜、菲律宾及中国。魁蚶在我国北至辽宁,南至广东沿海均有分布,以黄海北部较多[1]。魁蚶肉质鲜美,经济价值很高,然而近年来由于过度捕捞,使得其自然资源远远不能满足市场需求[2]。为了修复魁蚶的自然资源,各地相继开展了魁蚶的人工育苗及增殖放流。但增殖放流后魁蚶在放流海区的存活情况并不理想[3]。在魁蚶增殖放流的环节中,其苗种需要经历从中间培育场所转移至放流海域的一段运输过程。通常,魁蚶苗种运输广泛采用干运法,该法操作简便,成本较低,但不适合长距离运输[4]。在干运过程中,贝类暴露于空气中,此时温度、湿度以及干露时长都会对贝类造成影响。
其中温度作为一个重要的环境因子,与贝类的生长和存活密切相关[5-6]。任何温度的变化,都会在一定程度上导致贝类呼吸代谢、摄食吸收等的改变[2,7],高温导致的热胁迫还会降低细胞免疫活性、产生氧化应激、破坏酶结构稳定性,使得贝类的能量收支平衡被破坏,从而影响贝类的免疫机能[8-10],超出贝类承受范围的热胁迫最终还会导致贝类的死亡。干露作为对贝类的一种极端胁迫,会使贝类体内的水分逐渐丧失[11]。同时处于空气中的贝类无法像在水中一样顺利获得氧气,使得机体的厌氧代谢变为主体,而类似于乳酸、琥珀酸等厌氧代谢的产物会导致贝类酸中毒[12-13],使其免疫功能遭受破坏[14-15]。通常双壳贝类在遭受干露时会通过降低呼吸代谢水平,或通过贝壳开闭等进行一定程度的氧气交换,来减轻干露对自身的危害[16-20]。然而这种自我调节具有一定的局限性,干露过程中温度过高,或干露时长过长超出贝类的耐受极限后,贝类便会逐渐死亡[21-24]。
研究表明,贝类遭受干露时,机体不可避免地遭受厌氧代谢导致的损伤[12-15]。但这种损伤在一定程度内可被修复[25-26]。当贝类经历干露后再次进入水体时,通过有氧代谢来分解体内积累的厌氧代谢产物,从而使自身机能恢复到干露前水平。而这种恢复的直观表现就是贝类再次入水后短期的高耗氧率[27-28]以及潜沙行为的变化等。对于生活在海底近表层的潜底性生物来说,最大的捕食风险来自于底表层的捕食者[29],因此,潜沙行为对于埋栖型贝类具有重要意义[30-32]。魁蚶属埋栖型贝类,在增殖放流中只有苗种具备较强的潜沙能力,才能保证放流个体的存活与生长[33]。而苗种运输过程中经历的干露胁迫会对底播贝类的生理机能和潜沙行为造成不同程度的影响,本文研究了不同温度、不同干露时长下魁蚶幼贝呼吸代谢及潜沙行为的变化,以为魁蚶苗种运输和底播增殖技术的优化提供参考依据。
1 材料与方法
1.1 实验材料
实验用魁蚶幼贝采自胶南灵山湾筏式养殖区。将魁蚶取回后于40 cm × 50 cm × 40 cm循环水族箱中暂养 5 d。暂养期间每天早晚 2 次(早上 8:00,晚上 18:00 )投喂单细胞藻。用游标卡尺测量魁蚶的壳长、壳高、壳宽(精确到 0.01 mm),并称量湿重(精确到 0.01 g)。实验魁蚶的壳长为 (36.87±0.08) mm,湿重为(12.14±0.10) g。
实验用沙取自青岛第一海水浴场。取回实验室后用次氯酸钠溶液浸泡 24 h消毒,洗净后于 100 ℃烘干。取过 100 目筛的细沙待用。
1.2 实验设施及条件
实验使用品字型控温水族箱( 40 cm × 50 cm × 40 cm),水族箱内连续充气保持溶解氧在5 mg/L以上。箱内使用沙滤天然海水,海水 pH 为 7.6~8.1 ,盐度 31~34,暂养温度为 10℃,光照周期为 12 L∶12 D。
实验中魁蚶的干露在生化培养箱中进行。干露过程中,生化培养箱内的湿度不低于 85%,同时用潮湿的纱布覆盖魁蚶,每隔 2 h 向纱布洒水,以保持纱布的湿润。
1.3 实验方法
实验共分为 10、15和20 ℃ 3个温度组。暂养结束后,开始进行魁蚶的温度驯化,从暂养温度10℃开始,每天只升高海水温度 1℃,当实验水温分别达到15和20 ℃后,继续在相应温度下适应 5 d,以使魁蚶更好地调整其生理状态。然后从各温度组中随机选取魁蚶 40 只,在对应的适应温度下分别进行 2、4、8、16和24 h 干露。干露结束后,取 20 只魁蚶在对应的温度条件下进行呼代谢实验,余下的 20 只魁蚶进行潜沙实验。在呼吸代谢实验中,利用 YSI 600 水质分析仪连续监测呼吸室内海水溶解氧含量的变化,为降低在连续监测过程中分组实验可能存在的环境差异的影响,保证监测过程中魁蚶生理状态的一致性,将干露后的 20 只魁蚶同时放入一个由锥形瓶改制的容量为5 L的呼吸室,将锥形瓶瓶口用石蜡密封后分别在 10、15和20 ℃恒温水族箱内水浴 4 h,最终得到不同时段内 20只魁蚶的平均耗氧率;同时在 4 h 的呼吸代谢实验开始和结束时,从呼吸瓶中抽取 50 mL 水样,测定水样中氨氮的含量。在潜沙实验中,为消除个体间的影响,分别将 3 个温度环境中干露后的各 20 只魁蚶以 2 只为一组,放入 10 个底部敷有 10 cm 厚细沙的对应温度的水槽中,观察 12 h 内魁蚶的潜沙行为,记录每只魁蚶潜沙开始和结束的时间,以及 12 h 后完成潜沙的魁蚶个数。在开展呼吸代谢和潜沙实验的同时,取各温度组未经干露的魁蚶 40 只作为对照组。
1.4 数据计算
1.4.1 失水率
式中:失水率α为干露时魁蚶的失水量占魁蚶初始湿重的比;W1为干露前魁蚶的湿重;W2为干露结束后魁蚶的重量。
1.4.2 耗氧率
式中:RO2为Δt时间内魁蚶的耗氧率;ΔO2为Δt时间内呼吸室水体中溶解氧的变化量;V为呼吸室的体积;W为进行呼吸室内魁蚶总的湿重。
1.4.3 排氨率
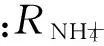
1.4.4 潜沙耗时与完成潜沙时间
t=t2-t1。
实验过程中,以魁蚶进入水中落在沙表面为计时零点t0,记录各个魁蚶的潜沙开始时间t1和潜沙结束时间t2。潜沙开始的标志是魁蚶双壳张开,腹足伸入沙中;潜沙结束的标志是魁蚶壳的后缘完全没入沙中。潜沙耗时t为魁蚶在潜沙过程中花费的时间,代表魁蚶潜沙时的速度;完成潜沙时间即从魁蚶入水至潜沙结束的时间t2。
1.4.5 潜沙率

潜沙实验持续 12 h 后,记录完成潜沙的魁蚶个数,计算各处理组魁蚶的潜沙率。
1.5 数据分析
采用 SPSS 17.0 软件处理数据。其中实验组与对照组间,以及实验组之间采用单因素方差分析进行差异显著性检验,P<0.05 表示差异显著。
2 结果
2.1 不同干露条件下魁蚶的失水率
在 10~15 ℃条件下,随干露时长的增加,魁蚶的失水率呈显著增加趋势。干露 24 h 后魁蚶的失水率均显著高于干露 2、4 和 8 h 组。而在 20℃条件下,只有干露 8 和 24 h 后魁蚶的失水率显著高于 2 h 组,其它各组之间失水率差异不显著。除 24 h 组之外,2、4、8和16 h 干露组均为温度 15℃时魁蚶的失水率最高。16和24 h 干露组,20℃条件下魁蚶的失水率最低(见图 1)。

(图中大写字母表示相同干露时长下不同温度组的组间差异(P<0.05),图中小写字母表示相同干露温度下不同干露时长组的组间差异(P<0.05)。The different capital letters denote significant differences between the groups exposed to the same interval, but the different temperatures. The different lowercase letters denote significant differences between the groups exposed to the same temperature, but the different intervals.)
图1 不同温度和干露时长下魁蚶的失水率
Fig.1 The water lost rate ofAnadarabroughtoniiduring exposure to air under different temperature and time interval
2.2 不同干露条件下魁蚶再次入水后的潜沙率
12 h 潜沙实验后,各组都观察到了未能完成潜沙的个体。未能完成潜沙的魁蚶分为2类:一类魁蚶只是双壳开启,未见腹足伸出等潜沙行为;另一类魁蚶腹足开始掘沙,但是贝壳只有部分埋入沙中。10 ℃组和 15 ℃组随干露时长的增加,12 h 内完成潜沙行为的魁蚶个体数呈下降趋势;20 ℃组在 12 h 内完成潜沙行为的个体数呈先减少后缓慢增多的趋势。对照组以及 2 h干露组在 10 ℃条件下的潜沙率最高,而当干露时长达到 8和 16 h 时, 20 ℃组的潜沙率最高。干露 24 h 后,15 ℃组的潜沙率高于 10 ℃组,而 20 ℃组在 12 h 内未出现潜沙个体(见图2)。
2.3 不同干露条件下魁蚶再次入水后的潜沙耗时
随着干露时长的增加,各温度组魁蚶的潜沙耗时呈现增加趋势,但组间差异不显著。在 10 ℃ 条件下,魁蚶潜沙耗时的中位数随着干露时长的增加呈现出先升高后降低的趋势,各干露组的潜沙时间显著高于对照组,且干露达到 16 h 后,潜沙耗时达到最大值。15 ℃ 条件下干露 24 h的魁蚶潜沙耗时最长,且显著高于对照组和 2 h 干露组的魁蚶。超过 4 h 的干露后,20 ℃ 条件下干露 8和 16 h 的魁蚶潜沙耗时显著高于对照组,且在 24 h 干露后幼贝活力大幅下降,12 h 内无潜沙个体出现(见图3)。
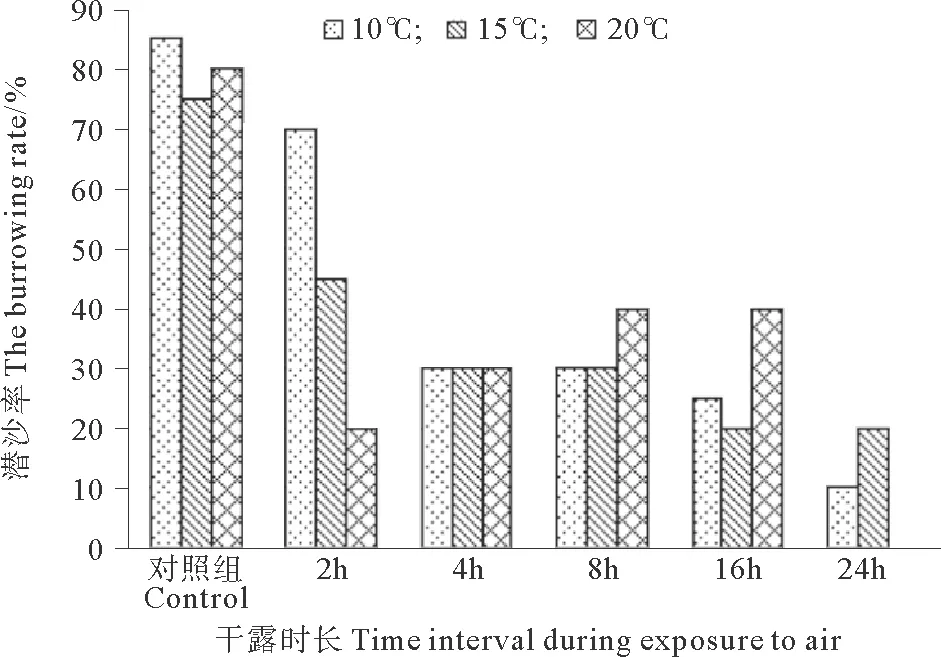
图2 不同温度和干露时长下魁蚶的潜沙率Fig.2 The burrowing rate of Anadara broughtonii after exposure to air under different temperature and time interval
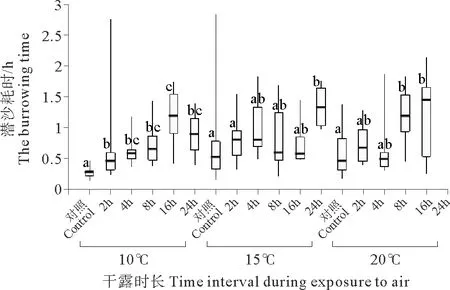
(盒子由第一四分位数(25 %)、中位数和第三四分位数(75 %)组成,线的两端分别代表最大值和最小值。图中小写字母表示相同干露温度下不同干露时长组的组间差异(P<0.05)。The different lowercase letters denote significant differences between the groups exposed to the same temperature, but the different intervals.)
图3 不同温度和干露时长下魁蚶潜沙耗时的箱线图
Fig.3 The box plots of the burrowing time ofAnadarabroughtoniiafter exposure to air under different temperature and time interval
2.4 12 h 内魁蚶完成潜沙时间与干露的关系
在潜沙实验中观察到各干露组的魁蚶再次入水后并未在短时间内开始潜沙,不同个体完成潜沙的时间差异较大。在同一温度条件下,随着干露时长逐渐增加,干露后 12 h 内具有潜沙行为的个体逐步减少。当干露温度较低时,具有潜沙行为的个体能够在较短时间内完成潜沙。例如: 10 ℃条件下,各干露组魁蚶在 12 h 内完成潜沙的时间较为集中,绝大部分在入水后前 3 h 内完成潜沙。而在 15 和 20 ℃ 时,各干露组魁蚶在 12 h 内完成潜沙的时间较为分散。随着干露温度的升高,入水后的恢复时间延长,开始潜沙的时间滞后,导致完成潜沙时间呈现增加趋势。在3个温度条件下,魁蚶完成潜沙时间的中位数随着干露时长的增加也呈现出先升高后降低的趋势(见图4)。

(盒子由第一四分位数(25 %)、中位数和第三四分位数(75 %)组成,线的两端分别代表最大值和最小值。图中小写字母表示相同干露温度下不同干露时长组的组间差异(P<0.05)。The different lowercase letters denote significant differences between the groups exposed to the same temperature, but the different intervals.)
图4 不同温度和干露时长下魁蚶完成潜沙的箱线图
Fig.4 The box plots of the time ofAnadarabroughtoniiburrowed into sand after exposure to air under different temperature and time interval
2.5 不同干露条件下魁蚶再次入水后的排氨率
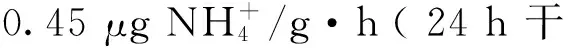
2.6 不同干露条件下魁蚶再次入水后的耗氧率
通过计算魁蚶经过干露再次入水后每 0.5 h 内的平均耗氧率,得出魁蚶再次入水后4 h 内耗氧率的变化趋势(见图 6)。对照组的耗氧率在各温度条件下的波动均最小。在 10、15和 20 ℃条件下,对照组耗氧率的变化范围分别为 3.15~6.77、5.50~14.27、5.52~10.31 μg/(g·h)。除 15和 20 ℃下干露 2 h 组,其它各处理组魁蚶在入水后 0.5 h 内的耗氧率均未超出对照组水平,但随后耗氧率呈现较大的起伏变化。当干露温度为 10 ℃时,魁蚶再次入水后耗氧率的最大峰值出现在 24 h 干露组,为 17.33 μg/(g·h);在 4 h 的恢复过程中,耗氧率的变幅范围为 0.36~17.33 μg/(g·h);干露温度为 15 ℃时,耗氧率最大峰值出现在 2 h 干露组,为 25.01 μg/(g·h),耗氧率的变幅范围为 0~25.01 μg/(g·h);干露温度为 20℃时,耗氧率最大峰值也出现在 2 h 干露组,为 33.52 μg/(g·h),耗氧率的变幅范围在 1.02~33.52 μg/(g·h)。由此可见,随干露温度的升高,相同干露时长下,魁蚶再次入水后耗氧率的峰值升高,耗氧率的波动幅度更加剧烈。

图5 干露后魁蚶的排氨率Fig.5 The ammonia excretion rate of Anadara broughtonii after exposure to air
3 讨论
研究发现,随着干露时长的增加,魁蚶幼贝失水率增加。但在 20 ℃条件下,随着干露时长的增加,平均失水率在干露超过 8 h 后不再增加。这可能与实验中观察到干露时魁蚶的开壳行为有关,魁蚶在干露后先开壳,经过一段时间后双壳又逐渐紧闭。可能是为了防止体内水分的进一步散失。Seaman[34]在对牡蛎 (Crassostreagigas) 进行活体保存时发现,通过对处于干露中的牡蛎不间断喷淋海水,在 20 周后牡蛎成体和稚贝的存活率分别为 52% 和 80%。说明贝类在开壳获取氧气进行呼吸的同时,体内水分的保持也是其存活的重要条件。本实验结果显示,在 10 ℃条件下干露 2 h 后魁蚶的失水率最低,且与该温度条件下干露 4 和 8 h 后的失水率无显著差异。分析认为, 10 ℃时由于温度较低,外套腔内水分散失速度较慢。15 ℃条件下,各干露组魁蚶的平均失水率均高于 20 ℃。推测20 ℃条件下,魁蚶受高温胁迫较强,干露时的闭壳时间较长,从而阻止了水分的散失。

图6 不同温度和干露时长下魁蚶再入水后的耗氧率Fig.6 Rates of oxygen consumption by Anadara broughtonii after exposure to air at different temperatures
实验发现,干露后魁蚶幼贝的潜沙能力随干露时长的增加而逐渐减弱,具体表现在完成潜沙的个体数量减少和完成潜沙的速度减慢,如 10 ℃条件下,干露 16 h的魁蚶潜沙耗时较之前组明显升高。同时还发现,魁蚶幼贝的潜沙能力随着干露温度的升高呈减弱趋势,具体表现在 10 ℃条件下干露的魁蚶再次入水后完成潜沙更迅速,主要集中在前 3 h 内完成潜沙,而 15和20 ℃ 干露组的魁蚶再次入水后完成潜沙过程费时更长。分析认为,随干露时长的增加厌氧代谢产物在贝类体内累积,导致其生理活性降低[25,28,35];同时,高温使贝类代谢水平升高,厌氧代谢产物的积累量也随之增加,从而使再次入水后的恢复时间延长。Marsden等[27]发现,新西兰贻贝 (Pernacanaliculus) 干露时的温度越高,有氧代谢降低的幅度越大。本实验观察到,10 ℃条件下,魁蚶幼贝干露后的潜沙行为恢复较快,有利于再次入水后躲避敌害生物的捕食[36]。但 20 ℃ 时,干露 8 和 16 h 魁蚶幼贝的潜沙率较其它 2 个温度组高,推测是高温干露时的闭壳阻止了幼贝水分的丧失,减少了干露对其活力的影响;但闭壳能够提供的保护作用有限,20 ℃ 时干露 24 h 后,幼贝基本失去了潜沙能力,再次入水后 12 h 观察期内未出现完成潜沙的个体。实验还观察到,魁蚶完成潜沙时间的中位数随着干露时长的增加呈现先升高后降低的趋势,分析是由于幼贝个体差异所致。一些体质较弱的个体在较短时间干露后可以完成潜沙,但耗费时间较长;而随着干露时长的增加体质较弱的个体再次入水后无法完成潜沙行为,而体质健壮的个体仍能够在较短时间内完成潜沙。因完成潜沙时间的计算只统计了成功潜沙的魁蚶个体,从而导致随着干露时长的增长,幼贝完成潜沙时间先升后降。
通过检测干露魁蚶再次入水后的耗氧率和排氨率,发现干露给其带来了显著的氧债和氨氮积累。表现为魁蚶幼贝在恢复期的耗氧率和氨氮排泄率显著高于对照组水平。贝类的呼吸代谢水平在一定范围内随温度的上升而升高[37-38]。本实验中,随干露温度的升高,相同干露时长下,魁蚶再次入水后耗氧率的峰值升高,耗氧率的波动幅度更加剧烈。然而各处理组耗氧率的峰值大小和出现时间并无明显规律。Widdows 等也发现干露后的氧债与干露时产生的厌氧代谢产物并非完全对应。各处理组魁蚶的耗氧率在 4 h 观察期内并未恢复到对照组水平。然而大西洋棱纹贻贝 (Geukensiademissa) 在遭受 3和 12 h 的干露后,其耗氧率可以分别在 30 min 和 2 h 后恢复正常[28]。分析认为,一些生长于潮间带的贝类由于涨落潮变化,会使其周期性的暴露于空气中,已经较好的适应了干露过程[39],并能够在干露后迅速恢复[40]。而魁蚶主要分布于潮下带和浅海[41],应对干露的能力较弱,干露时间过长会给魁蚶再次入水后的呼吸代谢、潜沙行为等带来较大影响。
研究结果表明,失水率、潜沙率、潜沙耗时、12 h 内完成潜沙的时间以及排氨率等指标与干露的温度和时长显著相关。随着干露时长的增加,魁蚶的失水率增加,能够完成潜沙的个体比例降低,个体潜沙花费的时间增长,氧债和氨氮积累增加。10 ℃条件下干露组的魁蚶较其它2个温度组具有更好的活力,干露时长达到 16 h 后,个体完成潜沙的耗时有明显增加、完成潜沙的个体数减少。因此,在魁蚶苗种运输过程中,需要在保持运输环境湿润的前提下尽量缩短运输时间,以 2 h 最佳,不宜超过 8 h。在运输过程中适当的降温有利于蚶苗在放流后的恢复,如放流海域温度较高时,蚶苗在放流前需要一定的温度驯化过程。
[1] 王如才, 王昭萍. 海水贝类养殖学[M]. 青岛: 中国海洋大学出版社, 2008: 362-370. Wang R C,Wang Z P. Aquaculture Science of Shellfish [M]. Qingdao: China Ocean University Press, 2008: 362-370.
[2] 张国范, 王子臣. 胁迫条件下魁蚶的耗氧率[C].// 贝类学论文集. 青岛: 青岛海洋大学出版社, 1995: 142-149. Zhang G F, Wang Z C. The consumption of oxygen of the blood clam, Scapharca Broughtonii in the stressed environment [C].// Transactions of the Chinese Society of Malacology. Qingdao: Qingdao Ocean University Press, 1995: 142-149.
[3] 唐启升, 邱显寅, 王俊, 等. 山东近海魁蚶资源增殖的研究[J]. 应用生态学报, 1994, 5(4): 396-402. Tang Q S, Qiu X Y, Wang J, et al. Resource enhancement of arkshell (Scapharca(Anadara)broughtonii) in Shandong off-shore waters [J]. Chinese Journal of Applied Ecology, 1994, 5(4): 396-402.
[4] 谢佳彦, 朱爱意. 几种重要水产品活体运输技术研究[J]. 水产科学, 2010, 29(9): 532-536. Xie J Y, Zhu A Y. The Technology of live aquatic animal transportation [J]. Fisheries Science, 2010, 29(9): 532-536.
[5] 尤仲杰, 徐善良, 边平江, 等. 海水温度和盐度对泥蚶幼虫和稚贝生长及存活的影响[J]. 海洋学报, 2001, 23(6): 108-113. You Z J, Xu S L, Bian P J, et al. The effects of sea water temperature and salinity on the growth and survival ofTegillarcagranosalarvae and juveniles [J]. Acta Oceanologica Sinica, 2001, 23(6): 108-113.
[6] 尤仲杰,陆彤霞,马斌,等. 温度对墨西哥湾扇贝幼虫和稚贝生长与存活的影响[J]. 水产科学, 2003, 22(1): 8-10. You Z J, Lu T X, Ma B, et al. The temperature on the growth and survival ofArgopectenirradiansconcentricus larvae and juveniles [J]. Fisheries Science, 2003, 22(1): 8-10.
[7] 袁有宪,陈聚法,陈碧娟. 栉孔扇贝对环境变化适应性研究—盐度, pH 对存活, 呼吸, 摄食及消化的影响[J]. 中国水产科学, 2000, 7(4): 73-77. Yuan Y X, Chen J F, Chen B J. Study on adaptability of scallopChlamysfarrerito environment-Effects of salinity and pH on survival, respiration, ingestion and digestion [J]. Journal of Fishery Sciences of China, 2000, 7(4): 73-77.
[8] 许友卿,吴卫君,蒋伟明,等. 温度对贝类免疫系统的影响及其机理研究进展[J]. 水产科学, 2012, 31(3): 176-180. Xu Y Q, Wu W J, Jiang W M, et al. Effect of temperature on immune system and the mechanism in shellfish [J]. Fisheries Science, 2012, 31(3): 176-180.
[9] Mosca F, Narcisi V, Calzetta A, et al. Effects of high temperature and exposure to air on mussel (Mytilusgalloprovincialis, Lmk 1819) hemocyte phagocytosis: Modulation of spreading and oxidative response [J]. Tissue and Cell, 2013, 45(3): 198-203.
[10] Sar G, Kearney M, Helmuth B. Combining heat-transfer and energy budget models to predict thermal stress in Mediterranean intertidal mussels [J]. Chemistry and Ecology, 2011, 27(2): 135-145.
[11] Hicks D W, McMahon R F. Temperature and relative humidity effects on water loss and emersion tolerance ofPernaperna(L.)(Bivalvia: Mytilidae) from the Gulf of Mexico [J]. Bulletin of Marine Science, 2003, 72(1): 135-150.
[12] Burnett L, Terwilliger N, Carroll A, et al. Respiratory and acid-base physiology of the purple sea urchin,Strongylocentrotuspurpuratus, during air exposure: Presence and function of a facultative lung [J]. The Biological Bulletin, 2002, 203(1): 42-50.
[13] Burnett L E. Physiological responses to air exposure: acid-base balance and the role of branchial water stores [J]. American Zoologist, 1988, 28(1): 125-135.
[14] Cardinaud M, Offret C, Huchette S, et al. The impacts of handling and air exposure on immune parameters, gene expression, and susceptibility to vibriosis of European abaloneHaliotistuberculata[J]. Fish & Shellfish Immunology, 2014, 36(1): 1-8.
[15] Chen M, Yang H, Delaporte M, et al. Immune responses of the scallopChlamysfarreriafter air exposure to different temperatures [J]. Journal of Experimental Marine Biology and Ecology, 2007, 345(1): 52-60.
[16] Garc a-March J R, Solsona M S, Garc a-Carrascosa A M. Shell gaping behaviour ofPinnanobilisL., 1758: circadian and circalunar rhythms revealed by in situ monitoring [J]. Marine Biology, 2008, 153(4): 689-698.
[17] Dowd W W, Somero G N. Behavior and survival of Mytilus congeners following episodes of elevated body temperature in air and seawater [J]. The Journal of Experimental Biology, 2013, 216(3): 502-514.
[18] Littlewood D T J. Aquatic and aerial respiration ofCrassostrearhizophorae[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1989, 93(4): 773-775.
[19] Littlewood D T J, Young R E. The effect of air-gaping behaviour on extrapallial fluid pH in the tropical oysterCrassostrearhizophorae[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1994, 107(1): 1-6.
[20] Willson L L, Burnett L E. Whole animal and gill tissue oxygen uptake in the Eastern oyster,Crassostreavirginica: Effects of hypoxia, hypercapnia, air exposure, and infection with the protozoan parasite Perkinsus marinus [J]. Journal of Experimental Marine Biology and Ecology, 2000, 246(2): 223-240.
[21] 刘建勇,卓健辉. 运输时间及水温对南美白对虾苗成活率的影响[J]. 水产养殖, 2005, 26(1): 14-17. Liu J Y, Zhuo J H. Effect of different transport time and water temperature to the survival rate of thePenaeusvannameiseedling [J]. Journal of Aquaculture, 2005, 26(1): 14-17.
[22] 杨凤, 谭文明, 闫喜武, 等. 干露及淡水浸泡对菲律宾蛤仔稚贝生长和存活的影响[J]. 水产科学, 2012, 31(3): 143-146. Yang F, Tan W M, Yan X W, et al. Effects of exposure to air, immersion in fresh-water on growth and survival of juvenile Manila clamRuditapesphilippinarum[J]. Fisheries Science, 2012, 31(3): 143-146.
[23] 于瑞海,王昭萍,孔令锋,等. 不同发育期的太平洋牡蛎在不同干露状态下的成活率研究[J]. 中国海洋大学学报(自然科学版), 2006, 36(4): 617-620. Yu Y H, Wang Z P, Kong L F, et al. A study on the survival rate of pacific oysters in different exposure states at different development stages [J]. Periodical of Ocean University of China, 2006, 36(4): 617-620.
[24] Davenport J, Wong T M. Responses of the blood cockleAnadaragranosa(L.)(Bivalvia: Arcidae) to salinity, hypoxia and aerial exposure [J]. Aquaculture, 1986, 56(2): 151-162.
[25] Almeida E A, Bainy A C D, Dafre A L, et al. Oxidative stress in digestive gland and gill of the brown musselPernapernaexposed to air and re-submersed [J]. Journal of Experimental Marine Biology and Ecology, 2005, 318(1): 21-30.
[26] Pampanin D M, Ballarin L, Carotenuto L, et al. Air exposure and functionality ofChameleagallinahaemocytes: Effects on haematocrit, adhesion, phagocytosis and enzyme contents [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2002, 131(3): 605-614.
[27] Marsden I D, Weatherhead M A. Effects of aerial exposure on oxygen consumption by the New Zealand musselPernacanaliculus(Gmelin, 1791) from an intertidal habitat [J]. Journal of Experimental Marine Biology and Ecology, 1998, 230(1): 15-29.
[28] Widdows J, Bayne B L, Livingstone D R, et al. Physiological and biochemical responses of bivalve molluscs to exposure to air [J]. Comparative Biochemistry and Physiology Part A: Physiology, 1979, 62(2): 301-308.
[29] Zwarts L, Wanink J. Siphon size and burying depth in deposit- and suspension-feeding benthic bivalves [J]. Marine Biology, 1989, 100(2): 227-240.
[30] Addino M, Lomovasky B J, Cremonte F, et al. Infection by gymnophallid metacercariae enhances predation mortality of SW Atlantic stout razor clamTagelusplebeius[J]. Journal of Sea Research, 2010, 63(2): 102-107.
[31] Dudas S E, McGaw I J, Dower J F. Selective crab predation on native and introduced bivalves in British Columbia [J]. Journal of Experimental Marine Biology and Ecology, 2005, 325(1): 8-17.
[32] Richardson H. Availability of buried littleneck clams (Venerupisjaponica) to northwestern crows (Corvuscaurinus) [J]. The Journal of Animal Ecology, 1985, 54(2): 443-457.
[33] 周玮, 刘一兵, 李坤, 等. 魁蚶苗种的潜沙行为观察[J]. 大连海洋大学学报, 2011, 26(6): 550-553. Zhou W, Liu Y B, Li K, et al. Observation of burrowing behavior and ability of spat with different sizes inScapharcabroughtoniiSckrenck [J]. Journal of Dalian Ocean University, 2011, 26(6): 550-553.
[34] Seaman M N L. Survival and aspects of metabolism in oysters,Crassostreagigas, during and after prolonged air storage [J]. Aquaculture, 1991, 93(4): 389-395.
[35] Zhang Z, Li X, Vandepeer M, et al. Effects of water temperature and air exposure on the lysosomal membrane stability of hemocytes in pacific oysters,Crassostreagigas(Thunberg) [J]. Aquaculture, 2006, 256(1): 502-509.
[36] Tallqvist M. Burrowing behaviour of the Baltic clamMacomabalthica: Effects of sediment type, hypoxia and predator presence [J]. Marine Ecology Progress Series, 2001, 212: 183-191.
[37] 栗志民, 刘志刚, 谢丽, 等. 体重和温度对华贵栉孔扇贝(Chlamys nobilis)耗氧率和排氨率的影响[J]. 海洋与湖沼, 2010, 41(1):99-105. Li Z M, Liu Z G, Xie L, et al. Effect of body weight and temperature on oxygen consumption and ammonia-N excretion rates ofChlamysnobilis[J]. Oceanologia Et Limnologia Sinica, 2010, 41(1): 99-105.
[38] 张媛, 方建光, 毛玉泽, 等. 温度和盐度对橄榄蚶耗氧率和排氨率的影响[J]. 中国水产科学, 2007, 14(4): 690-694. Zhang Y, Fang J G, Mao Y Z, et al. Effects of temperature and salinity on oxygen consumption rate and ammonia excretion rate of clamEstellarcaolivacea[J]. Journal of Fishery Sciences of China, 2007, 14(4): 690-694.
[39] Boyden C R. The behaviour, survival and respiration of the cocklesCerastodermaeduleandC.glaucumin air [J]. Journal of the Marine Biological Association of the United Kingdom, 1972, 52(3): 661-680.
[40] Widdows J, Shick J M. Physiological responses ofMytilusedulisandCardiumeduleto aerial exposure [J]. Marine Biology, 1985, 85(3): 217-232.
[41] Broom M J. The Biology and Culture of Marine Bivalve Molluscs of the GenusAnadara[M]. Manila, Philippines: International Center for Living Aquatic Resources Management, 1985.
责任编辑 朱宝象
Effects of Air Exposure Duration and Temperature on Burrowing Behavior and Respiratory Metabolism of Juvenile Anadara broughtonii
LIU Xu-Xu, ZHANG Xiu-Mei, QIN Le-Zheng, LI Wen-Tao
(College of Fisheries, Ocean University of China, Qingdao 266003, China)
In order to optimize the juvenileAnadarabroughtoniitransportation, and improve the survival of juvenile clams after bottom sowing, the influences of air exposure on the burrowing behavior and respiratory metabolism of juvenileA.broughtoniiat different temperatures and time intervals were examined. The juvenile clams were exposed to air for 2 h, 4 h, 8 h, 12 h and 24 h at 10 ℃, 15 ℃ and 20 ℃, respectively. The results showed that at the same exposure duration, water loss rate ofA.broughtoniiwas the highest at 15 ℃. Burrowing ability of the juvenile clams such as the proportion of burrowing clams and burrowing speed decreased with both air exposure duration and temperature increase. At 10 ℃, the burrowing ability of juvenile clams recovered rapidly after re-immersed in water. While at 20 ℃, after a 24 h air exposure, no clam completed burrowing, showing the loss of burrowing ability. During the air exposure, an oxygen debt and accumulation of ammonia excretion were observed. The oxygen consumption rate and ammonia excretion rate of the juveniles in all treatment groups were significantly higher than those of the control group when re-immersed in water. At the same air exposure duration, the peak oxygen consumption rate significantly increased with temperature with more intense fluctuations and longer time to recover to control levels after re-immersed. We concluded that juvenileA.broughtoniiis susceptible to air exposure. In the process of transportation, the temperature 10 ℃ is better than 15 ℃ and 20 ℃, and the transportation duration should be less than 8 hours.
Anadarabroughtonii; air exposure; temperature; burrowing behavior; juvenile; respratory metabolism; time intervals
海洋公益性行业科研专项经费项目( 201305043;201405010)资助 Supported by National Marine Public Welfare Research Project ( 201305043; 201405010 )
2016-05-12 ;
2016-07-20
刘旭绪(1989-),男,博士生,研究方向:主要从事资源增殖学研究。E-mail: why-lxx@163.com
** 通讯作者:E-mail: gaozhang@ouc.edu.cn
S917.4
A
1672-5174(2017)03-019-08
10.16441/j.cnki.hdxb.20160219
刘旭绪, 张秀梅, 覃乐政, 等. 干露时长及温度对魁蚶幼贝潜沙行为及呼吸代谢的影响[J].中国海洋大学学报(自然科学版), 2017, 47(3): 19-26.
LIU Xu-Xu, ZHANG Xiu-Mei, QIN Le-Zheng, et al. Effects of air exposure duration and temperature on burrowing behavior and respiratory metabolism of juvenileAnadarabroughtonii[J].Periodical of Ocean University of China, 2017, 47(3): 19-26.

