不同丛枝菌根菌株对3种珍贵树种促生效应试验
陈伟玉,麦志通,蔡开朗,陈运雷,洪文君
(三亚市林业科学研究院,海南 三亚 572000)
丛枝菌根(Arbuscular mycorrhizasfungi,AMF)是由球菌门的真菌与植物的根系形成的共生体,是地球上分布最广泛的菌根[1]。近年来,丛枝菌根真菌对宿主植物生长的有利作用已被广泛关注。大量的研究表明,接种AMF菌根后,能显著促进植物的生长、增加植物的生物量[2-3]、提高养分吸收率、品质及抗逆性[4-5],且更多地侧重研究对象为农作物[6]、经济作物[7]及部分林木[8-9],包括喜树[10]、降香黄檀[11-12]等珍贵树种。由于菌根的种间差异、种内的生态型差异均会影响到丛枝菌根真菌的作用效果。
发展珍贵树种是改善生态环境的迫切需要,是促进农民增收致富的有效途径。土沉香(Aquilaria sinensis)为瑞香科沉香属,为国家Ⅱ级重点保护野生植物;降香黄檀(Dalbergia odorifera)为蝶形花科黄檀属,因其木材珍贵,且拥有极具潜力的药用价值,天然资源急剧下降,已被列为国家二级保护植物[13];檀香(Santalum album)为檀香科檀香属常绿半寄生小乔木珍贵树种,是一种集药用、香料、宗教、雕刻材料于一体的重要珍贵热带经济树种[14]。本研究通过接种不同菌株对土沉香、降香黄檀和檀香3种珍贵树种的促进生长效应,评价不同菌种、菌株间的接种效应,探讨接菌后这3种珍贵树种生长与植物根系是否存在关联,为接种丛枝菌根促进珍贵树种生长的有效途径提供理论依据。
1 材料与方法
1.1 试验材料
供试菌种共4种,分别为采自不同地区的幼套近明球囊霉(Claroideoglomus etunicatu)和摩西斗管囊霉(Funneliformis mosseae)各2个菌株,由北京市农林科学院植物营养与资源研究所丛枝菌根真菌种质资源库(BGC)提供(表1),经盆栽沙培法扩繁获得菌种。

表1 供试菌剂基本信息
供试植物降香黄檀、檀香、土沉香的种子均为海南种源,降香黄檀和檀香为两个月实生苗,土沉香为半年生实生苗,其基础生长数据见表2。
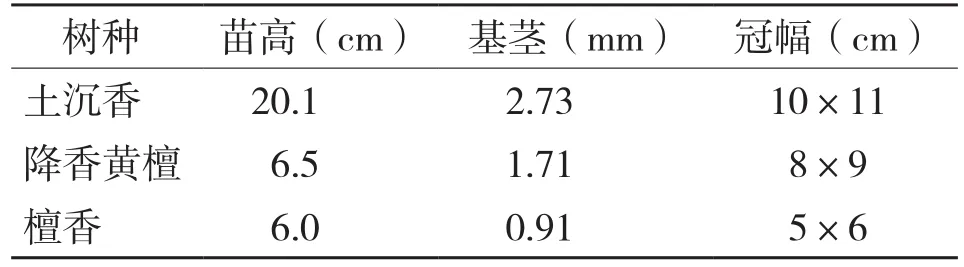
表2 3种珍贵树种幼苗的基础生长量
供试栽培基质以园土和椰糠基质按2∶1体积比混合制成,经0.2% K2MO4灭菌备用。基质的理化性质:pH值7.2,有机质含量18.5g/kg,全氮、全磷、全钾含量分别为0.72、0.45、4.23 kg/g,碱解氮、有效磷、速效钾含量分别为69.4、46.7、35.4 mg/kg。
1.2 试验方法
试验地点为三亚市林业科学研究院苗圃温室。选择长势均匀的降香黄檀、檀香和土沉香幼苗常规管理 15 d后,分别测量苗高、基径和冠幅数据作为基础生长量,然后接种幼套近明球囊霉菌株1和菌株2、摩西斗管囊霉菌株1和菌株2,每盆幼苗的根系周围分别施加CE1、CE2、FM1、FM2菌种50 g,对照组则施加幼苗袋装时相同的栽培基质50 g,每个处理48株。试验期间苗木浇水等管理措施保持一致。接种100 d后,测定苗木的生长量、生物量、菌根侵染率及根系结构等参数指标。
1.3 测定指标
苗高(基茎)净生长量=收获植株的生长量-基础植物的生长量
生物量:幼苗经105℃的烘箱中烘15 min杀青后,70℃烘干24 h,分别测定地上部、地下部生物量和总生物量,计算根冠比。
菌根依赖性(MD)菌根依赖性=菌根植株干质量/非菌根植株干质量。MD≤100%表示植物对菌根的依赖性较弱或没有依赖性,100%<MD≤300%表示植物对菌根有中等强度的依赖性,MD>300%表示植物对菌根的依赖性较强[15]。
根系菌根侵染率:随机选取各处理新鲜根30条,剪成长约1.0 cm的根段,应用锥虫蓝染色法检测根系菌根菌感染率[16],统计根系的侵染率和侵染强度。
根系特征值:将苗木完整的根系样品放置孔径0.150 mm筛上用清水小心冲洗掉根系表面的泥土,以防止脱落根系被水冲走。采用万深LA-S植物根系分析系统(杭州万深检测科技有限公司)测定全根系形态特征,包括根长、根表面积、根体积和根系直径。
1.4 数据处理
试验数据采用Microsoft Excel 2010进行统计分析和作图,采用SPSS 19.0软件进行方差分析和主成分分析。
2 结果与分析
2.1 接种不同菌种对3种珍贵树种的侵染效应
菌根侵染检测结果(图1)显示,除对照外,土沉香各处理均已感染菌根菌,感染率为100%;降香黄檀各处理包括对照的感染率均为100%;而檀香的菌根侵染率在38%~83%之间,以接种摩西斗管囊霉菌株1(FM1)处理侵染率最高,对照最低(图1A)。从菌根侵染强度来看,土沉香各接种处理的菌根侵染强度为58.35%~78.47%;降香黄檀以接种幼套近明球囊霉菌株1(CE1)处理的侵染强度最大,为81.43%,接种摩西斗管囊霉菌株2(FM2)处理次之;檀香各接种处理的侵染强度为50.36%~58.35%(图1B)。方差分析结果表明,3种珍贵树种接种处理的侵染强度均显著高于对照。
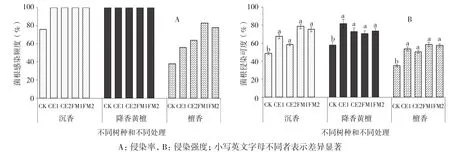
图1 不同菌种对3种珍贵树种的侵染效应
2.2 接种不同菌种对3种珍贵树种幼苗生长的影响
从图2可以看出,接种不同菌根真菌对3种珍贵树种的树高净生长量有不同影响。其中,土沉香幼苗树高净生长量以接种FM1处理最高,为14.3 cm,接种FM2处理次之;降香黄檀幼苗以接种CE2处理最高,为11.3 cm;檀香幼苗以接种FM2处理最高,FM1次之。方差分析结果表明,接种菌种处理的土沉香和降香黄檀幼苗均显著高于对照,接种FM1、FM2的檀香苗高净生长量显著高于对照,但与接种CE1、CE2处理差异不显著。
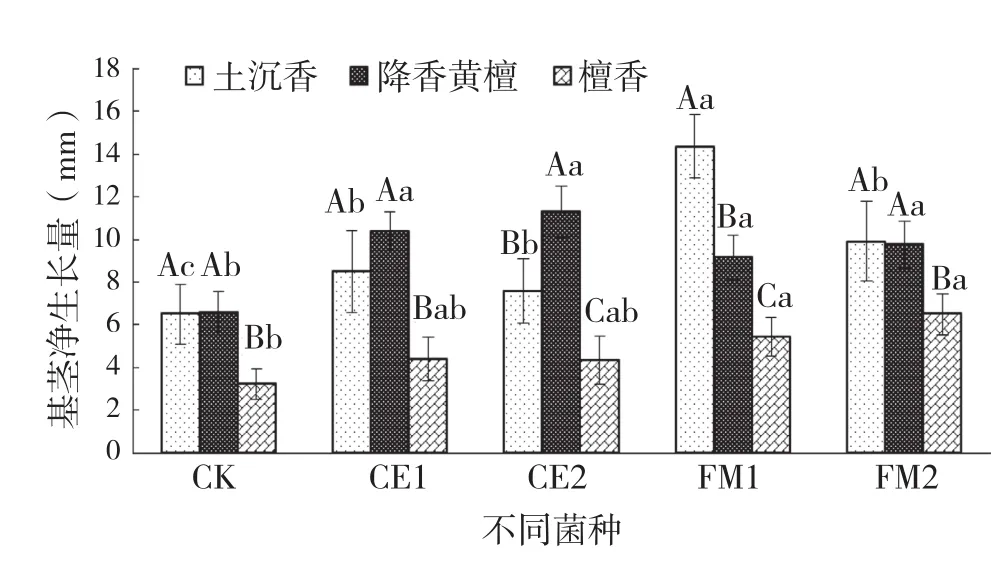
图2 接种不同菌种对3种珍贵树种幼苗的苗高净生长量比较
从不同树种接种同一菌种的苗高净生长量来看,土沉香和降香黄檀的苗高生长快于檀香。图2显示,无论是对照,还是接种处理,土沉香和降香黄檀的苗高生长量均显著高于檀香。
从幼苗基茎净生长量来看,依次为降香黄檀>土沉香>檀香。除对照和接种FM2处理外,降香黄檀幼苗的基茎净生长量显著高于土沉香和檀香;土沉香幼苗以接种FM2处理最高,降香黄檀以接种CE1处理最高,檀香以接种FM1处理最高。方差分析结果表明,土沉香接种CE和FM2处理显著高于对照,降香黄檀幼苗接种不同菌种处理亦均显著高于对照,檀香接种处理与对照均无显著差异(图3)。

图3 接种不同菌种对3种珍贵树种幼苗基茎净生长量的影响
2.3 接种不同菌种对3种珍贵树种幼苗生物量的影响
生物量检测结果(表3)表明,土沉香幼苗接种不同菌种的地上部生物量和总生物量均显著高于对照,均以接种FM2处理最高,接种FM1、FM2处理的地下部生物量较高;无论是总生物量,还是地上部、地下部生物量,接种不同菌种处理的降香黄檀幼苗生物量均显著高于对照,均以接种CE1处理最大;而檀香幼苗各处理的地上部、地下部和总生物量与对照差异不显著。土沉香各处理的根冠比在2.04~0.42之间,降香黄檀在0.20~0.35之间,檀香在0.21~0.47之间,说明3个树种接种不同菌种的根冠比与对照的差异均不显著。
2.4 接种不同菌种对3种珍贵树种的菌根依赖性比较
菌根依赖性结果(图4)显示,接种同一菌种,降香黄檀的菌根依赖性显著高于檀香和土沉香。接种不同的AMF后,降香黄檀菌根依赖性在800%~1088%之间,以接种CE1和CE2的菌根依赖性较高;檀香幼苗的菌根依赖性在340%~540%之间,以接种FM2的菌根依赖性较高,说明降香黄檀和檀香对本研究选用的菌种表现出较高强度的依赖性。而土沉香幼苗的菌根依赖性在200%~330%,表现出中等强度的菌根依赖性。
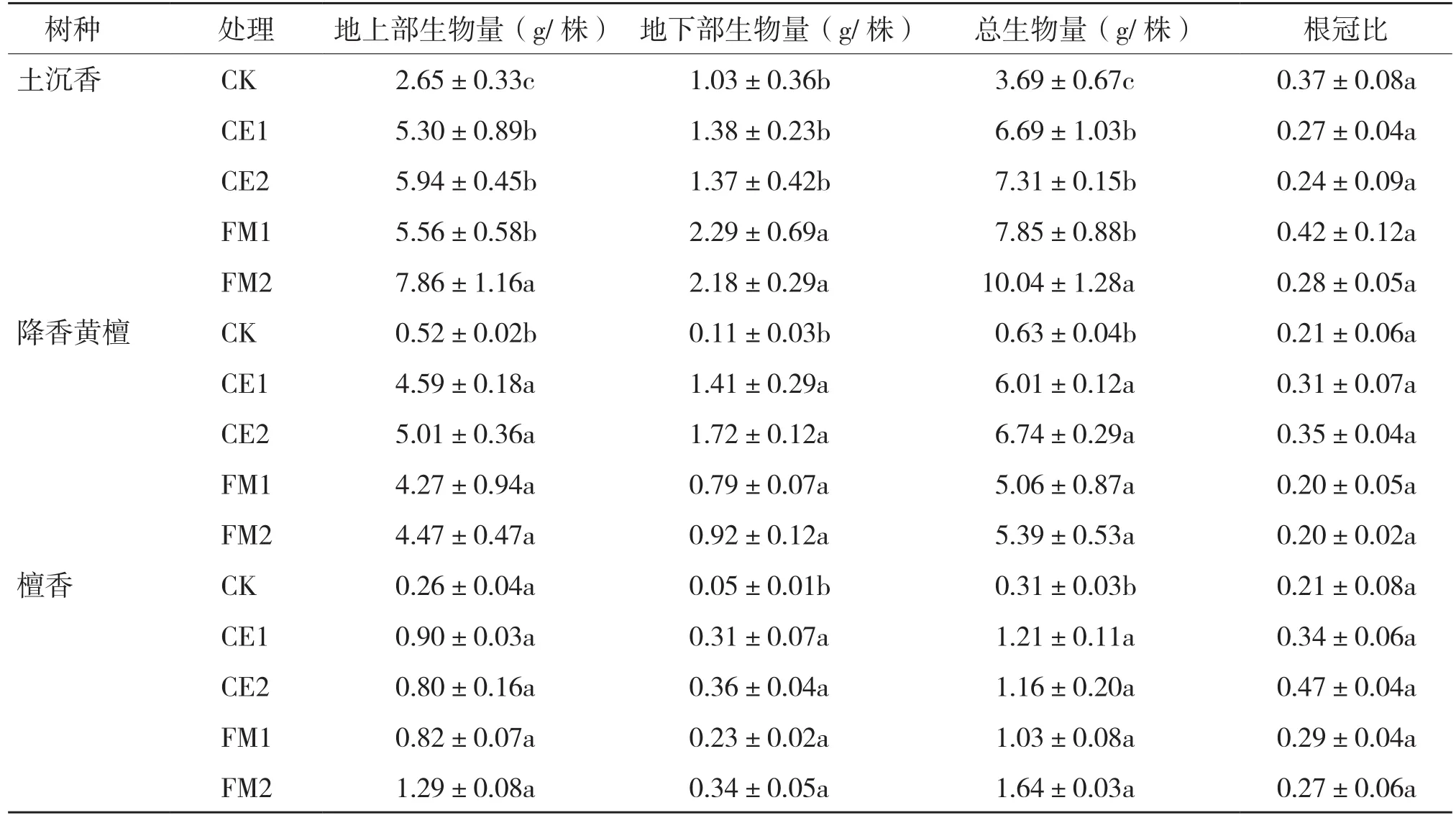
表3 接种不同菌种对3种珍贵树种幼苗生物量的影响

图4 接种不同菌种对3种珍贵树种幼苗的菌根依赖性比较
2.5 接种不同菌种对3种珍贵树种幼苗根系形态特征的影响
根系形态结构检测结果(表4)表明,接种不同菌根真菌对3种珍贵树种的根长、根表面积、根体积和根系平均直径均有显著影响。接种菌种后,土沉香各处理的根长、根表面积和根体积均显著高于对照,根系平均直径以接种FM1最大,为0.50 mm;降香黄檀各接菌处理的根长、根表面积和根体积也均高于对照,根系平均直径以接种CE2最大,为0.43 mm;檀香根长以接种FM1和FM2较长,各接菌处理根表面积和根系平均直径与对照差异不显著,根体积均显著高于对照。
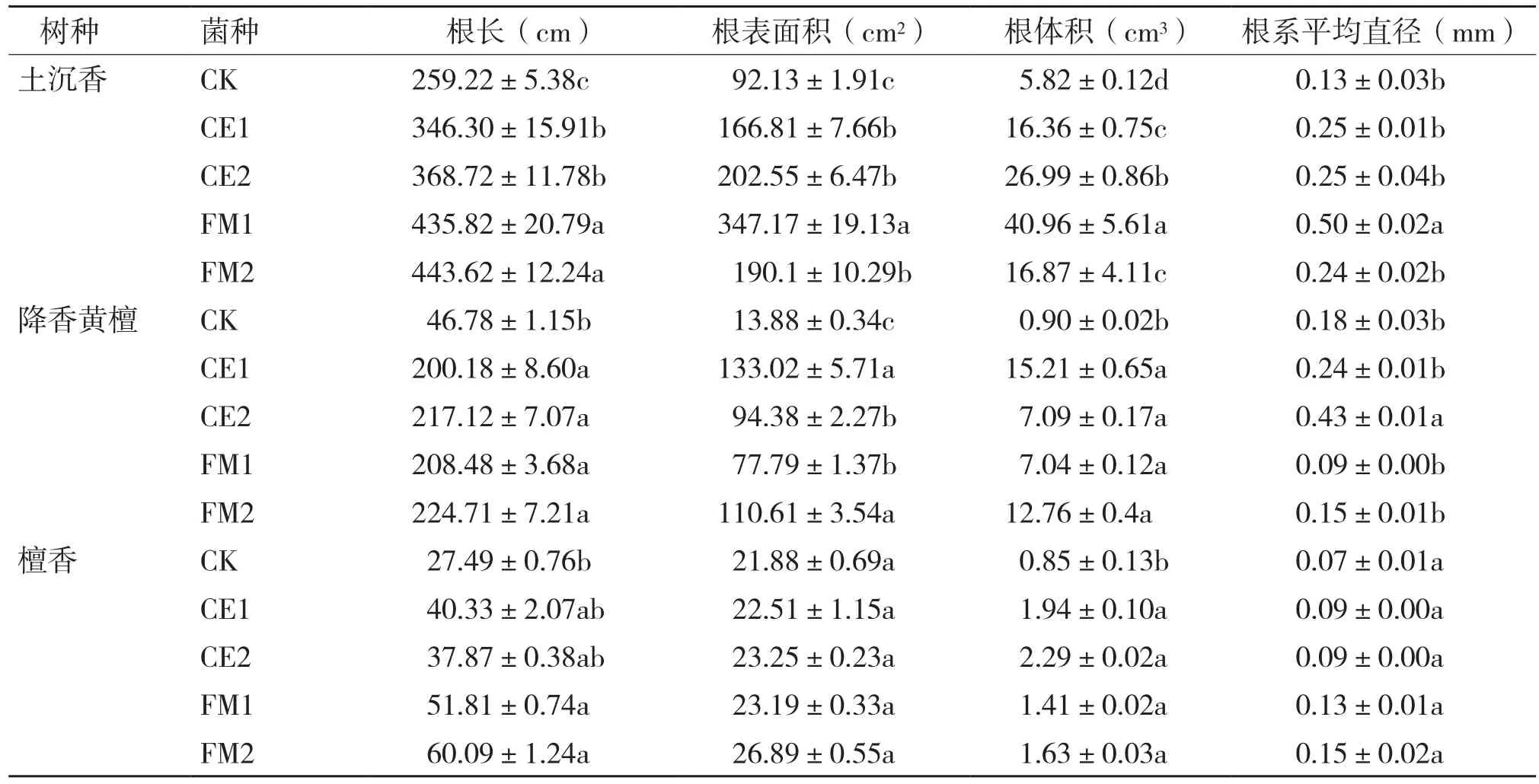
表4 接种不同菌种对3种珍贵树种根系形态特征的影响
2.6 3种珍贵树种根系形态特征与生长指标的PCA分析
将植物苗高、地径、生物量、根长、根表面积、根体积和平均根系直径指标进行PCA分析。结果显示,第一、二主成分的累积贡献率为95.2%,其中PC1占总方差的89.3%,PC2占方差的5.9%(图5)。第一排序(横)与地径、苗高、地上部生物量、地下部生物量、根体积、根表面积和根冠比呈正相关,与其他因子呈负相关;第二排序(纵)轴与总生物量、根长、根系平均直径呈正相关,与其他因子呈负相关。PC1主要反映地上部生物量、地下部生物量、根表面积和根体积因子,PC2主要反映根长和总生物量因子。
从图5还可以看出,接种丛枝菌根真菌对土沉香、降香黄檀和檀香能较好各自聚为一类,各树种对其因子响应不同,反映不同菌株不同树种对生长因子和根系因子具有差异。
3 结论与讨论
3.1 不同菌株对宿主植物亲和力的影响
球囊霉属是华南地区AMF的优势菌属,生态适应性较强[17-18],但不同菌株与不同植物的亲和力有差异[19]。本研究结果表明,无论是否接种菌种,降香黄檀各处理的菌根侵染率均为100%,侵染强度在58%以上;土沉香和檀香各处理的菌根侵染率均显著高于对照,侵染强度均在38%以上。由此反映了不同菌株对不同树种的亲和力不同。降香黄檀为根瘤菌植物,其根系与丛枝菌根共生关系可能要强于土沉香和檀香;檀香为半寄生植物[14],其根系与丛枝菌根共生能力可能从伴生植物中吸盘获取养分,从而自身根系侵染需要较长时间。Smith等[20]的研究则表明菌根侵染率受土壤营养条件、AM真菌种类、宿主植物种类、生态型及生长条件等多种因素的影响。

图5 3种珍贵树种根系形态特征与生长指标PCA分析
3.2 不同菌种对3种珍贵树种生长的促进效应
丛枝菌根真菌与宿主植物的互利共生效应,增强了植物从土壤中获取水分的能力[21],也改善了植物根系对矿质元素及养分的吸收[22],从而促进植物的生长。本研究结果表明,接种幼套近明球囊霉CE和摩西斗管囊霉FM均能不同程度地促进3种珍贵树种的生长和地上部、地下部生物量的积累,其中土沉香以接种FM菌株的生长量和生物量积累较高;降香黄檀以接种CE菌种的生长量和生物量积累较高,且显著高于对照;檀香接种CE和FM菌种的生长量和生物量均高于对照,反映了不同菌株对不同树种生长的影响存在差异。这与吴福勇等[23]的研究结果一致。
菌根菌是根际有益微生物,常作为微生物肥料来使用。莫惠芝等[12]研究揭示斗管囊霉与其他菌种混合对降香黄檀生长的促进作用优于单一菌种;刘子嘉等[24]研究表明聚丛球霉菌(Glomuse aggrregattum)对降香黄檀生长的促进作用较好。本研究结果也表明,接种AM菌种对这3种珍贵树种的生长有促进作用。
3.3 不同菌种对3种珍贵树种根系形态的影响
植物根系的生长与其生长发育密切相关,研究根系的形态特征、生长特性对珍贵树种育苗技术有着重要的指导作用。本研究结果表明,接种AMF后,土沉香、降香黄檀和檀香接菌处理的根系长度、根表面积和根体积均高于对照,说明接种AMF能提高植物根系生长,促进根系从土壤中吸收更多的水分和养分。本研究结果也进一步说明,AMF诱导根系的生长,使得菌根化植物的根系形态为其生长提供保障[25]。土沉香以接种FM1菌种的根系形态值较高,降香黄檀以接种CE2菌种根系生长较好,而檀香接种菌种对其根系生长的影响尚未表现出明显差异,这可能与接菌后植物根系菌丝长度和表面积生长扩散能力有关。本研究中的土沉香研究结果与袁丽环等[26]研究翅果油树(Elaeagnus mollis)、Wu等[27]研究红橘(Citrus tangerine)接种摩西球囊霉能显著提高其根系长度、根表面积和根体积的结果一致。而檀香幼苗接种后根系形态特征表现差异不明显,可能与接种时间较短、植物自身生长特性有关。Arpana等[28]研究表明菌根菌在提高地下部根系功能性状的同时,也提高了地上部的功能性状,也存在菌根菌对地上或地下部功能性状没有偏向性。本研究结果中土沉香和降香黄檀属于前者,檀香则属于后者。
本研究为短期试验,供试丛枝菌根真菌有利于这3种珍贵树种幼苗的生长,促进作用因菌种而异,然而在后期生长情况下,它们是否能持续保持较好的生长状态,即接种效应的可持续性仍有待进一步研究。
[1]刘润进,陈应龙. 菌根学[M]. 北京:科学出版社,2007:327.
[2]宋勇春,李晓林,冯固. 菌根真菌磷酸酶活性对红三叶草生境中土壤有机磷亏缺的影响[J].生态学报,2001,21(7):1130-1135.
[3]赵昕,阎秀峰. 丛枝菌根对喜树幼苗生长和氮、磷吸收的影响[J]. 植物生态学报,2006,30(6):947-953.
[4]张功,旺庆,峥嵘,等. 不同VA菌根真菌对马铃薯生长的影响[J]. 华北农学报,2001,16(4):115-118.
[5]李岩,焦惠,徐丽娟,等. AM真菌群落结构与功能研究进展[J]. 生态学报,2010,30(4):1089-1096.
[6]盖京苹,冯固,李晓林. 接种丛枝菌根真菌对甘薯生长的影响研究[J]. 中国生态农业学报,2004,12(1):111-113.
[7]张稼涵,房玉林,王美萍,等. AM真菌对红地球葡萄促生效应的初步研究[J]. 西北农林科技大学学报(自然科学版),2010,38(12):197-202.
[8]张中峰,张金池,黄玉清,等. 接种菌根真菌对青冈栎幼苗耐旱性的影响[J]. 生态学报,2016,36(11):3402-3410.
[9]洪文君,莫惠芝,方素琴,等. 接种光合菌和菌根菌对圆叶乌桕幼苗生长的影响[J]. 西南农业学报,2017,30(1):129-133.
[10]赵昕,宋瑞清,阎秀峰. 接种AM真菌对喜树幼苗生长及光合特性的影响[J]. 植物生态学报,2009,33(4):783-790.
[11]周雪刚,庄雪影,吴永彬. 降香黄檀幼苗接种AM真菌效应研究[J]. 林业实用技术,2012(8):6-8.
[12]莫惠芝,吴永彬,彭桂香,等. 光合细菌对降香黄檀幼苗的生长效应研究[J]. 广东农业科学,2014,41(2):70-74.
[13]Yu X,Wang W,Yang M. Antioxidant activities of compounds isolated fromDalbergia odoriferaand their inhibition effects on the decrease of glutathione level of rat lens induced by UV irradiation[J]. Food Chemistry,2007,104:715-720.
[14]李应兰.檀香引种研究[M].北京:科学出版社,2003.
[15]弓明钦,王凤珍,陈羽,等. 西南桦对菌根的依赖性及其接种效应研究[J]. 林业科学研究,2000,13(1):8-14.
[16]黄华成. 广东南昆山与铜鼓峰部分植物菌根及植物群落丛枝菌根菌多样性研究[D]. 广州:华南农业大学,2007.
[17]魏源,王世杰,刘秀明,等.喀斯特地区丛枝菌根真菌遗传多样性[J]. 生态学杂志,2011,30(10):2220-2226.
[18]莫惠芝,庄雪影.广东清远石灰岩层个植物群落菌根及土壤AMF 孢子多样性[J]. 广东林业科技,2013,29(1):9-15.
[19]Zeng Y,Guo L P,Chen B D,et al. Arbuscular mycorrhizal symbiosis and active ingredients of medicinal plants:current research status and prospective[J]. Mycorrhiza,2013,23(4):253-265.
[20]Smith S E,Read D J. Mycorrhizal Symbiosis[M].London:Academic Press,1997.
[21]毕银丽,丁保建,李晓林. VA菌根对冬小麦利用养分和水分的影响[J]. 土壤通报,2011,32(3):99-101.
[22]Dodd J C,Dougall T A,Clapp J P. The role of arbuscular mycorrhizal fungi in plant community establishment at Samphire Hoe,Kent,UK-The reclamation platform created during the building of the Channel tunnel between France and the UK[J]. Biodiversity and Conservation,2002,11:39-58.
[23]吴福勇,刘雪平,毕银丽,等. 不同生态型摩西球囊霉菌株对蜈蚣草砷吸收的影响[J]. 生态学杂志,2013,32(6):1539-1544.
[24]刘子嘉,罗静,刘福妹,等. AM真菌对降香黄檀幼苗生长的影响[J]. 中国城市林业,2015,13(3):35-38.
[25]邹英宁,吴强盛,李艳,等. 丛枝菌根真菌对枳根系形态和蔗糖、葡萄糖含量的影响[J]. 应用生态学报,2014,25(4):1125-1129.
[26]袁丽环,闫桂琴,朱志敏. 丛枝菌根(AM)真菌对翅果油树幼苗根系的影响[J]. 西北植物学报,2009,29(3):580-585.
[27]Wu Q S,He X H,Zou Y N,et al. Arbuscular mycorrhizas alter root system architecture ofCitrus tangerinethrough regulating metabolism of endogenous polyamines[J]. Plant Growth Regulation,2012,68:27-35.
[28]Arpana J,Bagyaraj D J,Prakasa Rao E V S,et al.Symbiotic response of patchouli〔Pogostemon cablin(Blanco)Benth.〕different arbuscular mycorrhizal fungi[J]. Advances in Environmental Biology,2008,2(1):20-24.

