超高效液相-串联质谱法同时检测孕产妇血清中18种抗生素
潘志峰 马文娟 颜崇淮 梁俊
(1.上海溯源生物技术有限公司,上海 201210;2.复旦大学生命科学学院,上海 200433;3.上海交通大学医学院附属新华医院,上海 200092)
抗生素的发现与应用在人和动物疾病的预防与治疗、畜禽养殖和水产养殖中作为添加剂加快动物生长和促进增产方面都起到了极其重要的作用[1],从而导致抗生素在全球范围内的大量使用,滥用的现象十分普遍[2-6]。环境污染物中抗生素的残留和动植物食品中食源性抗生素的存在导致人体可能通过食源性渠道持续性摄入抗生素,导致抗生素的低剂量持续性暴露。由于医用抗生素使用实质上是短期高剂量暴露,而来自食品或环境中的抗生素是低剂量持续暴露,近阶段研究结果提示抗生素的暴露模式可能是影响其促进脂肪生成的重要因素之一[7];Martin Blaser团队动物研究表明,食源性抗生素对生命早期可能会产生有害的长期影响,即使是在低浓度水平下也会影响婴幼儿肠道菌群平衡,并在婴幼儿后续的发育过程中影响其免疫系统的发育以及营养代谢(导致肥胖)[8,9],John Bieneistock团队研究揭示了诸如青霉素这样的窄谱抗菌素对于肠道微生物及其行为的影响,甚至会对行为和脑神经化学造成长期影响[10]。结合中国现状,来自畜牧养殖业、实验小鼠、儿童流行病学的证据一致表明:食源性污染物中抗生素的低剂量持续性暴露能改变生命体早肠道菌群分布,干预生命体早期发育。因此对于孕产妇和婴幼儿来说,监测孕产妇体内食源性抗生素暴露水平,预防和避免新生儿过早的接触抗生素显得尤为重要!
自1943年青霉素应用于临床,抗生素发展迅猛,比较常见的抗生素种类有β-内酰胺类、喹诺酮类、大环内酯类、酰胺醇类、氨基糖苷类、四环素类等,加上对革兰菌(G+/G-)有作用的其他抗生素,现有抗生素已达几千种。临床上血药浓度监测大多是针对单一化合物或某一族类(如青霉素类、磺胺类)的化合物进行研究[11,12],监测的药物浓度水平较高,而食源性抗生素暴露水平远低于血药浓度监测水平,并且种类繁杂,包含了几乎所有医用和兽用抗生素。目前还没有血清中多类别多种抗生素的同时检测的文献报道,为监测普通人群的抗生素暴露水平,需要建立一种更加灵敏稳定的检测方法。鉴于此,为了更有效地检测食源性抗生素在母婴体内的暴露水平,避免和干预抗生素暴露对于生命体早期生长发育的影响,本研究采用固相萃取-超高效液相色谱-串联质谱(SPE-LC-MS/MS)技术建立了血清中6类18种抗生素的同时定量分析方法,包括β-内酰胺类(β-lactams)、喹诺酮类(4-quinolones)、磺胺类(sulfonamides)、四环素类(Tetracyclines)、氯霉素类(chloramphenicol)和林可霉素(Lincomycin),可在8分钟内完成全部目标抗生素分析。
1 材料和方法
标准品:磺胺二甲嘧啶(Sulfadimidine)、磺胺吡啶(Sulfapyridine)、磺胺嘧啶(Sulfadiazine)、磺胺噻唑(Sulfathiazole)、青霉素(Penicillin)、阿莫西林(Amoxicilin)、氨 苄 西 林 (Ampicillin)、苯 唑 西 林(Oxacillin)、头孢噻吩(Cephalothin)、头孢噻肟(Cefotaxime)、左氧氟沙星(Levolfoxacin)、诺氟沙星(Norfloxacin)、环丙沙星(Ciprofloxacin)、四环素(Tetracycline)、土霉素(Oxytetracycline)、金霉素(Chlortetracycline)、氯霉素(Chloramphenicol)和林可霉素(Lincomicin)均购自中国药品生物制品检定所。
乙腈(质谱级)、甲醇(质谱级)、甲酸(色谱级)和磷酸(色谱级)均购自赛默飞世尔科技公司(Thermo Fisher Scientific)。
1.2 样本处理方法 取140μl血清样本,加入140μl的4%磷酸溶液,旋涡混匀1分钟,取混合液200μl加入到Oasis HLBμElution Plate小孔中进行固相萃取。上样前,SPE小孔依次用200μl甲醇和200μl水(水2次共400μl)活化平衡;上样后用抽滤装置抽干小孔并用100μl水冲洗2次后抽干。样本孔用50μl 60%乙腈洗脱并抽滤两次至抽干;用96孔收集板收集2次洗脱液上机待测。
1.3 液相色谱方法 色谱柱:ACQUITY UPLC HSS T3(1.8μm,2.1 mm×100 mm,美国 Waters公司);柱温40℃,进样量5μl,样品室温度10℃。流动相A为0.1%甲酸水溶液,流动相B为甲醇,流速0.4 ml/min,梯度洗脱程序见表1。
1.4 质谱方法 电喷雾离子源正负离子(ESI+/ESI-)切换模式,多反应监测(MRM)方式采集分析,毛细管电压分别为3.0k V+/2.5k V-,离子源温度为150℃,脱溶剂气温度为550℃,脱溶剂气流速为1000l/h,锥孔气流速为50ml/h。每种抗生素的详细质谱检测参数见表2。
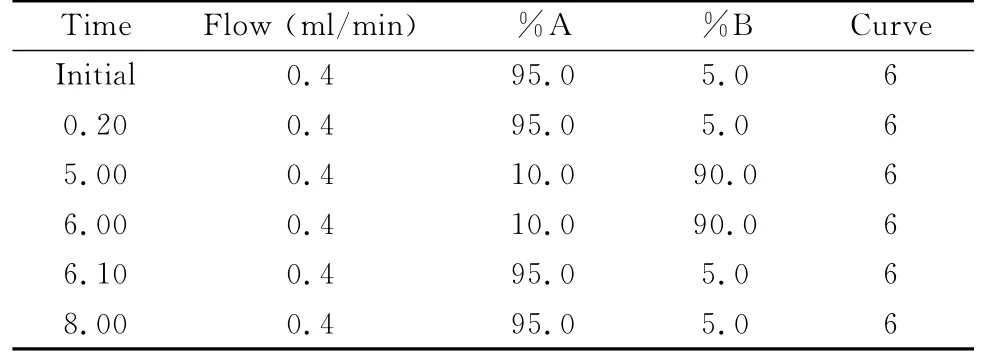
表1 18种抗生素梯度洗脱程序
2 结果
2.1 色谱条件的优化 分别考察了Waters ACQUITY UPLC系统的 BEH C18(1.7μm,2.1mm×50mm)和 HSS T3(1.8μm,2.1 mm×100 mm)色谱柱,结果显示T3色谱柱极性跨度大,对于阿莫西林等极性较大的化合物T3色谱柱的保留效果更佳。流动相的选择结果表明甲醇做溶剂时,抗生素能够完全分离且甲醇能够改善峰形,因此流动相选择甲醇。
2.2 质谱条件的优化 六大类抗生素的质谱行为不同,氯霉素在负离子模式(ESI-)下有较强信号,在正离子模式(ESI+)下信号非常弱,而其他种类抗生素正好相反。因此本方法中选择正、负离子模式同时监测,一次性对所有目标抗生素进行分析,减少了分析用时。2.3 样本前处理方法的优化 比较了传统的乙腈沉淀蛋白离心后氮吹复溶的方法与Oasis HLB固相萃取法,结果显示Qasis HLB SPE的净化效果与回收率都要好于蛋白沉淀氮吹法,且不易造成交叉污染。
洗脱液的考察,由于甲醇容易将磷脂等洗脱下来,因此选择以不同浓度梯度(100%、80%、60%)的乙腈水溶液进行洗脱,结果显示乙腈溶液的有机相比例过高会产生溶剂效应,60%乙腈的效果最佳,既保证了抗生素有较高的回收率,又能去除溶剂效应。
2.4 方法学验证 方法学验证参考《化学药物临床药代动力学研究技术指导原则》2014年第4号通告进行评估。
2.4.1 特异性 考察6个不同个体的空白生物样品色谱图(图1),以及空白生物样品外加对照物质色谱图(图2)。结果表明空白血液的基质构成不干扰目标抗生素的测定。
2.4.2 标准曲线和定量范围 标准曲线的配置,将抗生素标准品分别用水或甲醇溶解成1mg/ml的溶液,然后配置成相应质量浓度的混标,然后在空白血清中分别以不同质量浓度梯度做添加,配成含全部18种抗生素系列的血清样品。由于仪器对于每一种抗生素化合物的信号响应值不同,各种抗生素的检测灵敏度不同和参考相关化合物FDA限量标准为其他方法提供佐证等原因,各种抗生素的配置浓度有异同。表3为方法经最终优化后的标准曲线浓度和定量范围,标准曲线各浓度点的实测值与标示值之间的偏差在可接受的范围之内,最低浓度点的偏差在±20%以内,其余浓度点的偏差在±15%以内。
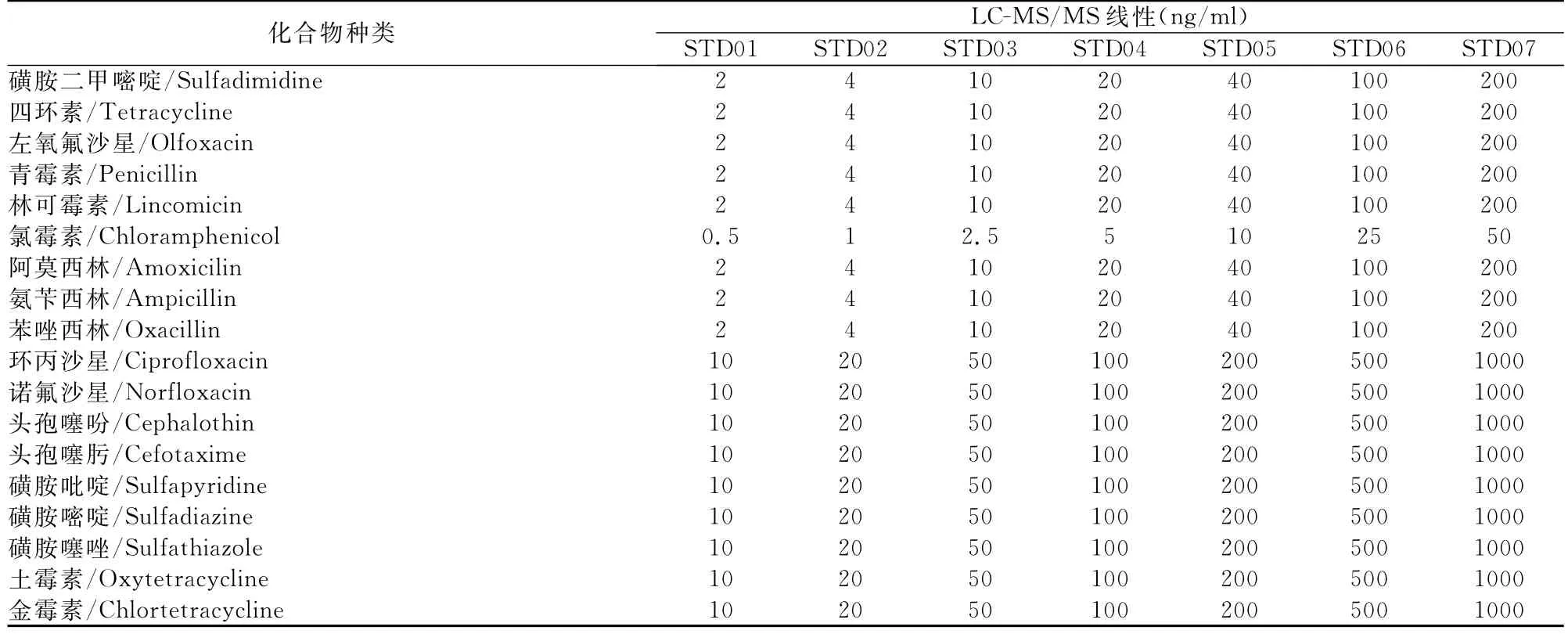
表3 18种抗生素的标准曲线浓度和定量范围
2.4.3 准确度与精密度 连续3天选取分析批次,选定标准曲线的STD2、STD4、和STD6添加到空白血清作为高、中、低3个浓度的质控样品,各做5次重复,统计回收率范围与偏差度见表4。
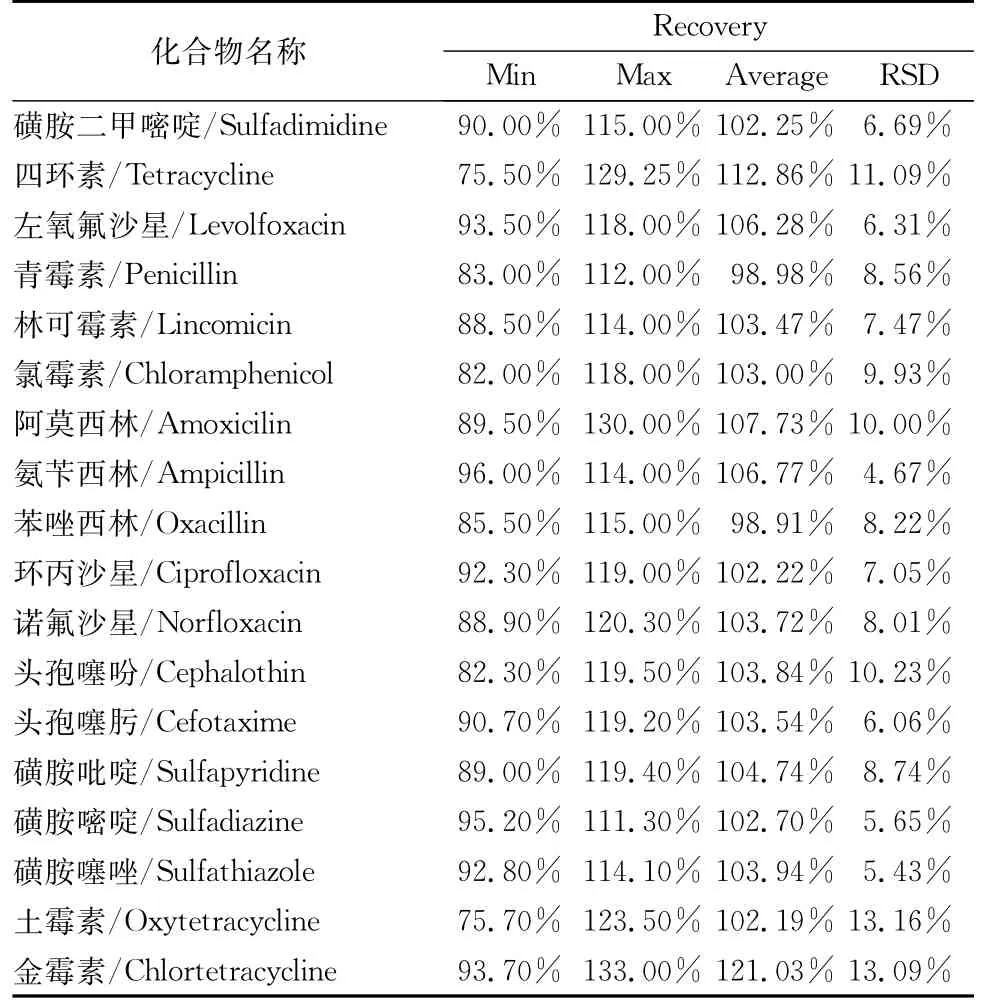
表4 18中目标抗生素的回收率范围统计
3 结论与探讨
本研究参考环境、食品安全、药代动力学研究等现有文献报道的液相色谱串联质谱分析法,并结合血液样本采样量少不利于不同种类抗生素多次检测的实际情况,对于血清样本的前处理和液相色谱、质谱条件等进行了优化,建立了血清中六大类共18种抗生素的UPLC-MS/MS分析方法,按照《化学药物临床药代动力学研究技术指导原则》进行方法学确证,结果表明该方法对于18种目标抗生素的检测具有良好的灵敏度和稳定性。与传统的药代动力学研究方法相比,本研究的创新性在于对人体内亚临床剂量或更低浓度多种抗生素的同时检测,绝大部分化合物灵敏度提高了一个数量级以上,目前临床上尚未有一次前处理同时检测多族类抗生素的应用。在当前我国环境污染尚未得到有效遏制,且人类持续暴露低剂量抗生素的危害不断得到证实的情况下,本研究的现实意义在于,避免重复采样,更符合人体内抗生素残留水平的监测,对于临床实施干预措施,减少抗生素暴露的不良影响提供数据支持。
结合中国现状,低剂量抗生素除了处方类药物之外,也存在于肉类和奶制品中。如果母亲在怀孕期间食用此类食物,就会长远影响孩子的行为,干预生命体早期发育。由于本研究监测的是食源性抗生素导致的孕产妇体内低剂量抗生素的持续性暴露水平,进而研究对于生命早期婴幼儿发育的影响,因此目标化合物取自文献或时事报道的环境检测、食品安全检测等使用和检出量较多的抗生素种类,而并非目前临床用药的常用抗生素。随着抗生素药物种类的不断研发与上市,本研究方法对于更多种类的抗生素检测、临床抗生素的联合用药监测等研究的适用性将进一步扩大;同时由于环境污染物不仅仅是只有抗生素污染,诸如真菌毒素、农药残留等都有可能通过人体的持续摄入而富集和暴露,因此本方法的建立对于其他族类、种类的多种化合物的检测也具有一定的参考价值。我们之后研究的方向也将会在现有研究的基础上,进一步建立参考方法,优化条件,增加更多种类的目标化合物的检测。
[1] Schlusener MP,Bester K.Persistence of antibiotics such as macrolides,tiamulin and salinomycin in soil[J].Environ Pollut,2006,143(3):565.
[2] 胡燕,白继庚,胡先明,等.我国抗生素滥用现状、原因及对策探讨[J].中国社会医学杂志,2013,30(2):128-130.
[3] Díaz-Cruz MS,López de Alda MJ,BarcelóD.Determination of antimicrobials in sludge from infiltration basins at two artificial recharge plants by pressurized liquid extraction-liquid chromatography tandem mass spectrometry[J].J Chromatogr A,2006,1130(1):72-82.
[4] Kim SC,Carlson K.Temporal and spatial trends in the occurrence of human and veterinary antibiotics in aqueous and river sediment matrices[J].Environ Sci Technol,2007,41(1):50-57.
[5] Peng X,Wang Z,Kuang W,et al.Apreliminary study on the occurrence and behavior of sulfonamides,ofloxacin and chloramphenicol antimicrobials in wastewaters of two sewage treatment plants in Guangzhou,China[J].Sci Total Environ,2006,371(1-3):314-322.
[6] Martínez-Carballo E,González-Barreiro C,Scharf S,et al.Environmental monitoring study of selected veterinary antibi-otics in animal manure and soils in Austria[J].Environ Pollut,2007,148(2):570-579.
[7] Wang H,Wang N,Wang B,et al.Antibiotics detected in urines and adipogenesis in school children[J].Environ Int,2016,89-90:204-211.
[8] Cho I1,Yamanishi S,Cox L,et al.Antibiotics in early life alter the murine colonic microbiome and diposity[J].Nature,2012,488(7413):621-626.
[9] Blustein J,Attina T,Liu M,et al.Association of caesarean delivery with child adiposity from age 6 weeks to 15 year[J].Int J Obes(Lond),2013,37(7):900-906.
[10] Leclercq S,Mian FM,Stanisz AM,et al.Low-dose penicillin in early life induces long-term changes in murine gut microbiota,brain cytokines and behavior[J].Nat Commun,2017,8:10562.
[11] 陈聪,严慧,沈保华,等.超高效液相色谱-串联质谱法同时测定全血中青霉素 G及其主要代谢产物[J].色谱,2012,30(5):445-451.
[12] 丁春雷,刘丽宏,童卫杭,等.LC-MS/MS法同时测定人血浆中氨苄西林氯唑西林浓度[J].药物分析杂志,2009,29(4):613-616.

