异养硝化菌的分离及在养殖废水处理中的应用
钱春园,郭晓泽,高 锋,陶 琼,郑 舟,薛 彬,郭远明
(1.浙江海洋大学海洋科学与技术学院,浙江舟山 316022;2.浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江舟山 316021)
近年来随着人们消费水平的提高,对于水产品的需求日益增加,国内水产养殖业快速发展。水产养殖行业日益向集约化、高密度养殖模式发展[1-4]。在养殖过程中,为了满足养殖生物的生长需求,需要大量投放饵料,由于饵料的吸收和利用率较低,大部分都以残饵粪便的形式存在于养殖水体中[4],造成养殖水体中氨氮、亚硝酸盐以及有机物等污染物的含量严重超标,水质逐步恶化,养殖水体的环境遭到严重破坏,养殖生物受到毒害,引起病害的频繁发生[5-11]。为了满足养殖生物的生长需求,养殖场通过频繁更换水的办法来改善水质。未经处理的养殖废水排放到环境中,增加了水体的化学耗氧量,并造成水体富营养化,有害藻类大量繁殖,导致赤潮和水华现象发生,破坏了生物的栖息地,使生物多样性和生态平衡遭到破坏[12-15]。
目前对养殖废水的净化处理大多都是利用传统的污水处理方法如活性污泥法和生物膜法等,专门针对养殖废水的净化处理技术较少。人们一直以为在污水处理系统中执行硝化功能的是自养型的微生物,硝化过程一般定义为微生物在有氧的条件下将氨氮氧化为亚硝酸盐氮,再进一步氧化为硝酸盐氮,因此脱氮工艺是按照自养硝化菌的特性来设计的[16-18]。在实践应用中,人们发现自养硝化菌增长速度比较缓慢,对环境条件要求严格,其最佳温度为35~42℃,在低温时(尤其是冬季)硝化速率低,硝化过程需要较高的溶解氧浓度(>3 mg/L),中性偏碱(7.0~8.0)的pH条件以及非常低的C/N值[19],为了提高硝化速率,往往需要更长的水力停留时间,这些条件增加了生物脱氮的难度与成本,限制了自养硝化菌的应用。
与自养硝化菌相比,异养硝化菌具有生长速度快,环境适应能力强等特点,近年来受到了国内外研究人员的广泛关注。KILLHAM[20]总结了以前关于异养硝化的研究进展,指出在某些环境中,异养菌可以将有机氮氧化为硝酸盐氮,而这个硝化过程是由异养硝化控制的。CASTIGNETTI,et al[21]初次报道了土壤中常见的反硝化菌能够产生异养硝化的现象。经过实验证明,与自养硝化菌相比,异养硝化菌的数量和生长速率高,环境适应性强,能耐受酸性环境,需要的溶解氧浓度低,活性高,而且许多异养硝化菌如假单胞菌Pseudomonas spp与粪产碱菌Alcaligenes faecalis[22],具有硝化-反硝化能力[19,23-24],大大的降低了工程应用的成本。将其投加在常规的废水中或者应用于生物修复某些特定污染水域,具有重要的价值和意义。
对于异养硝化菌的研究起步较晚,将其应用于高浓度氨氮废水处理的研究比较少,能够将其应用于实际废水处理的研究更少。因此,筛选出一株具有较高脱氮能力的异养硝化菌,并将其应用到氨氮浓度较高的养殖废水中,对水产养殖行业的废水处理具有重要的意义。针对以上问题,本文从土壤中筛选出一株高效异养硝化菌,并将该菌株应用于高氨氮浓度的甲鱼养殖废水净化中,旨在为高氨氮养殖废水的生物脱氮处理提供一种有效的方法。
1 材料与方法
1.1 材料
1.1.1 菌株来源
农田土壤中有机质和氮元素的含量较为丰富,符合异养硝化菌对于环境的要求,在本实验中菌株分离自农田土壤,土壤样品取自浙江省舟山市长峙岛马鞍村。
1.1.2 培养基
富集驯化培养基:(NH4)2SO42.0 g,丁二酸钠23.85 g,维氏盐溶液50 mL(维氏盐溶液组成:K2HPO45.0 g/L;MgSO4·7H2O 2.5 g/L;NaCl 2.5 g/L;FeSO4·7H2O 0.05 g/L;MnSO4·4H2O 0.05 g/L),加水进行溶解,补充蒸馏水至1 L;固体培养基:琼脂粉20 g,其他成分同驯化培养基。异养硝化培养基:同驯化培养基。各培养基在高压灭菌锅中灭菌后使用。
1.2 高效异养硝化菌株的分离纯化
1.2.1 异养硝化菌的驯化、富集
取1 g的土样放入盛有200 mL驯化培养基的500 mL锥形瓶中,30°C,180 r/min条件下进行摇床培养,驯化以3 d为一个周期。每一周期结束后将培养液静置片刻,取部分菌液至另外一个锥形瓶中,将新鲜的驯化培养基加入原来的培养液中,补足至200 mL。取出的菌液按驯化的周期依次从50 mL降至10 mL,补充的培养基也从开始150 mL升至190 mL,定期检测氨氮去除情况。当将氨试剂滴加在驯化的菌液后,呈现无色时,表示驯化完成。
1.2.2 菌株的分离纯化
将驯化好的溶液进行10倍浓度梯度稀释至10-5。在制备好的固体培养基上,从各个稀释梯度溶液中取0.1 mL进行稀释涂布(每个稀释度做3个平行),在生化培养箱中30°C恒温培养3 d。在形成菌落的平板上挑取圆形规则的单个菌落,划线分离,等到形成菌落后再用接种环将其接种到固体培养基上,放在30°C生化培养箱中进行恒温培养3 d。然后挑取一接种环的细菌与无菌水中,充分震荡,以此为细菌悬液。将细菌悬液按照活菌数测定的办法在平板上涂布,使其在培养皿上形成20~30个单菌落,然后将单菌落按以上的方法再挑菌一次[25]。经分离纯化得到15株菌。
1.2.3 高效异养硝化菌筛选
将筛选得到的15株菌分别接入已灭菌的装有100 mL异养硝化培养基的锥形瓶中,30°C,180 r/min条件下进行恒温摇床培养。3 d后检测OD600、pH、氨氮、亚硝酸盐氮、硝酸盐氮。选出一株脱氮效率高且培养过程中亚硝酸盐氮和硝酸盐氮生成较少的菌株。
1.3 菌株的硝化特性研究
在装有200 mL培养基的500 mL锥形瓶(已灭菌)中接入菌株,30°C,180 r/min条件下进行恒温摇床培养。每隔12 h检测异养硝化培养基中的OD600、pH、氨氮、亚硝酸盐氮、硝酸盐氮,制作菌株生长曲线和脱氮速率曲线。
1.4 异养硝化菌株对养殖废水的脱氮效果
1.4.1 养殖废水
养殖废水取自浙江省桐庐温室大棚甲鱼养殖基地,水体有恶臭味,呈暗黄色,有黑色沉淀物。养殖废水水质指标见表1。

表1 养殖废水水质指标Tab.1 Characteristics of aquaculture wastewater
1.4.2 菌株在养殖废水中的异养硝化作用研究
将在250 mL锥形瓶中装有200 mL的养殖废水灭菌后接入菌株,30℃,180 r/min条件下进行恒温摇床培养,每隔24 h检测氨氮、亚硝酸盐氮、硝酸盐氮的浓度。在250 mL的锥形瓶中加入200 mL养殖废水,灭菌,不接种菌株,以此为对照试验。
1.4.3 接种量对养殖废水氨氮去除效果的影响
将菌株的细菌悬液OD600调至1.0,接种至6个装有200 mL养殖废水的250 mL锥形瓶中,接种的体积分别占废水体积的1%、3%、5%、7%、9%和11%。在30℃,180 r/min条件下进行恒温摇床培养,每隔24 h检测氨氮浓度。
1.4.4 温度对养殖废水氨氮去除效果的影响
将菌株接种于已灭菌过的装有200 mL养殖废水的250 mL的锥形瓶中,分别在不同温度(10、20、30、35、40℃)下以180 r/min进行恒温摇床培养。每隔24 h检测检测氨氮浓度。
1.5 分析方法
NH4+-N:纳氏试剂光度法;NO3--N:酚二磺酸光度法;NO2--N:(1-萘基)-乙二胺光度法;NO3--N:紫外分光光度法;菌体生长密度的测定采用浊度法(OD600);TN:碱性过硫酸钾消解紫外分光光度法;COD:重铬酸钾法。异养硝化菌胞内氮:凯氏定氮法,pH值直接采用pH计测定。
2 结果与分析
2.1 菌株的分离纯化和筛选
经过约4个月的驯化、富集和3轮划线分离,得到能够在异养硝化固体培养基上生长的15株菌株。将15株菌株依次接入异养硝化液体培养基中,以未接种菌株的异养硝化液体培养基(原水)为空白对照,检测其浊度(OD600)以及NH4+-N、NO2--N和NO3--N的浓度。从图1中可以看出,15株菌株对于异养硝化培养基中的氨氮都有一定的降解能力,1号菌株和13号菌株生长较为旺盛,13号菌株的氨氮去除能力最强。并且这15株菌株在培养结束后,培养液中NO2--N和NO3--N的浓度均较低,因此,经过对比分析,将13号菌株作为本研究的对象,将其命名为HY13。
2.2 菌株HY13在异养硝化培养基中的生长
菌株在培养基中的生长曲线及pH的变化如图2所示。菌株生长呈现4个时期:适应期、对数增长期、稳定期、衰亡期。菌株在12 h之前生长缓慢,可以看作适应期。12 h之后进入对数增长期,在对数增长期,菌株HY13生长迅速,之后菌株的生长进入稳定期和衰亡期。另外,从图2中可以观察到,随着菌株的生长,液体培养基的pH值呈上升的趋势,pH值从培养开始时的6.95上升至培养结束时的9.15。传统的自养硝化反应是将碱性物质氨转化为酸性物质亚硝酸和硝酸的过程,通常会导致培养过程pH值的下降。本实验过程观察到的pH变化明显不同于自养硝化过程,间接说明了菌株HY13的异养硝化能力。实验中pH值升高的原因可能是由于培养基内丁二酸钠被大量利用后Na+浓度升高所致。
2.3 菌株HY13的脱氮特性
菌株在培养基中的氨氮降解速率特征如图所示。从图3可以看出,氨氮浓度在12 h之前降解缓慢,12 h之后下降迅速,96 h氨氮浓度降到最低,氨氮降解速率为61.8%,氨氮浓度降低迅速发生在菌株的对数增长期和稳定期。另外从图中可以看出,菌株HY13培养过程中在氨氮浓度不断降低的同时,硝酸盐氮和亚硝酸盐氮浓度没有明显的上升,而是维持在较低的浓度水平,表明菌株HY13去除水中氨氮的过程与传统自养硝化过程不同,本实验筛选的菌株HY13具有异养硝化能力。
2.4 菌株HY13在养殖废水中的硝化特性
将异养硝化菌株HY13接种至高氨氮含量的养殖废水中进行震荡培养,培养过程中养殖废水中NH4+-N、NO2--N、NO3--N浓度随培养时间的变化如图4所示。从图4可以看出,随着培养的进行,养殖废水中的NH4+-N浓度出现了明显的降低,从培养开始时的634.28 mg/L降低至培养结束时的226.13 mg/L,去除率达到64.3%,说明菌株HY13对于高浓度的养殖废水,具有较好的脱氮效果。对于养殖场废水处理的实际应用,具有很大的潜能。并且由图4可见,在整个培养过程中废水中NO2--N和NO3--N的浓度稳定维持在较低的水平,没有出现明显的上升。培养结束和培养开始时NO2--N的浓度分别为0.051 mg/L和0.057 mg/L,NO3--N的浓度分别为0.377 mg/L和0.378 mg/L,培养结束后测定得到培养液中胞内氮的浓度为236.73 mg/L(表2)。这表明在培养过程中废水中的铵盐没有被氧化成亚硝酸盐和硝酸盐,而是大部分被转化成了菌体内的胞内氮。这明显不同于传统硝化细菌的硝化反应,培养结束后废水中的NO2--N和NO3--N浓度均很低,无需在通过反硝化反应进行脱除。可见采用异养硝化方法进行高氨氮含量养殖废水的脱氮处理,可以使处理工艺变得更为简单,具有明显的优势。
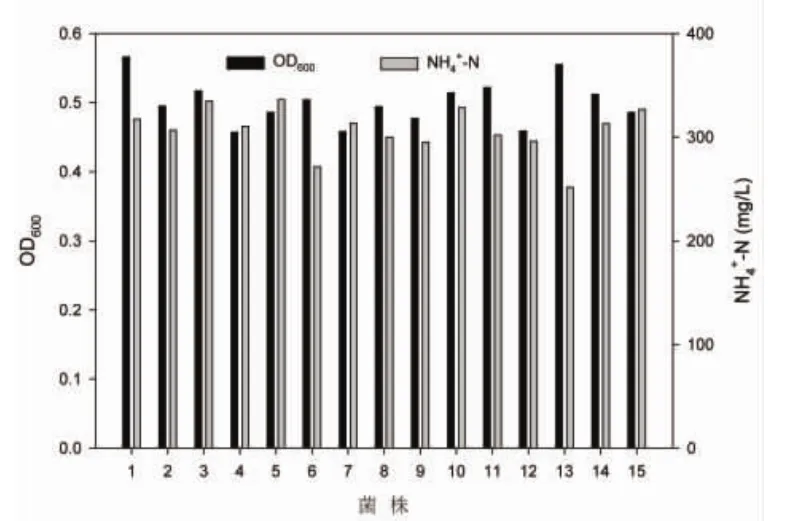
图1 异养硝化菌菌株的筛选Fig.1 Screening of heterotrophic nitrifying bacteria

图2 菌株HY13的生长曲线以及pH变化Fig.2 Growth curve of strain HY13 and the changes of pH during cultivation

图3 菌株HY13氨氮降解速率特征曲线Fig.3 Denitrification rate characteristiccurve of the strain HY13
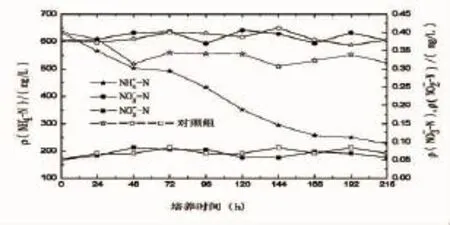
图4 菌株HY13在养殖废水中的脱氮速率特征曲线Fig.4 Curves of nitrogen removal of strain HY13 in aquaculture wastewater
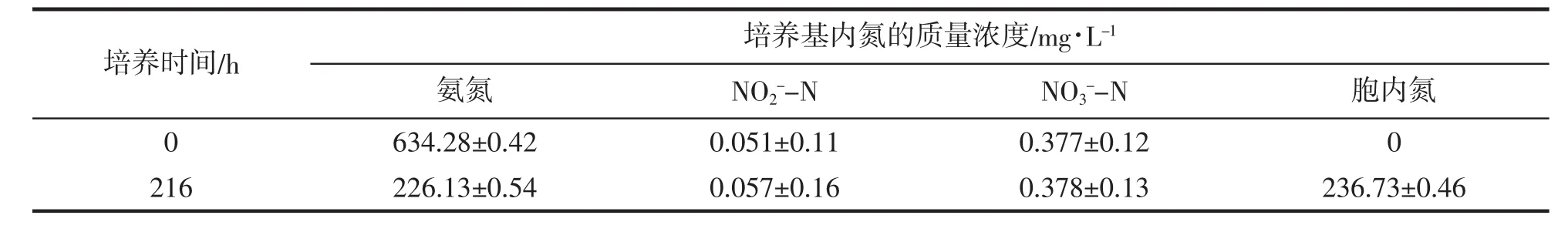
表2 菌株HY13的硝化功能Tab.2 Nitrification of strain HY13
2.5 接种量对养殖废水氨氮去除效果的影响
接种量的大小会影响到菌株的繁殖速度。高浓度的接种量可以提高脱氮的效率[28],在较短时间内达到比较好的效果。接种量过低,菌株的适应期会延长,培养时间则会增加,影响实验的进行。从图6可以看出,当在养殖废水中接入不同浓度的菌株时,经过24 h的培养,氨氮浓度都有不同程度的降解,接种量为5%的降解量最多。经过一段时间培养后,发现在相同的培养时间内,适当的增加接种量,会提高氨氮的转化率。当接种量为5%时,菌株对养殖废水的氨氮去除效果最好。当接种量大于5%时,菌株对营养物质的需求增加,但是养殖废水的底物和营养物质有限,随着培养时间的增加,营养物质逐渐被消耗,底物与供氧不足,使菌株HY13大量死亡,氨氮降解率降低。
2.6 温度对养殖废水氨氮去除效果的影响
对于微生物的生长来说,温度是一个重要的因素,每个微生物的最适温度不同。过高或者过低的温度都会影响菌株的酶活性,导致微生物的生长代谢缓慢或者停滞,从而影响对氨氮的去除能力[29-31]。养殖水体温度季节变化幅度较大,要找到菌株HY13在养殖废水中适应生长的温度,一般通过设置温度梯度来判断。从图7可以看出,菌株HY13在不同的温度条件下对养殖废水的氨氮都有一定的去除能力,进一步说明异养硝化菌对环境的要求不高,能够应用于各种环境。当温度为10℃时,菌株HY13对养殖废水的氨氮去除能力最弱,温度逐渐升高,氨氮去除能力逐渐提高。当温度为35℃时,菌株对养殖废水氨氮去除效果最好。当温度高于35℃时,菌株的氨氮降解能力又变弱。实验证明,过高或过低的温度都不适宜菌株HY13的生长。
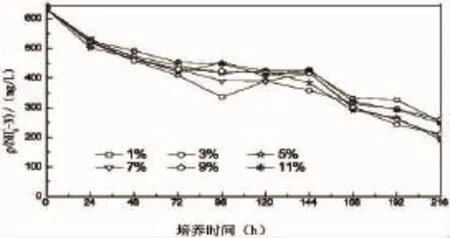
图6 接种量对菌株去除养殖废水中氨氮的影响Fig.6 Influence of inoculation amount of HY13 on ammonia nitrogen removal from aquaculture wastewater
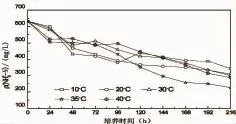
图7 温度对菌株氨氮去除特性的影响Fig.7 Influence of temperature on ammonia nitrogen removal from aquaculture wastewater by HY13
3 讨论
本实验筛选的菌株HY13接种于高氨氮浓度的水产养殖废水,实现了对废水中氨氮的异养硝化脱除,经216 h培养,去除率达到64.3%。并且出水中NO2--N和NO3--N的浓度均很低。氨、亚硝酸盐和硝酸盐均为废水中的氮素污染物,在水体中三者还能互相转化。传统的生物硝化反应仅将氨氧化为硝酸盐或亚硝酸盐,往往还需要后续在厌氧环境及有机物存在的情况下进行反硝化反应才能彻底去除废水中的氮素污染物,达到真正脱氮的目的。本实验中HY13未将氨氧化为亚硝酸盐或硝酸盐,根据实验中菌株胞内氮含量的测定,大部分被去除的氨转化为了菌株细胞体内的氮。在实际的污水处理过程中,这部分的氮将转移至剩余污泥中,从而提高了剩余污泥中氮的含量及肥效,有利于通过堆肥等过程将养殖场废水处理产生的污泥开发成作物肥料。
另外,值得注意的是本实验经菌株HY13处理后,养殖废水中NH4+-N的含量仍然达到200 mg/L以上,这主要与原水中NH4+-N浓度较高有关。在之前文献中的一些关于异养硝化菌的研究中,培养液中NH4+-N浓度约在90~180 mg/L[23,32],均低于本实验所用废水中的NH4+-N浓度。废水中较高的NH4+-N浓度或许对异养硝化菌的生长起到了一定的抑制作用,这方面有待于后续的进一步研究。
本研究通过异养硝化菌筛选及废水处理实验,初步证明了异养硝化菌能有效应用于高氨氮浓度的水产养殖废水的脱氮处理,但由于实验中采用的甲鱼养殖场废水中氨氮浓度较高,实验中未能将废水中的氨氮降低至排放标准以下,这有待于后续通过进一步改进培养及研究方案,从而实现废水中氨氮较彻底的去除。
4 结论
(1)本文以丁二酸钠为唯一碳源,从土壤中筛选出一株能够高效去除氨氮的菌株,并且在培养过程中只有少量的硝酸盐氮和亚硝酸盐氮产生,命名为HY13。
(2)将菌株接种与初始氨氮浓度为634.28 mg/L的甲鱼养殖废水中,经过216 h培养,氨氮浓度降为226.13 mg/L,氨氮降解率达到64.3%。
(3)养殖水体中,生态因子如温度、接种量等都会对水体氨氮的降解产生一定的影响。实验证明,当菌株HY13接种于养殖废水中,接种量为5%,温度为35℃时,氨氮降解率较高。
[1]张小玲,梁运祥.一株反硝化细菌的筛选及其反硝化特性的研究[J].淡水渔业,2006,36(5):28-32.
[2]胡家文,姚维志.养殖水体富营养化及其防治[J].水利渔业,2005,25(6):74-76.
[3]魏泰丽,余瑞兰,聂向平,等.水中亚硝酸盐对彭泽鲫血红蛋白及高铁血红蛋白的影响[J].大连水产学院学报,2001,16(1):67-71.
[4]蒋路平,朱建龙,罗金飞,等.水产养殖废水污染危害及其处理技术研究[J].现代农业技,2017(3):171-172.
[5]张晓栓,李 楠,蔡文贵,等.我国水产养殖水污染成因及其对策研究[J].中国渔业经济,2007(5):30-33.
[6]王建平,陈吉刚,斯烈钢,等.水产养殖自身污染及其防治的探讨[J].浙江海洋学院学报:自然科学版,2008,27(2):192-196.
[7]郑佳佳,沈 涛,傅罗琴,等.一株硝化反硝化菌的筛选鉴定及反硝化特性研究[J].水生生物学报,2012,36(1):161-167.
[8]张庆华,封永辉,王 娟,等.地衣芽孢杆菌对养殖水体氨氮、残饵降解特性研究[J].水生生物学报,2011,35(3):498-503.
[9]李 帆,荚 荣,查 诚.脱氮菌株P6的分离鉴定及其处理氨氮废水的试验研究[J].生物技术,2007,17(5):64-68.
[10]江 云.水产养殖废水生物净化技术研究[D].扬州:扬州大学,2013.
[11]黄 欢,汪小泉,韦 肖,等.杭嘉湖地区淡水水产养殖污染物排放总量的研究[J].中国环境监测,2007,23(2):94-97.
[12]刘静宇,夏宏彩.水体富营养化及污水脱氮除磷技术分析[J].技术开发,2015,22(8):216.
[13]胡海燕.水产养殖废水氨氮处理研究[D].青岛:中国海洋大学,2007.
[14]杨小琴,郭正富,胡玉国.水产养殖与农业面源污染研究[J].北京农业,2008(27):41-43.
[15]陈冬林,周慧芳.水产养殖废水净化与循环应用技术研究[J].中国水产,2016(5):91-93.
[16]秦源麟.废水生物处理[M].上海:同济大学出版社,1989.
[17]温东辉,唐孝炎.异养硝化及其在污水脱氮中的作用[J].环境污染与防治,2003,25(5):283-285.
[18]郑兴灿,李亚新.污水除磷脱氮技术[M].北京:中国建筑工业出版社,1998.
[19]赵 诣.三株异养硝化细菌的分离、特征及其对水产养殖废水脱氮作用研究[D].杭州:浙江大学,2010.
[20]KILLHAM K.Nitrification in coniferous forest soils[J].Plant and soil,1990,128:31-44.
[21]CASTIGNETII D,HOLLOCHCE T C.Hctcrtrophic nitrification among denitrifiers[J].Applied and Environmental Microbiology,1984,47(4):620-623.
[22]ZHAO Bin,AN Qiang,HE Yiliang,et al.N2O and N2production during heterophic nitrification by Alcaligenes faecalis strain NR[J].Bioresource Technology,2012,116:379-385.
[23]郝明辉,于鲁冀,李廷梅,等.一株异养硝化菌的筛选及生长特性研究[J].生物技术通报,2016,32(4):168-174.
[24]ISIAM A,CHEN D,WHITE R E.Heterotrophic and autotrophic nitrification in two acid pasturesoils[J].Soil Biology and Biochenmistry,2007,39(4):972-975.
[25]LIN Yan,KONG Hainan,HE Yiling,et al.Isolation and characterization of heterotrophic nitrifying bacteria[J].Environmental Science,2006,27(2):324-328.
[26]GAO Feng,YANG Zhaohui,LI Chen,et al.Concentrated microalgae cultivation in treated sewage by membrane photobioreactor operated in batch flow mode[J].Bioresource Technology,2014,167:441-446.
[27]李雨阳,文湘华.污水处理系统中氨氧化古菌的富集培养以及性质[J].微生物学报,2015,55(7):882-891.
[28]芮传芳,吴 涓,李玉成.异养硝化细菌的筛选、鉴定及其氨氮转化特性的研究[J].生物学杂志,2012,29(1):37-41.
[29]GONG Wenxin,WANG Shuguang,SUN Xuefei,et al.Biofiocculant production by culture of Serratia ficaria and its application in wastewater treatment[J].Bioresource Technology,2008,99(11):4 668-4 674.
[30]杨代金,张 穗,王玉军,等.一株氨氮降解菌的筛选及其降解特性的初步研究[J].山东农业科学,2009(3):87-90.
[31]闫志英,廖银章,李旭东.新型废水生物脱氮的微生物学研究进展[J].应用与环境生物学报,2006,12(2):292-296.
[32]曾庆梅,司文攻,李志强,等.一株高效异养硝化菌的选育、鉴定及其硝化条件[J].微生物学报,2010,50(6):803-810.

