钨酸盐体系中锑的硫化行为与分离
李永立,赵中伟
钨酸盐体系中锑的硫化行为与分离
李永立,赵中伟
(中南大学 冶金与环境学院,长沙 410083)
针对选择性沉淀法从钨酸盐溶液中除钼过程,根据已有的热力学数据,计算了伴生杂质锑的硫化平衡行为,并探讨和验证了深度除锑的可行性和途径。绘制溶液中各含锑离子随pH、溶液电势以及硫与锑的浓度比[S]/[Sb]变化的分布曲线,分析了溶液中pH、硫化剂用量以及溶液电势对锑硫化行为的影响规律,分析了选择性沉淀法的除锑能力及其影响因素,提出了深度分离锑杂质的方法,并通过实验对上述思路进行了验证。结果表明:当pH为7~10、[S]/[Sb]≥2时,溶液中99%以上含锑离子以SbS2−的形式存在;实验结果与理论预测一致,并取得了较好的效果,当硫用量和铜加入量为锑摩尔量的3倍时,除锑率达到了97%。
硫代锑酸盐;除锑;硫化反应;热力学;选择性沉淀法;钨酸盐溶液
“选择性沉淀法”是一种从钨酸盐溶液当中除去杂质钼的深度净化方法,在国内钨冶炼企业获得了广泛应用[1−5]。这一方法利用钨亲氧、钼亲硫的特性,向溶液当中加入S2−使钼转变成相应的硫代钼酸根阴离子。进而加入含铜化合物与硫代钼酸根结合而将钼除去。一般钨矿浸出所得的钨酸盐溶液当中,还含有砷锡锑等杂质,这些阴离子也可能与S2−反应转变成相应的硫代酸根阴离子,则也可能被同时除去,但锑的去除率往往仅有80%左右。
关于钼和砷的硫化热力学已有文献做了深入的研究[6−9],但有关锑的硫化热力学仅绘出了简单的电 位−pH图[10],其各离子分布图并未见报道。进行杂质锑的硫化行为的研究对于进一步认清含锑离子的形态分布以及优化反应条件,提高锑的硫化转化率和去除率具有重要意义。
1 热力学计算及计算方法
在Sb-S-H2O体系中,存在表1所示的平衡关系式。所有数据均引自文献[11],其中[Sb(OH)3o]表示溶液中Sb(OH)3o的浓度(mol/L),其余含义依此类推。由于缺乏相关物种的活度因子,所以在计算过程当中以浓度代替活度。
h表示溶液电势,与电子浓度的换算关系为h=−0.05916lg[e]
由(1)~(33)化学平衡关系式可以看出:溶液中游离锑和硫的离子形态有Sb(OH)3o、Sb3+、Sb(OH)2+、Sb(OH)2+、Sb2(OH)24+、Sb(OH)5o、Sb(OH)6−、Sb2HS4−、Sb2S42−、Sb2H2S4o、Sb2(OH)2S2o、SbS33−、SbS2−、Sb4S72−、SbS43−、Sb(OH)2S−、S2−、HS−和H2S。各含硫溶解组分浓度总和等于总硫浓度:[S]=4[Sb2HS4−]+ 4[Sb2S42−]+ 4[Sb2H2S4o]+2[Sb2(OH)2S2o]+3[SbS33−]+2[SbS2−]+ 7[Sb4S72−]+4[SbS43−]+[Sb(OH)2S−]+[S2−]+[HS−]+[H2S]。
各含锑溶解组分浓度总和等于总锑浓度:
[Sb]=[Sb(OH)3o]+[Sb3+]+[Sb(OH)2+]+[Sb(OH)2+]+ 2[Sb2(OH)24+]+[Sb(OH)5o]+[Sb(OH)6−]+2[Sb2HS4−]+ 2[Sb2S42−]+2[Sb2H2S4o]+2[Sb2(OH)2S2o]+[SbS33−]+[SbS2−]+4[Sb4S72−]+[SbS43−]+[Sb(OH)2S−]
本文作者在计算过程中依照文献[6]提供的方法,在计算过程中利用电势(h)与电子摩尔浓度([e])的关系(h=−0.05916lg[e]),将电子浓度作为变量进行计算。在给定总锑浓度、总硫浓度以及溶液的电势(h)的条件下,联立方程(14)~(33),得到19个含有19个未知数的方程组,解这个方程组可得各含锑离子的浓度。计算过程中方程(1)~(13)作为限制条件。

表1 25℃时Sb-S-H2O体系的平衡反应及其平衡常数[11]
2 结果与讨论
钨酸盐溶液中硫化除钼工艺是在碱性条件下进行的,因此本实验中选择pH>7作为研究范围。在计算过程中,为了寻求适当的溶液电势(h)的取值范围,需要首先对Sb-S-H2O系电位−pH图硫氧化线以下部分进行了绘制[12−13]。绘制过程中假定各离子浓度均为0.01 mol/L,并以浓度代替活度,气体均为标准大气压,图1为硫氧化线以下部分的Sb-S-H2O系电位−pH图,图中标出的平衡反应方程式以及计算式如表2所列。
从图1可以看出,当pH<14.6时,析氢线以上,S2−被氧化线以内,电势为−0.213~−0.855 V时,均存在以SbS2−为主的优势区域,这与传统上认为的锑主要以SbS43−的离子形态存在有所不同[14−15],因此有必要进一步弄清碱性条件下锑在硫化过程中的离子形态。

表2 S-Sb-H2O系中25℃下各平衡反应式与计算式[10−12]

图1 硫氧化线以下部分的Sb-S-H2O系电位−pH图
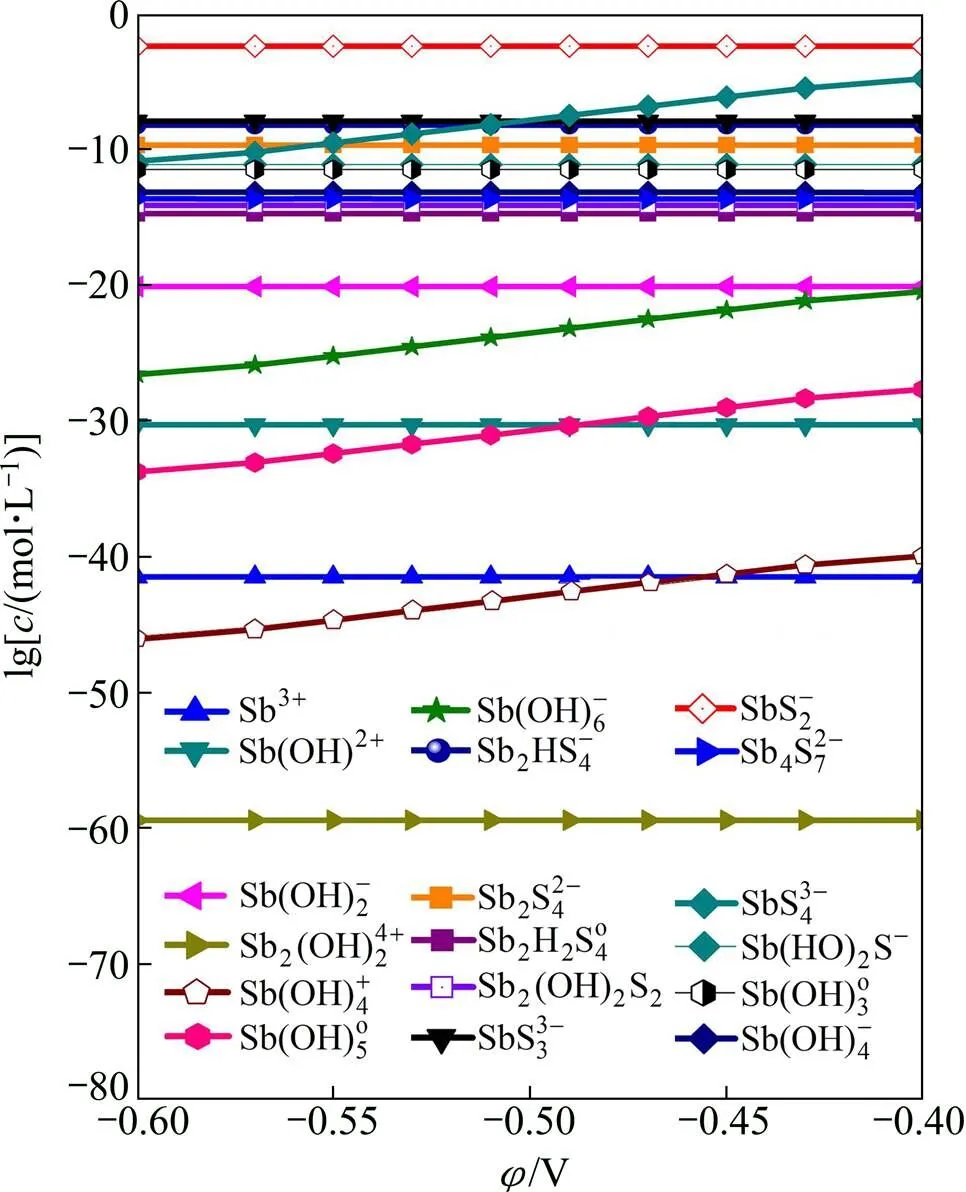
图2 各含锑离子分布随φh变化的分布曲线
从表1中可以看出,方程(1)、(7)、(9)、(12)、(19)、(20)、(21)、(29)均为氧化还原反应,考虑到溶液的电势会对含锑离子分布造成一定影响,因此,有必要考察溶液电势对锑离子分布的影响。首先假定溶液pH为10,锑4 mmol/L,硫化剂用量为总锑的10倍,同时溶液电势(h)必须满足水溶液中氢不被还原以及S2−不被氧化的条件,由图1可确定可允许的溶液电势为−0.6 V<h<−0.4 V。
通过计算,可得主要离子占总锑的含量随溶液电势h的变化规律,见如图4所示。从图4可以看出,在整个考察电势范围内,锑主要是以SbS2−离子的形式存在,但同时也可以看出SbS43−的浓度随着电势的增加虽然有小幅度的增加,但依然不占优势。
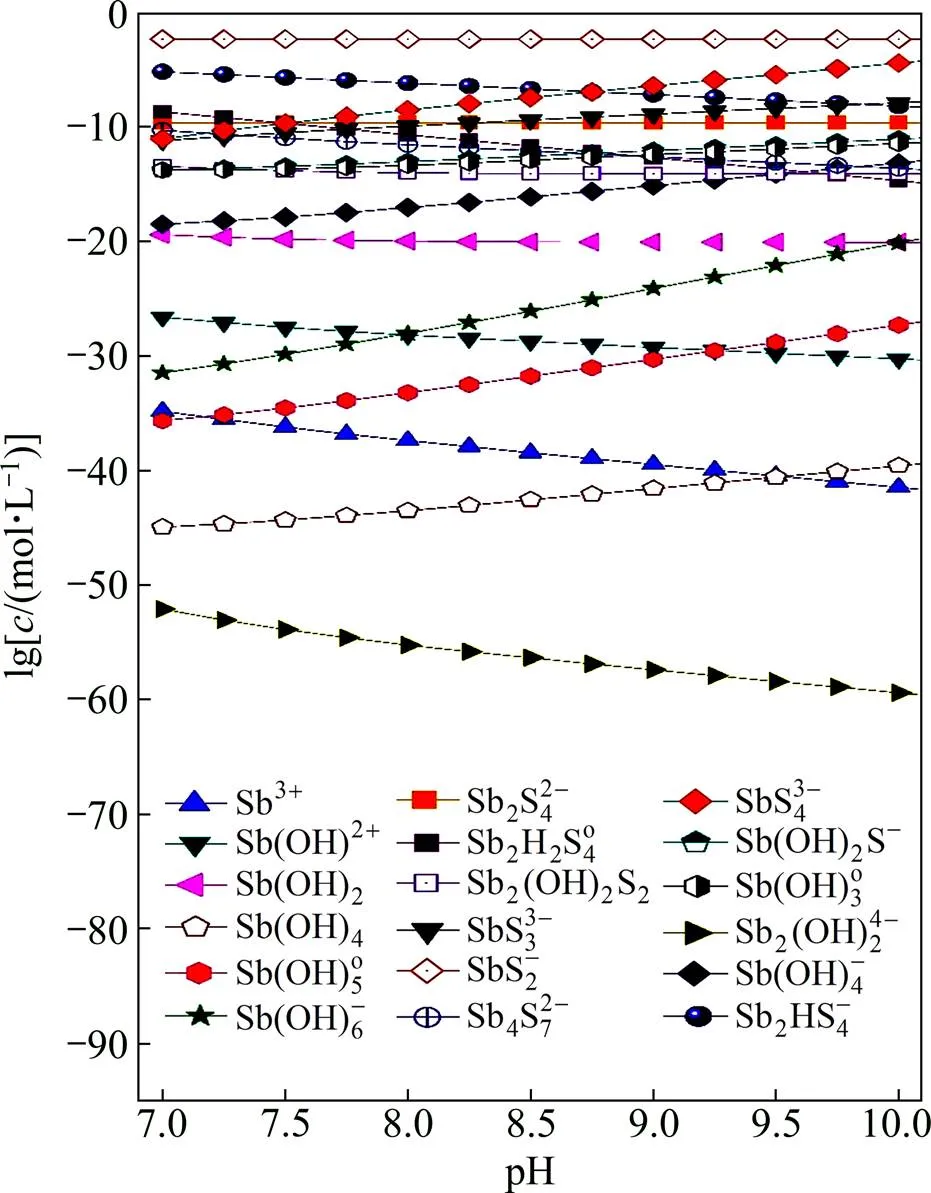
图3 25℃时各含锑离子lgc−pH曲线
此外,一般认为溶液pH会对溶液中各离子形态产很很大的会影响。为了研究溶液pH的影响,首先假定溶液电势(h)为−0.4 V,锑总浓度为4 mmol/L,硫化剂用量为总锑的10倍的基础上进行计算,得到了各含锑离子分布随pH变化的分布曲线,如图1所示。从图1可以看出,硫稳定存在的pH值范围为7~10。在这些条件下考察锑的离子分布随pH变化的情况,其结果见图3。由图3可以看出,锑依旧主要以低价的SbS2−离子形态存在,随着pH值的增大,SbS43−的离子浓度略有增大,但依旧以SbS2−为主。
与以前普遍认为的不同,锑主要并不以SbS43−的离子形态存在,而是被还原后呈低价的SbS2−离子,这是在除杂过程中需要考虑的。
而选择性沉淀法除钼是在钼完全硫化的条件下加入硫化铜(或加入铜化合物与溶液当中的游离硫原位反应生成硫化铜),过量的S2−以及硫化产物SbS2−和MoS42−等同时与硫化铜表面的铜原子发生竞争配位作用而被吸附共沉淀除去。而MoS42−是负二价阴离子,有两个未成键的硫原子可与铜原子进行配位,因而吸附沉淀时结合能力较强。SbS2−离子是负一价阴离子,只有一个未成键硫原子可用于配位,因而吸附沉淀时的结合能力远较MoS42−的弱。现有的选择性沉淀法技术主要目的是从溶液当中除去杂质钼。在最佳的除钼条件下,1g/L左右的游离S2−对SbS2−离子的竞争吸附作用显然相对要大得多。这可能是选择性沉淀法技术除钼效果比除锑更优的原因。如果能够通过优化条件实现SbS2−向SbS43−的转变,则有利于锑的深度去除。
为此,本文作者考察硫化剂的用量对含锑离子产生的影响,图4所示为假定[Sb]浓度为4 mmol/L,h固定为−0.4V,[S]/[Sb]分别为10、30、100时的主要含锑离子在总锑中的含量随溶液pH的变化趋势图。
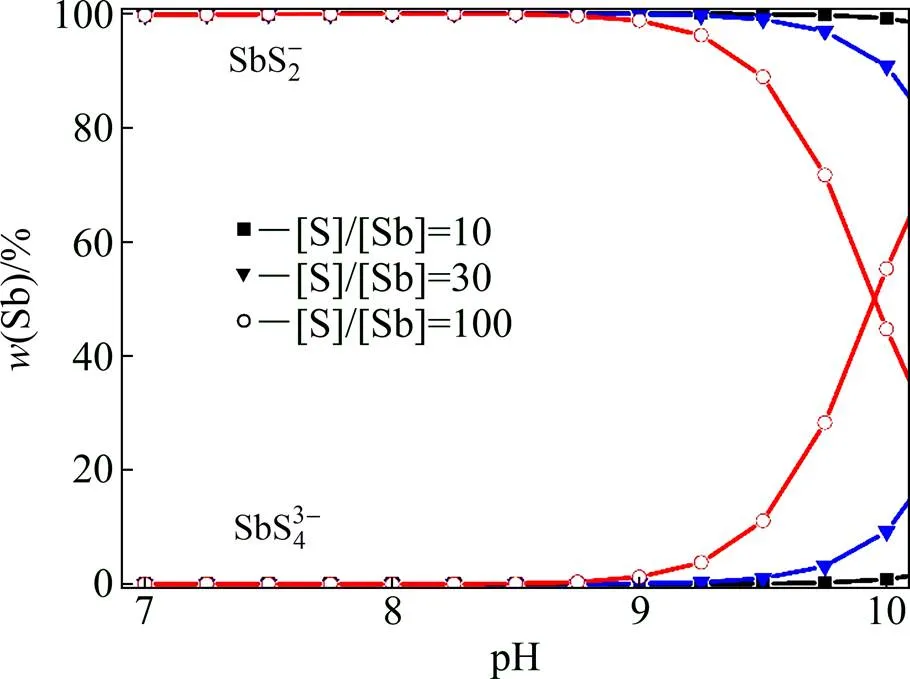
图4 pH对含锑离子分布的影响([S]/[Sb]=10, 20, 100)
从图4可以看出,随着硫化剂用量的增加, SbS43−离子的浓度逐步在增加。当pH=10,硫用量为锑的10倍时,SbS43−离子中锑含量占总锑的0.8%;硫用量为锑的30倍时,SbS43−离子中锑含量占总锑的9.24%;硫用量为锑的100倍时,SbS43−离子中锑含量占总锑的55.3%。实际生产过程中大量的增加硫化剂是不现实的,因为一方面会增加试剂消耗和环境排放,另一方便也会恶化主要杂质钼的去除条件。
上述的计算和分析结果表明,在选择性沉淀法除杂过程中,锑大多以难去除的SbS2−的形式存在,而通过改变溶液条件使其完全向易去除的SbS43−进行转变又不现实,这一矛盾看起来难以解决。但是,如果从另一个角度思考这一问题,也许会有新的解决思路。
选择性沉淀法过程中硫化钼酸根离子的除去过程,钼的自身性质决定其在硫化过程中需要过量的硫才能被完全硫化(一般游离1g/L的硫)。S2−、MoS42−和SbS2−同时与硫化铜表面的铜原子发生竞争配位作用,从而钼和锑被吸附共沉淀除去。从以前的研究分析可知,虽然硫对SbS2−离子的抑制作用比对MoS42−的大,但锑比钼更加容易硫化。
为了验证锑是否易硫化以及硫化程度,采用硫化剂用量仅为锑的2、4和6的条件下进行计算,同时固定[Sb]浓度为4 mmol/L,h=−0.4 V,这样以来就绘制了低硫化剂加入量条件下,SbS2−离子占总锑中的含量随溶液pH的变化曲线图,如图5所示。从图5中可以看出,即使[S]/[Sb]=2时(理论量),99%以上的锑在pH为7~10的范围内依旧是以SbS2−离子的形式存在。由此可以认为,此时溶液中几乎可以没有额外游离的硫离子,这样的溶液中加入与铜离子也许就可以以直接形成CuSbS2沉淀,而CuSbS2是一种天然矿物,溶解度极小。同时,由于溶液当中没有游离S2−,则其与SbS2−离子的竞争作用也不复存在。这样一来也许就能够实现锑的深度去除。
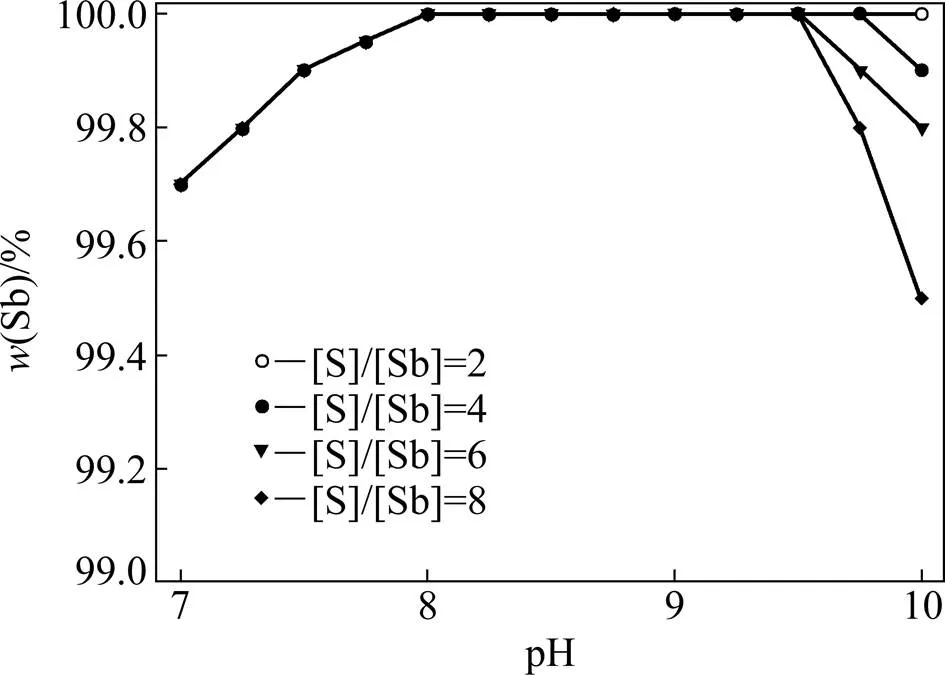
图5 pH对含锑离子分布的影响
为了进一步的实验验证,配制含钼、锑的溶液,并考察不同硫化铵加入量、以及硫酸铜用量对除锑效果的影响。
首先对硫化剂用量进行了考察,实验在室温下进行,配制含Mo 1.1 g/L、Sb 0.2 g/L的溶液,并按照[S]/[Sb]为3、5、7、9、11、13的量加入硫化铵,放置24 h;然后,在搅拌条件下,按照[Cu]/[Sb]=2的量加入硫酸铜(硫酸铜为58 g/L的水溶液),反应1 h后过滤分析,分析结果如图6所示。从图6可以看出,硫加入量仅为锑含量的三倍时,除锑率在90%以上,但是随着硫化剂用量的增加,除锑率反而一直在降低,当[S]/[Sb]=13时,锑的去除率降低到了75%左右。验证实验结果与理论预测一致,硫化剂用量的增加对除锑不利。
然后对铜用量对除锑的影响进行了考察。取上述硫化24 h后,[S]/[Sb]=3的溶液,铜加入量为锑摩尔量的1、2、3、4、5倍,其余实验条件与上述实验一致。实验结果如图7所示,从图7可以看出,随着铜用量的不断增加,锑的去除率也在不断增加,当铜用量为含锑量的3倍时,反应趋于平衡,此时锑去除率达到了97%左右,实现了锑的深度去除,上述猜想也得到了初步的验证。
因此,在处理含锑和钼的钨料液时,就可以采用分步法分别将锑和钼除去。先加入少量硫化剂进行锑的去除,然后再按照常规的选择性沉淀法除钼就可 以了。

图6 硫化剂用量对除锑的影响
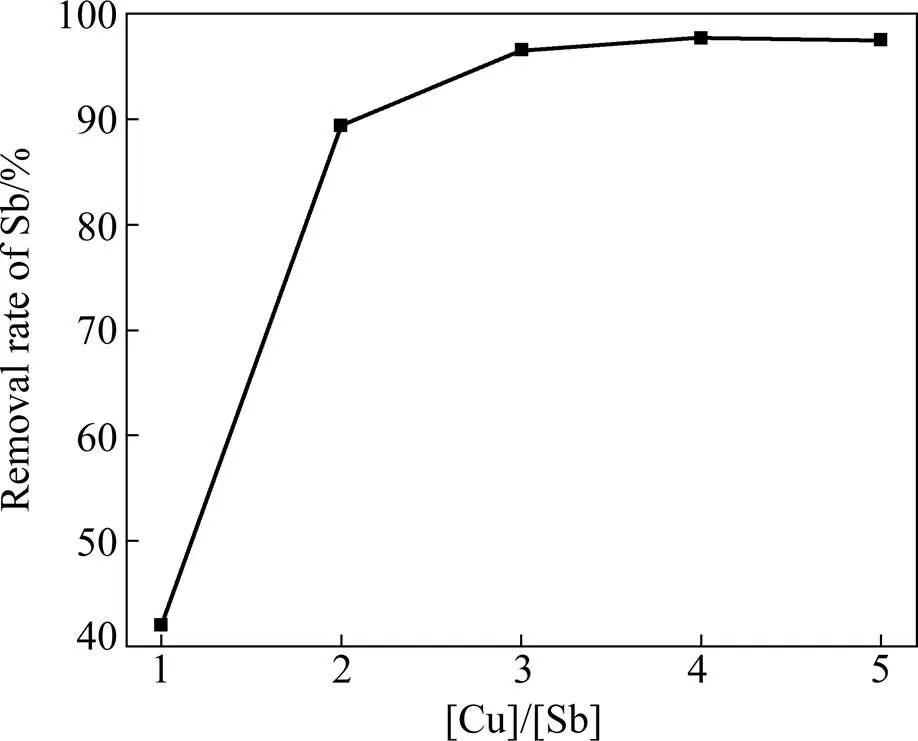
图7 铜用量对除锑的影响
3 结论
1) 热力学计算证明,锑非常容易被还原形成低价的SbS2−离子。
2) 常规选择性沉淀法除钼和锑是在游离1g/L的硫使钼完全硫化的前提条件下进行的,过量的S2−以及硫化产物SbS2−和MoS42−等同时与硫化铜表面的铜原子发生竞争配位作用而被吸附共沉淀除去。游离硫对SbS2−离子的竞争吸附能力要大与MoS42−,这可能是由于选择性沉淀法技术除钼效果比除锑效果更好。
3) 提出一种深度除锑和钼的可能方法。利用锑易被硫化的特性,在溶液中几乎没有游离S2−的条件下,加入铜离子使形成溶解度非常小的CuSbS2沉淀以深度去除锑。
4) 随着硫化剂用量的增加锑的去除率反而在不断降低,因而降低硫化剂的用量有利于锑的去除。从而验证试验的结果与理论预测一致,当硫用量和铜加入量为锑用量的三倍时,除锑率达到了97%以上。
[1] ZHAO Zhong-wei, GAO Li-li, CAO Cai-fang. Separation of molybdenum from tungstate solution-scavenging thiomolybdate by copper compound[J]. Metallurgical and Materials Transactions B-process Metallurgy and Materials Processing Science, 2012, 43(6): 1284−1289.
[2] 冶金过程强化学科组. “选择性沉淀法从钨酸盐溶液中除钼、砷、锡、锑”专利技术的新进展[J]. 中国钨业, 2000, 15(4): 29−30. Metallurgical Department. A new process of the process "Removal of Mo, As, Sn and Sb from tungstate solution by selective precipitation"[J]. China Tungsten Industry, 2000, 15(4): 29−30.
[3] 高利利, 赵中伟. 选择性沉淀法除钼后溶液中铜的行为研究[J]. 稀有金属, 2011, 35(3): 428−433. GAO Li-li, ZHAO Zhong-wei. Behavior of copper in solution after removing molybdenum by selective precipitation[J]. Chinese Journal of Rare Metals, 2011, 35(3): 428−433.
[4] 孙培梅, 李洪桂. 选择性沉淀法从钨酸盐溶液中除钼的工业试验[J]. 中国有色金属学报, 2001, 11(3): 499−502. SUN Pei-mei, LI Hong-gui. Commercial scale test of selective precipitation method for Mo removal from tungstate solution[J]. The Chinese Journal of Nonferrous Metals, 2001, 11(3): 499−502.
[5] 李洪桂, 孙培梅. 选择性沉淀法从钨酸盐溶液中除钼、砷、锑、锡等杂质的研究[J]. 中国钨业, 1998(4): 17−19. LI Hong-gui, SUN Pei-mei. The research of removal of Mo, As, Sn, Sb and other impurities from tungstate solution by selective precipitation[J]. China Tungsten Industry, 1998(4): 17−19.
[6] 霍广生, 赵中伟, 吴保林. 钼的硫化反应热力学分析[J]. 中南工业大学学报(自然科学版), 2001, 32(3): 259−261. HUO Guang-sheng, ZHAO Zhong-wei, WU Bao-lin. Thermaldynamic analysis on sulfidation of molybdate[J]. Journal of Central South University (Science and Technology), 2001, 32(3): 259−261.
[7] 谢 昊, 赵中伟, 曹才放. 硫化法除钼过程中杂质砷的行为[J]. 中南大学学报(自然科学版), 2012(2): 435−439. XIE Hao, ZHAO Zhong-wei, CAO Cai-fang. Behavior of arsenic in process of removing molybdenum by sulfide method[J]. Journal of Central South University (Science and Technology), 2001, 32(3): 259−261.
[8] 张家靓, 赵中伟, 陈星宇. W-Mo-H2O体系钨钼分离的热力学分析[J]. 中国有色金属学报, 2013, 23(5): 1463−1470. ZHANG Jia-liang, ZHAO Zhong-wei, CHEN Xing-yu. Thermodynamic analysis for separation of tungsten and molybdenum in W-Mo-H2O system[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(5): 1463−1470.
[9] 卢江波, 赵中伟, 李洪桂. 钨钼的硫化反应热力学分析[J]. 中国钨业, 2005, 20(4): 33−38. LU Jiang-bo, ZHAO Zhong-wei, LI Hong-gui. Thermodynamic analysis on sulfidation of molybdate and tungstate[J]. China Tungsten Industry, 2005, 20(4): 33−38.
[10] TANG Mo-tang, ZHAO Tian-cong. A thermodynamic study on the basic and negative potential fields of the systems of Sb-S-H2O and Sb-Na-S-H2O[J]. Journal of Central-South Institute of Mining and Metallurgy, 1988, 19(1): 35−43.
[11] MULTANI R S, FELDMANN T, DEMOPOULOS G P. Antimony in the metallurgical industry: A review of its chemistry and environmental stabilization options[J]. Hydrometallurgy, 2016, 164: 141−153.
[12] 魏 昶, 李存兄, 徐红胜. 高温下S-H2O系−pH图及水热硫化的应用[J]. 中国稀土学报, 2010, 28(S): 730−734. WEI Chang, LI Cun-xiong, XU Hong-sheng.−pH figures of S-H2O system under high temperature and application of hydrothermal sulfidation[J]. Journal of the Chinese Rare Earth Society, 2010, 28(S): 730−734.
[13] 张廷安, 牟望重. 转炉钒渣氧压酸浸过程V-Fe-H2O系的电位−pH图[J]. 中国有色金属学报, 2011, 21(11): 2936−2945. ZHANG Tin-gan, MU Wang-zhong. Potential−pH diagrams for V-Fe-H2O system during oxygen pressure acid leaching of vanadium-bearing converter slags[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(11): 2936−2945.
[14] 霍广生. 钨冶炼过程中钨钼分离新工艺及其理论研究[D]. 长沙: 中南大学, 2001: 68−77.HUO Guang-sheng. The new technics and basic theory of removing molybdenum from tungsten in the process of tungsten metallurgy[D]. Changsha: Central South University, 2001: 68−77.
[15] 李洪桂, 孙培梅. 从钨酸盐溶液中沉淀除钼、砷、锑、锡的方法: CN1203279 [P]. 1998−12−30.LI Hong-gui, SUN Pei-mei. A method for removal of Mo, As, Sn and Sb from tungstate solution: CN1203279 [P]. 1998−12−30.
Sulfidation and separation of antimony in tungsten solution
LI Yong-li, ZHAO Zhong-wei
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Aiming at the behavior of impurity Sb in the process of Mo separation by selective precipitation method, the distribution of diagram of various antimony-containing ions were drawn according to thermodynamic calculation results. And the sulfurization of Sb under conditions of different pH,hand [Sb]/[S] was discussed and verified. The effectiveness of selective precipitation and operating factors on antimony removing were analyzed considering the competitive coordination of S2−ions, and a method was proposed for deep removing antimony impurities. The result show that, under the conditions of pH 7−10 and [S]/[Sb]≥2, more than 99% of antimony exists as SbS2−. The above idea is verified by experiment and the results are consistent with theoretical predictions. When the dosage of sulfur and copper are 3 times, the removal rate of antimony is 97%.
sulfantimoniate; antimony removal; sulfidation reaction; thermodynamics; selective precipitation; tungstatesdution
(编辑 李艳红)
Project(51334008) supported by the Key projects of National Natural Science Foundation of China; Project (U1402274) supported by the National Natural Science Foundation of China-Yunnan Joint Fund Key Project, China
2016-12-08;
2017-07-14
ZHAO Zhong-wei; Tel: +86-731-88830476; E-mail: zhaozw@csu.edu.cn
国家自然科学基金重点项目(51334008);国家自然科学基金委−云南联合基金重点项目(U1402274U1402274U1402274)
2016-12-08;
2017-07-14
赵中伟,教授,博士;电话:0731-88830476;E-mail:zhaozw@csu.edu.cn
10.19476/j.ysxb.1004.0609.2017.12.24
1004-0609(2017)-12-2598-07
TF841
A

