Caveolin—1在腺性膀胱炎、膀胱移行细胞癌中的表达及其与细胞增殖、新生血管的关系及意义
蔡奕川+姚友生+李迎东
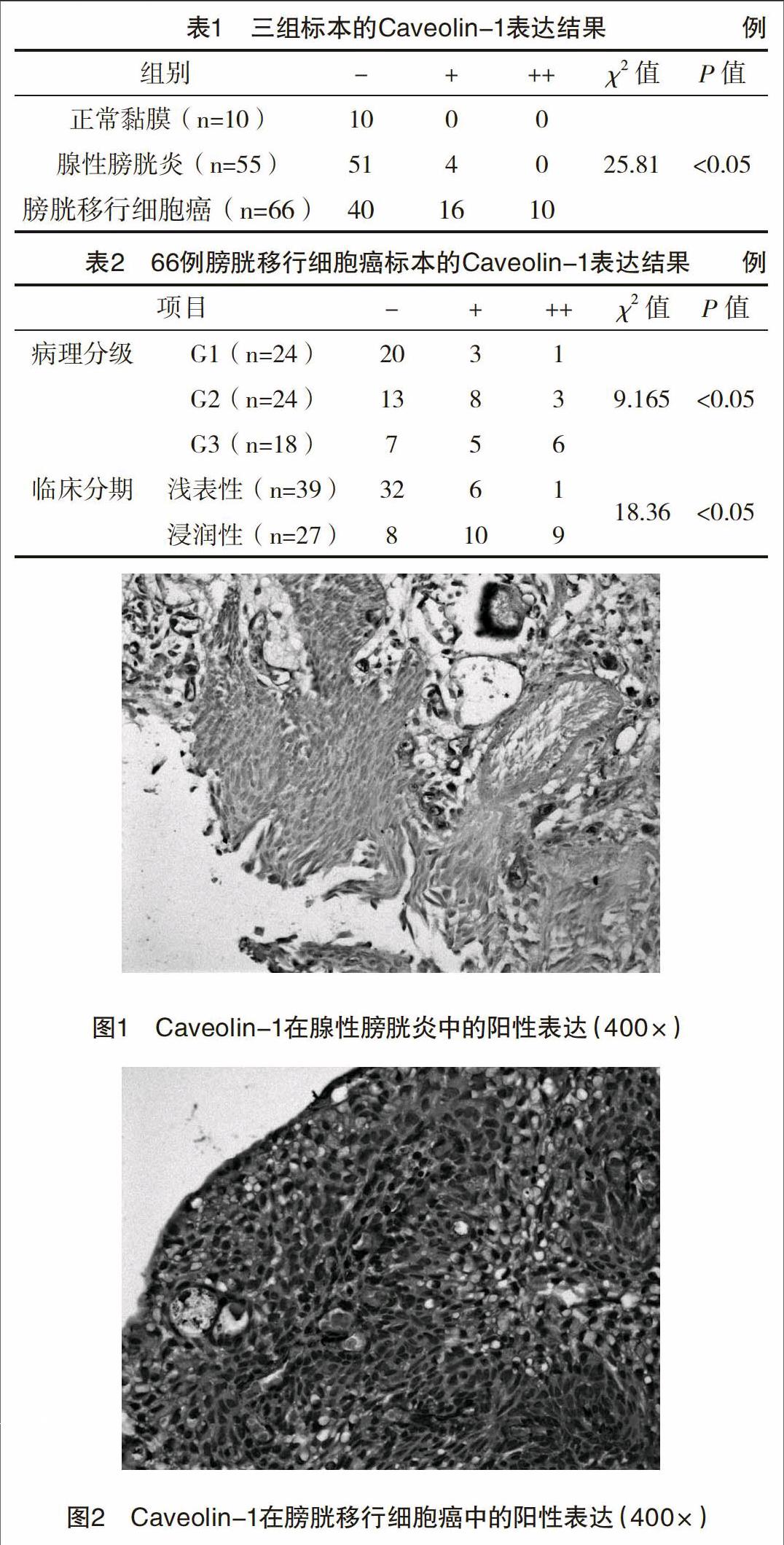
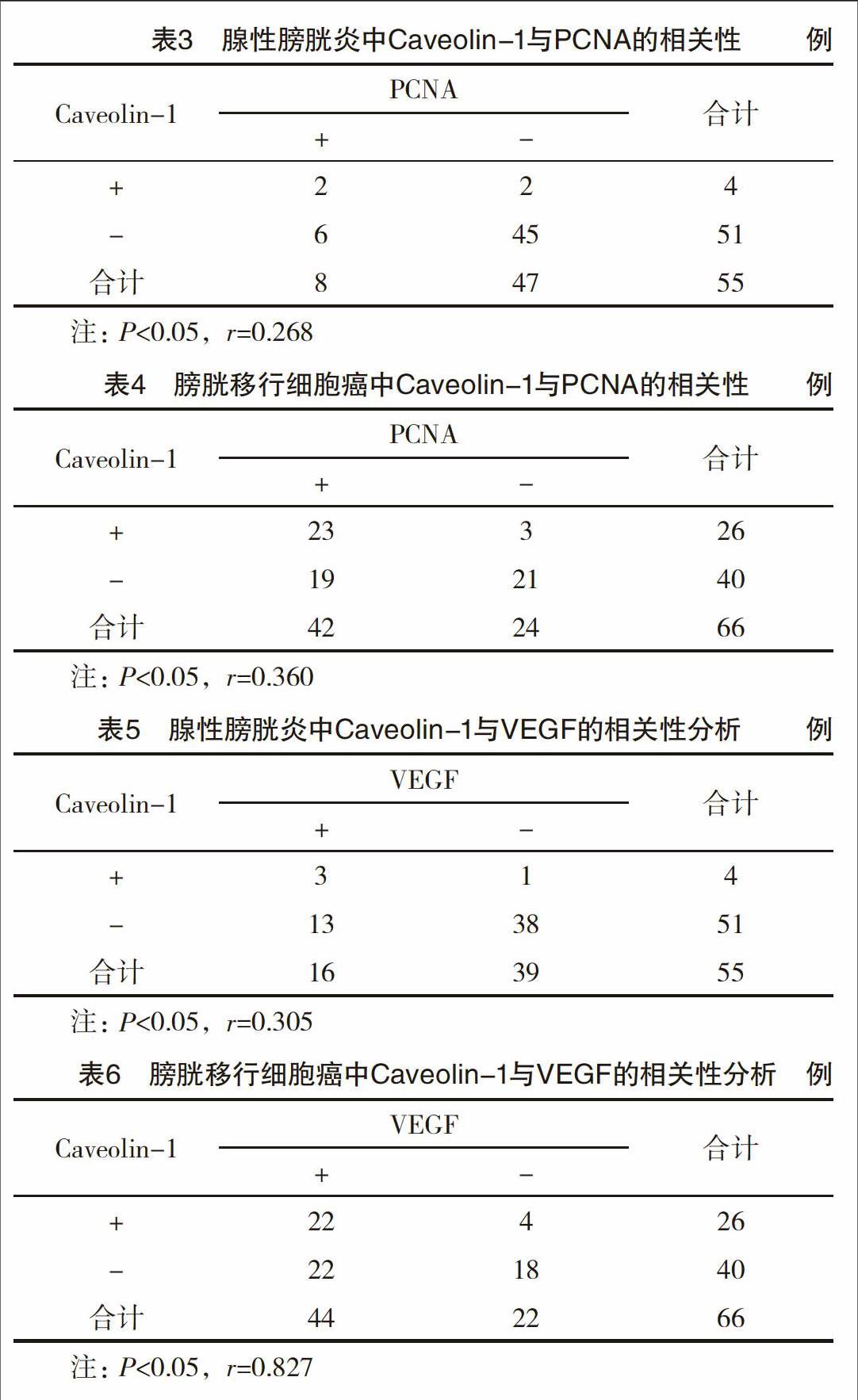
【摘要】 目的:探讨Caveolin-1在腺性膀胱炎、膀胱移行细胞癌中的表达及其与细胞增殖、新生血管的关系。方法:检测人膀胱移行细胞癌、腺性膀胱炎与正常膀胱黏膜组织中Caveolin-1、PCNA与VEGF的表达,并分析各指标间的相关性。结果:三组标本的Caveolin-1阳性率分别为0、7.27%与39.39%,比较差异有统计学意义(P<0.05),并且伴随肿瘤病理分级与临床分期的增高Caveolin-1阳性率不断升高,差异有统计学意义(P<0.05),同时腺性膀胱炎、膀胱移行细胞癌中Caveolin-1表达与PCNA、VEGF具有密切相关性。结论:Caveolin-1可作为反映腺性膀胱炎向膀胱癌转变的重要指标之一,与膀胱肿瘤细胞的增殖和新生血管生长有协同作用。
【关键词】 膀胱移行细胞癌; 腺性膀胱炎; Caveolin-1
doi:10.3969/j.issn.1674-4985.2016.34.005
腺性膀胱炎与膀胱癌有密切关联[1],不少研究认为腺性膀胱炎是一种良性病变,但具有恶变倾向,认为其可能是膀胱癌癌前病变的一种表现形式[2-3]。目前,有关小窝蛋白-1(Caveolin-1)的相关研究表明,其与不同类型恶性肿瘤的发生、发展及转移均存在关联[4],与其细胞的增殖、分化以及血管生成的信号传导具有相关性[5-6]。
1 资料与方法
1.1 一般资料 收集2011年1月-2015年6月在潮州市中心医院及中山大学孙逸仙纪念医院泌尿外科住院接受手术治疗的患者标本膀胱移行细胞癌66例,腺性膀胱炎55例及正常膀胱黏膜标本10例,全部组织均经福尔马林固定,石蜡包埋处理,连续切片,制成4 μm厚度的切片备染。原发性膀胱移行细胞癌手术标本66例,包括行膀胱全切术25例,膀胱部分切除术17例和经尿道电切术24例;其中男52例,女14例;年龄34~83岁,平均(60.17±10.40)岁;初发者40例,复发者26例;WHO病理分级中G1级24例,G2级24例,G3级18例;按UICC-TNM标准进行临床分期:浅表性肿瘤(Tis~T1)39例,浸润性肿瘤(T2~T4)27例,所有病例术前均未行化疗或放疗。腺性膀胱炎手术标本55例均行经尿道电切,其中男6例,女
49例;年龄30~72岁,平均(54.75±12.41)岁。另取10例正常膀胱黏膜作为正常对照,取自TURP7例及开放性前列腺摘除术3例,年龄53~76岁,平均(59.65±9.58)岁。各组患者年龄比较差异无统计学意义(P>0.05)。
1.2 试剂及方法 SP系列试剂盒第一抗体为大鼠抗人Caveolin-1多克隆抗体,购自Cell Signaling 公司,小鼠抗人增殖细胞核抗原單克隆抗体购自CHEMICON公司,兔抗人血管内皮生长因子单克隆抗体购自北京中杉金桥公司,二抗为即用型,以PBS代替一抗作阴性对照,参照UltraSensitiveTM S-P试
剂盒使用说明。
1.3 结果判断 Caveolin-1、血管内皮生长因子(VEGF)的阳性染色模式均为以细胞膜或细胞浆着色为阳性细胞信号,显微镜下每个切片随机取5个高倍镜视野,判定以染色强度和阳性细胞百分比的得分之和进行评估。(a)染色强度:不着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。(b)阳性细胞数:无阳性细胞数为0分,<25%为1分,25%~50%为2分,>50%为3分。以a+b之和评价:0分为(-)、1~3分为(+)、4~6分为(++)。PCNA阳性表达的判定:PCNA阳性着色定位于细胞核,以细胞核出现棕黄色颗粒为阳性染色。随机选择5个高倍视野,计数1000个细胞,计算阳性细胞百分比,阳性比≥10%时为表达阳性。每张切片至少观察到1000个细胞,计切片中每1000个肿瘤细胞中的阳性细胞数,取其平均值,按阳性细胞所占比例分为Ⅰ~Ⅳ级:0~10%为Ⅰ级,10%~25%为Ⅱ级,26%~50%为Ⅲ级,51%~100%为Ⅳ级。
1.3 统计学处理 使用SAS 9.0统计学软件进行分析,计量资料采用(x±s)表示,比较采用t检验,各指标之间的相关性分析用 字2趋势检验,以P<0.05为差异有统计学意义。
2 结果
2.1 三组标本的Caveolin-1表达 三组标本的Caveolin-1阳性率分别为0、7.27%与39.39%,比较均有统计学意义(P<0.05),并且伴随肿瘤病理分级与临床分期的增高其阳性率不断升高(P<0.05),见表1~2,图1~2。
2.2 Caveolin-1与PCNA、VEGF的相关性 腺性膀胱炎、膀胱移行细胞癌的Caveolin-1与PCNA、VEGF具有密切相关性,见表3~6。
3 讨论
腺性膀胱炎是一种膀胱黏膜上皮反应性增生改变[7],目前随着对其认识及诊断手段的提高,其发病率、复发率有增高的趋势,但其具体病因仍不甚清楚[8],相关研究认为是移行上皮在慢性刺激因素如感染、梗阻、物理刺激和化学致癌物等作用下,化生为腺上皮并通过分泌黏液而达到自身保护目的,其发生属于机体的一种防御机制[9-10]。小窝蛋白-1(Caveolin-1)是微囊蛋白的一种主要组成蛋白[11],目前多数研究表明Caveolin-1在癌细胞中表达上调,并与肿瘤发生、转移以及病理分级有关[12],提示Caveolin-1促进肿瘤的发生、发展和转移,与细胞的增殖、分子的信号传导有关[13]。膀胱癌及前列腺癌中,Caveolin-1均能以分泌型形式存在,且Caveolin-1的缺失能导致表皮细胞的过度增殖进而加速皮肤癌的发生[14]。
本组实验结果显示Caveolin-1在正常黏膜、腺性膀胱炎、膀胱癌有递增的趋势,腺性膀胱炎可能有潜在的恶变倾向,或者是正常膀胱黏膜恶变为膀胱癌的中间阶段。腺性膀胱炎与膀胱上皮肿瘤关系密切,人类尿路复层移行上皮生物学行为具有多变性,它可以在某些特定的间质影响下分化为前列腺上皮,也可以在某些条件下发生为鳞状上皮、腺上皮等,出现临床上的膀胱白斑、腺性膀胱炎、膀胱鳞状细胞癌、膀胱腺癌、尿路移行细胞癌等一些与分化相关的疾病。而腺性膀胱炎Caveolin-1阳性多见于结构紊乱且细胞异型增生较明显者[15],因此,笔者考虑其可能具有恶变潜能。腺性膀胱炎Caveolin-1表达为阳性者,当注意其可能具有恶变的潜能。虽然本研究发现腺性膀胱炎组的阳性表达率不高,且与正常黏膜组间比较差异无统计学意义(P>0.05),提示Caveolin-1对于区分腺性膀胱炎和正常组织可能没有意义。笔者考虑其一是标本量有限或者阳性率不高的原因,其二是与腺性膀胱炎标本的病理类型有关。此外,在膀胱移行细胞癌中Caveolin-1阳性率阳性表达率随肿瘤病理分级及临床分期的增高而增加。
血管内皮生长因子(VEGF)是目前已知的一族最强的促血管形成物质,在许多恶性肿瘤组织中呈高表达。本组实验结果发现:腺性膀胱炎组中VEGF阳性表达率为29.09%,膀胱移行细胞癌组中VEGF阳性表达率为66.67%,正常黏膜中无表达,三组间比较差异有统计学意义(P<0.01),并且正常黏膜组与腺性膀胱炎组、腺性膀胱炎组与膀胱移行细胞癌组间比较差异有统计学意义(P<0.01)。说明VEGF表达阳性对于区别正常黏膜、腺性膀胱炎、膀胱移行细胞癌有一定的意义,在腺性膀胱炎向膀胱移行细胞癌过渡的过程中新生血管也起到一定的作用。肿瘤的浸润伴随着肿瘤新生血管的形成,其关键环节在于血管形成诱导因子与抑制因子间平衡状态的改变[16]。黄随富等[17]发现VEGF在膀胱移行细胞癌中呈高表达与肿瘤的病理分级和临床分期相关,部分腺性膀胱炎也有表达,即VEGF阳性可能是腺性膀胱炎一种恶性变的危险信号,与大多数实体肿瘤一样,膀胱移行细胞癌也具有血管依赖性。
肿瘤的发生、发展和转移是涉及多种分子机制的极其复杂的过程,受许多特殊基因的调控[18]。本实验结果显示:Caveolin-1与PCNA在腺性膀胱炎、膀胱移行细胞癌中的表达呈正相关,说明Caveolin-1和PCNA对肿瘤细胞的增殖可能有协同作用。Caveolin-1可能在某些环节改变PCNA的信号传导有关,但具体机制还有待进一步研究。而且,腺性膀胱炎Caveolin-1染色阳性的4例中,有2例PCNA染色也阳性,其膀胱镜下表现为乳头状瘤样型(1例)和绒毛样水肿型(1例),组织切片上也有少数的异质性细胞。本实验表明:腺性膀胱炎恶变与其分型有一定关系,乳头状瘤样型恶变的潜能较大,而慢性炎症型、黏膜无显著改变型等其他类型恶变几率较小。所以对于滤泡水肿型,乳头状瘤样型腺性膀胱炎,特别是Caveolin-1与PCNA染色皆阳性的患者,存在恶变的潜能,应视为癌前病变,予以积极外科治疗,更应注意随访。
有研究认为Caveolin-1调节内皮细胞分化和促进血管生成[19-20]。赵醒等[21]发现在食管鳞癌中Caveolin-1促进肿瘤微血管生成。本实验结果显示:Caveolin-1与VEGF在腺性膀胱炎、膀胱移行细胞癌中的表达呈正相关,说明在腺性膀胱炎、膀胱移行细胞癌中Caveolin-1和VEGF的表达对肿瘤血管生成可能有协同作用。而且腺性膀胱炎中,Caveolin-1阳性表达的4例,有3例VEGF也出现阳性表达,其膀胱镜下表现为乳头状瘤样型(2例)和绒毛样水肿型(1例)。这提示对于滤泡水肿型,乳头状瘤样型腺性膀胱炎,特别是Caveolin-1与VEGF染色皆阳性的患者,更应注意随访。
综上所述,Caveolin-1可作为反应腺性膀胱炎向膀胱癌转变的重要指标之一,与膀胱肿瘤细胞的增殖和新生血管生长有协同作用。同时,Caveolin-1、PCNA和VEGF可作为反映腺性膀胱炎、膀胱移行细胞癌生物学行为和预后的指标。
参考文献
[1]冯强.腺性膀胱炎术后不同药物膀胱灌注的疗效比较[J].河南医学研究,2016,25(5):890-891.
[2]王磊,王炜,王照,等.MTA-1及PCNA在腺性膀胱炎中的表达及临床意义[J].中国现代医学杂志,2014,24(19):30-33.
[3]葛波,李鹏程,袁宏毅,等.Survivin在膀胱移行细胞癌及腺性膀胱炎中的表达及临床意义[J].中国现代医学杂志,2013,23(35):42-45.
[4]蔡晓曼,陈素钻,俞晶,等.小窝蛋白-1和E-钙黏蛋白在食管癌TE1细胞系中的表达及其意义[J].癌变·畸变·突变,2016,28(3):227-230.
[5]张松,田向永,袁孝伟,等.Caveolin-1在腮腺多形性腺瘤及瘤旁组织中的表达及临床意义[J].中国肿瘤临床,2014,41(7):449-452.
[6]黄小平,任必勇,朱川,等.Caveolin-1在食管鳞癌中的表达及意义[J].海南医学院学报,2014,20(10):1313-1315.
[7]丁德鑫,陈辉,王志,等.腺性膀胱炎及膀胱癌中livin和caspase-9的表达[J].现代生物医学进展,2016,31(6):1076-1078.
[8]林明恩,洪英楷,张炜,等.叉头蛋白M1在膀胱癌和腺性膀胱炎中的表达及临床意义[J].汕头大学医学院学报,2015,28(1):38-40.
[9]秦晓健,张海梁,万方宁,等.全逆行根治性膀胱切除治疗男性膀胱癌的临床应用及110例病例报告[J].中国癌症杂志,2014,24(6):433-437.
[10]丁锡奇,向从明,李光,等.肌层浸润性膀胱癌术中放疗的疗效及安全性[J].江苏医药,2014,40(5):540-542.
[11]向月,张雄,杨军,等.miR-124-3p通过负调控Caveolin-1表达N2a/APPswe细胞凋亡率及细胞内钙离子浓度[J].重庆医科大学学报,2015,40(5):671-676.
[12]马小斌,康华峰,包兴,等.pcDNA3.1(+)/caveolin-1真核表达质粒的构建及其在MCF-7乳腺癌细胞株中的表达[J].西安交通大学学报,2013,34(1):16-19.
[13] Jankovi? J,Tati? S,Bo?i? V,et al.Inverse expression of caveolin-1 and EGFR in thyroid cancer patients[J].Hum Pathol,2016,S0046-8177(16)30291-X.
[14]刘卫梅.Caveolin-1蛋白在直肠癌组织中的表达及其临床意义[J].中国医学工程,2016,24(3):1-2.
[15] Nakada Y,Yamamoto I,Horita S,et al.The prognostic values of caveolin-1 immunoreactivity in peritubular capillaries in patients with kidney transplantation[J].Clin Transplant,2016,30(11):1417-1424.
[16]周德生,寇志剛,陈瑶,等.Caveolin-1与血管新生相关性的研究进展[J].中国临床新医学,2013,6(3):270-272.
[17]黄随富,任选义,张高磊,等.膀胱移行细胞癌中VEGF表达的临床意义[J].现代肿瘤医学,2011,19(9):1805-1806.
[18]肖永红,梁晓飞,王悦,等.17β-雌二醇对SiO2刺激的小鼠肺成纤维细胞表达Caveolin-1和Ⅲ型胶原的影响[J].四川大学学报,2015,46(1):62-64.
[19]王善伟,徐侃伦,赵莉莉,等.Caveolin-1在乳腺浸润性导管癌间质内癌相关成纤维细胞中的表达水平与乳腺癌分子亚型的相关性[J].临床肿瘤学杂志,2012,17(6):511-515.
[20]赵乐,唐萃,杨磊,等.Caveolin-1、GPR30和Vimentin在甲状腺乳头状癌组织中的表达及意义[J].中国免疫学杂志,2015,31(11):1510-1514.
[21]赵醒,赵宇阳,王军,等.Caveolin-1在食管鳞癌中的表达及其意义[J].中华保健医学杂志,2014,16(3):177-178.

