ARTP生物育种技术与装备研发及其产业化发展
吴亦楠,邢新会,,张翀,,李和平,王立言
ARTP生物育种技术与装备研发及其产业化发展
吴亦楠1,邢新会1,2,张翀1,2,李和平2,3,王立言2

邢新会,清华大学教授,博士生导师,“百人计划”入选者。主持“国家自然科学基金重大仪器专项”项目、中以国际合作项目,“十二五”科技支撑计划项目,日本JST CREST等项目;发表SCI论文150余篇,合作著书8本,译著教材2部,申请发明专利100余项,获得发明专利60余项,其中1项国际专利。担任《Journal of Bioscience and Bioengineering》主编,《Biochemical Engineering Journal》副主编,《食品科学》、《生物产业技术》及5个英文学术期刊编委。获得第17届全国发明展览会奖银奖(2007年),北京市科学技术奖三等奖(2008年),中国石油和化学工业协会技术发明奖二等奖(2009年),中国侨界贡献奖(创新人才)(2010年),高等学校科学研究优秀成果奖(科学技术)科技进步奖二等奖(2015年)。E-mail:xhxing@mail.tsinghua.edu.cn
1.工业生物催化教育部重点实验室,清华大学化工系生物化工研究所,清华大学合成与系统生物学研究中心,北京 100084
2.清华大学无锡应用技术研究院生物育种中心,无锡 214072
3.清华大学工程物理系,北京 100084
安全高效的微生物诱变和高通量筛选技术与装备是生物技术科研及产业发展的核心,具有重要的研究价值和广泛的应用前景。笔者研究团队成功将基于大气压射频辉光放电的常压室温等离子体(ARTP)应用于生物诱变育种领域,对其与生物大分子、细胞之间的作用机理进行了系统研究,并研发了具有自主知识产权的ARTP生物育种仪。因操作安全简便、突变快、突变率高、获得的突变体性状稳定等特点,ARTP育种仪已成功应用于百种以上微生物的诱变育种,在行业引起了广泛关注,并实现了的国际出口。综述了ARTP生物育种技术的原理、装备研发现状及其近年来的研究和应用进展,并对其今后的发展趋势进行了展望。
ARTP;筛选;生物育种;诱变
自19世纪30年代以来, 生物发酵技术以其节能高效、绿色无害的特点被广泛用于生产各类化学品,服务于食品、医药、材料、环保、能源等领域。以化石资源为基础的现代工业面临着日益严重的资源短缺、环境污染、气候变化和能源危机,因此人类对工业生物技术及其绿色可持续发展工业给予极大的期待,生物经济呼之欲出[1]。快速选育具有高产、高鲁棒性、高稳定性、高安全性表型的工业微生物成为生物经济发展的关键技术。
微生物育种技术是生物经济的核心。近年来,随着分子生物学、代谢工程学、系统生物学及合成生物学等学科的快速发展,菌株的理性和半理性设计得到了长足的进步。分子育种技术具有一定的定向性,且因其引入了外源基因和合成途径,能极大地拓宽微生物生产的产品种类和效率,但由于细胞的复杂性,即使采用理性设计,仍无法完全准确预测结果,因此需要采用设计-构建-测试-学习循环(DBTL)的模式,但理性设计存在技术难度高、周期长,适用微生物种类有限、生物安全性等问题,在实际应用时仍面临着很多挑战。相比之下,具有悠久历史的诱变育种技术因其操作简单、成本相对较低、产生突变容易、适用范围广、属于非转基因操作等,仍是微生物育种研究和产业应用的平台技术。因此,发展安全高效的新型生物诱变技术具有重要的研究价值。
诱变育种根据其诱变源的不同可以分为化学诱变[2-3]、物理诱变[4-7]和生物诱变[8-9]。近年来,笔者研究团队基于大气压射频辉光放电原理,自主研发的常压室温等离子体(ARTP)诱变技术[10]及装备作为继离子束注入[6]和大气压介质阻挡放电等离子体(APDBD)体诱变技术[11-14]之后的又一安全高效诱变新方法。因不需要真空系统,设备结构简单、成本低;放电均匀、稳定、可控,操作简便,安全性高;等离子体产生条件温和(常压、室温范围),富含大量活性粒子,突变谱广,突变率高等,ARTP在工业微生物育种中得到了广泛应用并取得良好效果,引起了国内外科研机构和企业越来越多的关注。 本文重点介绍ARTP技术和装备的研究及应用发展。

图1 常见的APNED发生器[17]
1 ARTP生物育种技术原理
ARTP是常压非平衡放电等离子体(APNED)[15-16]的一种。APNED由带电粒子(电子、阴离子、阳离子)、自由基、中性粒子(激发的原子或分子)、光子(可见光和紫外线)和电磁场组成,其各组分比例因等离子体产生方式、放电电压、气源种类不同而略有差异。常见的APNED发生器如图1所示[17]。APNED因去除了复杂、昂贵的真空系统且温度较低,其热效应影响可以忽略而越来越受关注,被广泛用于细菌、真菌、病毒等病原体的灭活、伤口及医疗设备的消毒、细胞转染及癌症细胞的诱导凋亡等研究[18-21]。
大量研究表明,APNED与DNA、蛋白质、微生物细胞发生相互作用[17],从而产生细胞的致死和亚致死效应。APNED中存在的大量活性氧化物和活性氮化物是引起DNA断裂、真核细胞DDR响应、原核细胞SOS响应的主要因素[22-24]。APNED中常见的活性物质如表1[25]所示,活性物质与DNA的作用位点、诱导DNA断裂的作用过程如图2[26]和图3[17]所示。当N-糖苷键受到攻击或脱氧核糖发生脱氢反应时,DNA会由于一系列变化产生单链断裂;而当不同链上的断链位置相近时,能够产生双链断裂。裸露的DNA双链、质粒经由APNED处理后,在短时间内就会出现双链断裂和完全裂解的现象。APNED照射活细胞首先会改变细胞膜的通透性,但具有不同膜结构的细胞对APNED的耐受能力不同[13]。在膜结构被破坏之后,APNED内的活性粒子或其与水分子及胞内脂质、蛋白质等生物分子进一步反应生成的有机氧化物会引发DNA易错性修复机制[27]。当APNED照射强度过高时,细胞会死亡;而当强度适中时,细胞则会产生基因突变,胞内基因转录水平、翻译水平等都将随之变化[28-33]。王立言和张雪等[10,34]利用黄嘌呤氧化酶法和FDG与PI荧光染料从细胞水平上解析了上述作用机制。者研究团队首次用于微生物育种。并且研究团队揭示了ARTP与生物作用的机理,有良好的应用成效[35]。
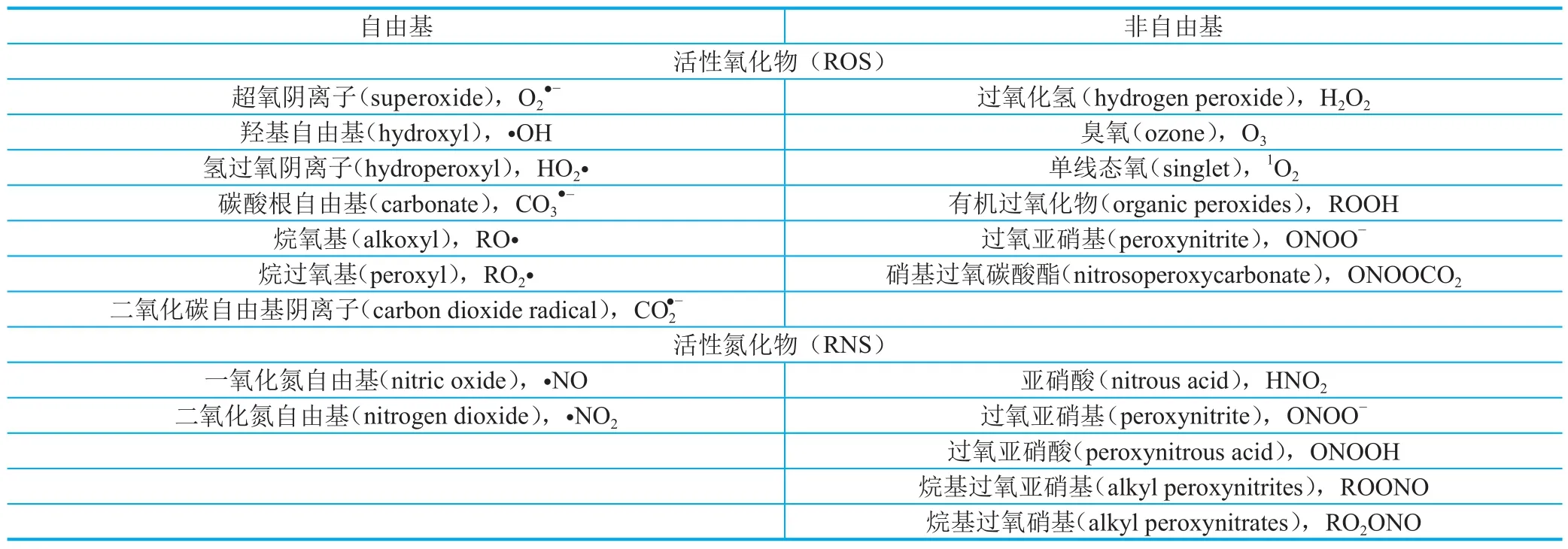
表1 APNED中常见的活性物质
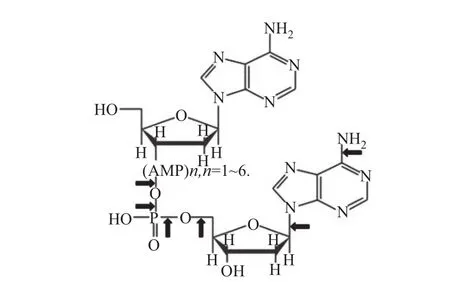
图2 等离子体活性物质与DNA的可能作用位点[26]
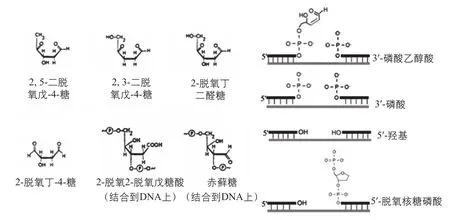
图3 活性物质引起的DNA断裂[17]
2 ARTP生物育种设备研发及诱变特点
AR TP生物育种技术的实验室研究平台如图4所示[10]。当工作气体经过两个通电电极之间时,具有高能量的电子与周围的中性粒子通过弹性碰撞和非弹性碰撞发生能量交换,使工作气体分子分解、激发或电离,随着电压的升高,气体被击穿产生放电,形成具有一定电离度的等离子体;在气流作用下产生的等离子体以一定的速度喷出并与空气中的组分反应,形成含有氮、氧、羟基等其他活性粒子的等离子体射流。
笔者研究团队以He为工作气体对该发生器的物理特性进行了系统深入的研究,代表性结果图5所示。
在大气压条件下,ARTP温度可控制在室温范围,适用于各类生物处理[10];在适宜的电极间距内,等离子体发生器能以α和γ模式实现放电[37]。后者可以用于诱发纯空气或氧气的持续性放电,起到降低气耗成本的目的[38],放电均匀、稳定[36]。等离子体含有丰富的活性粒子,紫外线强度和臭氧含量极低,具有高效诱变细胞的潜力[22]。
由于不同的活性物质作用于DNA的位点不同,造成的氧化损伤、基因突变的偏好性也会有所差异,因此,包含大量不同活性粒子的APNED基因突变范围广、突变率高,相比于传统的物理诱变方法能够产生更多的基因多样性和突变谱。ARTP作为APNED中放电最均匀、稳定、安全、可控和更温和的一类低温等离子体,被笔
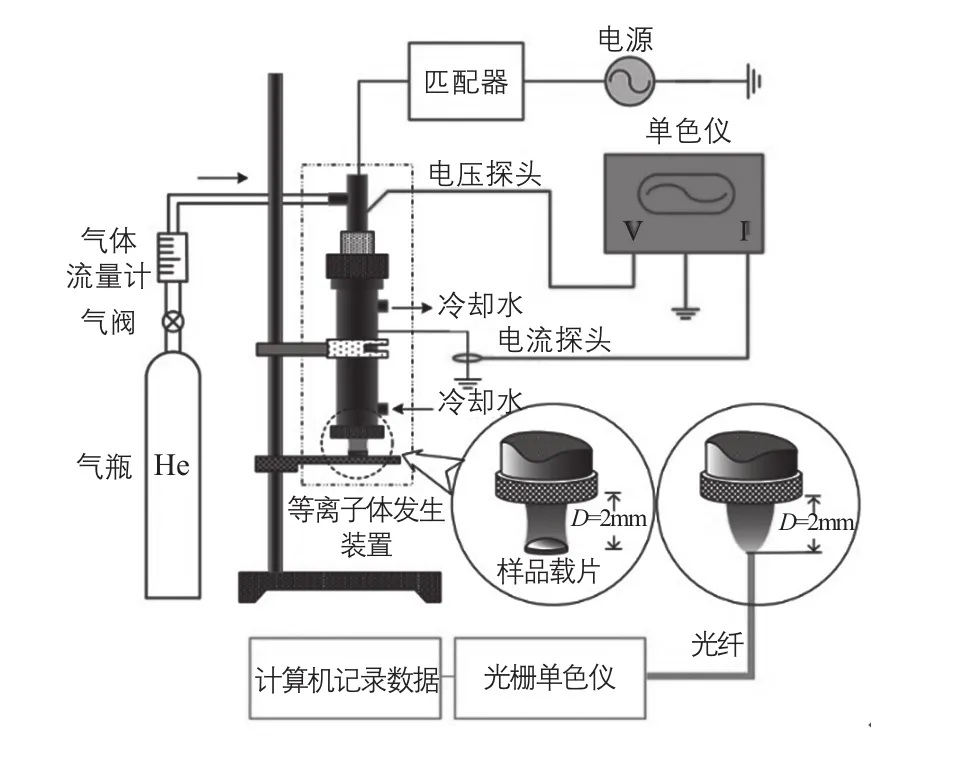
图4 ARTP生物育种设备的实验室研发平台[10]
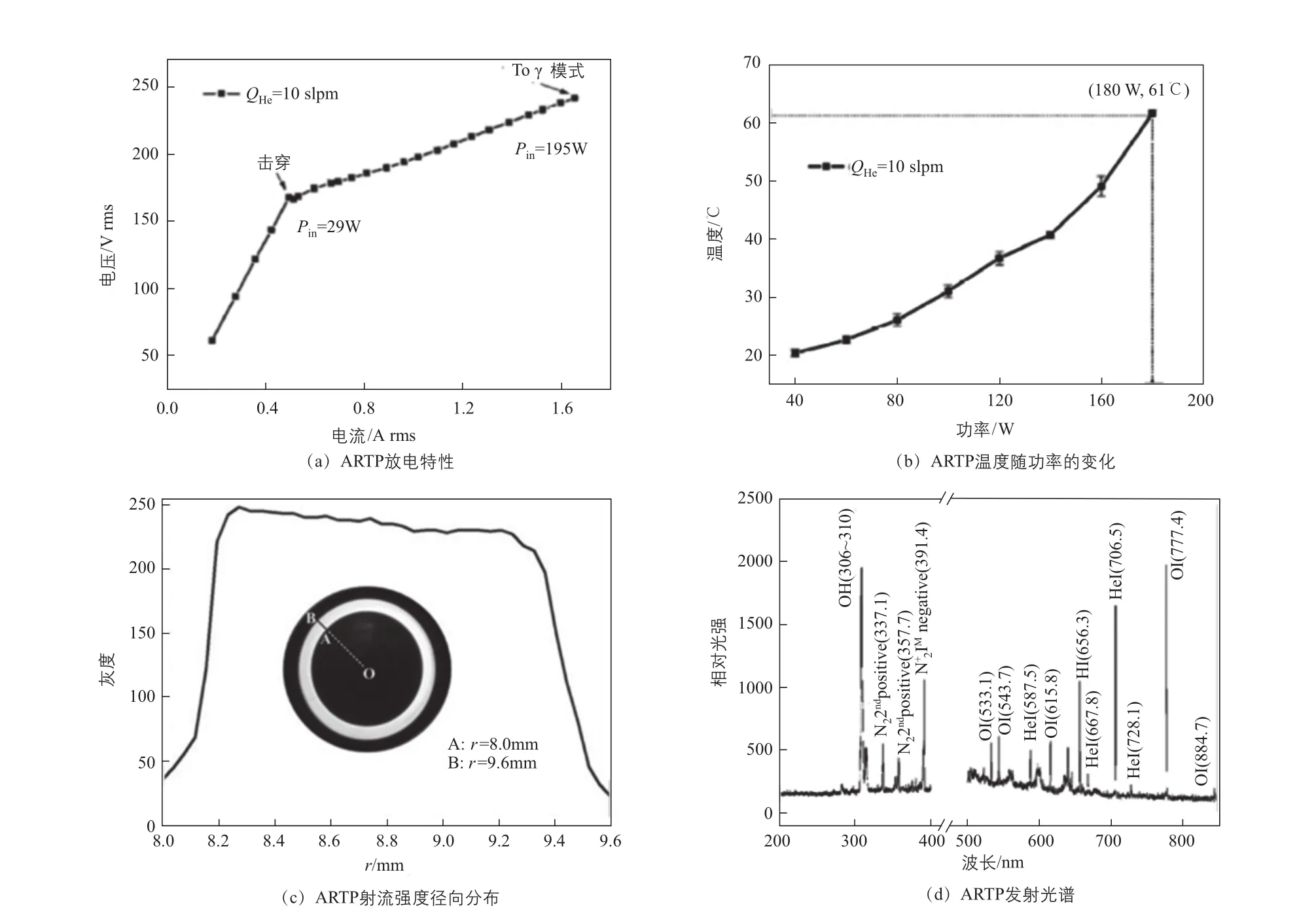
图5 ARTP基本物理性质[10,22,36]
笔者研究团队在揭示ARTP对胞外DNA损伤作用[22]的基础上,对生产阿维菌素的阿维链霉菌进行了诱变育种,结果显示诱变后的菌株菌落形态发生了明显变化,根据菌落形态对突变后的菌株进行筛选,获得了一株阿维菌素总产量提高18%、抗虫活性最高的组分B1a产量提高43%的高产菌株,且具有良好的遗传稳定性[35]。利用umu test原理和流式细胞仪,建立了各种诱变源对活细胞DNA损伤强度定量分析方法,结果显示ARTP对活细胞DNA的损伤强度远高于其他方法[10,34]。此外,笔者团队还通过f uctuation test方法比较了不同强度ARTP、UV、化学诱变的DNA损伤强度与突变率的关系[34],结果如图6所示。活细胞内DNA损伤强度与诱变率具有一定的正相关性,ARTP诱变的突变率高于其他诱变源,是一种更为高效的诱变源。
为了推进ARTP生物育种技术的广泛应用,实现技术的装备化及其产业化是关键,笔者团队在清华大学无锡应用技术研究院建立了生物育种研发中心,并孵化了无锡源清天木生物科技有限公司,成功研制了一系列ARTP诱变育种仪,满足不同应用需求,如图7所示。该系列仪器获得授权国家发明专利10余项,自2012年开始应用以来得到了学术界和工业界的广泛关注,并已出口到新加坡和日本等国。
3 ARTP生物育种技术在微生物改造中的应用
ARTP生物育种技术以其操作便捷性、安全性和高效性等特点得到了广泛应用,在微生物育种领域发挥着重要作用[39]。表2列举了近三年来ARTP生物育种技术应用的部分代表性案例,其他应用案例可参考已发表的综述论文[37,39]。
目前,ARTP生物育种技术已经成功用于百余种微生物的性能改造,包括细菌、真菌、微藻等,涉及生产能力、细胞生长速度及耐受性等表型的改变,服务于80余家国内外生物技术龙头企业和科研院所。另外,近两年ARTP生物育种技术在植物[51]和动物育种中的应用也初步获得了成功,这表明ARTP生物育种技术是具有普适性的诱变方法。以此为契机,发起并联合组建的中国生物发酵产业协会微生物育种分会为行业提供了平台支撑。
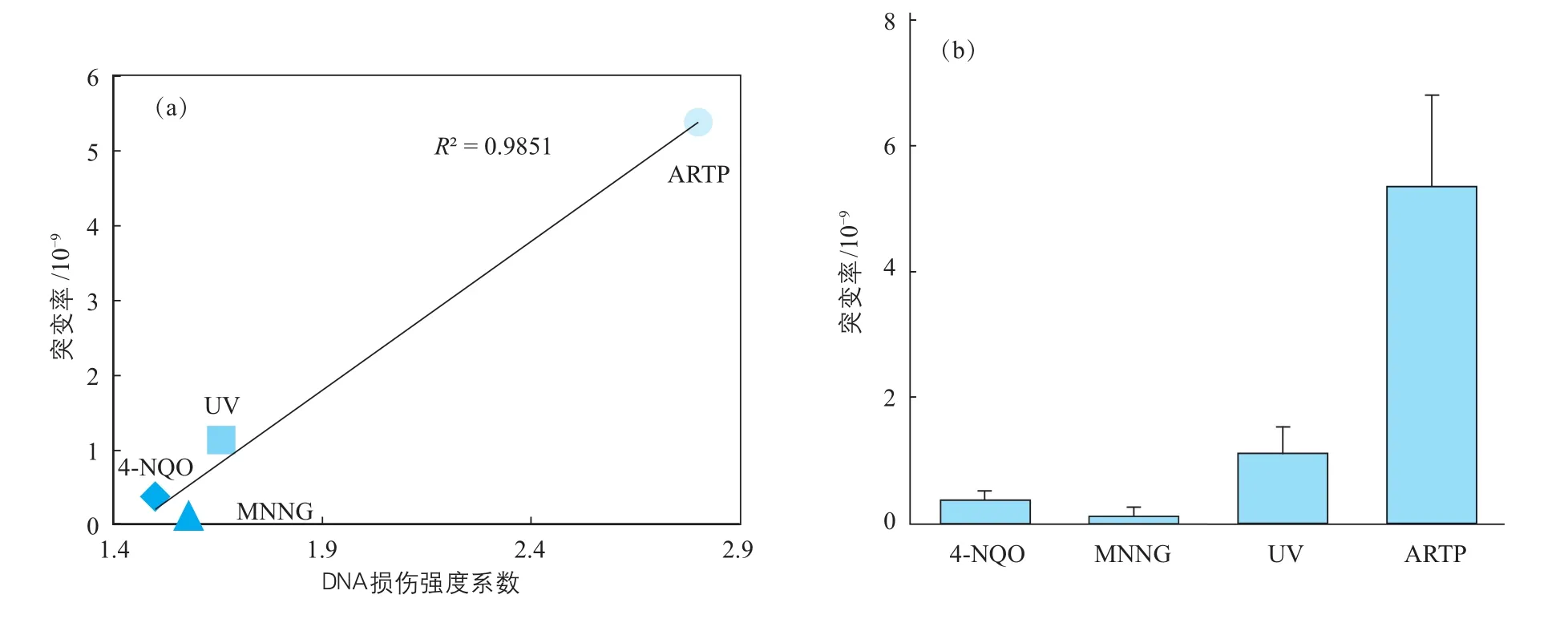
图6 ARTP与常规突变源的DNA损伤强度与突变率的关系(a)及突变率比较结果(b)[34]

图7 系列ARTP诱变育种仪
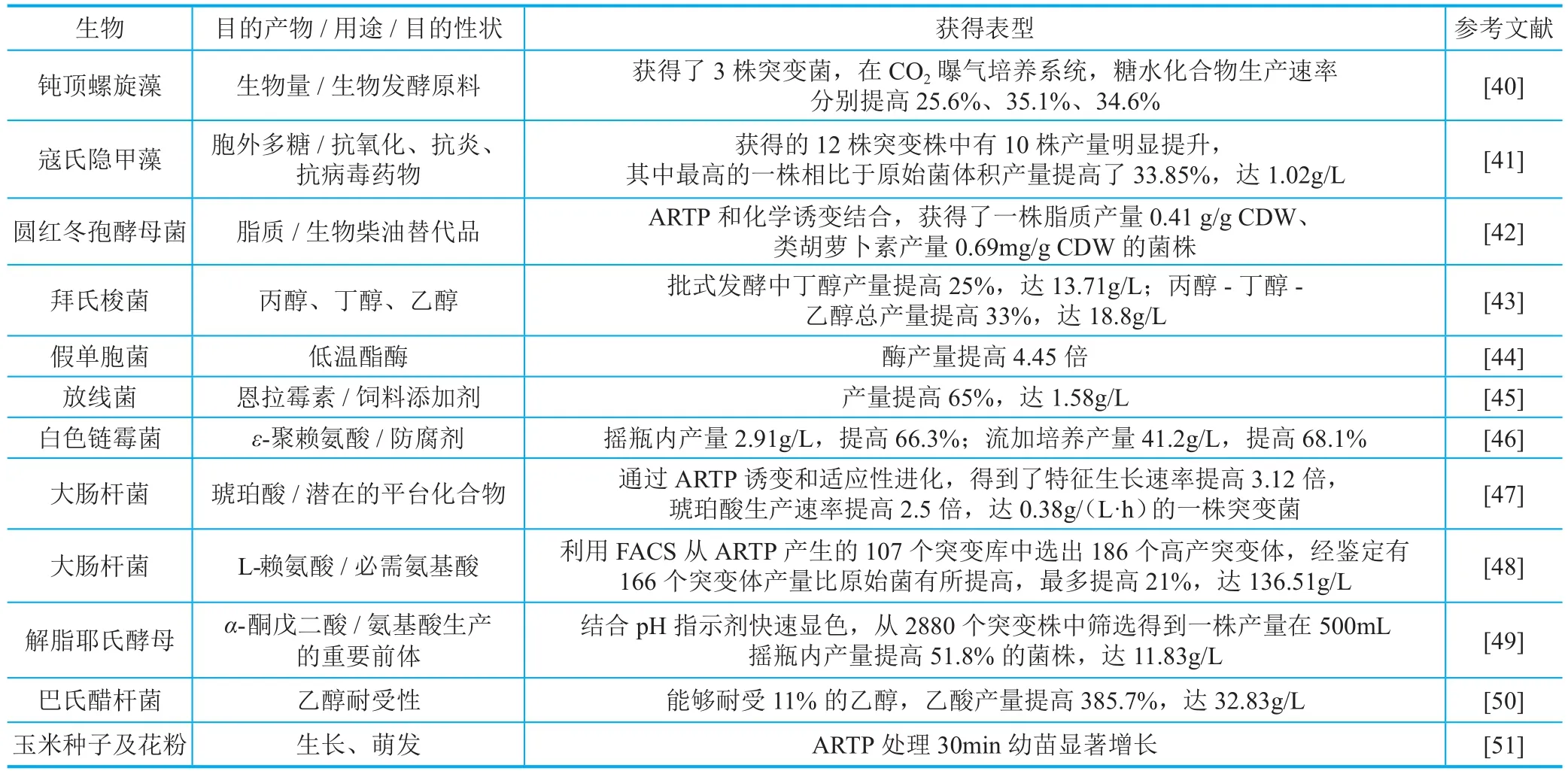
表2 ARTP生物育种技术近三年的部分代表性应用实例
4 ARTP生物育种技术展望
综上所述,基于ARTP固有的安全、简便、可控等物理学特点,笔者团队研发的ARTP生物育种装备具有高效构建多样性突变库、实现全局突变、基因沉默及激活途径等功能,是生物诱变育种的平台工具。
针对微生物菌种选育过程复杂、操作周期长的问题,除了发展快速引起基因组大范围突变技术之外,还需要将理性设计和非理性进化方法结合,系统地改造微生物细胞工厂。伴随着测序技术和生物信息学的飞速发展,经由ARTP诱变构建的突变库将为研究代谢网络调控、生物信号传导、酶促反应机制、表观遗传、GWAS等科学问题提供新素材,成为代谢工程和合成生物学等理性设计的重要平台工具(图8)。
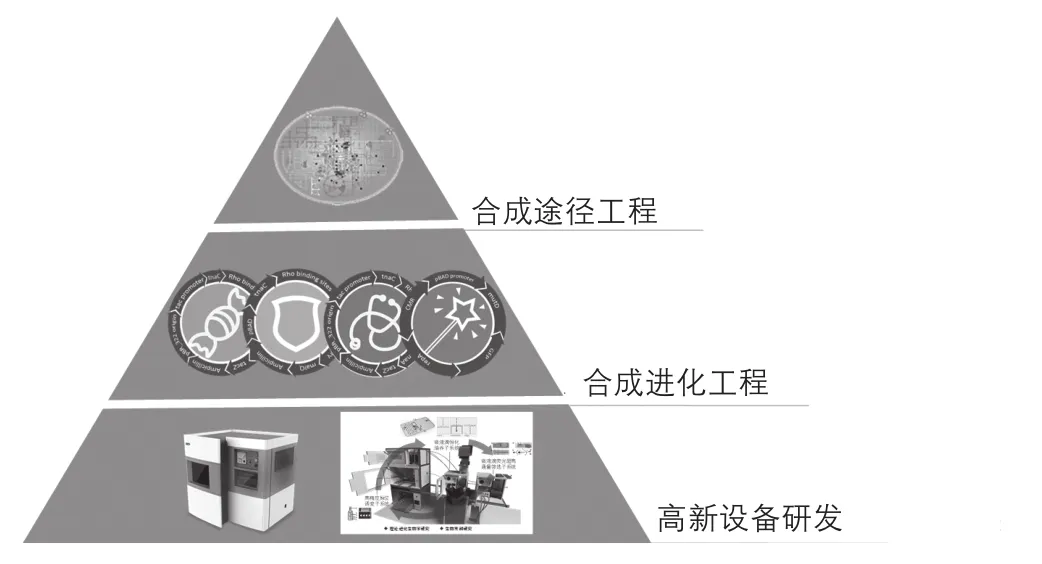
图8 面向菌种高效设计与改造的生物育种装备与进化工程和合成途径工程技术的整合研究
ARTP作为一种高效的突变工具,能在短时间内处理生物细胞并产生104以上的突变体,构建大的突变库。如何从多样性的大突变文库中快速精准地筛选具有理想目的性状的菌株是另一个急需解决的关键问题,这也是生物育种技术发展的前沿[52]。对于目标表型与细胞形态、颜色无关的工业微生物的筛选,高通量筛选和适应性进化技术成为未来发展的重要方向。自动化设备如移液站、Colony picker等的应用大大加快了这一研究的过程,但其通量大小和筛选效率依然有局限性,而且运行成本高。流式细胞仪[53-54]和微液滴技术[55-58]的兴起与应用能够很好的满足突变库的高通量筛选需求。两者能够通过生物传感器或荧光检测试剂将目的产物胞内或胞外浓度与荧光强度结合,以103~104个单菌/s的通量进行突变菌株的高效筛选。对于抗逆表型,适应性进化是有效的选择手段[59]。但摇瓶传代培养体系操作繁琐,耗时耗力;恒化培养体系则对培养设备有较高的要求,而且也存在操作复杂的问题。如果微液滴技术[60]能在芯片上实现长期的恒化培养及自动化操作,开发出在芯片上自动操作的适应性进化体系,将大幅度提升突变微生物的进化通量。基于此,本团队提出了将ARTP高效诱变技术与微液滴技术整合的新思路,目标是研制出诱变-筛选一体化的高通量生物进化仪,以实现微生物的定制化改造,为理论进化生物学和工业微生物育种提供系统、高效的平台,于2016年获得了国家自然科学基金委国家重大科研仪器研制专项的支持。
[1] OECD. The Bioeconomy to 2030 - Main f ndings and conclusions[R]. Paris,OECD,2009.
[2] MIAO Z H,RAO V A,AGAMA K,et al. 4-nitroquinoline 1-oxide induces the formation of cellular topoisomerase I-DNA cleavage complexes[J]. Cancer Research,2006,66(13):6540-6545.
[3] SLAMEŇOVÁ D,GÁBELOVÁ A,RUŽEKOVÁ L,et al. Detection of MNNG-induced DNA lesions in mammalian cells; validation of comet assay against DNA unwinding technique,alkaline elution of DNA and chromosomal aberrations[J]. Mutation Research - DNA Repair,1997,383(3):243-252.
[4] SINHA R P,HÄDER D P. UV-induced DNA damage and repair:a review[J]. Photochemical & Photobiological Sciences,2002,1(4):225-236.
[5] DE GRUIJL F R,VAN KRANEN H J,MULLENDERS L H F. UV-induced DNA damage,repair,mutations and oncogenic pathways in skin cancer[J]. Journal of Photochemistry and Photobiology B:Biology,2001,63(1-3):19-27.
[6] GU S B,LI S C,FENG H Y,et al. A novel approach to microbial breeding-low-energy ion implantation[J]. Applied Microbiology and Biotechnology,2008,78(2):201-209.
[7] 胡伟,陈积红,张珍,等. 重离子辐照柠檬酸菌株的诱变选育[J]. 辐射研究与辐射工艺学报,2012,30(1):53-57.
[8] COX E C,HORNER D L. Structure and coding properties of a dominant Escherichia coli mutator gene,mutD [J]. Proceedings of theNational Academy of Sciences of the United States of America,1983,80(8):2295-2299.
[9] CHOU H H,KEASLING J D. Programming adaptive control to evolve increased metabolite production [J]. Nature Communications,2013,4(10):1-8.
[10] 王立言. 常压室温等离子体对微生物的作用机理及其应用基础研究[D].北京:清华大学,2009. http://166.111.120.42/Thesis/Thesis/ThesisSearch/ Search_DataDetails.aspx?dbcode=ETDQH&dbid=7&sysid=213177.
[11] JÉRÔME F,CHATEL G,DE OLIVEIRA VIGIER K. Depolymerization of cellulose to processable glucans by non-thermal technologies[J]. Green Chem,2016,18(14):3903-3913.
[12] HOU Y M,DONG X Y,YU H,et al. Disintegration of biomacromolecules by dielectric barrier discharge plasma in helium at atmospheric pressure[J]. IEEE Transactions on Plasma Science,2008,36(4 PART 3):1633-1637.
[13] LU H,PATIL S,KEENER K M,et al. Bacterial inactivation by high-voltage atmospheric cold plasma:Inf uence of process parameters and effects on cell leakage and DNA[J]. Journal of Applied Microbiology,2014,116(4):784-794.
[14] YU H,XIU Z L,REN C S,et al. Inactivation of yeast by dielectric barrier discharge (DBD) plasma in helium at atmospheric pressure[J]. IEEE Transactions on Plasma Science,2005,33(4):1405-1409.
[15] HAERTEL B,VON WOEDTKE T ,WELTMANN K,et al. Non-thermal atmospheric-pressure plasma possible application in wound healing[J]. Biomolecules & Therapeutics,2014,22(6):477-490.
[16] NEHRA V,KUMAR A,DWIVEDI H K. Atmospheric non-thermal plasma sources[J]. International Journal of Engineering,2008,2(1):53-68.
[17] ARJUNAN K,SHARMA V,PTASINSKA S. Effects of atmospheric pressure plasmas on isolated and cellular DNA—A Review[J]. International Journal of Molecular Sciences,2015,16(2):2971-3016.
[18] FRIDMAN G,SHERESHEVSKY A,JOST M M,et al. Floating electrode dielectric barrier discharge plasma in air promoting apoptotic behavior in Melanoma skin cancer cell lines[J]. Plasma Chemistry and Plasma Processing,2007,27(2):163-176.
[19] LEDUC M,GUAY D,LEASK R L,et al. Cell permeabilization using a non-thermal plasma[J]. New Journal of Physics,2009,11(11):1-12.
[20] YILDIRIM E D,AYAN H,VASILETS V N,et al. Effect of dielectric barrier discharge plasma on the attachment and proliferation of osteoblasts cultured over poly(ε-caprolactone) scaffolds[J]. Plasma Processes and Polymers,2008,5(1):58-66.
[21] MORFILL G E,SHIMIZU T,STEFFES B,et al. Nosocomial infections - A new approach towards preventive medicine using plasmas[J]. New Journal of Physics,2009,11(11).
[22] LI G,LI H P,WANG L Y,et al. Genetic effects of radio-frequency,atmospheric-pressure glow discharges with helium[J]. Applied Physics Letters,2008,92(22):2006-2009.
[23] GAUNT L F,BEGGS C B,GEORGHIOU G E. Bactericidal action of the reactive species produced by gas-discharge nonthermal plasma at atmospheric pressure:A review[J]. IEEE Transactions on Plasma Science,2006,34(4 II):1257-1269.
[24] LACKMANN J W,SCHNEIDER S,EDENGEISER E,et al. Photons and particles emitted from cold atmospheric-pressure plasma inactivate bacteria and biomolecules independently and synergistically[J]. Journal of the Royal Society,2013,10(89):20130591.
[25] HALLIWELL B. Oxidative stress and neurodegeneration:Where are we now?[J]. Journal of Neurochemistry,2006,97(6):1634-1658.
[26] 隋澎,张翀,王立言. 开发高效菌株育种技术提升生物产业创新能力[J]. 生物产业技术,2015,3:82-84.
[27] KALGHATGI S,KELLY C M,CERCHAR E,et al. Effects of non-thermal plasma on mammalian cells[J]. PLoS One,2011,6(1):1-11.
[28] SHACKELFORD R E,KAUFMANN W K,PAULES R S. Oxidative stress and cell cycle checkpoint function[J]. Free Radical Biology and Medicine,2000,28(9):1387-1404.
[29] BARZILAI A,YAMAMOTO K I. DNA damage responses to oxidative stress[J]. DNA Repair,2004,3(8-9):1109-1115.
[30] SIMON H U,HAJ-YEHIA A,LEVI-SCHAFFER F. Role of reactive oxygen species (ROS) in apoptosis induction[J]. Apoptosis,2000,5(5):415-418.
[31] CIRCU M L,AW T Y. Reactive oxygen species,cellular redox systems,and apoptosis[J]. Free Radical Biology and Medicine,2010,48(6):749-762.
[32] SMITH J,LADI E,MAYER-PROSCHEL M,et al. Redox state is a central modulator of the balance between self-renewal and differentiation in a dividing glial precursor cell[J]. Proceedings of the National Academy of Sciences of the United States of America,2000,97(18):10032-10037.
[33] DROGE W,DRÖGE W. Free radicals in the physiological control of cell function[J]. Physiological Reviews,2002,82(1):47-95.
[34] ZHANG X,ZHANG C,ZHOU Q Q,et al. Quantitative evaluation of DNA damage and mutation rate by atmospheric and roomtemperature plasma (ARTP) and conventional mutagenesis[J].Applied Microbiology and Biotechnology,2015,99(13):5639-5646.
[35] WANG L Y,HUANG Z L,LI G,et al. Novel mutation breeding method for Streptomyces avermitilis using an atmospheric pressure glow discharge plasma[J]. Journal of Applied Microbiology,2010,108(3):851-858.
[36] WANG Z,LE P,GE N,et al. One-dimensional modeling on the asymmetric features of a radio-frequency atmospheric helium glow discharge produced using a co-axial-type plasma[J]. Plasma Chem Plasma Process,2012(32):859-874.
[37] 张雪,张晓菲,王立言,等. 常压室温等离子体生物诱变育种及其应用研究进展[J]. 化工学报,2014,65(7):2676-2684.
[38] LI H P,SUN W T,WANG H B,et al. Electrical features of radio-frequency,atmospheric-pressure,bare-metallic-electrode glow discharges[J]. Plasma Chemistry and Plasma Processing,2007,27(5):529-545.
[39] ZHANG X,ZHANG X F,LI H P,et al. Atmospheric and room temperature plasma (ARTP) as a new powerful mutagenesis tool[J]. Applied Microbiology and Biotechnology,2014,98(12):5387-5396.
[40] TAN Y,FANG M,JIN L,et al. Culture characteristics of the atmospheric and room temperature plasma-mutated Spirulina platensis mutants in CO2aeration culture system for biomass production[J]. Journal of Bioscience and Bioengineering,2015,120(4):438-443.
[41] LIU B,SUN Z,MA X,et al. Mutation Breeding of extracellular polysaccharide-producing microalga Crypthecodinium cohnii by a novel mutagenesis with atmospheric and room temperature plasma[J]. International Journal of Molecular Sciences,2015,16(4):8201-8212.
[42] ZHANG C,SHEN H,ZHANG X,et al. Combined mutagenesis of Rhodosporidium toruloides for improved production of carotenoids and lipids[J]. Biotechnology Letters,2016,38(10):1-6.
[43] KONG X,HE A,ZHAO J,et al. Efficient acetone-butanol-ethanol (ABE) production by a butanol-tolerant mutant of Clostridium beijerinckii in a fermentation-pervaporation coupled process[J]. Biochemical Engineering Journal,2016,105:90-96.
[44] DONG J,GASMALLA M A A,ZHAO W,et al. Characterisation of a cold adapted esterase and mutants from a psychrotolerant Pseudomonas sp. strain[J]. Biotechnology and Applied Biochemistry,2016.
[45] ZHANG D,WANG Q,LIANG X. Breeding high producers of enduracidin from Streptomyces fungicidicus by combination of various mutation treatments[J]. Advances in Applied Biotechnology,2014:133-142.
[46] WANG L,CHEN X,WU G,et al. Improved ε-poly-l-lysine production of Streptomyces sp. FEEL-1 by atmospheric and room temperature plasma mutagenesis and streptomycin resistance screening[J]. Annals of Microbiology,2015,65(4):2009-2017.
[47] MA J F,WU M K,ZHANG C Q,et al. Coupled ARTP and ALE strategy to improve anaerobic cell growth and succinic acid production by Escherichia coli[J]. Journal of Chemical Technology and Biotechnology,2016,91(3):711-717.
[48] WANG Y,LI Q,ZHENG P,et al. Evolving the L-lysine highproducing strain of Escherichia coli using a newly developed high-throughput screening method[J]. J Ins Microbiol Biotechnol,2016,43(9):1227-1235.
[49] ZENG W,DU G,CHEN J,et al. A high-throughput screening procedure for enhancing alpha-ketoglutaric acid production in Yarrowia lipolytica by random mutagenesis[J]. Process Biochemistry,2015,50(10):1516-1522.
[50] ZHANG T C,NAKAJIMA M. Evaluation of an ethanol-tolerant acetobacter pasteurianus mutant generated by a new atmospheric and room temperature plasma (ARTP)[J]. Advances in Applied Biotechnology,2015:277-286.
[51] MEIJIE L. Effects on maize seed and pollen germination by atmospheric and room temperature plasma[J]. Molecular Plant Breeding,2016,14(5):1262-1267.
[52] DIETRICH J A,MCKEE A E,KEASLING J D. High-throughput metabolic engineering:advances in small-molecule screening and selection[J]. Annual Review of Biochemistry,2010,79:563-590.
[53] FANG M,WANG T,ZHANG C,et al. Intermediate-sensor assisted push-pull strategy and its application in heterologous deoxyviolacein production in Escherichia coli[J]. Metabolic Engineering,2016,33:41-51.
[54] BINDER S,SCHENDZIELORZ G,STÄBLER N,et al. A highthroughput approach to identify genomic variants of bacterial metabolite producers at the single-cell level[J]. Genome Biology,2012,13(5):R40.
[55] MAZUTIS L,GILBERT J,UNG W L,et al. Single-cell analysis and sorting using droplet-based microf uidicsz[J]. Nature Protocols,2013,8(5):870-891.
[56] BARET J C,MILLER O J,TALY V,et al. Fluorescence-activated droplet sorting (FADS):eff cient microf uidic cell sorting based on enzymatic activity[J]. Lab Chip,2009,9(13):1850-1858.
[57] WANG B L,GHADERI A,ZHOU H,et al. Microfluidic high-throughput culturing of single cells for selection based on extracellular metabolite production or consumption[J]. Nature Biotechnology,2014,5:1-26.
[58] BROUZES E,MEDKOVA M,SAVENELLI N,et al. Droplet microf uidic technology for single-cell high-throughput screening[J]. Proceedings of the National Academy of Sciences of the United States of America,2009,106(34):14195-14200.
[59] PORTNOY V A,BEZDAN D,ZENGLER K. Adaptive laboratory evolution—harnessing the power of biology for metabolic engineering[J]. Current Opinion in Biotechnology,2011,22(4):590-594.
[60] JAKIELA S,KAMINSKI T S,CYBULSKI O,et al. Bacterial growth and adaptation in microdroplet chemostats[J]. Angewandte Chemie(International ed. in English),2013,52(34):8908-891 1.
Recent progress on atmospheric and room temperature plasma(ARTP) biobreeding technology, instrumentation and its industrialization
WU Yinan1,XING Xinhui1,2,ZHANG Chong1,2,LI Heping2,3,WANG Liyan2
1. MOE Key Laboratory for Industrial Biocatalysis, Institute of Biochemical Engineering, Department of Chemical Engineering, Center for Synthetic & Systems Biology, Tsinghua University, Beijing 100084, China
2. Biobreeding Research Center, Wuxi Research Institute of Applied Technologies, Tsinghua University, Wuxi 214072, China
3. Department of Engineering Physics, Tsinghua University, Beijing 100084, China
As the core of biotechnological research and industry, development of safe and eff cient microbial mutagenesis technology and high-throughput screening as well as their instrumentation is of importance. Our research group has successfully developed a novel biological mutation breeding technology using atmospheric and room temperature plasma(ARTP) and invented the ARTP biobreeding equipment with our own intellectual property rights. Due to the benef ts of easy operation, rapid mutation capability, high mutation rate, high mutant genetic stability and high safety for the operators, ARTP biobreeding equipment has attracted extensive attention in the industry and academy and has achieved international exports. It has been successfully applied in the breeding of more than 100 kinds of microorganisms. This paper summarizes the recent progress on ARTP biobreeding technology and prospects.
ARTP; screening; biobreeding; mutagenesis
10.3969/j.issn.1674-0319.2017.01.006
吴亦楠,在读博士,主要从事代谢工程、微生物高通量育种等方面的研究。E-mail:wuyinan14@mails.tsinghua.edu.cn
清华大学自主科研计划(20161080108),日本JST CREST项目,国家自然科学基金委国家重大科研仪器研制专项(2162780028)