慢性牙周炎患者唾液蛋白酶谱分析
李倩 周学东 樊亚平 杨腾宇 吴松涛 余宇 陈娇 张平 冯云
口腔疾病研究国家重点实验室 华西口腔医院(四川大学),成都 610041
·基础研究·
慢性牙周炎患者唾液蛋白酶谱分析
李倩 周学东 樊亚平 杨腾宇 吴松涛 余宇 陈娇 张平 冯云
口腔疾病研究国家重点实验室 华西口腔医院(四川大学),成都 610041
目的 比较慢性牙周炎患者和牙周健康者的唾液蛋白谱差异,以期为慢性牙周炎的诊断和治疗监测提供依据。方法 收集慢性牙周炎患者和牙周健康者刺激性唾液,采用蛋白芯片技术,对慢性牙周炎患者和正常人的唾液蛋白酶谱进行分析。结果 慢性牙周炎患者和牙周健康者唾液蛋白酶的表达具有统计学差异。其中,慢性牙周炎患者唾液中去整合素金属蛋白酶(ADAM)8,基质金属蛋白酶(MMP)-8、-12,脑啡肽酶/CD10,尿激酶纤维蛋白溶酶原激活剂/尿激酶的表达高于牙周健康者(P<0.01);ADAM9,含凝血酶敏感素基序的去整合素金属蛋白酶(ADAMTS)1、13,组织蛋白酶B、E、L、V、X/Z/P,激肽释放酶6、7、11、13,MMP-9,蛋白酶3、早老素1和前蛋白转化酶9的表达低于牙周健康者(P<0.05)。结论 慢性牙周炎患者的唾液蛋白酶谱与牙周健康者具有显著差异,唾液蛋白酶谱分析将有望成为慢性牙周炎临床诊断和治疗监测的实验检查手段。
唾液; 慢性牙周炎; 蛋白酶谱
唾液是人体的重要体液成分之一,与人类的健康和疾病密切相关,具有重要的潜在研究价值。唾液中的蛋白在口腔免疫防御系统中发挥着重要作用,其中富脯蛋白、富酪蛋白、胱蛋白、富组蛋白、黏蛋白等主要功能蛋白质的作用已经研究得比较透彻[1-3]。蛋白酶是水解蛋白肽键的一类酶的总称,作为一种特殊的蛋白质,蛋白酶还有待深入研究。蛋白酶通过裂解氨基酸的肽键,分离水解蛋白质,进而调节改变蛋白的生物学功能[4-5]。人唾液中的蛋白酶主要来源于宿主和细菌,这些蛋白酶在代谢调控中发挥着不同的功能。从某种角度来说,对蛋白酶的研究是对唾液研究的必要补充[6]。慢性牙周炎是一种发生在牙周支持组织的慢性感染性炎症,引起牙周支持组织的破坏,最终导致牙齿的松动、脱落。近年来,对蛋白酶与慢性牙周炎关系的研究主要集中在基质金属蛋白酶(matrix metalloproteinase,MMP)和组织蛋白酶(cathepsin),而慢性牙周炎与其他蛋白酶的关系研究甚少,这也亟待进一步探索。
蛋白芯片作为一种高通量监测系统,利用靶分子与捕捉分子相互作用的原理来监测蛋白分子间的作用。鉴于其高通量的优点,蛋白芯片正逐步成为蛋白研究的新工具。本实验通过蛋白芯片技术比较慢性牙周炎患者和正常人唾液蛋白酶谱的差异,以期通过检测唾液蛋白酶谱的变化为慢性牙周炎的发病机制、无创诊断、治疗及监测提供一定的实验依据。
1 材料和方法
1.1 材料
Salivette唾液收集管(Sarstedt公司,德国),高速低温离心机(Heraeus公司,德国),-80 ℃冰箱(Thermo公司,美国),pH检测仪(上海久世环保科技有限公司)。
人蛋白酶芯片试剂盒(Human Protease Array Kit,R&D Systems公司,美国),其中包含:芯片膜、Array Buffer 4、Array Buffer 6、Wash Buffer液、Detection Antibody Cocktail、Streptavidin-HRP、Chemi Reagent 1、Chemi Reagent 2、4-Well-Multi-dish底物盘、透明盖。X胶片(Kodak公司,美国),X射线摄影暗盒(中国蔚蓝医疗器械有限公司),X胶片烘箱(上海万锐实验室设备有限公司),HP LaserJet M1522nf扫描仪(中国惠普有限公司),ImageJ软件(美国国立卫生研究院)。
1.2 分组
本实验中唾液样本的收集经过四川大学华西口腔医院医学伦理委员会的严格审查和批准(审查项目编号:WCHSIRB-ST-2014-082),志愿者在完全知情的情况下签署知情同意书。
由牙周科医生按1999年牙周病分类国际研讨会制定的慢性牙周炎的诊断标准[7],从四川大学华西口腔医院牙周科门诊随机选择慢性牙周炎患者和牙周健康者各6例。
慢性牙周炎患者入选标准如下。1)每个象限至少3颗牙有牙周探诊深度(probing depth,PD)≥5 mm且临床附着丧失(clinical attachment loss,CAL)≥3 mm的位点,全口探诊出血(bleeding on probing,BOP)(+)位点比例>40%,口内余留牙齿多于20颗(至少包括4颗磨牙,不包括第三磨牙);2)年龄段为18~55岁;3)所有研究对象全身健康,无近期用药史、无系统性疾病及过敏史;4)女性未妊娠,未服避孕药,且不在月经期;5)3个月内未服用过抗生素及非甾体类抗炎药;6)无明显牙体、黏膜疾病,无正在进行治疗的口腔疾病,6个月内未进行过牙周治疗。
牙周健康者纳入标准如下:1)无PD≥4 mm或CAL>1 mm的位点,BOP(+)位点比例<10%;2)年龄段为18~55岁;3)所有研究对象全身健康,无近期用药史、无系统性疾病及过敏史;4)女性未妊娠,未服避孕药,且不在月经期;5)3个月内未服用过抗生素及非甾体类抗炎药;6)无明显牙体、黏膜疾病,无正在进行治疗的口腔疾病,6个月内未进行过牙周治疗。
1.3 收集刺激性唾液
各组入选者在唾液收集前禁止饮水,清水漱口后将唾液收集管中的棉卷置于口腔内咀嚼5 min,待棉卷完全浸湿后放入收集管内(如唾液中含血则弃之),置于冰盒内。
唾液样本立即转入离心管中,4 ℃、12 000 r·min-1离心10 min后,吸取上清液,由0.2 μm滤器过滤除菌,-80 ℃冰箱保存备用。
1.4 蛋白芯片分析唾液样本
唾液样本及反应试剂于冰上解冻。在4-Well-Multi-dish底物盘中,加入2 mL Array Buffer 6反应液,轻微摇晃使反应液均匀地分布于底物盘中。用镊子将芯片膜从避光袋中取出,平铺在底物盘里(带字母标识面朝上)。然后将底物盘平稳放置于摇床上,并确保反应液与芯片膜充分接触,在室温下孵育1 h。
取慢性牙周炎患者和牙周健康者的唾液样本各1 mL,分别与0.5 mL Array Buffer 4反应液混合,使最终体积为1.5 mL。然后向其中加入15 μL Detection Antibody Cocktail,混匀该混合液,在室温下孵育1 h。
移出4-Well-Multi-dish底物盘中的Array Buffer 6反应液,将孵育好的混合液置入底物盘中,盖好盖子,然后在低温(2~8 ℃)、摇床上过夜(>12 h)孵育。
用镊子将芯片膜从底物盘里取出,置于一个新的塑料盘中(提前加入20 mL 1×Wash Buffer),在摇床上清洗10 min,重复此步骤,共3次。同时将4-Well-Multi-dish底物盘用蒸馏水清洗并干燥。
按1︰2 000的比例,用Array Buffer 6反应液稀释Streptavidin-HRP。然后将2 mL稀释好的Streptavidin-HRP反应液加入清洁后的4-Well-Multi-dish底物盘里,用镊子将芯片膜再次置于底物盘中,盖好盖子后置于摇床上,在室温下孵育30 min。随后,将芯片膜取出、置于另一个含有20 mL的1×Wash Buffer的塑料盘里,在摇床上清洗10 min,重复此步骤,共3次。
用镊子从塑料盘里取出芯片膜,置于一片塑料薄膜上,并用吸水纸擦掉多余的Wash Buffer。然后在芯片膜上均匀滴加1 mL Chemi Reagen混合液(Reagen1与Reagen2以1︰1的比例)。于室温下孵育1 min之后,用另一片塑料薄膜覆盖芯片膜(注意排除两塑料薄膜间的气泡,以确保芯片膜在两塑料薄膜之间,且保持芯片膜与Chemi Reagen混合液的充分接触)。
将制作完成的薄膜片置于X射线摄影暗盒内,放入胶片,盖好暗盒,在X线下曝光10 min。X胶片经烘箱烘干后,采用CanoScan LiDE 700F扫描仪扫描,最后用ImageJ软件记录平均光密度值。
1.5 统计学处理
采用SPSS 19.0软件对数据进行统计学分析,根据资料类型采用one-way ANOVA检验,P<0.05为差异具有统计学意义。
2 结果
美国R&D Systems公司的人蛋白酶芯片试剂盒可以一次性检测34种蛋白酶(图1):去整合素金属蛋白酶(disintegrin and metalloproteinase,ADAM)8、ADAM9;含凝血酶敏感素基序的去整合素金属蛋白酶(a disintegrin and metalloproteinase with thrombospondin motifs,ADAMTS)1、ADAMTS13;cathepsin A、cathepsin B、cathepsin C、cathepsin D、cathepsin E、cathepsin L、cathepsin S、cathepsin V、cathepsin X/Z/P;激肽释放酶(kallikrein)3/前列腺特异抗原(prostate specific antigen,PSA)、kallikrein 5、kallikrein 6、kallikrein 7、kallikrein 10、kallikrein 11、kallikrein 13;MMP-1、MMP-2、MMP-3、MMP-7、MMP-8、MMP-9、MMP-12、MMP-13;蛋白酶(proteinase)3、尿激酶纤维蛋白溶酶原激活剂(uridylyl phosphate adenosine,uPA)/尿激酶(urokinase)、二肽基肽酶(dipeptidyl peptidase-Ⅳ,DPPIV)/CD26、脑啡肽酶(neprilysin)/CD10、早老素1(presenilin-1)、前蛋白转化酶(proprotein convertase)9。
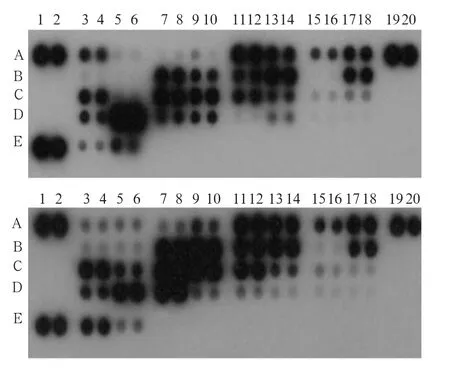
图 1 慢性牙周炎患者与牙周健康者的唾液蛋白酶谱比较Fig 1 Analysis of salivary protease spectrum between patients with chronic periodontitis and healthy people
蛋白酶谱和含量分析结果(图1、2)表明,慢性牙周炎患者和牙周健康者唾液蛋白酶的表达具有统计学差异。1)ADAM和ADAMST家族:慢性牙周炎患者唾液中ADAM8的表达高于牙周健康者(P<0.01),ADAM9、ADAMTS1、ADAMTS13的表达低于牙周健康者(P<0.01)。2)cathepsin家族:慢性牙周炎患者唾液中cathepsin B、E、L、V、X/Z/P的表达低于牙周健康者(P<0.05)。3)kallikrein家族:慢性牙周炎患者唾液中kallikrein 6、7、11、13的表达低于牙周健康者(P<0.05)。4)MMP家族:慢性牙周炎患者唾液中MMP-8和MMP-12的表达高于牙周健康者(P<0.01),MMP-9的表达低于牙周健康者(P<0.01)。5)其他:proteinase 3、presenilin 1和proprotein convertase 9的表达低于牙周健康者(P<0.01),neprilysin/CD10、uPA/urokinase的表达高于牙周健康者(P<0.01)。
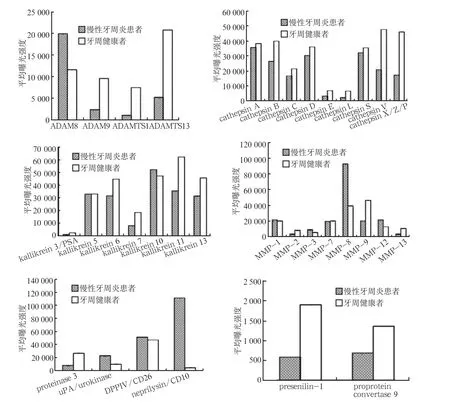
图 2 34种蛋白酶的表达分析Fig 2 Analysis of expression of 34 proteases
3 讨论
人类对唾液的研究已有悠久的历史。由于唾液的来源与组成复杂,其生理学、临床学意义等近年来才受到密切关注[8]。唾液研究之所以成为热点,主要源于其简单无创的采集方式;同时,与血液采集相比,唾液的采集方式对受检者和检验者来说都是相对安全的;而且其贮存也十分简易经济。这些优点都使唾液受到临床及科研人员的青睐[9-11]。随着检测技术的不断更新与提升,研究[5-8]表明,全面、综合的唾液分析对口腔及全身疾病的生理研究、病理分析和诊断都有很大的帮助。
蛋白酶是水解蛋白肽键的一类酶的总称。它通过裂解连接氨基酸的肽键,分离水解蛋白质,进而调节改变蛋白的生物学功能[4-5]。慢性牙周炎是宿主针对牙周致病菌感染所发生的慢性炎症反应性疾病,以牙周支持组织的破坏、降解为主要的病理特征。MMP和cathepsin均不同程度参与了牙周支持组织的降解过程,与慢性牙周炎的发生发展密切相关。其他唾液蛋白酶与慢性牙周炎的关系还有待进一步研究发现。
本研究显示,慢性牙周炎患者和牙周健康者的唾液蛋白酶表达具有差异性:慢性牙周炎患者唾液中ADAM8、MMP-8、MMP-12、neprilysin/CD10、uPA/urokinase的表达高于牙周健康者(P<0.01);ADAM9,ADAMTS1,ADAMTS13,cathepsin B、E、L、V、X/Z/P,kallikrein 6、7、11、13,MMP-9,proteinase 3,presenilin-1和proprotein convertase 9的表达低于牙周健康者(P< 0.01)。
proteinase 3属于PMNs的蛋白酶,即糜蛋白酶家族中的丝氨酸蛋白酶,主要储存于中性粒细胞。研究[12-13]指出,proteinase 3与一些炎性及非炎性疾病相关,其在感染性肺炎中发挥一定的抗菌作用,同时也在肾小球肾炎、关节炎、天疱疮等非感染性疾病中发挥着重要作用。本课题组[14]研究发现,无龋儿童唾液中的proteinase 3浓度明显高于低度或重度龋病患儿。慢性牙周炎患者唾液中proteinase 3的降低机制尚不清楚,有待进一步阐明。
ADAM家族[15]是近年来发现的一类锚定于细胞膜的细胞表面蛋白家族,该家族成员具有显著的结构特点:即含有4个较为保守的潜在功能域——蛋白水解域、粘连域、融合域和胞内信号域。从这些蛋白的结构域来看,其可能在胞外基质的水解、细胞—细胞、细胞—基质的粘连、细胞融合以及信号转导等细胞功能活动中发挥着重要作用。ADAM家族广泛参与各种生理活动,如组织形成、伤口愈合等;同时也参与肿瘤的形成、转移等病理过程,如ADAM8、ADAM9在肿瘤的发生发展、转移中起着重要作用。ADAMTS[16]属于金属蛋白水解酶家族成员,在人类基因组中已有19个ADAMTS家族成员被发现。ADAMTS基因的缺失、突变及其蛋白的过表达均可导致多种疾病的产生,如:ADAMTS1以及ADAMTS13的异常表达、活性下调与恶性肿瘤的侵袭、转移密切相关。慢性牙周炎患者与牙周健康者唾液中ADAM家族的表达并不一致,其是否同MMP一样参与了牙周支持组织的降解,这是一个很有意义的问题,其能否作为慢性牙周炎临床诊断和治疗监测的实验室生物标记物也需要进一步探索。
uPA/urokinase[17]是一种丝氨酸蛋白酶,由成纤维细胞、单核细胞、中性粒细胞、上皮细胞、肿瘤细胞等合成。慢性牙周炎患者唾液中uPA升高可能是由牙周致病菌所引起的宿主免疫反应导致的。
neprilysin/CD10[18]是一种内源性阿片肽,各种内源性阿片肽与疼痛调控的关系都是当前研究的热点。国内外大量文献报道了牙髓疼痛与脑啡肽酶的关系,而目前尚无脑啡肽酶与慢性牙周炎关系的相关报道。
kallikrein是激肽系统的主要限速酶,是一组存在于多数组织和体液中的丝氨酸蛋白酶。激肽释放酶-激肽系统作为内源性多酶系统,参与调控心血管、神经系统等的生理功能,与心脏病、肾病、炎症反应、癌症等疾病的发生密切相关[19-20]。研究[21]表明,kallikrein4在釉质的分泌、成熟过程中扮演着重要作用,其基因突变或缺失将导致釉质发生不全。kallikrein在慢性牙周炎患者的唾液中表达明显降低,是否与其对牙周组织血管的调控密切相关,这可能成为对牙周炎研究的又一突破。
本研究虽然发现慢性牙周炎患者与正常人唾液蛋白酶的表达存在显著差异,为研究蛋白酶与慢性牙周炎的关系开辟了更广阔的前景;但这些蛋白酶的差异表达是否与慢性牙周炎的发生发展相关,是否可以作为评估慢性牙周炎严重程度的新指标成为口腔及全身健康状态的新指标,目前都尚不明确。本课题组将进一步研究不同程度慢性牙周炎患者的唾液蛋白酶表达差异,深入发现慢性牙周炎发生发展过程中不同阶段的唾液蛋白酶表达差异及不同类型牙周炎患者的唾液蛋白酶表达差异,希望通过对唾液蛋白酶的分析检测为牙周炎的精确诊断、个性化治疗、疗效及预后评估提供更有效的辅助方法。
[1] Van Nieuw Amerongen A, Bolscher JG, Veerman EC. Salivary proteins: protective and diagnostic value in cariology [J]. Caries Res, 2004, 38(3):247-253.
[2] Chiappin S, Antonelli G, Gatti R, et al. Saliva specimen: a new laboratory tool for diagnostic and basic investigation [J]. Clin Chim Acta, 2007, 383(1/2):30-40.
[3] Helmerhorst EJ, Oppenheim FG. Saliva: a dynamic proteome [J]. J Dent Res, 2007, 86(8):680-693.
[4] Chaudhry AS. Comparing two commercial enzymes to estimate in vitro proteolysis of purifi ed or semi-purifi ed proteins[J]. J Anim Physiol Anim Nutr (Berl), 2005, 89(11/12): 403-412.
[5] Boudida Y, Gagaoua M, Becila S, et al. Serine protease inhibitors as good predictors of meat tenderness: which are they and what are their functions[J]. Crit Rev Food Sci Nutr, 2016, 56(6):957-972.
[6] Lima DP, Diniz DG, Moimaz SA, et al. Saliva: refl ection of the body[J]. Int J Infect Dis, 2010, 14(3):e184-e188.
[7] Armitage GC. Development of a classifi cation system for periodontal diseases and conditions[J]. Ann Periodontol, 1999, 4(1):1-6.
[8] Schipper RG, Silletti E, Vingerhoeds MH. Saliva as research material: biochemical, physicochemical and practical aspects [J]. Arch Oral Biol, 2007, 52(12):1114-1135.
[9] Smith GA, Riedford K. Epidemiology of early childhood caries: clinical application[J]. J Pediatr Nurs, 2013, 28(4): 369-373.
[10] Ng MW, Ramos-Gomez F, Lieberman M, et al. Disease management of early childhood caries: ECC collaborative project[J]. Int J Dent, 2014, 2014:327801.
[11] Ng MW, Ramos-Gomez F. Disease prevention and management of early childhood caries[J]. J Mass Dent Soc, 2012, 61(3):28-32.
[12] Guarino C, Legowska M, Epinette C, et al. New selective peptidyl di(chlorophenyl) phosphonate esters for visualizingand blocking neutrophil proteinase 3 in human diseases[J]. J Biol Chem, 2014, 289(46):31777-31791.
[13] Rao NV, Wehner NG, Marshall BC, et al. Characterization of proteinase-3 (PR-3), a neutrophil serine proteinase. Structural and functional properties[J]. J Biol Chem, 1991, 266 (15):9540-9548.
[14] Yang TY, Zhou WJ, Du Y, et al. Role of saliva proteinase 3 in dental caries[J]. Int J Oral Sci, 2015, 7(3):174-178.
[15] 蔡静莉, 杨凌峰, 王蓉, 等. ADAM家族研究进展[J]. 国外医学分子生物学分册, 2000, 22(4):197-201.
Cai JL, Yang LF, Wang R, et al. Research progress of ADAM family[J]. J Med Mol Biol, 2000, 22(4):197-201.
[16] 郭丽丽, 郭胜利, 郭炜. ADAMTS家族在肿瘤中的研究进展[J]. 医学综述, 2015, 21(11):1975-1979.
Guo LL, Guo SL, Guo W. Research progress of a disintegrin and metalloproteinase with thrombospondin family in tumor [J]. Med Recapitul, 2015, 21(11):1975-1979.
[17] Inuzuka K, Ogata Y, Nagase H, et al. Signifi cance of coexpression of urokinase-type plasminogen activator, and matrix metalloproteinase 3 (stromelysin) and 9 (gelatinase B) in colorectal carcinoma[J]. J Surg Res, 2000, 93(2):211-218.
[18] 华小川, 赖文莉. 脑啡肽及其与牙疼痛关系的研究进展[J]. 国际口腔医学杂志, 2007, 34(3):197-199.
Hua XC, Lai WL. Development of research of enkephalin in tooth pain[J]. Int J Stomatol, 2007, 34(3):197-199.
[19] 李磊, 李岩. Kallikrein 10的调控机制及其肿瘤临床应用的价值[J]. 中国肿瘤生物治疗杂志, 2014, 21(1):109-113.
Li L, Li Y. Regulatory mechanisms and clinical application values of kallikrein 10 gene in cancer[J]. Chin J Cancer Biother, 2014, 21(1):109-113.
[20] Pan W, Zhu P, Huizhen YU. Advances in tissue kallikrein and TIMP on vascular remodeling[J]. Adv Cardiovasc Dis, 2014, 35(4):498-503.
[21] 王光平, 李明霞, 刘建国. 激肽释放酶4与釉质发生不全[J]. 国际口腔医学杂志, 2013, 40(4):537-539.
Wang GP, Li MX, Liu JG. Kallikrein 4 and amelogenesis imperfecta[J]. Int J Stomatol, 2013, 40(4):537-539.
(本文编辑 李彩)
Analysis of salivary protease spectrum in chronic periodontitis
Li Qian, Zhou Xuedong, Fan Yaping, Yang Tengyu, Wu Songtao, Yu Yu, Chen Jiao, Zhang Ping, Feng Yun. (State Key Laboratory of Oral Diseases, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China)
Supported by: The National Natural Science Foundation of China (81372892); Sichuan Province Science and Technology Innovation Team Program (JCPT 2011-9).
Objective This study aimed to investigate the difference in salivary protease expression in patients with chronic periodontitis and normal individuals. Methods The stimulating saliva in patients with chronic periodontitis and normal individuals were collected. Protein chip technology was adapted to analyze salivary protease spectrum. Results Among the 34 proteases in the chip, disintegrin and metalloproteinase (ADAM)8, matrix metalloproteinase (MMP)-8, MMP-12, neprilysin/ CD10, and uridylyl phosphate adenosine/urokinase showed a signifi cantly increased concentration in the saliva of chronic periodontitis patients compared with those in the saliva of normal individuals (P<0.01). By contrast, the concentrations of ADAM9, a disintegrin and metalloproteinase with thrombospondin motifs (ADAMTS)1, ADAMTS13, cathepsin B, E, L, V, X/Z/P, kallikrein 6, 7, 11, 13, MMP-9, proteinase 3, presenilin-1, and proprotein convertase 9 sharply decreased (P<0.05). Conclusion The results demonstrated that protease spectrum in the saliva of chronic periodontitis patients and normal individuals signifi cantly differed. Analysis of salivary protease spectrum is a potential clinical method to examine, diagnose, and monitor chronic periodontitis.
saliva; chronic periodontitis; protease spectrum
R 781.4
A
10.7518/hxkq.2017.01.005
2016-02-16;
2016-06-10
国家自然科学基金(81372892);四川省科技厅平台建设项目(JCPT 2011-9)
李倩,硕士,E-mail:996462491@qq.com
冯云,副教授,博士,E-mail:953463551@qq.com
Correspondence: Feng Yun, E-mail: 953463551@qq.com.

