贝伐珠单抗不良反应的文献计量分析
余文韬,王怡鑫,蒋 刚(四川省肿瘤医院药学部,成都 610041)
贝伐珠单抗不良反应的文献计量分析
余文韬*,王怡鑫,蒋 刚#(四川省肿瘤医院药学部,成都 610041)
目的:对贝伐珠单抗在临床应用的安全性进行评价,为其临床合理、安全使用提供参考。方法:利用文献计量分析的方法,以“贝伐单抗”“贝伐珠单抗”“安维汀”“不良反应”“Avastin”“Bevacizumab”“Adverse reaction”为关键词,检索PubMed、Ovid、Web of Science、中国期刊全文数据库、维普和万方数据库自建库起至2015年12月收录的文献。采用EndNote X7软件对检索到的文献进行去重、分类,利用Excel 2007软件对纳入文献的发表时间、发表国家、适应证、药品不良反应(ADR)累及器官/系统及临床表现进行分析。结果:共纳入文献240篇,其中论著199篇、综述19篇、病例报道22篇。贝伐珠单抗用于恶性实体瘤时常见的ADR有高血压、出血、动脉/静脉血栓、蛋白尿等,与说明书相符;而说明书中记载的常见ADR腹泻、便秘未见相关报道;此外,心力衰竭可能是被忽略的严重的ADR。大剂量是发生高血压的高危因素;肿瘤部位和类型与出血的风险相关;高龄和血栓病史是发生血栓的高危因素。在超适应证用于眼部新生血管疾病时的ADR包括角膜擦伤、晶状体损伤、眼内炎、眼压升高、视网膜脱落和葡萄膜炎等。结论:临床医师、药师在选择贝伐珠单抗治疗相关疾病时应排除使用该药可能发生严重的ADR的高危人群,并对其常见的ADR进行合理监测,选择合适的剂量和疗程,发生ADR时要及时正确地处理。
贝伐珠单抗;文献计量分析;药品不良反应
贝伐珠单抗(Bevacizumab)于2004年经美国食品与药物管理局(FDA)批准上市,是首个应用于临床的与血管内皮生长因子(VEGF)结合的重组人源化单克隆抗体[1]。2010年,贝伐珠单抗在我国上市,其主要适应证为转移性结直肠癌,上市以来被广泛应用于临床,目前在抗肿瘤领域取得了良好的治疗效果,但其价格昂贵,且临床上对其药品不良反应(ADR)的了解有限。现阶段上市后ADR的评价主要来自两个方面:一是药品生产企业、药品经营企业和医疗机构上报的ADR;二是来源于发表的文章,包括临床试验、ADR个案报道和案例系列报道等[2]。本研究采用第二类资源,利用文献计量学[3]的方法系统检索与贝伐珠单抗ADR相关的文献,对贝伐珠单抗的安全性进行整体评价,对其ADR发生的可能机制、危险因素、处理措施及防治方法等进行分析,以期为其临床合理、安全使用提供参考。
#通信作者:主任药师。研究方向:医院药学。电话:028-85420338。E-mail:jiang379@139.com
1 资料与方法
1.1 文献检索
检索时间从建库起至2015年12月,包括PubMed、Ovid(SP)、Web of Science、中国期刊全文数据库(CJFD)、万方数据库和维普数据库。检索词包括“贝伐单抗”“贝伐珠单抗”“安维汀”“不良反应”“Avastin”“Be-vacizumab”“Adverse reaction”等。
1.2 文献筛选与分析
对检索出的文献采用EndNote X7软件进行数据库内去重,再通过阅读摘要由两人筛选、分类整理。文献纳入标准:贝伐珠单抗ADR相关的全部论著、综述和病例报道;文献排除标准:无关的文献、信件、会议摘要等。采用Excel 2007软件建立评价数据库,分析文献的总体分布情况、发文量前10位的国家、适应证的分布、ADR累及器官/系统及临床表现和防治措施等。
2 结果
2.1 文献检索情况
在英文数据库检索出相关文献465篇,其中PubMed 98篇、Ovid 223篇、Web of Science 144篇,经人工去重及排除不符合纳入标准的文献后,最终纳入85篇,包括论著55篇、综述9篇和病例报道21篇。在中文数据库检索出相关文献251篇,其中CJFD 45篇、万方数据库155篇、维普数据库51篇,最终纳入文献155篇,包括论著144篇、综述10篇和病例报道1篇。
2.2 文献发表时间分布
国外的首篇英文文献发表于2007年,文献发表数量在2010年显著上升,在2013年达到高峰。国内首篇文献发表于2005年,文献发表数量同样在2010年显著上升,与贝伐珠单抗于2010年正式通过原国家食品与药品监督管理局(CFDA)批准相符,在2012年达到高峰。文献发表时间分布见图1。

图1 文献发表时间分布Tab 1 Distribution of publication time of literatures
2.3 发文量前10位的国家
我国的发文量远超其他国家,与我国人口基数大、肿瘤患者多、医疗从业人员多直接相关。但我国发表的文章中仅有3篇被科学引文索引数据库(SCI)收录,故若以SCI收录的统一标准进行发文量的比较,我国的发文量与印度、土耳其、以色列和加拿大并列。发文量前10位的国家统计见表1。
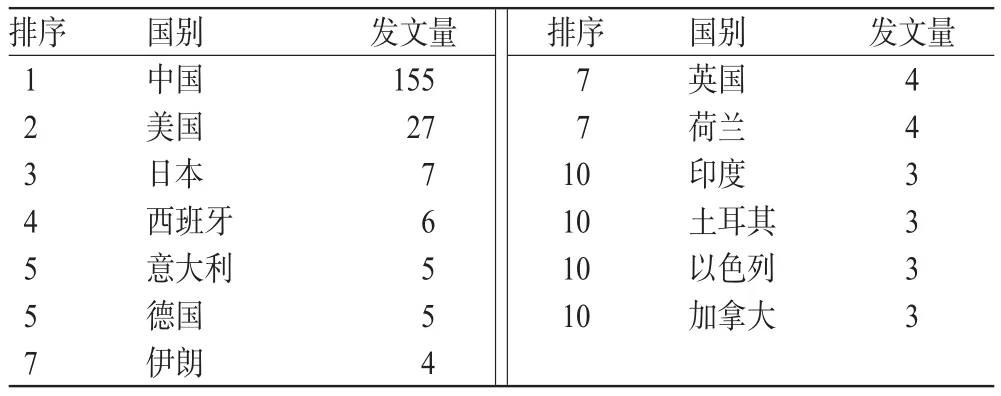
表1 发文量前10位的国家统计(篇)Tab 1 Top 10 countries in the list of published papers number(prece)
2.4 贝伐珠单抗临床适应证分布
199篇论著中有184篇涉及单一的适应证,具体见表2(表中CNV为脉络膜新生血管;RNV为视网膜新生血管)。目前FDA发布的贝伐珠单抗说明书的适应证包括:转移性结直肠癌、非鳞癌的非小细胞肺癌、多形性胶质母细胞瘤、难治性复发或转移的宫颈癌和转移的肾细胞癌,与纳入文献的适应证分布基本一致。对于三阴乳腺癌的治疗,由于贝伐珠单抗不能延长该类患者总生存期(OS)而被美国FDA撤回了该适应证。对于贝伐珠单抗治疗卵巢癌的前瞻性研究国内外几乎同步。国内有将贝伐珠单抗应用于胃癌的相关研究,国外并未发现相关报道。近2年来,国内数个研究将贝伐珠单抗尝试用于治疗恶性胸腹腔积液,纳入文献都报道了显著的有效性和可以耐受的ADR,国外并无相关研究,笔者分析可能与其经济效应有关。另外,国内外采用玻璃体内注射贝伐珠单抗治疗眼部新生血管疾病的前瞻性试验也早在2006年就有报道[3],但是由于是侵袭性操作且ADR不确切,一直仅处在研究阶段[4]。
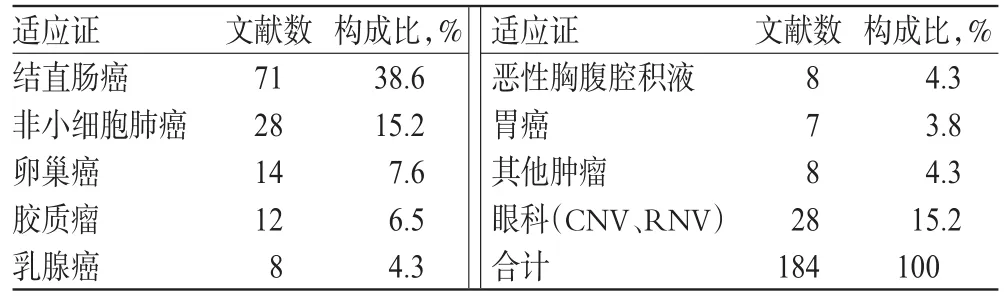
表2 贝伐珠单抗临床适应证分布Tab 2 Distribution of clinical indications of bevacizumab
2.5 ADR累及器官/系统及临床表现
ADR累及器官/系统及临床表现见表3。表3虽不能精确反映各ADR的发生率,但对发现新的ADR和说明书中未提及的常见的ADR有一定意义。如贝伐珠单抗说明书提到便秘、腹泻是非常常见的ADR,但在所纳入的文献中几乎未提及;说明书中缺乏对心血管系统相关ADR的描述,但根据本研究,心力衰竭、心律失常等在纳入文献中的提及率分别为11.8%、6.8%。

表3 ADR累及器官/系统及临床表现Tab 3 Organs/system involved in ADR and clinical manifestations
3 讨论
3.1 用于恶性实体瘤时的ADR
3.1.1 高血压 所有用贝伐珠单抗联合或不联合化疗方案治疗实体瘤的临床试验都报道了高血压的发生,其发生率为8%~29%,3级高血压的发生率在11%左右。贝伐珠单抗引起高血压发生的可能机制:一是减少内皮细胞一氧化氮的含量,降低外周血管密度从而引起血管收缩;二是增加血管壁通透性,从而增加血容量,导致血压升高[5]。患者在接受贝伐珠单抗第1次治疗后发生血压升高的比例较低,一般在治疗开始后的4~12个月发生率较高。另外,刘贤忠等[6]的Meta分析研究表明,剂量分别为7.5 mg/kg和15 mg/kg的两组患者,高剂量组发生高血压的相对风险比更大(P<0.05);Ahmadizar F等[7]纳入了44个随机对照试验(RCTs)的Meta分析得出了相同的结论。但是我国的用药剂量相对欧美各国偏低,通常是5 mg/kg或10 mg/kg,每2周1次。综上,在使用较大剂量的贝伐珠单抗时更应警惕患者发生高血压的ADR。
相关处理及用药监测:对于有高血压病史的患者保证患者的血压控制在150/100 mmHg(1 mmHg=0.133 kPa)以下。对于治疗期间出现了高血压的患者应在每次给药期间监测血压,并监测肾功能,同时根据临床情况给予降压药物;虽然没有特别的推荐,但是根据降压药物的机制,血管紧张素转换酶抑制剂可抑制纤溶酶原激活物质抑制因子的表达,且对蛋白尿有治疗作用,可以考虑优先选择。如果患者出现2~3级高血压应暂停用药,同时给予降压药,待血压恢复到治疗前水平,若治疗1个月仍未控制,则不应该再使用贝伐珠单抗[8]。
3.1.2 蛋白尿 蛋白尿的发生率为18%~41%,治疗肾癌时发生率更高。蛋白尿发生的原因包括:抑制肾小球脏层上皮细胞VEGF的表达,导致肾小球滤过膜的通透性增高;引起肾小球微血管血栓的形成,导致肾小球内压增高、滤过膜的通透性增加[9]。
相关处理及用药监测:大多数研究认为此损伤是可逆的,故可在治疗期间监测尿常规,如果尿蛋白结果是++,则应行24 h尿蛋白的定量检查,定量结果>2 g则暂停治疗,至尿蛋白<1 g/24 h再恢复贝伐珠单抗的治疗,但如发生肾病综合征(CTC-4级蛋白尿),则应永久停用贝伐珠单抗[10]。
3.1.3 出血 出血的发生率为20%~60%,且有因出血发生的死亡病例。临床表现主要为皮肤、黏膜出血,以鼻出血最为常见[11]。既往研究显示,肺鳞癌、既往有出血病史的患者使用贝伐珠单抗后出血风险高,目前已不推荐贝伐珠单抗用于此类人群。使用贝伐珠单抗引起出血的机制与肿瘤靠近大血管、肿瘤的坏死、肿瘤的病理类型、空洞的形成相关[12]。患者用药前应先对肿瘤的病理类型、位置、浸润深度进行充分的评估。另外,对于有中枢神经系统转移的患者,如需使用贝伐珠单抗,应先行手术或放疗的预处理,以降低出血的风险[13]。
3.1.4 血栓 贝伐珠单抗引起血栓的发生率为3%~19%,包括静脉血栓(深静脉血栓、肺栓塞)和动脉血栓(脑血管事件、心肌梗死)。根据纳入文献,结直肠癌患者为恶性肿瘤中静脉血栓发生率最高的,可达19%;而肾癌患者的静脉血栓发生率最低,为3%。而且,有动脉血栓史或年龄>65岁的患者,发生动脉血栓的风险增高。
相关处理及用药监测:有Meta分析表明,应用贝伐珠单抗治疗期间使用小剂量的阿司匹林不会增加患者的出血风险,且可预防动脉血栓的形成[14]。但贝伐珠单抗治疗期间若出现任何级别的动脉血栓都应该永久停用贝伐珠单抗。若发生静脉血栓,应给予低分子肝素钠治疗5~10 d,并监测患者凝血功能及国际标准化比值(INR)[15]。
3.1.5 其他 胃肠道穿孔:其发生率与贝伐珠单抗说明书相符,但是发生后死亡率较高。根据纳入文献,胃肠道穿孔可以发生在胃、小肠或结肠的任何一个部位,发生率为0.3%~11.4%,可能与肿瘤类型、肿瘤生长的部位有关。卵巢癌患者使用贝伐珠单抗后胃肠道穿孔的发生率最高,为11.4%;乳腺癌患者胃肠道穿孔的发生率最低,为0.3%。另外,确定的高危因素包括:较高的剂量、肿瘤沿肠道生长、既往有放疗的炎性反应、手术或内镜检查对胃肠道有创伤[16]。故在使用贝伐珠单抗前应对以上情况进行评估,避免发生严重的胃肠道穿孔。
心脏毒性:主要表现为充血性心力衰竭,发生率<2%。在贝伐珠单抗应用最广的结直肠癌患者中未发生心脏相关ADR;发生心脏毒性的人群主要集中在乳腺癌患者,这与其使用蒽环类、紫杉类化疗药物相关。另外,有充血性心力衰竭病史和胸部放疗病史的患者也是高危人群。
对于术后伤口并发症目前已形成共识:术后>4周再使用贝伐珠单抗不会影响伤口的愈合,使用贝伐珠单抗>4周后再行手术也不会影响伤口的愈合[17]。另外,国内外文献都有报道的罕见ADR包括乏力、管瘘和过敏反应等。而仅国外文献报道的ADR还包括口腔黏膜炎、皮疹、可逆性后脑白质病综合征、下颌骨坏死和厌食等。
3.2 用于眼部新生血管疾病时的ADR
VEGF除了分布于人体各种组织以外,在眼部、视网膜周细胞、色素上皮细胞、内皮细胞和神经节细胞等也均有分布,其过度的表达会促进血管的异常增生,从而引起相关的眼部疾病[18]。贝伐珠单抗为血管内皮生长因子受体(VEGFR)抑制剂,因此根据其机制可用于治疗血管异常增生的眼部疾病。目前的临床研究表明,使用贝伐珠单抗玻璃体内注射短期内是较安全的[19],且对于CNV、RNV已观察到显著疗效,但是这一有创操作潜在的ADR和远期的后遗症都尚待明确,故贝伐珠单抗治疗眼部新生血管疾病仍属于超说明书用药[20]。根据本研究纳入的文献,贝伐珠单抗玻璃体内注射后眼部ADR有角膜擦伤、晶状体损伤、眼内炎、眼压升高、视网膜脱落、葡萄膜炎、白内障进展、急性视力下降、视网膜中央动脉阻塞、视网膜下出血和视网膜色素上皮撕裂等;其他ADR包括血压增高和急性缺血性心脏病发作等[21]。
4 结语
目前,对于药品上市后的安全性研究方法较局限,数据来源一方面主要是依据来自各省市ADR监测中心自愿上报的ADR报告,但此数据存在少报、漏报的情况;另一方面是来源于大量发表的文献中,包括临床试验、个案报道、案例系列报道,对前者所得的信息可形成更全面的补充。本研究采用文献计量综合分析的方法,纳入了国内外与贝伐珠单抗ADR相关的包括论著、综述和病例报道的所有文献,对贝伐珠单抗的安全性进行了较全面的概括。
根据本研究可知,虽然国内相关文献数量多,但国外报道的ADR种类和个案数都远超国内,故本研究得到某些ADR的发生率与国外有差异,提示我国临床医师、药师应更仔细地观察,并及时上报新的ADR。在采用贝伐珠单抗治疗之前,临床医师、药师应对患者的既往病史和现病史进行充分的了解,以排除使用该药可能发生严重ADR的高危人群,并对常见的ADR进行合理监测和规避,选择合适的剂量和疗程,发生ADR时应及时、正确地处理,以确保用药安全、有效、经济。
[1] Ferrara N.Vascular endothelial growth factor:basic science and clinical progress[J].Endocr Rev,2004,25(4):581-611.
[2] Almenoff JS,Pattishall EN,Gibbs TG,et al.Novel stastistical tools for monitoring the safety of marketed drugs [J].Clin Pharmacol Ther,2007,82(2):157-166.
[3] Peng R,Qin G,Li X,et al.Sub-bleb injection of bevacizumab in treatment of littering bleb neovascularization[J]. Int J Ophthalmol,2006,10(3):556-557.
[4] Micieli JA,Micieli A,Smith AF.Identifying systemic safety signals following intravitreal bevacizumab:systematic review of the literature and the Canadian Adverse Drug Reaction Database[J].Can J Ophthalmol,2010,45(3):231-238.
[5] Higa GM,Abraham J.Biological mechanisms of bevacizumab-associated adverse events[J].Expert Rev Anticancer Ther,2009,9(7):999-1007.
[6] 刘贤忠,徐志波,张先元,等.贝伐单抗联合铂类治疗晚期非小细胞肺癌疗效与安全性的Meta分析[J].中国现代应用药学,2015,32(11):1382-1388.
[7] Ahmadizar F,Onland-Moret NC,de Boer A,et al.Efficacy and safety assessment of the addition of bevacizumab to adjuvant therapy agents in cancer patients:a systematic review and meta-analysis of randomized controlled trials [J].PLoS One,2015,10(9):6104-6105.
[8] Dincer M,Altundag K.Angiotensin-converting enzyme inhibitors for bevacizumab-induced hypertension[J].Ann Pharmacother,2006,40(12):2278-2279.
[9] Shord SS,Bressler LR,Tiernery LA,et al.Understanding and managing the possible adverse effects associated with bevacizumab[J].Am J Health Syst Pharm,2009,66(11):999-1013.
[10] Crino L,Dansin E,Garrido P,et al.Safety and efficacy of first-line bevacizumab-based therapy in advanced non-squamous no-small-cell lung cancer:a phase 4 study [J].Lance Oncol,2010,11(8):733-740.
[11]Miller KD,Chap LI,Holmes FA,et al.Randomized phaseⅢtrial of capecitabine compared with bevacizumab plus capecitabine in patients with previously treated metastatic breast cancer[J].J Clin Oncol,2005,23(4):792-799.
[12] Shepherd FA,Sridhar SS.Angiogenesis inhibitors under study for the treatment of lung cancer[J].Lung Cancer,2003,41(Suppl1):63-72.
[13] Leighl NB,Bennouna J,Yi J,et al.Bleeding events in bevacizumab-treated cancer patients who received fulldose anticoagulation and remained on study[J].Br J Cancer,2011,104(3):413-418.
[14] Mourad JJ,des Guetz G,Debbabi H,et al.Blood pressure rise following angiogenesis inhibition by bevacizumab:a crucial role for microcirculation[J].Ann Oncol,2008,19(5):927-934.
[15] Nalluri SR,Chu D,Keresztes R,et al.Risk of venous thromboembolism with the angiogenesis inhibitor bevacizumab in cancer patients:a meta-analysis[J].JAMA,2008,300(19):2277-2285.
[16] 陈乃兴,金科涛.贝伐单抗治疗卵巢癌的临床研究进展[J].中国药房,2012,23(10):934-936.
[17] Hapani S,Chu D,Wu S.Risk of gastrointestinal perforation in patients with cancer treated with bevacizumab:a meta-analysis[J].Lancet Oncol,2009,10(10):559-568.
[18] Sharma K,Marcus JR.Bevacizumab and wound-healing complications:mechanisms of action,clinical evidence,and management recommendations for the plastic surgeon [J].Ann Plas Surg,2013,71(4):434-440.
[19] Spitzer MS,Wallenfelsthilo B,Sierra A,et al.Antiproliferativeand cytotoxic properties of bevacizumab on different ocular cells[J].Br J Ophthalmo,2006,90(10):1316-1321.
[20] 何彬,马林昆,钟华.安维汀在眼科中的应用[J].昆明医学院学报,2012(S1):270-273.
[21] AI-Qureshi S,Shaikh S.Intravitreous bevacizumab adult safety data:the evidence so far[J].Clin Experimen Ophthalmol,2012,40(1):3-5.
(编辑:晏 妮)
Bibliometric Analysis of Bevacizumab-induced ADR
YU Wentao,WANG Yixin,JIANG Gang(Dept.of Pharmacy,Sichuan Tumor Hospital,Chengdu 610041,China)
OBJECTIVE:To evaluate the safety of clinical application of bevacizumab,and to provide reference for rational and safe use of it.METHODS:Using“beifa dankang”“beifazhu dankang”“anweiting”“buliang fanying”“Avastin”“Bevacizumab”“ADR”as keywords,literatures about bevacizumab-induced ADR were retrieved from PubMed,Ovid,Web of Science,CJFD,VIP,Wanfang database from the establishment of database to Dec.2015,all of which were collected and categorized by EndNote X7 software.Included literatures were analyzed by using Excel 2007 in respects of publication time and country,indications,organs/systems involved in ADR,clinical manifestations,etc.RESULTS:A total of 240 literatures were included.There were 199 original articles,19 reviews and 22 case reports.When bevacizumba was used for malignant solid tumor,the common ADRs were mainly hypertension,hemorrhage,thromboembolism,proteinuria,which were consistent with package inserts of bevacizumba.But the common ADRs diarrhea and constipation as the package inserts described were not found in the included literatures.In addition,heart failure may be a severe ADR which was neglected.High dose was risk factor of hypertension;the location and type of a tumor were associated with hemorrhage;advanced age and history of thrombosis were the risk factors of thromboembolism.ADRs induced by super-indication use of bevacizumab for ocular neovascularization were corneal abrasion,crystalline lens injury,endophthalmitis,increased intraocular pressure,ablatio retinae,uveitis,etc.CONCLUSIONS:When applying bevacizumab,clinical physicians and pharmacists should rule out the high risk population and strengthen ADR monitoring,select suitable dose and course and deal with ADR properly.
Bevacizumab;Bibliometric analysis;ADR
R969.3
A
1001-0408(2017)02-0190-04
2016-07-11
2016-09-02)
DOI10.6039/j.issn.1001-0408.2017.02.12
*药师,硕士。研究方向:临床药学。电话:028-85420311。E-mail:64187565@qq.com

