我院2 295例药品不良反应报告质量分析Δ
周歧骥,冉春艳,伍尚梅,刘承统,何思陆#,黄锁义(.右江民族医学院附属医院药剂科,广西百色5000;.桂林医学院药学院,广西桂林 54004;.右江民族医学院药学院,广西百色 5000)
·不良反应与监测·
我院2 295例药品不良反应报告质量分析Δ
周歧骥1*,冉春艳2,伍尚梅3,刘承统1,何思陆1#,黄锁义3(1.右江民族医学院附属医院药剂科,广西百色533000;2.桂林医学院药学院,广西桂林 541004;3.右江民族医学院药学院,广西百色 533000)
目的:了解我院药品不良反应(ADR)上报的总体质量,为进一步提高ADR报告质量、推进医院ADR监测工作提供数据支持。方法:收集我院2011年1月-2015年12月的ADR报告,分别从报告类型、监测期内药品(新药)与监测期外药品(老药)ADR报告情况、报告人职业、报告科室、ADR临床表现和原始报表缺项等方面进行统计分析。结果:共收集2 295例ADR,其中已知一般的ADR报告例数最多,共1 943例(占84.66%),新的严重的ADR报告仅有20例(占0.87%);老药引起的ADR共2 136例(占93.07%);报告人职业以护士为主,共1 999例(占87.10%),医师和药师分别占7.28%和5.62%;上报科室以门诊注射室为主,共1 473例(占64.18%),手术和非手术科室分别占15.08%和15.16%;ADR临床表现以已知的常见症状为主,共1 938例(占97.48%),罕见症状仅占2.52%;原始报表缺项项目以相关重要信息、ADR过程描述和关联性评价为主,分别占81.92%、69.19%和57.08%。结论:我院ADR报告总体质量不高。应改变当前ADR监测药师的工作模式,深入临床进行ADR报表核实、宣传,提高ADR报告的质量,并建立ADR上报长效机制。
药品不良反应;报告;质量;工作模式
近年来,随着国家药品不良反应(ADR)监测工作在法律法规、监测组织机构、监测队伍和评价能力等方面取得长足发展和进步[1],我院的ADR监测工作也逐渐步入正轨,ADR报告数量逐年快速增长,并多次获得省级及市级ADR监测机构的各项表彰及奖励。但笔者作为一名临床药师兼医院ADR监测员,在ADR监测实践过程中发现尚有不足之处,特别是存在ADR报告质量不高及ADR监测工作模式不完善等问题。国内多项研究也表明,ADR报告数量在逐年增加,但总体质量如资料的完整性、规范性、时效性、因果关系评价的准确性等还有待进一步提高[2-5]。而现阶段,医疗机构仍是我国ADR报告的主体[6],其报告质量是整个ADR监测体系质量的关键,医师、药师及护士的ADR监测和报告意识及其对ADR信息采集方法的掌握程度对医院ADR信息质量起着决定性的作用。因此,笔者对我院2011-2015年ADR报告的质量进行了分析和比较,为进一步提高ADR报告质量、推进医院ADR监测工作提供数据支持。
1 资料与方法
收集2011年1月-2015年12月我院成功上报的ADR报告共2 295份,分别从报告类型、监测期内药品(新药)与监测期外药品(老药)ADR报告情况、报告人职业、报告科室、ADR临床表现和原始报表缺项等方面进行分类统计,采用Excel 2007软件进行数据处理。
根据原国家食品药品监督管理局2007年颁布的《药品注册管理办法》,即:新药品种监测期自新药批准生产之日起计算,最长不得超过5年。本研究中,监测期内药品(新药)按批准文号计算上市<5年统计,监测期外药品(老药)按批准文号计算上市≥5年统计。
2 结果
2.1 ADR报告类型
ADR按严重程度及是否已知分为4种报告类型,分别为:已知一般的、已知严重的、新的一般的和新的严重的。2 295例中,涉及的ADR报告主要为已知一般的,共1 943例,占84.66%;新的一般的287例,占12.51%;已知严重的45例,占1.96%;新的严重的20例,占0.87%。我院2011-2015年ADR报告类型分布见表1。ADR报告和监测工作的主要质量指标之一是新的严重的ADR报告数[7]。由表1可见,我院近5年ADR报告中新的严重的ADR报告仅20例,最高年份2012年也仅9例,占相应年度的2.28%,远远低于世界卫生组织(WHO)的标准。

表1 我院2011-2015年ADR报告类型分布[例(%%)]Tab 1 Type distribution of ADR reports in our hospital from 2011 to 2015[case(%%)]
2.2 新药与老药ADR报告情况分布
2 295例ADR中,涉及新药64个品种、老药504个品种。由新药引起的ADR共159例,占6.93%;老药引起的ADR 2 136例,占93.07%,可见我院ADR报告主要以老药引起的ADR为主。我院2011-2015年新药与老药致ADR分布见表2。
2.3 ADR报告人职业分布
2 295例ADR报告中,护士上报1 999例,占总报告数的87.10%;医师上报167例,占7.28%;药师上报129例,占5.62%。可见,我院ADR报告上报人主要集中在护士,而医师和药师填报ADR报告的比例较低。我院2011-2015年ADR报告人职业分布见表3。
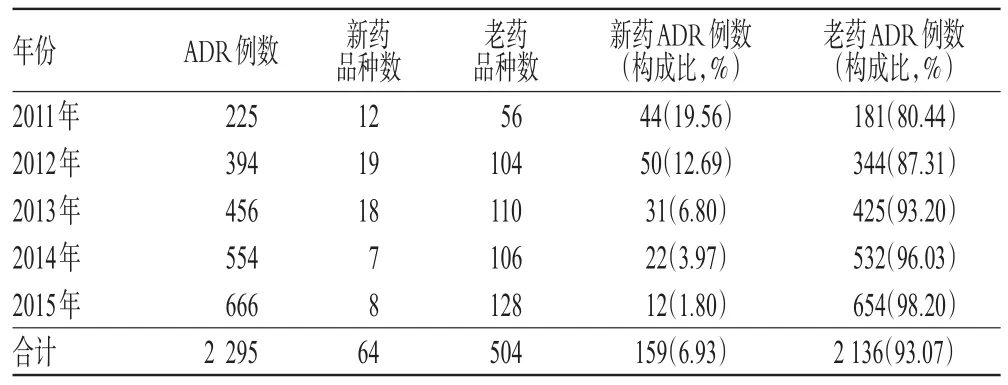
表2 我院2011-2015年新药与老药致ADR分布Tab 2 Distribution of new drugs and previous drugsinducedADR in our hospital from 2011 to 2015
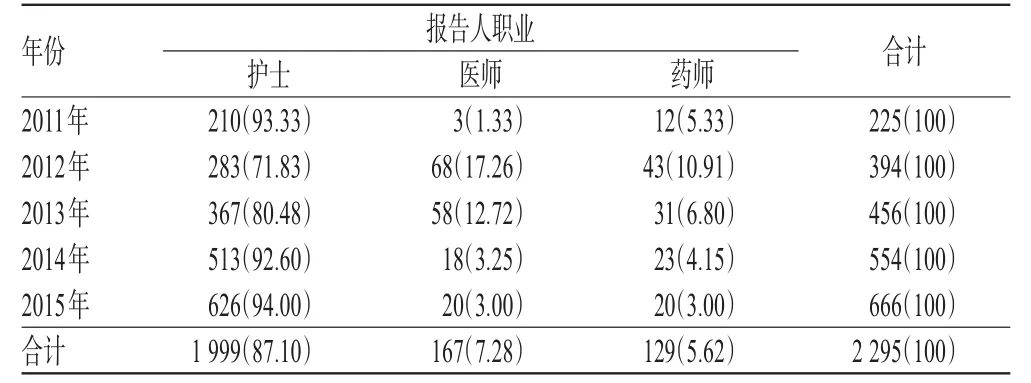
表3 我院2011-2015年ADR报告人职业分布[例(%%)]Tab 3 Distribution of occupational of ADR reporters in our hospital from 2011 to 2015[case(%%)]
2.4 ADR报告科室分布
我院ADR报告主要来源于门诊注射室,5年中门诊注射室ADR报告数占相应年度百分比最高达81.98%(2015年),最低年度也达到了41.62%(2012年),从2012年开始门诊注射室报告呈现逐年增长趋势。而手术科室、非手术科室最高仅为相应年度的23.25%(2013年)和29.19%(2012年),且总体呈降低趋势。药剂科上报数量最低,报告数占比最高仅为相应年度的10.91%(2012年)。我院2011-2015年ADR上报科室分布见表4。
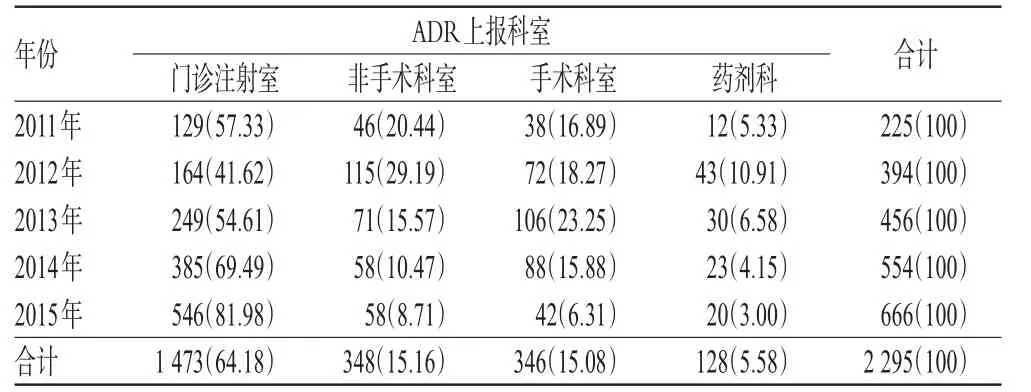
表4 我院2011-2015年ADR上报科室分布[例(%%)]Tab 4 Department distribution of ADR reports in our hospital from 2011 to 2015[case(%%)]
2.5 ADR的临床表现
根据ADR的临床表现,以药品说明书【不良反应】项下标注的常见症状(斑丘疹、皮疹、潮红、恶心、呕吐、腹痛、胸闷、头晕头痛、寒战、发热、口干、便秘、咳嗽、面色苍白、腹泻等)和罕见症状(白细胞减少、过敏性休克、剥脱性皮炎、椎体外系反应、肝功能异常、血管刺激性疼痛、飞蝇幻视、语言障碍、阴道出血等)为标准,将已知一般的和已知严重的ADR报告分为质量较高的罕见症状报告和质量一般的常见症状报告。统计显示,1 988例已知ADR报告中常见症状报告为1 938例,占97.48%;罕见症状报告仅为50例,占2.52%,且罕见症状报告所占比例总体呈下降趋势。我院2011-2015年ADR报告的临床表现分布见表5。
2.6 原始报表缺项情况
2 295份ADR原始报表的质量较差,报表中缺项项目较多,其中缺项比例最高的是相关重要信息(主要包括既往病史和过敏史等),共1 880例,占81.92%;其次为ADR过程描述,共1 588例,占69.19%;再次为关联性评价,共1 310例,占57.08%;除此之外,报告类型(占42.61%)、患者基本信息(占44.79%)、ADR结果(占47.19%)缺项比例均达到40%以上。我院2011-2015年ADR报告原始报表缺项统计见表6。
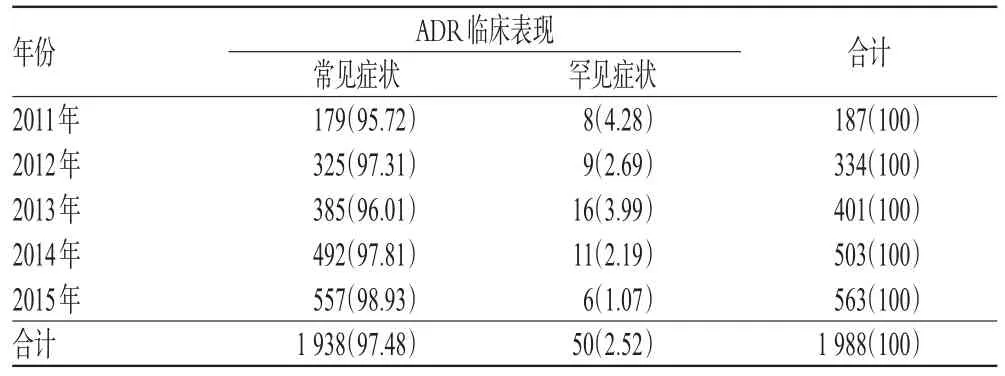
表5 我院2011-2015年ADR报告的临床表现分布[例(%%)]Tab 5 Distribution of clinical manifestations of ADR reports in our hospital from 2011 to 2015[case(%%)]
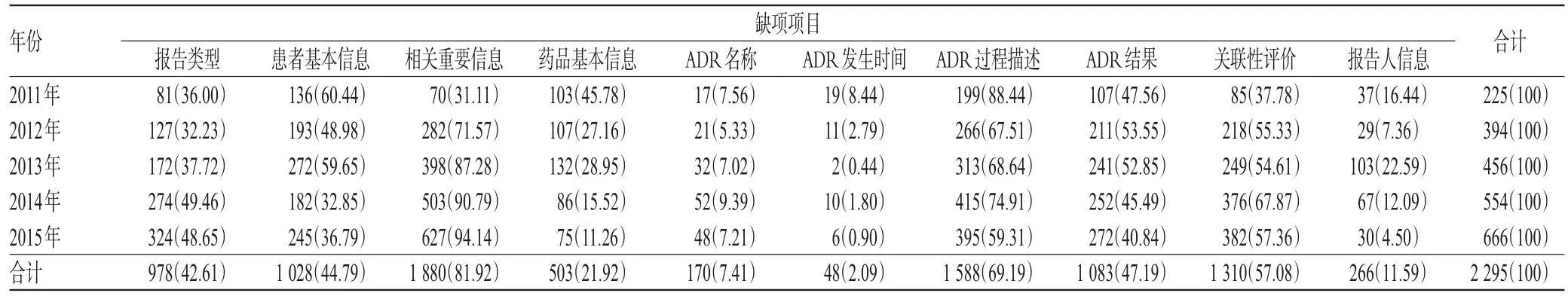
表6 我院2011-2015年ADR报告原始报表缺项统计[例(%%)]Tab 6 Original report missing items ofADR reports in our hospital from 2011 to 2015[case(%%)]
3 分析及讨论
3.1 ADR报告类型分析
由表1可见,我院上报的ADR报告中,新的、严重的报告仅占总数的15.34%,而根据WHO的标准,成熟的药品风险评估中心的ADR报告中,30%应为新的、严重的ADR报告[3],可见我院ADR报告远没有达到监测体系发现信号进而开展风险管理的要求。ADR监测意在重点发现新的、严重的病例,防范群体药害事件发生,严重病例的上报有助于ADR工作的开展和预防重大ADR的发生,我院ADR报告虽然具有一定的数量,但在报告的质量方面尚处于监测的初级阶段。
3.2 新药与老药ADR报告分析
我国《药品不良反应报告和监测管理办法》规定:新药监测期内的国产药品应当报告该药品的所有ADR;其他国产药品,报告新的和严重的ADR。众所周知,由于新药上市前安全性评价的局限,上市后的ADR监测尤为重要,国外新药上市后5年内发现严重的ADR而被撤市的案例时有发生,如美国默克公司生产的罗非昔布片在被批准上市5年时因严重的ADR而被撤市召回[8]。这就要求新药ADR报告必须占有一定的比例,而我院仍以重复报告监测期外老药引起的ADR为主,新药ADR报告越来越少,失去了重点监控新药ADR的功能。
3.3 ADR报告人职业分析
由表3可见,我院ADR报告人职业结构分布悬殊,大部分集中在护士,且护士ADR报告比例总体呈增长趋势,而医师和药师报告比例则有所下降。其原因可能有以下几点:(1)护士是患者用药后最直接的监测员,当患者用药后出现异常情况时,护士第一时间了解并记录,故护士上报的ADR报告多为用药之后不久出现的ADR。(2)医师的职业特点决定其主要关注临床疗效,而对临床较常见的ADR(如皮疹、静脉炎等)较少关注,认为是否上报影响不大。多项研究表明,临床医师对于ADR上报工作的总体认知度较低,特别是低年资、低职称医师的认知度整体上明显低于中高年资、中高级职称的医师,是造成目前医师ADR报告数量过少的原因[9-10]。(3)普通药师由于工作地点在药房,接触患者较少,无法及时观察到患者用药后的情况,而从事ADR监测及上报的临床药师数量有限,故造成药师ADR报告数量较少。
3.4 ADR报告科室分析
我院ADR报告主要来源于门诊注射室,而手术科室、非手术科室和药剂科ADR报告较少,且有进一步降低的趋势。其原因为我院注射室已经形成良好的ADR上报氛围,与主管ADR的药师交流较多,能够在ADR发生后及时地上报,而其他手术科室、非手术科室与药师交流较少,科主任或护士长不熟悉ADR,对ADR上报工作不够重视,医院对科室ADR没有具体的上报要求,加之填写ADR报告表格费时费力,久而久之就形成对ADR疏于管理的氛围,造成ADR上报数量越来越少。而药剂科上报数量最少,与医院药师的人数、职业特点、工作环境、意识等均有关。
3.5 ADR临床表现分布分析
ADR报告的目的之一是发现临床罕见的、新的ADR[11],而我院ADR报告仍以质量一般的常见症状报告为主,其原因可能为常见症状主要涉及皮肤及消化系统,发生ADR时症状明显,易于观察,与原患疾病容易区分,护士即可直接上报;而一些罕见的临床症状大多涉及血液系统、神经系统等,当发生ADR时,不易察觉且易与原患疾病混淆,需要医师分析确认后才能上报,而临床医师往往忙于日常工作,对ADR关注较少,即使发现了ADR也不一定上报,从而导致罕见ADR漏报情况的出现。
3.6 ADR原始报表缺项分析
《药品不良反应报告和监测管理办法》第15条规定:ADR报告的填报内容应真实、完整、准确。报表的完整不仅体现了病例报告的真实性和可追溯性,同时也有利于专业人员分析和评价ADR报表,从中提取有价值的安全性信号[4,12]。在2 295份ADR原始报表中,存在缺项的依次为相关重要信息、ADR过程描述、关联性评价等。说明我院护士、医师和药师在填写ADR报告时对报告项目的理解较差,对相关重要信息、过程描述、关联性评价、报告类型等信息的重要价值不理解,不会填写或不愿意花时间详细填写,许多信息依靠医院ADR监测药师从病历中查阅补充,而完善报表的药师不是第一线的上报人,对具体的ADR发生时间、症状、好转时间等不能掌握第一手资料,在资料缺乏的时候依靠经验上报,造成ADR报告与真实情况存在偏差的问题。
3.7 对ADR监测药师工作模式的思考
从以上分析可见,我院ADR报告质量较差,这与医师、护士对ADR的意识及信息采集方法的掌握程度直接有关,也与当前我院监测药师依旧遵循传统的工作模式间接相关。传统的ADR监测模式,ADR监测药师只负责完善医师、护士上报的ADR报表,不进入临床,与医师、护士不接触、不熟悉,对医师、护士的培训也仅限于每年1次的全院ADR培训,其效果甚微。而借鉴于我院ADR工作在门诊注射室取得的成功经验,笔者认为,首先监测药师应改变当前的工作模式,深入临床对ADR进行核实,直接对医师、护士进行针对性的培训和帮助;其次,普通药师应转变观念,提高对ADR的上报意识;再次,医院应在政策和经济上增加对该项工作的支持,例如给予一线上报的医师、护士及药师一定的经济鼓励,表彰先进ADR监测集体及个人等。
综上所述,我院ADR报告总体质量不高。ADR监测是一项利国利民的重要工作,基层的医务人员在提高ADR报告数量的同时,更应注重ADR报告的质量,而作为当前ADR监测工作主要力量之一的药师,应改变当前的工作模式,深入临床进行ADR报表核实、宣传,以提高ADR报告的质量,并建立ADR上报长效机制。
[1] 刘巍,李馨龄,程刚,等.我国药品不良反应报告质量评估现状的分析与思考[J].中国药物警戒,2014,11(9):561-566.
[2] 邵蓉,唐吉锋.我国药品不良反应监测体系实施效果评价[J].中国卫生政策研究,2014,7(8):29-36.
[3] 沙建萍,胡晋红,王卓,等.上海市药品不良反应监测系统中4 491份有效报告的分析[J].药学实践杂志,2007,25(4):257-260.
[4] 沈剑文,王大猷,张亮,等.上海市不同专业医务人员药品不良反应报告质量分析[J].中国药物警戒,2009,6(5):285-290.
[5] 刘均,杨世民,冯变玲,等.西安市医疗机构医务人员药品不良反应报告的质量分析[J].西北药学杂志,2012,27(3):263-266.
[6] 国家食品药品监督管理局.国家药品不良反应监测年度报告:2014年[EB/OL].(2015-07-17)[2016-06-10]. http://www.sda.gov.cn/WS01/CL0078/124407.html.
[7] 李小东.2006-2010年药品不良反应报告和监测工作质量评价[J].中国医院用药评价与分析,2012,12(2):165-168.
[8] 魏晶,潘卫三,杨悦.监测期内新药不良反应监测措施的研究[J].中国新药杂志,2009,18(5):393-395.
[9] 高璇,李智平.236家医院儿科医务人员自身因素对儿童不良反应上报率影响的探讨[J].中国药学杂志,2015,50(2):182-186.
[10] 范蓓蓓,苟小军,杨晓露,等.我院不同职业和职称医务人员对药品不良反应认知度调查[J].中国药房,2016,27(15):2024-2027.
[11] 侯荣华.187例新的/严重的药品不良反应报告分析[J].中国药房,2014,25(26):2460-2462.
[12] 丛骆骆,李虹耀,白羽霞.北京市药品不良反应监测数据报告质量评价[J].中国医药工业杂志,2015,46(6):653-657.
Quality Analysis of 2 295 Cases of ADR Reports in Our Hospital
ZHOU Qiji1,RAN Chunyan2,WU Shangmei3,LIU Chengtong1,HE Silu1,HUANG Suoyi3(1.Dept.of Pharmacy,the Affiliated Hospital of Youjiang Medical College for Nationalities,Guangxi Baise 533000,China;2.College of Pharmacy,Guilin Medical College,Guangxi Guilin 541004,China;3.College of Pharmacy,Youjiang Medical College for Nationalities,Guangxi Baise 533000,China)
OBJECTIVE:To investigate the overall quality of ADR report in our hospital,in order to further improve the quality of ADR report,promote the hospital ADR monitoring and provide data support.METHODS:ADR reports were collected from our hospital during Jan.2011-Dec.2015,and were analyzed statistically in respects of report type,ADR reports during monitoring period(new drugs)and outside monitoring period(previous drugs),reporter’s occupation,departments,ADR clinical manifestations and original report missing item,etc.RESULTS:A total of 2 295 cases of ADR were collected,the number of known general ADR reports were the most,being 1 943 cases(84.66%),but there were 20 cases of new severe ADR(0.87%);2 136 ADR cases were induced by previous drugs(93.07%).Most of reporters were nurse,including 1 999 cases in total(87.10%),and physicians and pharmacists accounted for 7.28%and 5.62%,respectively.More of reports were from outpatient injection room,including 1 473 cases in total(64.18%),and surgical and non-surgical departments accounted for 15.08%and 15.16%,respectively. ADR clinical manifestations were mainly common symptoms,involved in 1 938 cases(97.48%);only 2.52%were rare symptoms.The original report missing items mainly included relevant important information,the description of the ADR process and correlation evaluation,accounting for 81.92%,69.19%and 57.08%.CONCLUSIONS:On the whole,the quality of ADR reports in our hospital are poor.It is necessary to change the current ADR monitoring mode of pharmacists,check and propaganda ADR reports in the clinic,improve the quality of ADR reports and establish long-term mechanism of ADR reports.
ADR;Report;Quality;Working mode
R969.3
A
1001-0408(2017)02-0186-04
2016-06-20
2016-08-18)
(编辑:晏 妮)
广西高等教育创优计划项目
*主管药师,硕士。研究方向:临床药学、药品不良反应。电话:0776-2836240。E-mail:qijizhou1@126.com
#通信作者:副主任药师。研究方向:医院药学。电话:0776-2837654。E-mail:hesilu168@sina.com
DOI10.6039/j.issn.1001-0408.2017.02.11

