一株枯草芽孢杆菌噬菌体的生物学特性分析及抗性菌株的诱变筛选
刘秀侠 徐海燕 辛国芹 穆熙军 孙学森 谷巍
(山东宝来利来生物工程股份有限公司,泰安 271000)
一株枯草芽孢杆菌噬菌体的生物学特性分析及抗性菌株的诱变筛选
刘秀侠 徐海燕 辛国芹 穆熙军 孙学森 谷巍
(山东宝来利来生物工程股份有限公司,泰安 271000)
枯草芽孢杆菌工业生产发酵过程中经常出现噬菌体污染的问题,分离筛选以枯草芽孢杆菌为宿主菌的噬菌体,分析其生物学特性并采用自发突变方法筛选噬菌体抗性菌株。以枯草芽孢杆菌KC-260为宿主菌,从车间异常发酵液中分离纯化得到一株噬菌体,将其命名为P260,富集培养后测定效价,对其热稳定性、最佳感染复数、宿主范围、抑制剂和消毒剂耐受性等生物学特性进行了研究。为防治噬菌体P260的污染,利用自发突变的方法筛选对噬菌体P260有抗性的枯草芽孢杆菌突变菌。结果显示,分离纯化得到一株效价为3.45×1010PFU/mL的噬菌体P260,该噬菌体具有一定的宿主专一性,对凝结芽孢杆菌和短小芽孢杆菌不敏感。噬菌体P260在高温条件下很容易失活,不耐热,70℃处理15 min存活率下降极为明显;25 mg/L的ClO2对P260有极强的杀灭作用;0.5%的草酸铵和柠檬酸铵对该噬菌体有一定的抑制作用。P260感染宿主菌的最佳感染复数为0.01,增殖的潜伏期为15 min,45 min进入裂解期。通过自发突变的方法获得了抗噬菌体菌株ZF-260,发酵过程中添加噬菌体后ZF-260的生长不受影响,说明ZF-260是一株可以抗噬菌体P260的优良菌株。研究了噬菌体P260的生物学特性,获得了遗传稳定且活菌数高的抗性菌株ZF-260。
枯草芽孢杆菌;噬菌体;抑制剂;消毒剂;自发突变
枯草芽孢杆菌在目前工业微生物发酵方面具有较高的应用价值,是各种酶类的理想表达宿主[1]。但是,在枯草芽孢杆菌发酵过程中极易遭受噬菌体感染而使生产受到影响。噬菌体污染后难以治理,因此发酵过程中对噬菌体污染问题应综合防治、预防为主[2]。建立发酵车间内部及周边环境的常规定期消毒制度是枯草芽孢杆菌噬菌体污染的主要防治措施,Clevenger等[3]研究表明次氯酸盐、氯气等常规氯化消毒剂对枯草芽孢杆菌及其噬菌体有较好的灭活效果。陈卫团等[4]实验表明200 mg/L二氧化氯(ClO2)作用枯草芽孢杆菌黑色变种芽孢10 min杀灭对数值≥5.0。在噬菌体污染的发酵液中添加螯合剂或二价阳离子Ca2+、Mg2+等[5,6]可抑制噬菌体的侵染。选育防御噬菌体感染、繁殖和抗噬菌体的枯草芽孢杆菌突变菌株对于科学研究、医疗和工业应用方面有较为重要的意义[7]。
在枯草芽孢杆菌KC-260发酵生产过程中,活菌数下降、菌体裂解、菌液变澄清等异常现象时有出现。采用更换菌种和单纯的环境治理虽然在一定程度上可以减轻噬菌体污染的情况,但是却没有起到实质性的治理效果。为了对污染芽孢杆菌的噬菌体有进一步的详细了解,需要分离纯化感染芽孢菌的噬菌体,并对其生物学性质进行分析,以便有针对性地治理噬菌体污染问题。
本研究从异常发酵液中分离纯化得到一株噬菌体P260,对其生物学特性进行研究,并检测多种抑制剂、消毒剂对其抑制杀灭效果,同时采用自发突变的方法选育抗噬菌体菌株,以期在工业化生产过程中为噬菌体污染的防治提供参考依据。
1 材料与方法
1.1 材料
1.1.1 实验材料 枯草芽孢杆菌菌株KC-260、其他供试芽孢杆菌及噬菌体P260均由山东宝莱利生物工程公司分离并保存。
1.1.2 主要试剂 氢氧化钠(天津凯通化学试剂有限公司)、氯化钠(天津博迪化工股份有限公司)、蛋白胨(北京奥博星生物技术有限责任公司)、酵母浸膏(天津市英博生化试剂有限公司)等。
1.1.3 主要仪器 THZ-C恒温振荡器、 DHP-9012电热恒温培养箱、S22PC型可见分光光度计、GZX-9140MBE电热鼓风干燥箱、BCD-196TMPI冰箱、JJ300型电子天平等。
1.1.4 枯草芽孢杆菌培养基 酵母膏5 g/L、蛋白胨10 g/L、葡萄糖2 g/L、NaCl 10 g/L,调pH7.0;底层培养基为固体培养基(琼脂粉浓度为15 g/L),上层培养基为半固体培养(琼脂粉浓度为5 g/L)。
1.1.5 抑制剂溶液 500 mg/L苹果酸母液的配制方法为称取0.05 g苹果酸加到100 mL无菌水,0.22 μm滤膜过滤除菌,4℃保存(其他抑制剂母液的配制方法类似)。在培养至对数前期的枯草芽孢杆菌菌液中,添加抑制剂母液,使终浓度分别为预计浓度。
1.2 方法
1.2.1 噬菌体的分离纯化和效价测定
1.2.1.1 噬菌体的分离和纯化 用双层平板法分离纯化噬菌体[8]:取10 mL发酵液4 000 r/min离心10 min,取上清液经0.22 μm无菌滤膜过滤除菌后,适当稀释后取100 μL滤液与300 μL培养至对数生长前期(OD600为0.4左右)的枯草芽孢杆菌KC-260混合,37℃静置15 min后与4-5 mL预先融化并冷却到48℃以下半固体培养基混匀,混匀后立即倒在预先倒好、已凝固的底层琼脂培养基上,铺平待凝;置37℃培养12-24 h,肉眼观察噬菌斑形态及大小。
用牙签挑单个噬菌斑接入含有对数前期的枯草芽孢杆菌的液体培养基内,富集培养3-5 h后离心,取上清过滤除菌,稀释适当倍数后取100 μL与300 μL处于对数期的宿主菌菌液混合,37℃放置15 min后倒双层平板,次日挑单个噬菌斑继续按相同步骤操作,如此反复多次,直到平板上噬菌斑大小、形状均比较一致。
挑取单个噬菌斑接入处于对数前期的宿主菌菌液中,培养至菌液澄清后离心取上清,过滤除菌后即为纯化后的噬菌体溶液,4℃保存备用。
1.2.1.2 噬菌体效价测定 将噬菌体溶液10倍梯度稀释后,分别取100 μL与300 μL处于对数前期的宿主菌菌液混合,倒双层平板,过夜培养后计数。按如下公式计算噬菌体效价:噬菌体效价(PFU/mL)=噬菌斑个数×稀释倍数×10。
1.2.2 噬菌体特性研究
1.2.2.1 噬菌体最佳感染复数的测定 感染复数(multiplicity of infection,MOI)是指初始感染时加入噬菌体的数量与宿主菌数量的比值,是研究病毒感染宿主时两者间比例关系的重要的生物指标[9]。将保存的噬菌体原液梯度稀释至不同浓度,按不同感染复数(100、10、1、0.1、0.01和0.001)加入噬菌体原液/稀释液和处于对数前期的宿主菌溶液,然后加入适量液体培养基37℃振荡培养3-5 h,离心取上清液过滤除菌后测定效价。以不加噬菌体的宿主菌和不加宿主菌的噬菌体为对照,以产生最高噬菌体效价对应的感染复数为最佳感染复数[10]。
1.2.2.2 噬菌体热稳定性测定 将保存的噬菌体溶液稀释至108PFU/mL,分别于50℃、60℃、70℃和80℃水浴5-20 min,测定不同温度处理后的噬菌体效价,计算其存活率。
1.2.2.3 噬菌体宿主范围的确定 将不同的芽孢杆菌分别培养至对数前期,分别取300 μL与100 μL噬菌体溶液混合,倒双层平板,次日观察是否有噬菌斑形成,以是否形成噬菌斑判断噬菌体对芽孢菌是否有侵染能力[11]。
1.2.3 噬菌体抑制剂、消毒剂的筛选
1.2.3.1 抑制噬菌体实验 检测植酸、苹果酸、草酸铵、柠檬酸铵、六偏磷酸钠等对噬菌体的抑制效果。将芽孢杆菌培养至对数前期,在菌液中加入噬菌体和待检抑制剂,以不加噬菌体和抑制剂的作为对照,过夜培养后测定OD600,通过比较对照组与实验组的OD600值判定抑制剂的抑制效果。
1.2.3.2 灭活噬菌体实验 将保存的噬菌体溶液稀释至107PFU/mL,分别利用12.5、25、30、40和50 mg/L的ClO2对噬菌体处理10-40 min后测定效价,检测消毒剂对噬菌体的灭活效果。
1.2.4 芽孢杆菌抗噬菌体菌株的选育
1.2.4.1 自发突变抗噬菌体菌株的选育 在处于对数期的宿主菌中,按最佳感染复数加入噬菌体,过夜培养,将菌液稀释后涂布平板,挑取平板上单菌落分别培养至对数期后加入噬菌体(以不加噬菌体的为对照),过夜培养,观察生长情况,将生长正常的菌液在加入噬菌体的情况下继续传代培养3次,取菌液培养至对数期加入噬菌体倒双层平板,若无噬菌斑出现则确定为噬菌体抗性菌株[12]。
1.2.4.2 突变株遗传稳定性的检测 将抗性菌株分别在加和不加噬菌体的培养基传代10次,每次测定OD600,通过比较OD600判定抗性菌株的遗传稳定性。
1.2.4.3 突变株与出发菌株生长性能的比较 分别将出发菌株、抗性突变株活化后接入新鲜培养基中,培养24 h后取样活菌计数。
2 结果
2.1 噬菌体的分离纯化和效价测定
枯草芽孢杆菌KC-260异常发酵液中分离纯化得到的噬菌体P260,能快速裂解宿主,使培养菌液变得澄清,在LB双层平板上呈现形态、大小较一致的噬菌斑,噬菌体滴度较高,纯化后的噬菌体溶液效价为3.45×1010PFU/mL。图1显示,噬菌体P260噬菌斑形状近圆形,中间透明,边缘有晕,过夜培养后直径达2-3 mm。

图1 噬菌体P260噬菌斑形状
2.2 噬菌体的性质分析
2.2.1 噬菌体的最佳感染复数测定 按照不同的感染复数加入噬菌体和宿主菌,培养5 h后收集噬菌体双层平板法测定管中的噬菌体滴度,结果见表1。当感染复数MOI为0.01时,噬菌体滴度为1.45×1010PFU/mL,在所有的MOI中,该噬菌体滴度最高。因此,确定噬菌体P260感染其宿主枯草芽孢杆菌KC-260的最佳感染复数为0.01。

表1 噬菌体P260的感染复数测定
2.2.2 噬菌体的一步生长曲线 由图2可知,噬菌体P260的潜伏期约为15 min,爆发的时间约为45 min。

图2 噬菌体P260的一步生长曲线
2.2.3 噬菌体的热稳定性 热稳定性分析(图3)表明,噬菌体P260随处理温度升高,存活率下降极为明显,70℃处理15 min后噬菌体活力几乎为零。
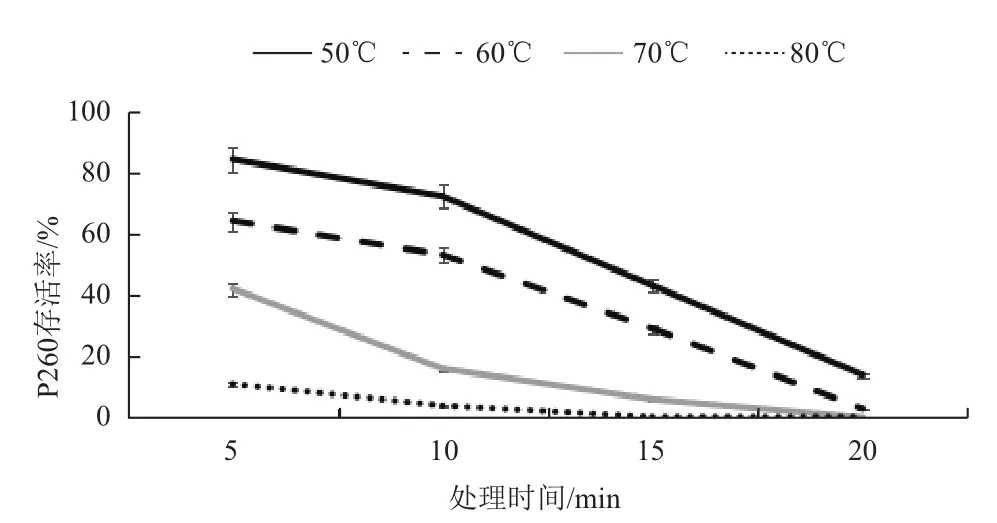
图3 不同温度对噬菌体P260存活率的影响
2.2.4 噬菌体的宿主范围 通过双层平板法确定P260噬菌体的宿主范围,结果见表2。以枯草芽孢杆菌为宿主菌筛选出的P260可侵染枯草芽孢杆菌、地衣芽孢杆菌,但并不侵染供试的凝结芽孢杆菌和短小芽孢杆菌。

表2 噬菌体的宿主范围
2.3 噬菌体抑制剂、消毒剂的筛选
2.3.1 抑制剂的筛选 通过比较OD600值判定抑制剂对噬菌体P260的抑制效果以及对枯草芽孢杆菌KC-260的影响。由图4可知,植酸、苹果酸等6种抑制剂对枯草芽孢杆菌KC-260的生长无显著抑制作用,0.5%的草酸铵和柠檬酸铵对噬菌体有一定的抑制作用。

图4 不同抑制剂对噬菌体P260及宿主菌KC-260作用效果
2.3.2 消毒剂ClO2对噬菌体的杀灭作用 图5显示,25 mg/L以上浓度的消毒剂ClO2对107PFU/mL噬菌体P260避光作用30 min有较为显著(P<0.05)的杀灭作用。

图5 消毒剂ClO2对噬菌体P260灭活效果
2.4 抗噬菌体芽孢菌的诱变选育
通过自发突变的方法筛选到一株噬菌体抗性菌株,编号ZF-260。
2.4.1 抗噬菌体突变株噬菌体抗性的稳定性 将抗性菌株分别在加和不加噬菌体的培养基中传代10次,每次测定OD600。表3显示,传代10次后突变株ZF-260仍具有噬菌体抗性,说明突变株ZF-260抗噬菌体特性较稳定。

表3 ZF-260噬菌体抗性稳定性(OD600)
2.4.2 在添加噬菌体P260条件下的500 mL培养瓶发酵 为了验证ZF-260的抗性,在500 mL摇瓶中分别对ZF-260和KC-260进行了培养,并在发酵5 h时添加终效价为1.0×107PFU/mL的P260噬菌体液,结果见图6。添加噬菌体P260后5 h时KC-260菌体明显稀少(图6-D);添加噬菌体P260后15 h时,显微镜观察到KC-260有大量菌体裂解碎片,只有极少数形成芽孢(图6-E);添加噬菌体P260后25 h时,KC-260菌体几乎完全被P260裂解(图6-F),菌液几乎澄清;相比较KC-260而言,ZF-260表现出良好的抗噬菌体P260特性(图6-A、6-B和6-C)。
2.4.3 突变菌株ZF-260与出发菌株KC-260的活菌数比较 与出发菌株KC-260(9.6×108CFU/mL)相比,ZF-260(1.93×109CFU/m)的活菌数比KC-260高101%。

图6 ZF-260和KC-260在添加P260噬菌体的条件下的菌体形态(100×)
3 讨论
在酶、氨基酸、乳制品和抗生素等微生物发酵生产过程中,噬菌体污染是导致发酵异常的一个常见原因[2]。噬菌体对外界的理化因素,如高温、紫外线等敏感,张建璀[13]在研究生产肌苷的枯草芽孢杆菌发酵液时分离得到噬菌体TXp1,该噬菌体对紫外线较为敏感,且在80℃处理40 min即可迅速失去活性。而本研究中得到的噬菌体P260对70℃以上的高温敏感,发酵罐等可采用高温灭菌的方式彻底杀灭噬菌体。次氯酸盐、漂白粉等消毒剂对噬菌体有较好的杀灭效果[3,4],浓度超过25 mg/L的消毒剂ClO2对107PFU/mL噬菌体P260避光作用30 min有较为显著的杀灭作用,因此消毒剂ClO2可用于发酵车间室内及室外环境的消毒。
噬菌体污染对芽孢杆菌的工业化发酵生产具有较为严重的安全隐患,筛选对噬菌体抑制效果明显,同时又不影响枯草芽孢杆菌正常生长的抑制剂,是有效解决噬菌体污染问题的一个解决途径。我们前期的试验已证明0.150%植酸对枯草芽孢杆菌噬菌体P85和P90有明显的抑制效果[14]。通过本研究发现,多数抑制剂虽然不影响枯草芽孢杆菌的正常生长,但是对噬菌体抑制效果极为有限。
通过诱变方法选育抗噬菌体菌株被认为是防治噬菌体污染的重要手段,自发突变、紫外诱变、化学诱变均是经常使用的方法。张建璀[13]在研究枯草芽孢杆菌噬菌体TXp1时通过自然突变和紫外诱变的方法获得了噬菌体抗性菌株,从而选育得到可用于菌种轮换的生产菌株。在本研究中筛选得到一株抗性菌株,其生长性能较出发菌株有所提升[15]。后续工作中,笔者准备尝试采取复合诱变的方法选育噬菌体抗性菌株。
4 结论
本研究从车间异常发酵液中分离、纯化、富集得到一株效价为3.45×1010PFU/mL的枯草芽孢杆菌噬菌体P260。P260感染宿主菌的最佳感染复数为0.01,增殖的潜伏期为15 min,45 min进入裂解期。当感染复数为0.01时该噬菌体具有最高的滴度,该噬菌体侵染芽孢杆菌的能力较强,比较容易发生噬菌体污染。噬菌体P260具有一定的宿主专一性,除对凝结芽孢杆菌和短小芽孢杆菌不敏感外,能侵染枯草芽孢杆菌和部分地衣芽孢杆菌。噬菌体P260在高温条件下很容易失活,不耐热,通过70℃处理15 min噬菌体几乎完全失活。在避光条件下,25 mg/L消毒剂ClO2对噬菌体有较好的杀灭效果。0.5%的草酸铵和柠檬酸铵对该噬菌体有一定的抑制作用。通过自发突变的方法获得了抗噬菌体菌株ZF-260,在人工添加终效价为107PFU/mL的噬菌体的发酵中,ZF-260的生长不受影响,ZF-260是一株可以抗噬菌体P260并具有高活菌数的优良菌株。
[1]余小霞, 田健, 刘晓青, 伍宁丰. 枯草芽孢杆菌表达系统及其启动子研究进展[J]生物技术通报, 2015, 31(2):35-44.
[2] 王小玲. 浅议发酵乳生产中噬菌体的污染与防治[J]. 山西科技, 2012(2):130-131.
[3]Clevenger T, Wu Y, DeGruson E, et al. Comparison of the inactivation of Bacillus subtilis spores and MS2 bacteriophage by MIOX, ClorTec and hypochlorite[J]. J Appl Microbiol, 2007, 103(6):2285-2290.
[4]陈卫团, 王希提, 武传珍. 二氧化氯消毒剂杀菌及消毒效果观察[J]. 中国初级卫生保健, 2007, 21(8):61-62.
[5]Jakutytė L, Lurz R, et al. First steps of bacteriophage SPP1 entry into Bacillus subtilis[J]. Virology, 2012, 422(2):425-434.
[6]Persson R, McGeehan J, Wilson KS. Cloning, expression, purification, and characterisation of the dUTPase encoded by the integrated Bacillus subtilis temperate bacteriophage SPbeta[J]. Protein Expr Purif, 2005, 42(1):92-99.
[7]Yee LM, Matsuoka S, Yano K, et al. Inhibitory effect of prophage SPβ fragments on phage SP10 ribonucleotide reductase function and its multiplication in Bacillus subtilis[J]. Genes Genet Syst, 2011, 86(1):7-18.
[8]Martha RJ, Clokie AMK. Bacteriophages:methods and protocols, Volume 1:Isolation, characterization, and interactions[M]. Humana Press, 2008:28.
[9]方伟. 德氏乳杆菌抗噬菌体菌株的筛选及抗性机理研究[D].哈尔滨:东北农业大学, 2013.
[10]Lu Z, Breidt F Jr, et al. Isolation and characterization of a Lactobacillus plantarum bacteriophage, ΦJL21, from a cucumber fermentation[J]. Int J Food Microbiol, 2003, 84(2):225-235.
[11]Adams M. Bacteriophages[M]. London:Interscience Publishers, 1959.
[12]Daniela MG, Jorge AR. Characterization of spontaneous phage resistant derivatives of Lactobacillus delbrueckii commercial strains[J]. International Journal of food Microbiology, 2006, 111:126-133.
[13]张建璀. 枯草芽孢杆菌噬菌体TXp1的生物学特性及抗性菌株的选育[D]. 新乡:河南师范大学, 2014.
[14]刘秀侠, 穆熙军, 赵效南, 等. 植酸对枯草芽孢杆菌及其噬菌体的作用研究[J]. 中国酿造, 2015, 34(6):123-127.
[15]李阳. 直接发酵法生产L-色氨酸的研究[J]. 福建师范大学学报, 2009, 33(3):81-84.
(责任编辑 狄艳红)
Biological Characteristics of Bacillus subtilis Bacteriophage and Mutagenesis Breeding of Resistant Strains
LIU Xiu-xia XU Hai-yan XIN Guo-qin MU Xi-jun SUN Xue-sen GU Wei
(Shandong Baolai-Leelai Bio-Industrial Group,Tai’an 271000)
Bacteriophage infection usually occurs in industrial fermentation,thus this work aims to isolate and screen bacteriophage with Bacillus subtilis as host,to analyze its biological characteristics,and to screen anti-phage strains via spontaneous mutation. With B. subtilis KC-260 as the host bacterium,a bacteriophage,designated as P260,was isolated and purified from the fermentation broth. Its titer was measured after enrichment culture,and then its biological characteristics such as thermal stability,optimal multiplicity of infection,host range,inhibitor,disinfectant-tolerance,etc. were investigated. In order to prevent the contamination from phage P260,anti-phage 260 strains were screened by spontaneous mutations. As results,titer of P260 reached 3.45×1010PFU/mL,it had a certain host specificity,and not sensitive to Bacillus coagulans and Bacillus pumilus. P260 easily lost its activity at high temperature,i.e.,not heat-resistant,and its survival rate under 70℃ condition for 15 min decreased significantly. ClO2in 25 mg/L had a strong exterminate effect on P260. The 0.5% ammonium oxalate and ammonium citrate presented inhibition to P260. Optimal multiplicity of infection of phage P260 to the host was 0.01,one step growth curve showed that the incubation period was 15 min and the lytic stage started after 45 min. An anti-phage strain ZF-260 was obtained by spontaneous mutation. ZF-260 was not affected when adding phage P260,which indicated that ZF-260 was an excellent strain of anti-phage P260. In conclusion,the biological characteristics of phage P260 was studied,and ZF-260 with stable genetic and high viable cell count was obtained.
Bacillus subtilis;bacteriophages;inhibitor;disinfectant;spontaneous mutation
10.13560/j.cnki.biotech.bull.1985.2017.02.021
2016-05-03
刘秀侠,女,硕士,研究方向:微生态制剂的研发及菌种选育;E-mail:liuxiuxia0208@126.com
穆熙军,男,助理研究员,研究方向:微生态制剂的研发;E-mail:705490100@qq.com

