荧光示踪技术对土壤中诱变菌的生长研究
王 婷,孙红文,毛洪钧 (南开大学环境科学与工程学院,天津 300071)
荧光示踪技术对土壤中诱变菌的生长研究
王 婷,孙红文*,毛洪钧 (南开大学环境科学与工程学院,天津 300071)
采用荧光染料DAPI(4’, 6-Diamidino-2-Phenylindole)对外源微生物Bacillus subtilis 38(B38)的DNA分子进行标记,利用荧光示踪技术对外源微生物的生长繁殖进行有效监测.通过筛选DAPI 工作液的使用浓度与菌悬液的稀释比例,得出采用0.1 µg/mL浓度的DAPI对稀释106倍的菌悬液进行染色,荧光信号强度适宜,菌体分散度良好,可实现准确计数.采用上述染色条件,对60d内土壤B38菌体数量的变化进行阶段性监测.结果发现,接种后菌体浓度显著增加,平衡后菌体浓度达到(1.05±0.01)×1010cells/mL,与初期施加量相比,增长量达到3个数量级.以上结果表明,采用DAPI染料对外源微生物进行荧光示踪计数,为监测外源微生物的生长繁殖状态提供了一种简便、有效的方法.
荧光标记;荧光计数;DAPI;细菌;土壤
生物强化技术作为土壤重金属污染的一种原位修复手段,近年来成为环境领域的研究热点
[1-2].接种到土壤中的外源微生物需要适应新的环境条件,并且外源微生物与土著微生物之间存在相互竞争作用,引入的外源微生物能否在土壤中得到正常的生长繁殖、发挥其最大活性决定着生物强化技术实施的成败[3],因此有必要对外源微生物的生长繁殖情况进行跟踪调查.
目前,对土壤微生物计数的研究方法主要有传统的培养分离法[4],放射性同位素标记法[5-6],稳定同位素标记法[7-8]和荧光标记示踪法[9-11].
近年来,一些学者致力于土壤中微生物的靶向示踪研究.钱明媚等[12]采用稳定性同位素方法,以13C标记了自养固碳微生物的cbbLR基因,利用分子生物学手段分析标记后的 cbbLR基因多样性,从而揭示了自养固碳微生物在免耕水稻土中的丰度和多样性. Kinsella等[13]将放射性同位素 2-氟-2-脱氧-D-葡萄糖(18FDG)标记的拉恩菌加入模拟的酸化矿质土壤中,利用正电子发射断层成像技术(PET)对标记后的微生物进行放射性成像分析,以对微生物的地下活动情况进行原位监测.鲍林林等[14]选择氨单加氧酶基因(amoA)作为分子标记物,通过分子生物学手段对标记的基因进行克隆和测序,以跟踪北运河表层沉积物中的氨氧化古菌和氨氧化细菌的群落多样性、丰度、系统发育及其与环境因子的响应关系.
但是放射性同位素标记法中使用的放射性同位素不可避免的会给待测微生物造成损害,影响微生物正常的传代,影响计数结果的准确性.此外,放射性同位素标记试剂具有放射性,会造成环境污染,且通常需要复杂的放化设备及防辐射防护措施,因此在实际土壤的修复中应用存在局限性.而稳定同位素标记法中用到的稳定同位素试剂为高技术含量、高附加值的高端科研用试剂,存在国外试剂垄断国内市场的局面[15].此外,生物标记物的定量测定需要借助色谱、质谱等大型仪器[8,16].因此,该技术存在成本高、方法复杂、实验周期长等缺点.
荧光染色法分为荧光免疫染色法和荧光染料染色法.荧光染料主要分为2大类:一类不能够透过活细胞膜,仅能够对固定的细胞和细胞膜有破损的细胞核进行染色的染料,例如碘化丙啶(PI)[17]和溴化乙锭(EB)[18]等;另一类能够透过活细胞的细胞膜进入细胞内部进行染色,例如羧基二乙酸荧光素(CFDA)[19]、罗丹明123(Rh123)[20]、4’, 6’-二脒基-2-苯基吲(DAPI)[21]等;显然,后者更有可能在保持外源微生物的活性的前提下进行荧光标记.其中DAPI与DNA结合之后,荧光强度比结合之前增加了近25倍[21].此外,DAPI可以穿透完整的细胞膜,与 DNA分子稳定结合,因此不仅可以对固定细胞进行染色,还可以用于活细胞的染色.
1976年,Williamson等[22]首先将DAPI用作DNA 荧光染料,成功的用于观测酵母菌的线粒体DNA.之后Lin等[23]将DAPI用于检测姊妹染色体的交换,并应用到染色体显带技术上[21].后来许多研究者使用 DAPI来研究原核生物的DNA和真核生物的细胞核以及核外DNA.DAPI比其他的荧光染料具备以下优点:采用直接染色法,操作方便快速;灵敏度非常高,能检测到 2× 10-4pg DNA;使用量非常少,通常不超过 0.5μg/ mL;稳定性好,荧光衰退期要低于其他染料.
近年来,DAPI 被引入微生物生态学的研究,在荧光原位杂交技术中,用 DAPI 对微生物的DNA 进行标记,较多的应用于污水处理系统或土壤等样品的微生物总量估计[24-25].例如,陈琛等
[26]使用 DAPI荧光染色计数法测量了感潮河段沉积物中的细菌数量,通过调整染料浓度、染色时间等影响因素,成功对沉积物中的细菌总量进行了计数.但是将其应用于单一外源微生物的靶向定位示踪的研究甚少.
为实现对土壤修复过程中所加入的单一外源微生物的生长繁殖情况进行跟踪监测的目的,本论文创新性的引入荧光示踪技术.使用荧光染料DAPI对诱变菌的DNA 进行标记,与微生物载体诺沃肥复合后,接种于受污染土壤.通过筛选DAPI 染料的使用浓度与菌悬液的稀释比例,采用荧光计数技术,成功的实现对外源微生物在土壤中的生长繁殖情况的跟踪研究.为外源微生物生长繁殖的定量化研究提供了一种简便、快捷的方法,保证生物强化修复技术的顺利实施.
1 材料与方法
1.1 培养基及溶液的配制
使用液体牛肉膏-蛋白胨培养基对活性菌株B38进行培养.培养基的配制方法为:准确称取蛋白胨 10g/L,氯化钠 5g/L,牛肉膏5g/L,用 1mol/L的盐酸和 1mol/L的氢氧化钠调节 pH=7.2,于121
℃高压蒸汽灭菌30min备用.
0.85 %(M/V)生理盐水的配制:准确称取0.85g氯化钠,溶解后用蒸馏水稀释至 100mL,于121℃下高压灭菌30min备用.
DAPI 储备液的配制:用双蒸水将 DAPI 粉末配制成 1.0×103μg/mL的储备液,于-20℃保存备用.
DAPI工作液的配制:用磷酸盐缓冲溶液(PBS,pH=7.4)分别稀释储备液至 10μg/mL、0.1μg/mL,制得DAPI工作液,于4℃保存备用[27].
1.2 菌种的培养及生长曲线的测定
本实验中用到的诱变菌种 B38为实验室前期以枯草芽孢杆菌为初始菌种,通过紫外诱变5min得到的高效镉耐受性的诱变菌种[28].出发菌枯草芽孢杆菌购买自国家普通微生物菌种保藏管理中心(CCGMC).出发菌株对镉有一定的抗性,其最小抑制浓度(MIC)为 0.25mmol/L,而选育出的 B38菌种,其抗镉性能大大提高,MIC达到了3mmol/L[29].
将B38菌体接种于5mL牛肉膏蛋白胨液体培养基中,于37℃,150r/min活化培养10h至对数生长期中段;之后取 1mL菌悬液接种于 100mL牛肉膏蛋白胨液体培养基,于37℃,150r/min扩大培养.每隔 2h,利用紫外可见分光光度计测定菌悬液的OD600值,并同时对菌悬液进行显微计数,测定B38的生长曲线[29].每组实验设置3个平行.
1.3 DAPI染料对诱变菌的荧光染色方法
挑取一环B38诱变菌接种于5mL液体牛肉膏-蛋白胨培养基中,于 35℃,150r/min下活化培养10h至对数生长期中段.取1mL活化的B38菌悬液,接种于100mL液体牛肉膏-蛋白胨培养基,于35℃,150r/min,扩大培养10h.
取10mL菌悬液,9000r/min离心10min,弃去上清液,用灭菌的 0.85%生理盐水重新悬浮菌体.加入37%的甲醛溶液固定B38细胞.
各取2mL固定后的菌悬液,分别加入0.2mL,浓度为1.0×103μg/mL、10μg/mL和0.1μg/mL的DAPI荧光染料,避光染色15min.
分别将染色的菌悬液用 0.85%的生理盐水稀释至104和106倍使用.用0.22μm的黑色核孔滤膜过滤染色后的菌悬液,用 0.85%的生理盐水洗涤 6次,以洗去多余的染料.用 1:1的甘油和PBS试剂配制封片剂,将核孔膜置于载玻片上,封片,用荧光显微镜在紫外下观察细菌染色情况[25].以未荧光标记的菌体作为对照,每组实验设置 3个平行.
1.4 荧光标记诱变菌在液体培养基中的传代实验
挑取一环B38诱变菌接种于5mL液体牛肉膏-蛋白胨培养基中,35℃,150r/min下活化培养10h.取1mL活化的菌悬液,接种于100mL液体牛肉膏-蛋白胨培养基中.于 35℃,150r/min,扩大培养10h.
取10mL 菌悬液,3000r/min离心10min,弃去上清液,用灭菌的 0.85%生理盐水重新悬浮菌体.在2mL 菌悬液中加入通过荧光染色实验确定浓度的DAPI 荧光染料,避光染色15min.用0.85%的生理盐水洗涤 6 次,以洗去多余的染料.取1mL菌悬液接种至 100mL液体牛肉膏-蛋白胨培养基,传代培养10h.
提取10mL菌悬液,稀释至适当浓度.取2mL菌悬液用 0.22μm的黑色核孔滤膜过滤,将核孔膜置于载玻片上,封片,用荧光显微镜在紫外下观察计数.以未经荧光标记的菌体作为对照,每组实验设置3个平行.
1.5 荧光标记诱变菌的土壤荧光示踪方法
采集天津市津南区污水灌溉多年的蔬菜农田土壤0~20cm表层土,风干后过2mm筛.其理化性质见表1.
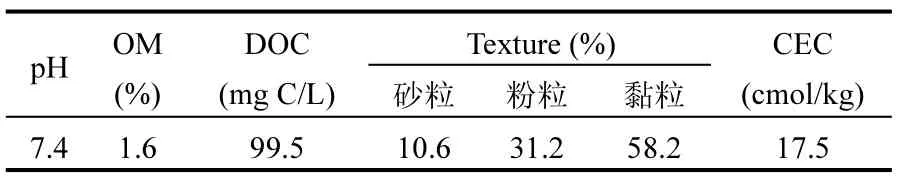
表1 供试土壤的理化性质与重金属背景含量Table 1 Properties and heavy metal concentrations of the tested soils
挑取一环B38 诱变菌接种于5mL液体牛肉膏-蛋白胨培养基中,35℃,150r/min下活化培养10h至对数生长期中段.取1mL活化的B38菌悬液,接种于 100mL液体牛肉膏-蛋白胨培养基.于35℃,150r/min,扩大培养 10h.取 10mL菌悬液,在3000r/min下,离心 10min,弃去上清液,用灭菌的0.85%生理盐水重新悬浮菌体.取 2mL菌悬液,加入选定浓度的 DAPI荧光染料,避光染色 15min.用0.85%的生理盐水洗涤6次,以洗去多余的染料.
微生物载体诺沃肥取自天津市经济技术开发区诺维信®(中国)生物技术有限公司.将诺沃肥风干后磨碎,过2mm筛备用.
选择诺沃肥与土壤的质量比为2%的施用量,以20mL/kg的接种量(即2%的施用水平)将荧光标记的 B38菌悬液与微生物载体充分接触制备成改良剂,继而与土壤(800g)充分混合均匀后于人工气候箱中培养,温度控制在 25±1℃,光周期为12:12,定期浇水以保持一定的土壤湿度.
培养第 1、5、10、20、30、60d采集 0.5g土壤样品,加入 10mL生理盐水于室温下 200r/ min振荡15min以提取土壤中的微生物.取10mL提取液,稀释后取2mL菌悬液用0.22μm的黑色核孔滤膜过滤,将核孔膜置于载玻片上,封片,用荧光显微镜在紫外下观察计数.土壤微生物数量的计算方法为,将计数所得数量转换为每克干土所含微生物数(cells/g).以未经荧光标记的菌体作为对照,每组实验设置3个平行.各组处理见表2.

表2 分组设置Table 2 Treatments with different amendments designed in the experiment
2 结果与讨论
2.1 诱变菌B38的生长曲线
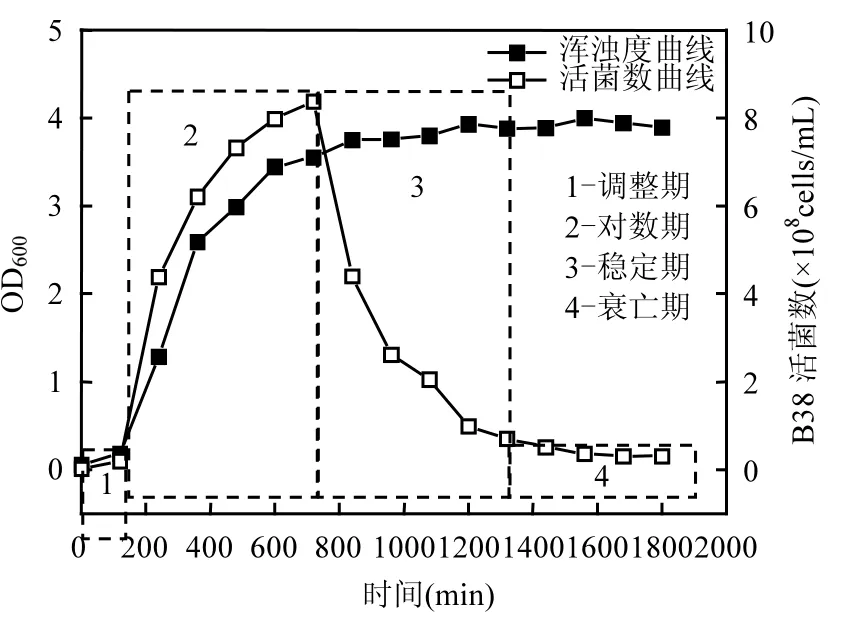
图1 B38菌种的生长曲线Fig.1 The growth curve of B38 species
诱变菌B38的生长曲线如图1所示.B38的生长繁殖分为4个阶段:调整期(1)、对数期(2)、稳定期(3)和衰亡期(4).B38在 2h左右进入对数生长期,此阶段菌体快速生长,生物量迅速增加;12h后,菌体进入稳定期,活菌数曲线和浑浊度曲线同时达到峰值.处于对数生长期中后段的菌株具有较高的生理活性,因此,选择培养时间为10h,即培养至对数生长期中后段的菌悬液进行后续实验.
将12h以内的活菌数与菌悬液的OD600值进行线性回归,拟合结果见图 2.从接种期至对数生长期结束,活菌数与菌悬液的 OD600值之间存在显著正相关关系(r2=0.9766),因而在后续培养实验中,采用测定对数生长期B38菌悬液OD600值的方法,通过线性回归计算对细菌数量进行计数,这一发现可显著提高实验效率.
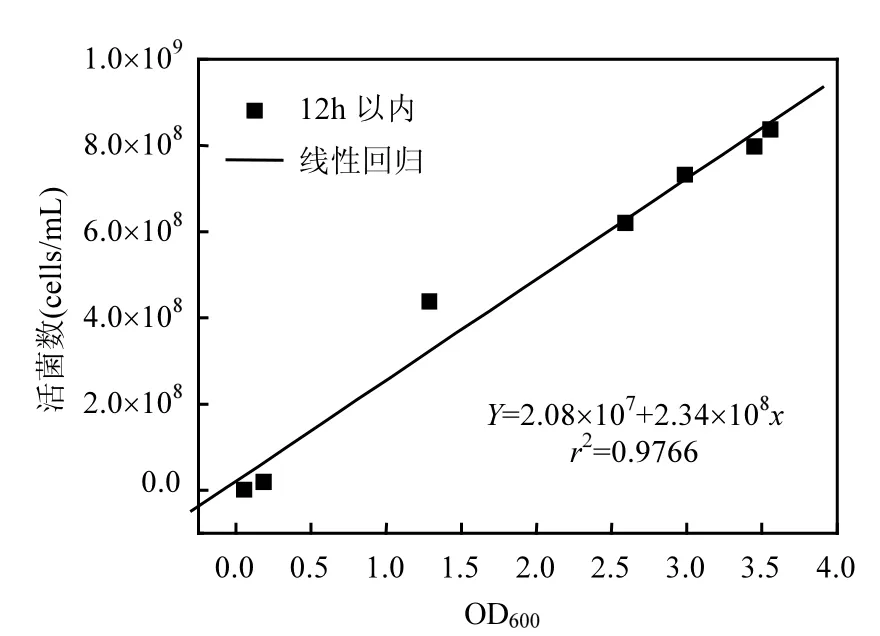
图2 活菌数与菌悬液的OD600值之间的线性关系Fig.2 The linear regression of biomass concentration versus OD600
2.2 DAPI对诱变菌B38的荧光染色结果
DAPI对诱变菌B38的荧光染色结果见图3.图3a为未染色的B38菌体(对照组),在紫外光下观察不到荧光反应,因此排除了菌体自发光对实验的干扰.为探索适宜的DAPI染料浓度,选择不同浓度梯度的 DAPI储备液和工作液进行荧光染色实验.图 3b为使用 1.0×103μg/mL的 DAPI储备液对 B38菌体进行染色的结果,可见 DAPI对B38染色成功,但是视野中荧光反应过强,因而判断染料浓度过高.继而稀释储备液,使用浓度为10μg/mL的 DAPI工作液进行染色,结果荧光反应仍然过强,无法识别菌株个体,因此需对 DAPI工作液进一步进行稀释(图3c).图4d为使用浓度为0.1μg/mL的DAPI工作液进行染色的结果,视野中荧光反应强度适中,但滤膜上可观察到一定厚度的蓝色菌膜,这是由于菌体浓度过高导致,为进行准确计数需对菌悬液进行稀释.尝试将菌悬液稀释 104倍(图 3e),菌膜消失,但是菌体仍呈现团聚状态,无法对个体进行识别和准确计数,因此进一步将菌悬液稀释至106倍(图3f),如图可见菌体分散度良好,且荧光反应强度适宜,可进行计数分析.因此,选择0.1μg/mL 的DAPI染料浓度、菌悬液稀释106倍进行后续研究.

图3 诱变菌B38的荧光染色结果(×50)Fig.3 B38cells stained with DAPI (×50)
2.3 荧光标记诱变菌在液体培养基中的传代研究
使用浓度为0.1µg/mL的DAPI染料对菌悬液进行染色,稀释 106倍后进行荧光显微计数,得到菌悬液浓度为(3.21±0.22)×108cells/mL.根据菌体计数与菌悬液的OD600值线性关系方程(图2),由菌悬液的 OD600值计算得到扩大培养后的菌悬液浓度为(4.92±0.15)×108cells/mL.荧光计数浓度与理论浓度吻合,因而 DAPI荧光染色显微计数方法可用于对B38菌体的计数研究.
对传代培养 10h 后的菌悬液进行荧光显微计数,所得菌体浓度为(5.58±0.13)×108cells/mL,查找 B38 生长曲线(图 2),该菌体浓度符合 10h培养应有的浓度.因此,荧光特性成功的在B38传代过程中得以保持,计数准确有效,DAPI荧光染色显微计数方法对于B38的传代示踪研究可行.
2.4 荧光标记诱变菌在土壤中数量随时间的变化
使用的菌悬液初始接种浓度为(5.58±0.13)× 108cells/mL,以 2%的接种量接种于土壤中,计算得到土壤中 B38 初始浓度为(1.12±0.03)× 107cells/g.
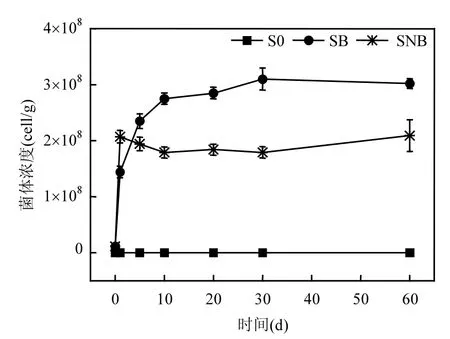
图4 诱变菌B38在土壤中的荧光标记示踪结果(S0:对照;SB:仅添加荧光标记的B38;SNB:同时添加诺沃肥和荧光标记的B38)Fig. 4 Concentrations of fluorescence labeled B38 strain in soil samples under different treatments (S0: control; SB: soil amended with labeled B38; SNB: soil amended with NG and labeled B38)
采集第1、5、10、20、30、60d的土壤样品对B38诱变菌进行荧光计数,结果见图4.添加未进行荧光标记 B38 菌体的对照组(S0)未观察到荧光反应,这就同时排除了土著微生物自发光对荧光计数的干扰.仅添加荧光标记的 B38(SB),土壤B38 菌体浓度呈不断上升的状态,30d 后达到平衡,直到 60d 菌体浓度仍维持稳定水平,浓度达到(3.02±0.09)×108cells/g,以20mL/kg的接种量换算,可得浓度相当于(1.51±0.004)×1010cells/mL,与初始接种量相比,浓度增加了超过3个数量级.诺沃肥与标记的 B38复合的一组(SNB),自施加后菌体浓度迅速上升,1d之后即迅速达到稳定状态并可以保持至 60d,最终浓度为(2.09±0.28)× 108cells/g,以20mL/kg的接种量换算,可得浓度相当于(1.05±0.01)×1010cells/mL,与初始接种量相比,浓度提高了近3个数量级.
荧光示踪第 60d的各组处理土壤样品 B38标记菌的荧光成像结果见图 5.添加未进行荧光标记的B38菌体的对照组观察不到荧光反应,外源微生物 B38和土著微生物都不存在自发光现象,对计数结果不存在干扰影响.仅添加荧光标记的B38的一组(SB),镜检下土壤中B38菌体浓度最高.诺沃肥与标记的B38复合的一组(SNB),标记菌浓度反而低于SB组处理.
前期使用 DNA扩增-变性梯度凝胶电泳(PCR-DGGE)技术对各组处理土壤总的微生物丰度进行研究,与对照相比,仅添加 B38的处理(SB)土壤微生物多样性并没有明显改善,而加入诺沃肥后(SNB)土壤总的微生物丰度显著提高
[30].结合本文针对外源微生物B38的DAPI荧光计数结果可见,B38作为一株在高浓度镉胁迫下通过紫外诱变获得的高效重金属耐受菌株,与土著微生物相比,对高污染、低肥力的恶劣环境条件有着较高的适应性及发展潜力,在与土著微生物的竞争中取得明显的优势.载体诺沃肥含有较高的有机质含量(91.8%)与阳离子交换容量(107.8cmol/kg),可为土壤微生物提供碳源、氮源等营养物质[30],因此,添加诺沃肥后,土壤肥力得到提高,环境条件的改善使得土著微生物得以生长繁殖,这就使得土著微生物开始对外源微生物B38的生长造成竞争性抑制,因此SNB处理下的B38菌体浓度反而低于SB的处理.但是,在达到平衡后,SNB处理下B38的生物量与初期施加量相比增加至近 3个数量级(图 4),参考生长曲线(图 1),B38对数期的菌体浓度峰值((8.38±0.12)× 108cells/mL)与初期接种量((1.56±0.08)×106cells/ mL)相比翻倍达到近3个数量级,因此,B38投加到受污染的土壤中后生长繁殖状况良好.这说明在生物强化处理技术的实施过程中,外源微生物B38的活性得到了保持与发挥,这就保证了投加外源微生物可以按照所预期的思路加速生物修复进程.

图5 不同处理下诱变菌B38 60d荧光照相结果(×50)Fig.5 Fluorescence microscopy of the cells of fluorescence labeled B38 strain at 60d under different treatments
3 结论
3.1 为研究土壤中施加外源微生物B38后,其菌体浓度随时间的变化情况,本文创新性的引入了DAPI荧光染色技术标记微生物的DNA分子进行显微荧光示踪计数研究.选择不同浓度梯度的染料进行对比,结果显示使用高浓度的工作液镜检下荧光反应过强,无法识别单个菌体,最终选择0.1μg/mL的DAPI为最适浓度.
3.2 为能够对菌体数进行准确计数,选择不同稀释倍数进行镜检.结果发现当菌悬液稀释 106倍后,菌体分散度高、数量适中,可实现计数.使用荧光显微计数得到的 B38 菌体浓度为(3.21± 0.22)×108cells/mL,使用OD600值换算得到的浓度为(4.92±0.15)×108cells/mL,二者达到高度一致,因此荧光染色显微计数方法准确可行.
3.3 将标记后的B38加入土壤中,传代培养10h后,提取土壤微生物悬液对B38菌体进行荧光计数,所得菌体浓度为(5.58±0.13)×108cells/mL,符合B38的生长曲线.因此经过标记的外源微生物的荧光特性在传代过程中得到了良好的保持.
3.4 在60d的时间内跟踪外源微生物B38在实际土壤修复过程中的数量变化.结果发现B38对恶劣的环境有较高的适应性和发展潜力;在添加了微生物载体后,由于载体物质为土著微生物和外源微生物同时提供碳源、氮源及其他营养物质,此时,土著微生物对B38的生长繁殖起到了部分竞争抑制作用,但是 B38菌体浓度仍达到(1.05±0.01)×1010cells/mL,与初期施加量相比,提高了近3个数量级,外源微生物得到了良好的生长繁殖.
[1] Tyagi M, Fonseca M M R D, Carvalho C C C R D. Bioaugmentation and biostimulation strategies to improve the effectiveness of bioremediation processes [J]. Biodegradation, 2011,22(2):231-241.
[2] Bento F M, Camargo F A O, Okeke B C, et al. Comparative bioremediation of soils contaminated with diesel oil by natural attenuation, biostimulation and bioaugmentation [J]. Bioresource Technology, 2005,96(9):1049-1055.
[3] Bouchez T, Patureau D, Dabert P, et al. Ecological study of a bioaugmentation failure [J]. Environmental Mcrobiology, 2000, 2:179-190.
[4] Kirk J L, Beaudette L A, Hart M, et al. Methods of studying soil microbial diversity [J]. Journal of Microbiological Methods, 2004, 58:169-188.
[5] Bååth E. Thymidine incorporation into soil bacteria [J]. Soil Biology & Biochemistry, 1990,22(6):803–810.
[6] Harris D, Paul E A. Measurement of bacterial growth rates in soil [J]. Applied Soil Ecology, 1994,1(4):277–290.
[7] Zhang C L. Stable carbon isotopes of lipid biomarkers: analysis of metabolites and metabolic fates of environmental microorganisms [J]. Current Opinion in Biotechnology, 2002, 13(1):25-30.
[8] Bull I D, Parekh N R, Hall G H, et al. Detection and classification of atmospheric methane oxidizing bacteria in soil [J]. Nature, 2000,405:175-178.
[9] Roberts P M, Goldfarb D S. In vivo nuclear transport kinetics in Saccharomyces cerevisiae [J]. Methods in Cell Biology, 1997, 53:545-557.
[10] Morono Y, Takano S, Miyanaga K, et al. Application of glutaraldehyde for the staining of esterase-active cells with carboxyfluorescein diacetate [J]. Biotechnology Letters, 2004, 26:379-383.
[11] Miyanokurosaki N, Barnor J S, Takeuchi H, et al. In vitro and in vivo transport and delivery of phosphorothioate oligonucleotides with cationic liposomes [J]. Antiviral Chemistry and Chemotherapy, 2004,15:87-94.
[12] 钱明媚,肖永良,彭文涛,等.免耕水稻土固定 CO2自养微生物多样性 [J]. 中国环境科学, 2015,35(12):3754-3761.
[13] Kinsella K, Schlyer D J, Fowler J S, et al. Evaluation of positron emission tomography as a method to visualize subsurface microbial processes [J]. Journal of Hazardous Materials, 2012, 213–214(3):498-501.
[14] 鲍林林,陈永娟,王晓燕.北运河沉积物中氨氧化微生物的群落特征 [J]. 中国环境科学, 2015,35(1):179-189.
[15] 杜晓宁,王 伟,雷 雯.稳定性同位素标记试剂的研发及应用展望 [J]. 化学试剂, 2015,37(9):769-775.
[16] Boschker H T S, Nold S C, Wellsbury, et al. Direct linking of microbial populations to specific biogeochemical processes by13C-labelling of biomarkers [J]. Nature, 1998,392:801-805.
[17] Ling E, Shirai K, Kanekatsy R, et al. Classification of larval circulating hemocytes of the silkworm, Bombyx mori, by acridine orange and propidium iodide staining [J]. Histochemistry and Cell Biology, 2003,120:505-511.
[18] Alzola E, Chaib N, Pochet S, et al. Modulation by propranolol of the uptake of ethidium bromide by rat submandibular acinar cells exposed to a P2X7agonist or to maitotoxin [J]. Cellular Signaling, 2001,13:465-473.
[19] Fukunaga S, Jintoku T, Iwata Y, et al. Investigation of microorganisms in bentonite deposits [J]. Geomicrobiology Journal, 2005,22:361-370.
[20] Lugo M R, Sharom F J. Interaction of LDS-751with P-glycoprotein and mapping of the location of the R drug binding site [J]. Biochemistry, 2005,44:643-655.
[21] Lin M, Comings D, Alfi O. Optical studies of the interaction ofcounting aquatic microflora1 [J]. Limnology and Oceanography, 1980:25:943-948.
[28] Jiang C, Sun H, Sun T, et al. Immobilization of cadmium in soils by UV-mutated Bacillus subtilis 38bioaugmentation and Novo Gro amendment [J]. Journal of Hazardous Materials, 2009,167: 1170-1177.
[29] Chen H, Yao J, Wang F, et al. Toxicity of three phenolic compounds and their mixtures on the gram-positive bacteria Bacillus subtilis in the aquatic environment [J]. Science of the Total Environment, 2010,408:1043-1049.
[30] Wang T, Sun H, Mao H, et al. The immobilization of heavy metals in soil by bioaugmentation of a UV-mutant Bacillus subtilis 38assisted by NovoGro biostimulation and changes of soil microbial community [J]. Journal of Hazardous Materials, 2014,278:483-490.
[22] Willamson D, Fennell D. The use of fluorescent DNA-binding agent for detecting and separating yeast mitochondrial DNA [J]. Methods in Cell Biology, 1976,12:335-351.
[23] Lin M, Alfi O. Detection of sister chromatid exchanges by 4′-6′-diamidino-2-phenylindole fluorescence [J]. Chromosoma, 1976,57:219-225.
[24] Rogers S W, Ong S K, Moorman T B. Mineralization of PAHs in coal–tar impacted aquifer sediments and associated microbial community structure investigated with FISH [J]. Chemosphere, 2007,69:1563-1573.
[25] Lozada M, Itaria R F, Figuerola E L, et al. Bacterial community shifts in nonylphenol polyethoxylates-enriched activated sludge [J]. Water Research, 2004,38:2077-2086.
[26] 陈 琛,黄 珊,吴群河,等.DAPI荧光染色计数法的感潮河段沉积物细菌数量测量影响因素研究 [J]. 环境科学, 2010,31(8): 1918-1925.
[27] Porter K G, Feig Y S. The use of DAPI for identifying and
Investigation of growth in a UV-mutant species in soil using fluorescent tracing technique.
WANG Ting, SUN Hong-wen*, MAO Hong-jun
(College of Environmental Science and Engineering, Nankai University, Tianjin 300071, China). China Environmental Science, 2017,37(1):328~335
The DNA molecular of the exotic microorganism Bacillus subtilis 38 (B38, a mutant species of Bacillus subtilis) was used labelled by a fluorescent dye, DAPI (4’, 6-Diamidino-2-Phenylindole), to monitor the microorganism growth during the process of soil remediation by bioaugmentation technique. By optimizing the DAPI concentration and the dilution ratio of the bacterial suspension, an ideal DAPI concentrations of 0.1 µg/mL and a bacterial suspension dilution fold of 106were applied, and the appropriate fluorescence intensity and cell dispersity for the accurate fluorescent dot counting were obtained. The quantitative changes of B38 in 60 days soil remediation was monitored under the optimized conditions. The results showed that the numbers of B38 in soil increased obviously, and then reached an equilibrium concentration of (1.05±0.01)×1010cells/mL. The equilibrium concentration was as high as 3orders of magnitude of the initial dosage. Thus, DAPI labelled fluorescent tracing technique was a convenient and effective approach to monitor the growth and reproduction of exotic microorganism.
fluorescent labeling;fluorescent counting;DAPI;bacterium;soil
X53
A
1000-6923(2017)01-0328-08
王 婷(1985-),女,天津人,讲师,博士,主要从事土壤重金属污染修复研究.发表论文10余篇. 4′-6-diamidino-2-phenylindole with DNA and metaphase chromosomes [J]. Chromosoma, 1977,60:15-25.
2016-03-25
天津市应用基础与前沿技术研究计划(青年项目) (15JCQNJC15200);国家科技支撑计划项目(2014BAC23B0205)
* 责任作者, 教授, sunhongwen@nankai.edu.cn

