能谱CT定量参数鉴别诊断原发性胃淋巴瘤和胃癌
唐 琪,谢 东,苏丹柯,罗宁斌,金观桥,廖成成,王 铮,覃云英
(1.广西医科大学附属肿瘤医院影像诊断中心,3.淋巴血液肿瘤科,广西 南宁 530021;2.广西医科大学研究生学院,广西 南宁 530021)
能谱CT定量参数鉴别诊断原发性胃淋巴瘤和胃癌
唐 琪1,2,谢 东1*,苏丹柯1,罗宁斌1,金观桥1,廖成成3,王 铮1,覃云英1
(1.广西医科大学附属肿瘤医院影像诊断中心,3.淋巴血液肿瘤科,广西 南宁 530021;2.广西医科大学研究生学院,广西 南宁 530021)
目的 探讨能谱CT(GSI)定量参数鉴别诊断原发性胃淋巴瘤(PGL)和胃癌(GC)的价值。方法 收集PGL患者16例(PGL组)、GC患者24例(GC组),行平扫和GSI双期增强扫描。测量两组肿瘤病灶的单能量CT值、碘(水)基物质浓度和有效原子序数(Zeff),计算标化碘浓度(NIC)、能谱曲线斜率(λHU)、标化原子序数(Zeff-c)。采用独立样本t检验对各定量参数进行比较分析,运用ROC曲线评估其诊断效能。结果 PGL组增强双期40~90 keV图像λHU均低于GC组(t=2.90、3.69,P=0.008、0.001)。PGL组动脉期40 keV、静脉期40~120 keV单能量CT值均低于GC组(P均<0.05);PGL组70 keV增强双期NIC、动脉期标化水浓度均低于GC组,PGL组静脉期Zeff-c高于GC组(P均<0.05);静脉期70 keV单能量图像以λHU=2.63 mg/cm3为阈值鉴别诊断PGL和PC的敏感度和特异度分别为62.5%和100%。结论 GSI定量参数对PGL和GC的鉴别诊断有一定实用价值。
淋巴瘤;胃肿瘤;体层摄影术,X线计算机;能谱成像
原发性胃淋巴瘤(primary gastric lymphoma, PGL)是原发于胃黏膜固有层和黏膜下层淋巴组织的恶性肿瘤,居胃恶性肿瘤的第2位,发病率仅次于胃癌(gastric carcinoma, GC)[1]。早期PGL在黏膜下浸润生长,胃镜活检易漏诊,其CT表现为胃壁弥漫增厚,增强呈持续性强化,与GC影像学表现有较多重叠[2],因此两者鉴别诊断存在困难。临床上PGL与GC的治疗方法及预后截然不同[3],因此,两者的准确诊断对于指导临床治疗及预后评估尤为重要。能谱成像技术具有多参数、双能量成像的优势,可为疾病诊断提供有价值的定量诊断信息。本研究旨在分析比较PGL和GC的能谱CT定量参数特征,探讨能谱成像技术鉴别诊断PGL和GC的临床应用价值。
1 资料与方法
1.1一般资料 回顾性分析2015年9月—2016年7月于我院接受能谱CT检查的PGL和GC患者的资料。入组标准:①胃镜活检及病理证实为PGL和GC的患者;②能谱CT检查前均未接受手术及放、化疗治疗;③自愿参与且能顺利完成CT能谱检查。排除标准:①既往有胃肠道手术病史;②既往有胃外淋巴瘤病史;③临床病理资料不全者。本组共纳入PGL患者16例,男10例,女6例,年龄36~67岁,中位年龄54.5岁;其中弥漫大B细胞淋巴瘤9例,黏膜相关淋巴组织淋巴瘤7例;纳入GC患者24例,男15例,女9例,年龄30~65岁,中位年龄50.0岁;其中黏液腺癌9例、非黏液腺癌15例。
1.2仪器与方法 患者接受能谱CT扫描前需禁食 6~8 h,并于检查前0.5 h肌注山莨菪碱10 mg,同时饮温水约800~1 000 ml使胃腔充盈。采用GE Discovery 750HD CT机,扫描范围自膈顶到髂嵴。先行常规CT平扫,扫描参数:管电压140 kVp,管电流 250 mA,层厚5 mm,转速0.8 s/rot,螺距0.984;增强扫描采用能谱CT模式,采用高压注射器经肘静脉注入非离子型对比剂碘佛醇80 ml(300 mgl/ml),流率 3~ 4 ml/s;扫描参数:管电压为80 kVp与140 kVp瞬时高速切换,管电流260 mA,层厚5 mm,层间距 5 mm,螺距0.983;采用Bolus触发技术,在对比剂注射12 s后检测肾门水平腹主动脉内对比剂浓度变化,达到100 HU时触发扫描,静脉期于动脉期完成扫描 60 s后进行。扫描完成后对能谱图像采用40%自适应统计迭代重组技术(ASiR)重建,并将重建图像传送至AW 4.6工作站进行后处理。
1.3图像分析与测量 由2名经验丰富的影像医师在工作站上以盲法完成对图像的独立分析。于病灶质地较均匀区勾画ROI,ROI面积为15~25 mm2,并尽量置于病灶中央,避开囊变、坏死及血管,并尽量保持动脉期与静脉期ROI大小和位置一致,每个ROI测量3次,取其平均值。需测量和计算的数据如下:①病灶增强双期能谱曲线斜率(λHU),以40 keV和90 keV作为参考点,λHU=(HU40 keV-HU90 keV)/50;②40~140 keV病灶单能量CT值;③70 keV碘(水)浓度、有效原子序数(Zeff);④标化碘浓度(normalized iodine concerntration, NIC),NIC=IC病灶/IC腹主动脉,IC病灶为病灶碘(水)浓度,IC腹主动脉为腹主动脉碘(水)浓度;⑤标化原子序数(Zeff-c)=Zeff病灶/Zeff腹主动脉。⑥各能谱参数最佳诊断阈值、曲线下面积(area under curve, AUC)、敏感度和特异度。

2 结果
2.1单能量CT值 两组患者单能量CT值随能量的增高逐渐递减,且变化幅度渐趋减小。动脉期,两组单能量CT值仅在40 keV有差异(P<0.05);静脉期,两组单能量CT值在40~120 keV均有差异(P均<0.05),130 keV、140 keV单能量CT值差异均无统计学意义(P>0.05)。见表1。
2.2能谱曲线斜率 两组增强双期40~140 keV能谱曲线均呈下降型(图1)。动脉期PGL组和GC组40~90 keV λHU分别为1.43±0.51、2.18±0.88;静脉期分别为2.00±0.37、2.85±0.84,PGL组λHU均低于GC组,差异有统计学意义(t=2.90、3.69,P=0.008/0.001)。
2.3GSI定量参数和最佳诊断阈值 动脉期70 keV,PGL组NIC低于GC组、标化水浓度高于GC组(P均<0.05),两组Zeff-c差异无统计学意义(P>0.05);静脉期70 keV,PGL组NIC、Zeff-c均低于GC组(P均<0.05),两组标化水浓度差异无统计学意义(P>0.05)(表2,图2、3)。70 keV,各能谱参数诊断PGL阈值和诊断效能见表3。静脉期λHU=2.63为阈值时,AUC最大为0.806,敏感度和特异度分别为62.5%和100%(图4)。
3 讨论
PGL起源于胃黏膜下层淋巴滤泡,发病率占胃非上皮恶性肿瘤的首位,以中老年人多见,男性略多于女性。PGL易与GC混淆,PGL与GC鉴别诊断困难的原因有:①两者均表现为上腹部疼痛、食欲减退及消瘦,临床表现较为相似;②CT平扫及增强均可表现为胃壁增厚,腔内肿块,胃腔狭窄,影像学表现有较多重叠;③胃镜下两者形态学表现相似。研究[4]报道,术前影像学及胃镜下PGL误诊为GC的概率高达75.0%~92.3%,最终需依靠病理检查才能确诊。PGL与GC的治疗方式大相径庭,GC以根治切除术为主,放化疗为辅,而PGL则主张保守治疗,化疗联合局部放疗为主要治疗手段[3]。因此,PGL与GC的鉴别诊断对于指导临床治疗具有重要意义。

表1 双期增强扫描PGL组与GC组单能量CT值(HU,±s)
注:130 keV、140 keV时两组单能量CT值差异均无统计学意义(P>0.05),故未列出

表2 70 keV双期增强扫描PGL组与GC组GSI定量参数比较(±s)
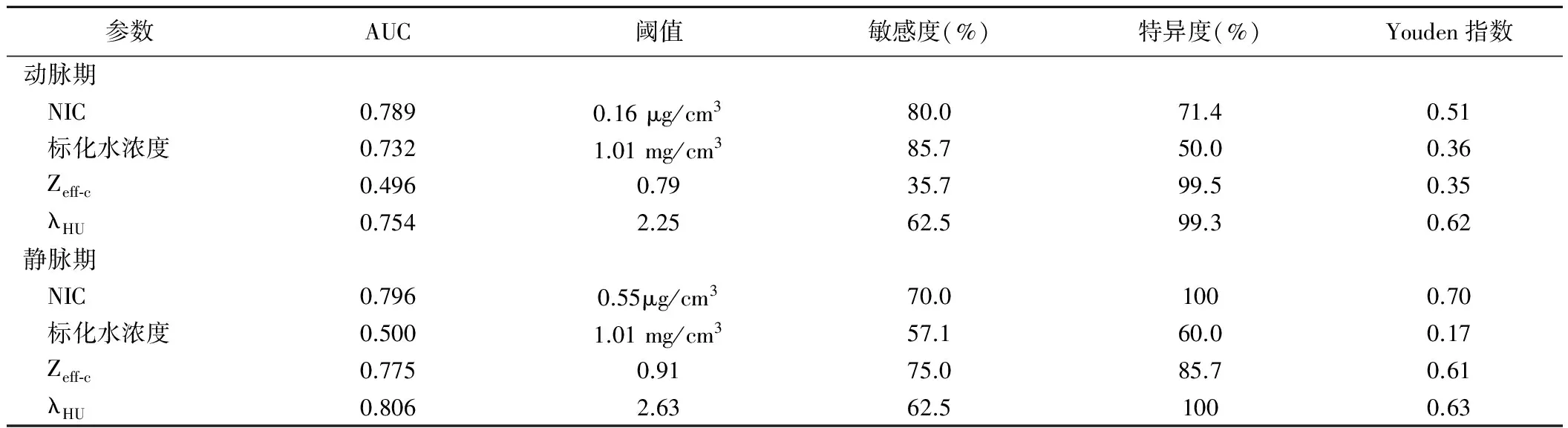
表3 GSI定量参数诊断PGL最佳诊断阈值及诊断效能

图1 PGL组和GC组增强双期40~140 keV能谱曲线
能谱CT成像技术是近年来新兴的CT功能成像技术,可通过实现80 kVp和140 kVp两组电压瞬时高效切换,获得40~140 keV一系列连续单能量图像和碘(水)基物质分离图像,结合物质衰减曲线,能提供更丰富的定性和定量诊断信息[5-6]。能谱CT成像技术突破了早期仅依据病灶CT值来诊断疾病的局限性,能够同时提供包括CT值在内的多项定量参数指标,显著提高诊断准确率与自信心。此外,较常规螺旋CT,能谱CT成像可提高图像信噪比和空间分辨率,对微小病灶的检出亦具有其独特的优势[7]。
能谱CT兼具定量诊断属性及常规CT定性诊断价值,研究显示[8-9],能谱CT定量参数在区分不同组织类型肿瘤方面具有广阔的应用前景。柴彦军等[10]研究表明,能谱CT定量参数分析结合肿瘤的强化方式特点,有助于鉴别胃神经鞘瘤和胃间质瘤,证实能谱定量参数在胃部肿瘤鉴别诊断中的可行性;此外,Pan等[11]利用能谱定量参数对不同分化级别的胃癌进行比较,结果表明能谱CT定量参数可用以鉴别正常胃壁、原位癌及早期胃癌,表明能谱定量参数鉴别诊断不同分化程度胃癌具有优越性。本研究主要利用能谱CT定量参数鉴别诊断PGL与GC,参数包括40~140 keV各单能量CT值、碘(水)浓度、Zeff及λHU等。为了消除个体差异和循环因素的影响,选取同层面腹主动脉为参考,对各参数进行标准化处理。

图2 患者男,39岁,原发性胃弥漫大B细胞淋巴瘤 A、B.CT增强双期扫描(70 keV动脉期、70 keV静脉期)见胃大弯侧胃壁弥漫增厚(箭),肿块呈持续性强化; C.病理图(HE,×100)
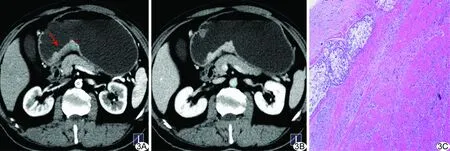
图3 患者男,54岁,胃印戒细胞癌 A、B.CT增强双期扫描(70 keV动脉期、70 keV静脉期)见胃窦部胃壁明显增厚(箭),肿块呈持续性强化; C.病理图(HE,×100)
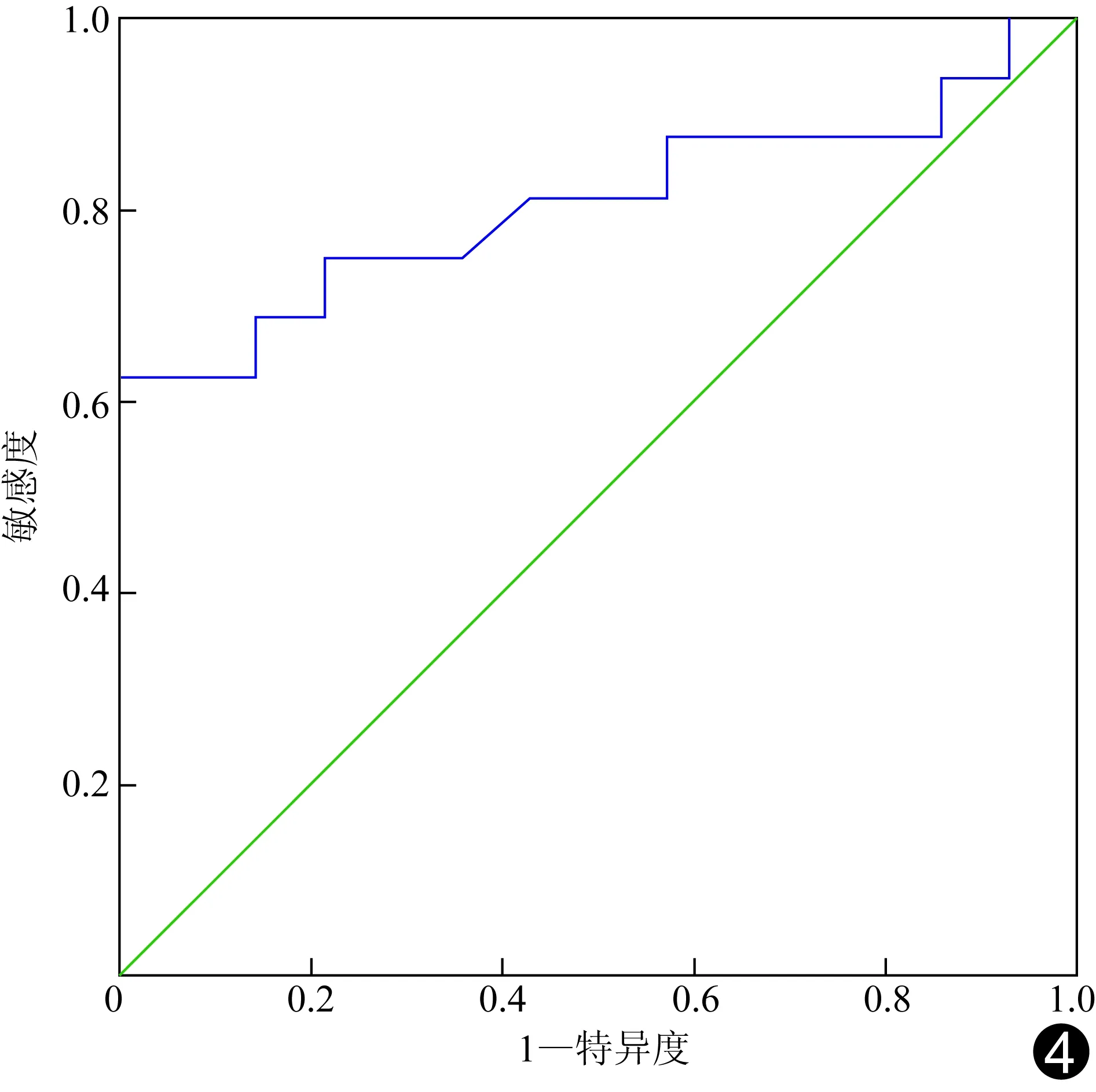
图4 静脉期λHU鉴别诊断PGL和GC的ROC曲线
物质衰减曲线由光电效应和康普顿效应共同决定,其反映了物质的射线吸收系数随能量改变的变化量,射线吸收系数与物质的原子序数、密度等有关。本研究结果显示,同一时相,两组能谱曲线均呈递减型,但GC组斜率高于PGL组,考虑原因可能是PGL和GC的血供情况不同,GC的血管较PGL更丰富,血流速度更快,管壁通透性更大,对比剂渗透及洗脱时间更短[12]。PGL与GC单能量CT值随能量增高逐渐减低,相同能级下,两者静脉期单能量CT值均高于动脉期,这与其动态增强“延迟强化”特点相吻合[13-14]。本组同一能级下,动脉期PGL组单能量CT值仅在40 keV时低于GC组(P<0.05),而在50~140 keV能级范围内,两组单能量CT值差异无统计学意义,原因可能是低能量下图像组织对比度较大,更有利于显示病灶。而40~120 keV能级下,静脉期PGL组单能量CT值均低于GC组(P均<0.05),这可能与肿瘤的微血管密度及供血血管的管壁结构不同有关,肿瘤血供的不同,间接导致两种肿瘤的强化程度有差异[15]。
碘是CT对比剂的主要成分,标准化碘浓度直接反映病灶的血供情况。本研究利用能谱70 keV单能量下标化碘(水)浓度来鉴别PGL和GC,结果显示增强动、静脉期PGL组NIC均低于GC组,表明GC的血供较PGL更丰富。物质分离由基物质对组成,在保持水浓度不变的情况下研究碘浓度的变化,结果更有意义。本研究结果显示,动脉期70 keV标化水浓度高于GC(P<0.05),静脉期则差异无统计学意义(P>0.05),由此可见,为减少水浓度对物质分离的影响,依据病灶静脉期NIC来鉴别诊断PGL和GC比动脉期更有价值。
X射线与化合物相互作用的过程可等效于与某种单质相互作用,这种单质的原子序数称之为Zeff[16]。Zeff可用于对物质组成成分进行分析,尤其是对密度相似、CT值相近的物质,利用Zeff可对物质的真实成分进行准确分析。本研究结果表明,70 keV,静脉期PGL的Zeff-c低于GC,可能是两种肿瘤内部分子组成成分不同所致,亦有助于鉴别诊断。
本研究局限性:①样本数较少;②胃癌患者分化程度不同,一定程度上可能影响统计结果;③本研究为回顾性分析,存在一定选择偏倚,后续将进行前瞻性研究使研究结果更完善。
综上所述,能谱CT定量参数能够客观地反映PGL和GC的组织细胞学特征和血流动力学变化,基于此,能谱成像技术可作为一种多参数检测方法鉴别诊断PGL和GC,具有一定的临床实用价值。
[1] McFarlane M, Wong JL, Paneesha S, et al. Synchronous upper and lower gastrointestinal Mucosa-Associated lymphoid tissue lymphomas. Case Rep Gastroenterol, 2016,10(2):241-247.
[2] 林秉淞.胃肿瘤MSCT表现及其临床病理特征分析56例.世界华人消化杂志,2013,21(10):915-919.
[3] Mehmet K, Sener C, Uyeturk U, et al. Treatment modalities in primary gastric lymphoma: The effect of rituximab and surgical treatment. A study by the Anatolian Society of Medical Oncology. Contemp Oncol (Pozn), 2014,18(4):273-278.
[4] 王旦,吴建胜,吴明,等.CT联合内镜检查对胃肠道恶性淋巴瘤的诊断价值.中国内镜杂志,2007,13(2):182-185.
[5] Liu X, Ouyang D, Li H, et al. Papillary thyroid cancer: Dual-Energy spectral CT quantitative parameters for preoperative diagnosis of metastasis to the cervical lymph nodes. Radiology, 2015,275(1):167-176.
[6] 林晓珠,沈云,陈克敏.CT能谱成像的基本原理与临床应用研究进展.中华放射学杂志,2011,45(8):798-800.
[7] Hou WS, Wu HW, Yin Y, et al. Differentiation of lung cancers from inflammatory masses with dual-energy spectral CT imaging. Acad Radiol, 2015,22(3):337-344.
[8] Yu Y, Guo L, Hu C, et al. Spectral CT imaging in the differential diagnosis of necrotic hepatocellular and hepatic abscess. Clin Radiol, 2014,69(12):e517-e524.
[9] 赵娜,程琦.CT能谱成像在鉴别肾血管平滑肌脂肪瘤和肾癌的应用价值.临床放射学杂志,2015,34(6):945-950.
[10] 柴彦军,周俊林,罗永军,等.能谱CT鉴别诊断胃神经鞘瘤和胃间质瘤.中国医学影像技术,2014,30(11):1674-1678.
[11] Pan Z, Pang L, Ding B, et al. Gastric cancer staging with dual energy spectral CT imaging. PLoS One, 2013,8(2):e53651.
[12] Chen CY, Jaw TS, Wu DC, et al. MDCT of giant gastric folds:Differential diagnosis. AJR Am J Roentgenol, 2010,195(5):1124-1130.
[13] 潘金万,梁长虹,阙松林,等.原发性胃淋巴瘤多排螺旋CT表现.中国医学影像技术,2010,26(2):294-296.
[14] 彭卫军,周康荣,秦新裕,等.浸润型胃癌的CT表现特点与临床应用价值.临床放射学杂志,2002,21(8):623-626.
[15] 张清波,陈绪光,焦俊.胃癌螺旋CT增强扫描表现与肿瘤血管生成关系的初步研究.中华放射学杂志,2005,39(7):714-717.
[16] Li M, Zheng X, Li J, et al. Dual-Energy computed tomography imaging of thyroid nodule specimens comparison with pathologic findings. Invest Radiol, 2012,47(1):58-64.
Dual-energy spectral CT quantiative parameters in differential diagnosis of primary gastric lymphoma and gastric carcinoma
TANGQi1,2,XIEDong1*,SUDanke1,LUONingbin1,JINGuanqiao1,LIAOChengcheng3,WANGZheng1,QINYunying1
(1.MedicalImagingCenter, 3.DepartmentofLymphBloodOncology,GuangxiMedicalUniversityTumorHospital,Nanning530021,China; 2.GraduateSchool,GuangxiMedicalUniversity,Nanning530021,China)
Objective To investigate the value of spectral CT quantitative parameters in differential diagnosis of primary gastric lymphoma (PGL) and gastric carcinoma (GC). Methods Sixteen patients with PGL (PGL group) and twenty-four patients with GC (GC group) were enrolled. All patients underwent plain and two phases enhanced spectral CT scans. The monochromatic CT values, iodine (water) concentration and effective atomic number (Zeff) of the two groups were measured, and the parameterized values (Zeff) and the slope of the spectral Hounsfield unit curve (λHU) were calculated in two phases, respectively. The spectral characteristic parameters listed above were quantitative analyzed by two-samplesttest. The diagnostic efficacies were evaluated by ROC analysis. Results During both arterial and venous phases,λHUon 40—90 keV monochromatic images was lower in PGL group than that in GC group (t=2.90, 3.69;P=0.008, 0.001). In both arterial phase on 40 keV and venous phase on 40—120 keV monochromatic images, the CT values in PGL group were significantly lower than those in GC group (allP<0.05). On 70 keV monochromatic images, the normalized iodine concerntration on enhanced dual-phase and the normalized water concerntration in arterial phase were lower in PGL group than those in GC group (allP<0.05). However, Zeff-cin venous phase was higher in PGL group than that in GC group (P<0.05). The best single parameter for differential diagnosis of PGL and GC was λHUon 70 keV monochromatic images, and taking λHU=2.63 mg/cm3as threshold values, the sensitivity and specificity were 62.5% and 100%, respectively. Conclusion Quantitative assessment with gemstone spectral imaging quantitiative parameters is practical in differential diagnosis of PGL and GC.
Lymphoma; Stomach neoplasms; Tomography, X-ray computed; Spectral imaging
广西医疗卫生适宜技术研究与开发课题(S201417-06)、广西研究生教育创新计划(YCBZ2014029)。
唐琪(1992—),女,湖北宜昌人,在读硕士。研究方向:肿瘤影像诊断。E-mail: 1157932721@qq.com
谢东,广西医科大学附属肿瘤医院影像诊断中心,530021。E-mail: xiedong0310@163.com
2016-08-09
2016-11-04
腹部影像学
10.13929/j.1003-3089.201608039
R735.2; R814.42
A
1003-3289(2017)02-0221-06

