脑梗死合并脑白质疏松相关因素分析
张 捷 陈海亮 许 多 张林艳 周杜娟
福州神经精神病防治院神经内科 福州 350008
脑梗死合并脑白质疏松相关因素分析
张 捷 陈海亮 许 多 张林艳 周杜娟
福州神经精神病防治院神经内科 福州 350008
目的 探讨脑白质疏松(leukoaraiosis,LA)的主要发病因素与发病机制,以达到降低发病率及预防脑梗死的目的。方法 收集2013-10—2015-10在我院神经科住院的脑梗死患者,根据典型影像学改变分为LA组与非LA组。对比2组可能危险因素。采用SPSS 17.0软件和S-PLUS 8.0软件,先对可能的危险因素行单因素分析,再用Logistic回归对初步筛选出的危险因素行多因素分析。比较LA的严重程度与筛选出的相关因素的关系。结果 (1)2组间危险因素的单因素分析显示,年龄、体重指数、冠心病、血红蛋白、同型半胱氨酸、脑梗死分型比较差异有统计学意义(均P<0.05)。(2)多因素Logistic回归分析显示,年龄(OR=1.142,95%CI:1.052~1.239,P=0.001)和同型半胱氨酸(OR=1.212,95%CI:1.023~1.436,P=0.026)是LA的独立危险因素。(3)Bootstrap法估计相加交互作用指标的可信区间显示,年龄和同型半胱氨酸与LA的发病存在正相加交互作用[RERI=0.01487(95%CI:0.000 32~0.061 15)、AP=0.011 14(95%CI:0.000 61~0.035 63)、S=1.047(95%CI:1.012 70~1.081 76)]。(4)有序多分类Logistic回归分析显示,年龄(β=0.093,95%CI:0.056~0.129,P=0.000)越大,LA程度越严重;LA程度越严重,MMSE评分(β=-0.137,95%CI:-0.189~-0.085,P=0.000)越低。结论 (1)年龄和同型半胱氨酸是LA的两个独立危险因素。(2)年龄和同型半胱氨酸与LA的发病存在正相加交互作用,即这两因素的联合作用大于单独作用之和。(3)年龄越大,LA程度越严重。(4)LA程度越严重,认知功能障碍越明显。(5)LA的发病机制不清楚,可能与脑小血管病变有关。
脑白质疏松;同型半胱氨酸;脑梗死
脑白质疏松(leukoaraiosis,LA)由Hachinski等于1987年首先提出,是一个影像学概念,用以描述脑室周围及皮质下白质的弥漫性斑点状或班片状改变,其CT表现为低密度影,MRI T2加权或FLAIR像表现为高信号。随CT、MRI检查的普及,发现脑梗死患者中LA占高比例,脑梗死与LA的关系密切,可能是一种疾病的不同阶段或是不同的类型,若在LA阶段加以控制,就可能避免脑梗死的发生和发展。本研究通过分析脑梗死合并LA患者的相关因素,探讨其主要危险因素与发病机制,以加深对LA的认识,达到降低发病率及预防脑梗死的目的。本项目已获得福建省福州神经精神病防治院医学伦理委员会的批准。
1 资料与方法
1.1 一般资料 选择2013-10—2015-10在我院神经内科住院的脑梗死患者150例,男90例,女60例,平均70.10岁。根据典型影像学改变分为LA组87例与非LA组63例。
1.2 入选标准 (1)年龄≥18岁。(2)均为我院神经内科住院的脑梗死患者。(3)脑梗死的诊断符合世界卫生组织(WHO)规定缺血性卒中的诊断标准,并经头颅CT或MRI检查确诊。(4)能配合完成头颅CT或MRI、颈部血管彩超、临床生化指标及MMSE量表等检查。
1.3 排除标准 (1)非脑梗死。(2)各种原因(如严重的失语、视觉听觉障碍、精神障碍、意识障碍)不能完成临床检查和数据收集。(3)其他类型的脑白质病变(如外伤、缺氧性脑病、遗传性代谢性疾病、自身免疫性疾病、中毒、感染、脑积水、恶性肿瘤、理化因素等导致的脑白质变性)。(4)严重的内科疾病(如肝肾功能不全、甲状腺功能减退)。(5)正在服用药物(如他汀类降脂药、降压药、糖尿病药物、叶酸、B族维生素、卡马西平、苯妥英钠、氨甲喋呤等)。
1.4 数据收集 入院当日详细询问患者的病史、既往史和个人史,包括性别、年龄、有无高血压、糖尿病、冠心病、高脂血症、卒中史及吸烟、饮酒情况。脑卒中、高血压、冠心病、糖尿病、高脂血症的诊断参照WHO诊断标准。测量患者的身高、体质量、收缩压和舒张压,进行MMSE量表评估。次日清晨空腹采肘静脉血,送检分析血细胞和临床生化指标,包括血红蛋白、葡萄糖、总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、同型半胱氨酸等。相关医技科室进行颈部动脉斑块、颈动脉内膜中层厚度、心电图及头颅CT或MRI(包括T1WI、T2WI和FLAIR)等检查。
1.5 LA的分级 采用Aharon-Ptrelz标准将脑白质疏松分为5级:0级,侧脑室周围未见低密度区;1级,侧脑室额角或枕角可见低密度区;2级,侧脑室额角和枕角可见低密度区;3级,沿侧脑室周围可见连续低密度区;4级,侧脑室周围及放射冠可见低密度区。

2 结果
2.1 LA组与非LA组危险因素的单因素分析 见表1。年龄、体重指数、冠心病、血红蛋白、同型半胱氨酸、梗死分型比较差异有统计学意义(均P<0.05)。

表1 LA组与非LA组危险因素的单因素分析结果
注:与非LA组比较,*P<0.05
2.2 多因素Logistic回归分析 见表2。将年龄、体重指数、冠心病、血红蛋白、同型半胱氨酸及脑梗死分型为自变量,以LA的有无为因变量进行分析显示,年龄(OR=1.142,95%CI:1.052~1.239,P=0.001)和同型半胱氨酸(OR=1.212,95%CI:1.023~1.436,P=0.026)是LA的独立危险因素。
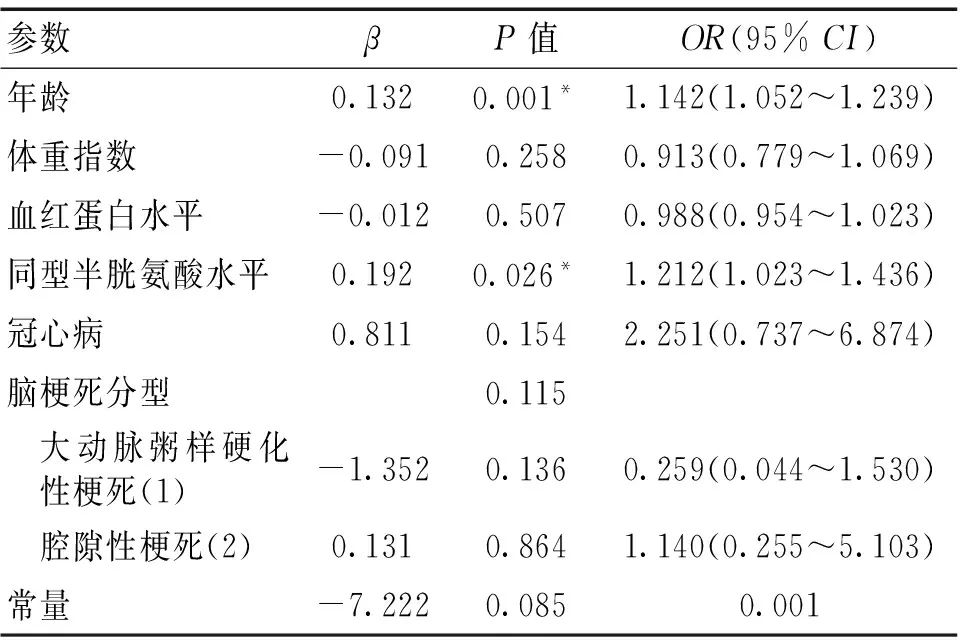
表2 多因素Logistic回归分析结果
注:*P<0.05
2.3 年龄和同型半胱氨酸两因素相加和相乘交互作用分析 应用S-PLUS软件中的Bootstrap法估计相加交互作用指标的可信区间显示,RERI=0.014 87(95%CI:0.000 32~0.061 15),AP=0.011 14(95%CI:0.000 61~0.035 63),S=1.047(95%CI:1.012 70~1.081 76),RERI和AP的95%CI>0,S的95%CI>1,可认为年龄和同型半胱氨酸与LA的发病存在相加交互作用。两因素相加交互作用引起的超额相对危险度为0.014 87,LA发病中归因于两者交互作用的比例为1.114%。S指数>1说明年龄和同型半胱氨酸联合作用大于两因素的单独作用之和。Logistic回归分析显示,年龄、同型半胱氨酸的P值>0.05,说明两者间无相乘交互作用。
2.4 有序多分类Logistic回归分析 见表3和表4。将年龄和同型半胱氨酸作为协变量,以LA的分级(0~4)作为因变量进行分析显示,年龄(β=0.093,95%CI:0.056~0.129,P=0.000)越大,LA越严重。将MMSE评分作为协变量,LA的分级(0~4)作为因变量进行分析显示,LA越严重,MMSE评分(β=-0.137,95%CI:-0.189~-0.085,P=0.000)越低。
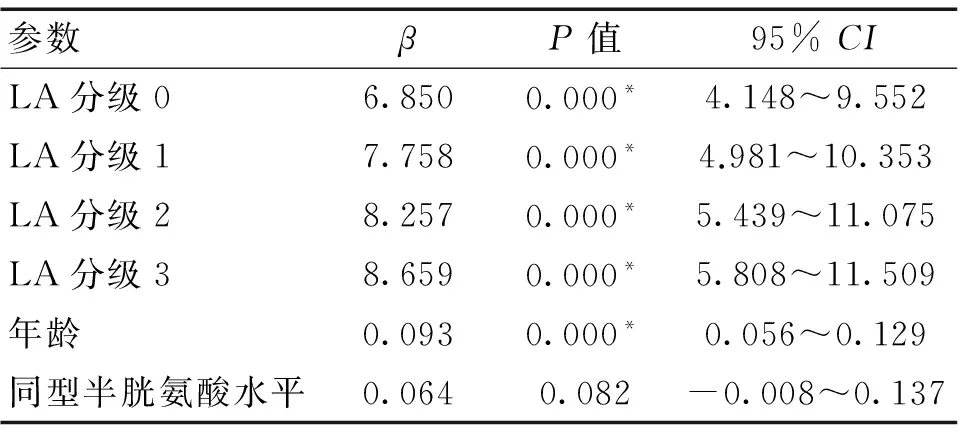
表3 LA严重程度与危险因素的有序Logistic回归分析结果
注:*P<0.05
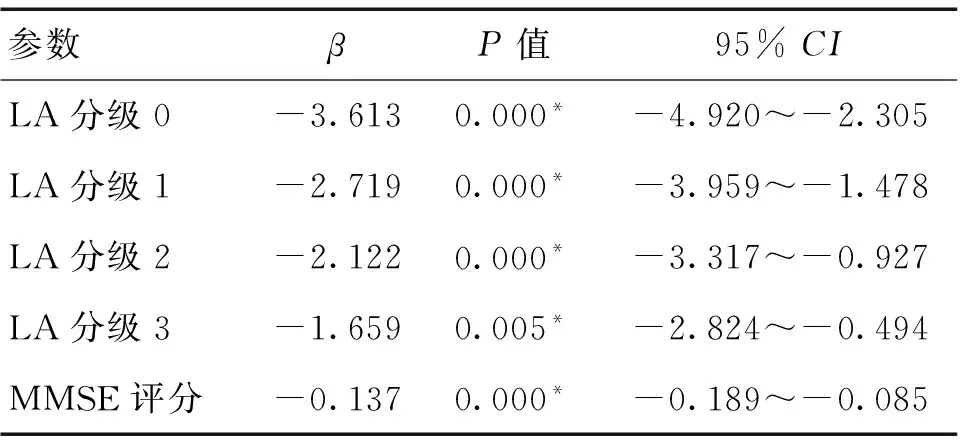
表4 LA严重程度与MMSE评分的有序Logistic回归分析结果
注:*P<0.05
3 讨论
LA以往被认为是正常老化过程的一部分,被人们忽视,甚至在神经影像表现上也被认为是一种无害的发现。近来,人们认识到LA在认知和运动功能的下降、抑郁症、脑血管疾病、排尿障碍及其他脑损伤(腔隙性梗死、脑萎缩和胼胝体形态)方面均有一定作用,且预后差,治疗手段有限。因此,寻找和控制危险因素,预防病变的形成和进展,意义重大。
LA的发病机制知之甚少,已有的假说认为,可能是由于慢性缺血导致内皮功能障碍,随之发生小动脉硬化的结果。目前研究主要从血流动力学和微血管病变进行阐述。Webb等[2]认为,LA与脑动脉搏动密切相关,而后者依赖于主动脉搏动和大血管硬化。动脉硬化降低动脉波形的阻尼,从而增加大脑中动脉血流的搏动,且传递到脑小血管,潜在造成脑小血管的破坏,导致LA。Chung等[3]认为,颈静脉回流在LA发病机制中起关键作用。颈静脉回流通过持续或长期重复逆行脑静脉压传播和静脉流出量不足,可能导致慢性脑静脉高压、脑静脉的结构异常变化、脑血流量的降低、内皮功能障碍及脑白质血管源性水肿等,进而导致LA。Huang等[4]认为,LA脑白质的小动脉壁增厚和硬化与细胞外基质成分的累积有关。这些变化可能阻碍白质血管周围组织液的淋巴引流,导致LA白质的液体增加。
本组病因学研究显示,年龄和同型半胱氨酸是LA的两个独立危险因素。年龄和同型半胱氨酸的OR值分别是1.192和1.191,即年龄增加1岁,患LA的危险性增加1.192倍;同型半胱氨酸增加1 μmol/L,患LA的危险性增加1.191倍。两因素相加和相乘交互作用分析显示,年龄和同型半胱氨酸与LA的发病存在正相加交互作用,即两因素的联合作用大于单独作用之和。年龄和同型半胱氨酸同时也是脑小血管病变的危险因素,支持LA是一种脑小血管病的观点。缺血性卒中的危险因素包括高血压、糖尿病、高脂血症、心房纤颤、吸烟及动脉粥样硬化斑块狭窄等。本组LA患者虽然也有上述因素的存在,但与对照组比较,这些因素只是混杂因素并无统计学意义。这与Schulz等[5]的研究结果一致。该研究显示,LA与吸烟、高胆固醇血症、缺血性心脏病、周围血管疾病或糖尿病不相关,也与颈动脉疾病的严重程度无关,提示其病因学独立于动脉粥样硬化性疾病之外。
同型半胱氨酸导致LA的可能机制包括:(1)脑室周围脑白质的解剖位置处于分水岭区域,几乎没有侧支循环,易受到损害和发生病理解剖的改变。(2)一种依赖半胱天冬酶-1的程序性细胞死亡模式pyroptosis或参与LA的发病机制。半胱天冬酶-1被高水平激活时,会引起细胞死亡,并释放炎性细胞内容物,激活免疫反应[6]。同型半胱氨酸通过半胱天冬酶-1依赖性炎性体活化,优先诱导内皮细胞发生pyroptosis[7],造成血管内皮细胞功能障碍和血脑屏障的通透性增高,导致大分子物质外渗和局部水肿,引起白质损害。(3)同型半胱氨酸引起颅内小动脉玻璃样变性和增厚,进而阻碍白质血管周围组织液的淋巴回流,加重白质的液体聚集,最终形成LA。年龄是LA的另一个危险因素,与同型半胱氨酸有正相加交互作用。有序Logistic回归分析显示,LA的严重程度随老年人年龄的增加而加重,这种现象的机制可能是:老年人的血脑屏障功能减退,受到有害因素的侵袭更易发生通透性的改变;同时,脑白质髓鞘内的卵磷脂随年龄增长逐年减少,易发生脱髓鞘性改变,从而导致LA的程度不断加剧。
认知功能下降与LA有密切的相关性,严重的LA患者发生痴呆的风险增加了几乎4倍[8]。脑白质纤维束的损伤可能导致皮质-皮质下之间的网络全面断开,导致全面认知障碍和血管性痴呆。本组有序Logistic回归分析显示,LA与MMSE评分相关,即患者认知功能的损害随LA程度的加重而加重。LA的主要临床表现就是认知的下降,从而导致生活质量的不断恶化。Price等[9]的研究提示,LA牵涉到AD/VAD谱系痴呆工作记忆和视空间障碍的特定阈值点。当LA累及3%以上白质时,工作记忆将受损;更多的脑白质疏松(13%)受累,会出现视空间障碍。一个纵向研究[10]表明,尽管广泛性脑白质疏松患者的认知功能损害起初是轻度的,但随着时间的推移,会发生进一步的全面恶化。
目前看来,LA是一逐渐进展性疾病,尤其后期LA分级达4级时,患者可能出现严重的痴呆,往往卧床不起,生活不能自理,给个人、家庭和社会带来沉重的负担。因此,寻求治疗与预防LA进展的药物与方法对患者和社会都有重要的意义。目前对于LA尚无确切的治疗方法,早期口服维生素B6、B12及叶酸纠正同型半胱氨酸水平,可能预防白质病变的进展。但这仍需要大量的临床研究予以进一步的证实。本研究的不足之处是样本数量偏小,有些其他危险因素或未归纳其中,LA的病因与发病机制仍不清楚,仍需大样本的病例对照研究予以明确。
[1] 潘金仁,陈坤.队列研究资料相加交互作用可信区间的Bootstrap法估计[J].中华流行病学杂志,2010,31(7):808.
[2] Webb AJ,Simoni M,Mazzucco S,et al.Increased Cerebral Arterial Pulsatility in Patients With Leukoaraiosis:Arterial Stiffness Enhances Transmission of Aortic Pulsatility[J].Stroke,2012,43(10):2 631.
[3] Chung CP,Hu HH.Pathogenesis of leukoaraiosis:role of jugular venous reflux[J].Med Hypotheses,2010,75(1):85.
[4] Huang YH,Zhang WW,Lin L,et al.Could changes in arterioles impede the perivascular drainage of interstitial fluid from the cerebral white matter in leukoaraiosis?[J].Neuropathol Appl Neurobiol,2010,36(3):237.
[5] Schulz U,Meagher T,Rothwell PM,et al.Leukoaraiosis is unrelated to carotid stenosis or risk factors for atherosclerosis[J].J Neurol Neurosurg Psychiatry,2010,81:e18.
[6] 邬皓晨,陈勇军,徐易尘,等.Caspase-1在炎症及程序性细胞死亡过程中的作用[J].中国细胞生物学学报,2011,33(2):182.
[7] Xi H,Zhang YL,Xu YJ,et al.Caspase-1 Inflammasome Activation Mediates Homocysteine-Induced Pyrop-Apoptosis in Endothelial Cells[J]. Circ Res,2016,118(10):1 25-1 539.
[8] Debette S,Beiser A,DeCarli C,et al.Association of MRI markers of vascular brain injury with incident stroke,mild cognitive impairment,dementia,and mortality:the Framingham Offspring Study[J].Stroke,2010,41(4):600.
[9] Price CC,Mitchell SM,Brumback B,et al.MRI-leukoaraiosis thresholds and the phenotypic expression of dementia[J].Neurology,2012,79(8):734.
[10] Jokinen H,Kalska H,Ylikoski R,et al.Longitudinal cognitive decline in subcortical ischemic vascular disease:the LADIS Study[J].Cerebrovasc Dis,2009,27(4):384.
(收稿2016-08-08)
Correlation factor analysis of cerebral infarction complicated with leukoaraiosis
ZhangJie,ChenHailiang,XuDuo,ZhangLinyan,ZhouDujuan
DepartmentofNeurology,FuzhouPreventionandCureHospitalforNeuropathyandPsychosis,Fuzhou350008,China
Objective To explore the main pathogenic factors and pathogenesis of leukoaraiosis(LA)for the purpose of reducing its incidence and preventing cerebral infarction.Methods The selected inpatients with cerebral infarction in the department of neurology in our hospital from October 2013 to October 2015 were collected continuously.According to the typical imaging changes,cases were divided into LA group and non-LA group.The possible risk factors were compared between two groups.The data were analyzed by SPSS 17.0 and S-PLUS 8.0.First,the possible risk factors were analyzed by univariate analysis,and then Logistic regression was used in multivariate analysis.The relationship between the severity of LA and the screened factors were compared.Results Univariate analysis of the risk factors showed that the differences in age,body mass index,coronary heart disease,hemoglobin,homocysteine cevebral infarction subtype were statistically significant between the two groups(allP<0.05).Then the multivariate Logistic analysis revealed that age(OR=1.142,95%CI:1.052 to 1.239,P=0.001)and homocysteine(OR=1.212,95%CI:1.023 to 1.436,P=0.026)were the independent risk factors for LA.Additionally,the additive interaction of Bootstrap estimation method for confidence intervals revealed that both age and homocysteine had additive interactions with LA[RERI=0.014 87(95%CI:0.000 32 to 0.061 15),AP=0.011 14(95%CI:0.000 61 to 0.035 63),S=1.047(95%CI:1.012 70 to 1.081 76)].Furthermore,Logistic regression analysis on ordinal multi-classification data revealed that the older they grew,the more seriously the degree of LA(β=0.093,95%CI:0.056 to 0.129,P=0.000),and the lower the MMSE scores(β=-0.137,95%CI:-0.189 to -0.085,P=0.000).Conclusion Firstly,age and homocysteine are the two independent risk factors for LA.Secondly,age and homocysteine have positive additive interactions with LA,namely the combined effect of these two factors is greater than the sum of the single effects.Thirdly,the older they grow,the more seriously the degree of LA.Fourthly,the more serious the degree of LA is,the more obvious cognitive impairment.Finally,the pathogenesis of LA remains unclear,which may be related to cerebral small vessel diseases.
Leukoaraiosis;Homocysteine;Cerebral infarction
福州市卫生局青年科研项目(2013-S-wq21)
R743.33
A
1673-5110(2017)02-0005-04

