白癜风免疫微环境对黑素细胞CXCL10表达的影响
李博为 李舒丽 杨钰琪 张伟刚 刘 玲 高天文 李春英
·论著·
白癜风免疫微环境对黑素细胞CXCL10表达的影响
李博为 李舒丽 杨钰琪 张伟刚 刘 玲 高天文 李春英
目的: 明确白癜风免疫微环境对黑素细胞CXCL10表达的影响。方法: 采用qRT-PCR检测进展期白癜风患者皮损组织中的细胞因子;采用qRT-PCR及ELISA检测白癜风免疫微环境中上调的细胞因子对黑素细胞系PIG1 CXCL10表达和分泌。结果: 进展期白癜风患者皮损组织中IFN-γ、TNF-α和IL-1β mRNA表达上调;三者联合刺激显著上调PIG1细胞CXCL10 mRNA的表达以及蛋白分泌,并呈现时间依赖性。结论: 白癜风局部免疫微环境促进黑素细胞表达及分泌CXCL10,可能参与白癜风发病。
白癜风; 免疫微环境; 黑素细胞; 趋化因子CXC配体10
白癜风是一种局部或广泛的黑素细胞被破坏的色素脱失性疾病,目前关于其致病机理尚不明确。现有研究表明,自身免疫在白癜风发病中扮演重要角色,白癜风患者体内存在免疫细胞异常活化、自身抗体大量产生[1]。趋化因子是能够吸引白细胞迁移的一类低分子量蛋白质,在免疫反应中具有关键作用,趋化因子CXC配体10(chemokine C-X-C motif ligand 10,CXCL10)是其中重要的一员。现有研究表明,白癜风患者血清高表达CXCL10,其可能参与白癜风发病和进展[2]。然而,黑素细胞是否具有合成分泌CXCL10的功能尚未见报道。本研究旨在离体细胞水平研究白癜风免疫微环境对黑素细胞CXCL10表达和分泌的影响。
1 材料与方法
1.1 主要仪器与试剂 酶标仪、PCR扩增仪和荧光定量PCR仪为美国BIO-RAD公司生产。人永生化黑素细胞系PIG1由美国芝加哥大学Caroline Le Poole教授馈赠,254培养基和胎牛血清购于美国Gibco公司,总RNA提取试剂盒购于安美生物科技公司,反转录cDNA试剂盒和SYBR Premix Ex Taq II kit购于大连Takara公司,PCR引物由大连Takara公司设计并合成,重组人IFN-γ、TNF-α和IL-1β刺激因子购于Cell Signaling Technology公司,CXCL10 ELISA检测试剂盒购于美国RD公司。
1.2 方法
1.2.1 皮肤组织样本处理 白癜风患者皮损组织来源于我科皮肤病理中心,6例进展期患者的诊断符合2003年中西医结合学会皮肤病专业委员会色素病组颁布的白癜风临床诊断分型标准修订版[3]。6例正常皮肤样本来源于同期接受美容手术患者的非曝光部位,且均无自身免疫性疾病及家族史。两组样本性别匹配,年龄无统计学差异。标本取材均经患者及志愿者知情同意并经过第四军医大学西京医院伦理委员会批准。正常皮肤和白癜风患者皮损组织样本从液氮罐取出,各取表皮面积相等的50 mg全层皮片于灭菌研钵中磨碎,呈粉末状后加入1 mL Trizol在冰上裂解组织,提取总RNA。
1.2.2 细胞培养及处理 PIG1细胞用含5% FBS的254培养基于37℃、5% CO2条件下培养。将PIG1细胞接种于6孔板,分为4个处理组,即单独刺激3组和联合刺激1组,血清饥饿16 h后,分别予以IFN-γ(10 ng/mL)、TNF-α(10 ng/mL)、IL-1β(10 ng/mL)、IFN-γ+TNF-α+IL-1β联合刺激24 h后收集细胞和上清;另外,联合刺激组进行时间梯度实验,在处理后12、24、48和72 h收集细胞和上清,分别检测CXCL10 mRNA表达及蛋白分泌水平。
1.2.3 qRT-PCR检测细胞因子mRNA表达 所有皮肤组织和经过不同细胞因子刺激后的细胞用Trizol试剂提取总RNA后,严格按照反转录cDNA试剂盒说明书进行操作,采用qRT-PCR检测IFN-γ、TNF-α、IL-1β、TGF-β、IL-17、IL-21、IL-22、IL-23及CXCL10的mRNA水平,实验所用特异引物序列详见表1。

表1 RT-PCR实验所用引物序列
1.2.4 ELISA检测CXCL10分泌 收集不同刺激处理预定时间的细胞上清,按照ELISA检测试剂盒操作说明配制好所用试剂,进行加样、加工作液、37℃孵育、加底物溶液和终止溶液后,即刻用酶标仪在450 nm读取数值并分析数据。
1.2.5 统计学方法 所有实验均进行至少3次独立重复,实验结果采用Graphpad Prism 5统计软件进行分析,采用student-t检验进行统计,P<0.05为差异有统计学意义。
2 结果
2.1 进展期白癜风患者皮损组织局部细胞因子mRNA表达情况 提取健康人和进展期白癜风患者皮损组织RNA后采用qRT-PCR检测多种相关细胞因子mRNA表达变化。结果显示,进展期白癜风患者皮损组织中IFN-γ、TNF-α和IL-1β mRNA表达水平显著升高,而TGF-β、IL-17、IL-21、IL-22和IL-23 mRNA表达情况在进展期白癜风患者皮损和健康人之间没有显著差异(图1),表明进展期白癜风患者皮损组织浸润的炎症因子以IFN-γ、TNF-α及IL-1β为主,而非Th17型细胞因子。

图1 进展期白癜风患者皮损组织局部细胞因子mRNA表达情况(**P<0.01,***P<0.001)
2.2 细胞因子诱导PIG1细胞CXCL10 mRNA的表达情况 通过上述上调的细胞因子刺激PIG1细胞,发现IL-1β单独刺激并不能上调PIG1细胞CXCL10 mRNA的表达,TNF-α轻度上调CXCL10 mRNA,但无显著差异,而IFN-γ及其与TNF-α、IL-1β联合能显著上调PIG1细胞CXCL10 mRNA表达(图2a)。且三者联合处理可以时间依赖方式增加PIG1细胞CXCL10 mRNA的表达(图2b)。
2.3 细胞因子诱导PIG1细胞CXCL10的分泌情况 本实验检测了筛选出的三种细胞因子对PIG1细胞CXCL10的分泌情况。结果显示,IFN-γ和TNF-α单独刺激或者三者联合刺激均能显著促进CXCL10分泌,但是IL-1β的单独刺激仍然不能诱导其分泌(图3a)。此外,我们检测三种细胞因子联合处理不同时间后CXCL10的分泌,发现三者联合处理同样以时间依赖方式增加PIG1细胞CXCL10分泌(图3b)。以上结果提示,和CXCL10 mRNA上调一致,白癜风患者皮损免疫微环境的异常促进黑素细胞分泌CXCL10。
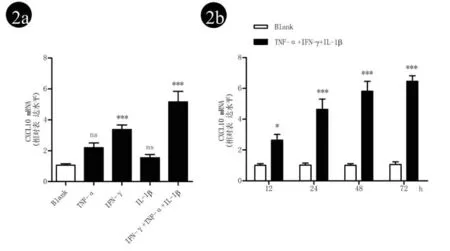
图2 2a:细胞因子单刺激和联合刺激PIG1细胞24 h后CXCL10 mRNA的表达情况(***P<0.001);2b:IFN-γ,TNF-α及IL-1β联合刺激PIG1细胞不同时间后CXCL10 mRNA的表达情况(*P<0.05,***P<0.001)

图3 3a:细胞因子单刺激和联合刺激PIG1细胞24 h后CXCL10的分泌情况(*P<0.05,***P<0.001);3b:IFN-γ,TNF-α及IL-1β联合刺激PIG1细胞不同时间后CXCL10的分泌情况(**P<0.01,***P<0.001)
3 讨论
白癜风是一种常见的色素脱失性疾病,以表皮黑素细胞被破坏导致皮肤黏膜白斑为特征。黑素细胞被破坏的机制迄今尚未完全阐明,但比较公认的是,T细胞免疫应答是导致表皮黑素细胞免疫损伤的主要原因[4,5]。研究发现,白癜风患者的外周血中CD4+和CD8+T细胞的数量及比例发生变化[6],且白癜风患者皮损有大量促炎细胞因子及CD8+T细胞浸润,最终导致黑素细胞免疫损伤。我们通过检测白癜风患者皮损局部细胞因子表达,发现白癜风皮损以Th1型细胞因子IFN-γ为主,其次为促炎因子TNF-α及IL-1β,而Th17型细胞因子均无明显升高。这为应用于银屑病患者的以拮抗Th17型细胞因子的生物制剂并不能有效缓解白癜风病情提供了合理解释,表明白癜风与银屑病患者存在不同的致病细胞因子表达谱。van den Boorn等[7]之前分离白癜风皮损CD8+T细胞,发现这些CD8+T细胞在抗原刺激活化后,可分泌较多的IFN-γ及TNF-α,认为活化的CD8+T细胞是这些细胞因子的主要来源。
最近大量研究证实,IFN-γ、TNF-α及IL-1β均可诱导多种细胞分泌趋化因子促使T细胞向外周组织定向迁移。有学者报道,白癜风患者皮损高表达IFN-γ诱导型的Th1趋化因子CXCL10,伴随高表达其受体CXCR3的CD8+T细胞浸润;并在小鼠模型中证实CXCL10驱动黑素细胞特异的CD8+T细胞向皮损处定向迁移,介导黑素细胞损伤;此外,使用CXCL10中和抗体可以阻止色素脱失并促进白癜风小鼠复色[2]。近期,我国项蕾红研究团队通过临床样本研究证实,白癜风患者血清中高表达CXCL10,与VASI(Vitiligo Area Scoring Index)评分正相关,而且进展期白癜风患者治疗后其血清CXCL10水平降低[8]。因此,阐明CXCL10的表达机制对理解白癜风的发病进展及治疗策略选择,均具有重要意义。以往研究发现,CXCL10可由角质形成细胞、内皮细胞、成纤维细胞、树突状细胞、中性粒细胞等分泌[9,10]。黑素细胞是否分泌CXCL10尚不清楚。我们的研究首次发现,IFN-γ、TNF-α及IL-1β均可诱导黑素细胞分泌CXCL10,且以三者联合效果最为显著。此外,我们注意到TNF-α单独刺激24 h黑素细胞显著促进CXCL10分泌,但其mRNA水平仅轻度上调无显著差异。Harris等[11]研究发现,TNF-α处理3 h后CXCL10 mRNA水平显著上调,8 h后降至与对照组无差异;而ELISA检测发现8 h时CXCL10分泌明显高于对照组,表明TNF-α刺激后,CXCL10 mRNA与蛋白水平并不完全一致,这一现象为我们的研究提供了一定的解释。
综合我们的研究及国内外进展,我们提出,白癜风皮损局部浸润的CD8+T细胞活化后可分泌IFN-γ、TNF-α等细胞因子,形成局部免疫微环境,可诱导黑素细胞分泌CXCL10,借此募集表达其受体CXCR3的CD8+T细胞迁移至皮损,进一步促进IFN-γ、TNF-α等的分泌,形成正反馈环路,放大白癜风皮损局部免疫反应。
综上,我们明确了白癜风皮损以IFN-γ、TNF-α及IL-1β显著上调的免疫微环境,进一步在体外证实这些细胞因子可诱导黑素细胞合成并分泌趋化因子CXCL10,促进白癜风局部T细胞免疫应答,参与白癜风发病及进展。
[1] Laddha NC, Dwivedi M, Mansuri MS, et al. Role of oxidative stress and autoimmunity in onset and progression of vitiligo[J]. Exp Dermatol,2014,23(5):352-353.
[2] Rashighi M, Aqarwal P, Richmond JM, et al. CXCL10 is critical for the progression and maintenance of depigmentation in a mouse model of vitiligo[J]. Sci Transl Med,2014,6(223):223ra23.
[3] 中国中西医结合学会皮肤性病专业委员会色素病学组.白癜风临床分型及疗效标准(2003年修订稿)[J].中华皮肤科杂志,2004,37(7):440.
[4] Zhang Y, Liu L, Jin L, et al. Oxidative stress-induced calreticulin expression and translocation: new insights into the destruction of melanocytes[J]. J Invest Dermatol,2014,134(1):183-191.
[5] Richmond JM, Frisoli ML, Harris JE. Innate immune mechanisms in vitiligo: danger from within[J]. Curr Opin Immunol,2013,25(6):676-682.
[6] Dwivedi M, Laddha NC, Arora P, et al. Decreased regulatory T-cells and CD4(+)/CD8(+) ratio correlate with disease onset and progression in patients with generalized vitiligo[J]. Pigment Cell Melanoma Res,2013,26(4):586-591.
[7] van den Boorn JG, Konijnenberg D, Dellemijn TA, et al. Autoimmune destruction of skin melanocytes by perilesional T cells from vitiligo patients[J]. J Invest Dermatol,2009,129(9):2220-2232.
[8] Wang XX, Wang QQ, Wu JQ, et al. Increased expression of CXCR3 and its ligands in patients with vitiligo and CXCL10 as a potential clinical marker for vitiligo[J]. Br J Dermatol,2016,174(6):1318-1326.
[9] Antonelli A, Ferrari SM, Giuggioli D, et al. Chemokine (C-X-C motif) ligand (CXCL) 10 in autoimmune diseases[J]. Autoimmun Rev,2014,13(3):272-280.
[10] Groom JR, Lauster AD. CXCR3 ligands: redundant, collaborative and antagonistic functions[J]. Immnol Cell Biol,2011,89(2):207-215.
[11] Harris DP, Bandyopadhyay S, Maxwell TJ, et al. Tumor necrosis factor (TNF)-α induction of CXCL10 in endothelial cells requires protein arginine methyltransferase 5 (PRMT5)-mediated nuclear factor (NF)-κB p65 methylation[J]. J Biol Chem,2014,289(22):15328-15339.
(收稿:2016-09-07 修回:2016-09-27)
Effects of immune microenvironment on the expression of CXCL10 in melanocytes of vitiligo
LIBowei,LIShuli,YANGYuqi,ZHANGWeigang,LIULing,GAOTianwen,LIChunying.
DepartmentofDermatology,XijingHospital,FourthMilitaryMedicalUniversity,Xi'an710032,China
LIChunying,E-mail:lichying@fmmu.edu.cn
Objective: To determine the effects of immune microenvironment on the expression of CXCL10 in melanocytes of vitiligo. Methods: Quantitative Real-Time PCR was performed to detect the expression of cytokines in skin lesions from progressive vitiligo patients. And then, a melanocyte cell line-PIG1 was stimulated by the cytokines that were up-regulated in vitiligo lesions and to measure the expression and secretion of CXCL10 in PIG1 cells. Results: The mRNA level of IFN-γ, TNF-α and IL-1β were up-regulated in the skin lesions of progressive vitiligo patients. When a combined stimulation with the three cytokines, the expression and secretion of CXCL10 in PIG1 cells were up-regulated significantly, in a time-dependent manner. Conclusion: Immune microenvironment in vitiligo can promote the expression and secretion of CXCL10 in melanocytes, which may contribute to the onset of vitiligo.
vitiligo; immune microenvironment; melanocytes; CXCL10
国家自然科学基金资助项目(编号:81602764, 81472893)
第四军医大学西京皮肤医院,陕西西安,710032
李春英,E-mail: lichying@fmmu.edu.cn

