感染性和寄生虫性皮肤病的皮肤镜诊断专家共识
中国中西医结合学会皮肤性病学分会皮肤影像学组
·专家共识·
感染性和寄生虫性皮肤病的皮肤镜诊断专家共识
中国中西医结合学会皮肤性病学分会皮肤影像学组
皮肤镜是一种非侵袭性在体诊断技术,初用于色素性皮肤病的诊断,后又广泛应用于多种常见皮肤病的诊断和鉴别诊断。本共识分别从病毒感染性皮肤病、细菌感染性皮肤病、真菌感染性皮肤病、寄生虫性皮肤病等几个方面,详细阐述几种常见感染性和寄生虫性皮肤病的皮肤镜表现,提供部分感染性和寄生虫性皮肤病的皮肤镜诊断和鉴别诊断依据。
1 病毒性皮肤病
1.1 疣 根据疣的临床表现及部位,皮肤疣可分为寻常疣、扁平疣、跖疣、尖锐湿疣等,疣状表皮发育不良也被认为与人乳头瘤病毒感染密切相关。
寻常疣 寻常疣在皮肤镜下呈多数紧密排列的乳头瘤样结构,乳头状瘤中心可见红色点状或袢状血管,周围绕以白色的晕,似蛙卵样,这些点状血管比扁平疣中的稍大,常伴有出血及毛细血管血栓(图1a)[1]。
扁平疣 扁平疣的皮肤镜特点为浅褐色至黄色背景上规则分布的小红点,这些小红点也称为点状血管,病理上对应为真皮乳头层毛细血管的顶端(图1b)[2]。
跖疣 跖疣通常无点状或袢状血管,皮肤镜下可见黄色无结构区域,其上有多数不规则分布的红褐色至黑色小点或线状条纹(出血),出血是由于足跖部长期血管压力较高所致(图1c)。这些出血点有助于跖疣与胼胝鉴别,后者无出血点,表现为边界清楚的黄白色均质结构,中央可见红色至青紫色无结构区(图1d)[3]。
尖锐湿疣 尖锐湿疣的常见皮肤镜模式为非特异性模式、指状模式、镶嵌模式及瘤状模式等,且同一皮损中常有两种模式并存。镶嵌模式由多数直径大小相仿,类似马赛克的扁平圆形结构组成(图1e)。瘤状模式为短的圆形簇集性的瘤样突起,直径和长度均相似(图1f)。指状模式则表现为多数较长的独立的指状突起,直径相仿,长短不一(图1g)。尖锐湿疣的皮肤镜血管表现有小球状血管、发夹状血管及点状血管等,也有部分皮损无血管表现。此外,尖锐湿疣在皮肤镜下还可见到色素沉着和角化[4]。
典型的尖锐湿疣通过肉眼观察易诊断,但某些不典型皮损(尤其是微小的尖锐湿疣)常需与多种疾病相鉴别。皮肤镜下,尖锐湿疣常见的瘤样模式和指状模式与脂溢性角化病的沟壑样(或脑回样)结构相似,且点状及发夹状血管、色素沉着、角化等表现既可见于尖锐湿疣,也可见于脂溢性角化病,故某些尖锐湿疣很难与生殖器部位的脂溢性角化病鉴别。由于尖锐湿疣很少见到粉刺样开口和粟丘疹样囊性结构,这两种皮肤镜表现往往提示脂溢性角化病。前庭乳头状瘤又称假性湿疣,呈前庭上皮或小阴唇内侧面质软的乳头瘤样改变,表面光滑,颜色与周边黏膜相同,无自觉症状,易误诊为尖锐湿疣。皮肤镜下,前庭乳头状瘤呈对称的透明细指状结构,粗细较均匀或末端略膨大,并行排列,基底彼此独立,中心可见不规则的索状血管(图1h)。而尖锐湿疣往往为多发性、形状不规则的突起,颜色更白,位于同一基底之上,基底宽大而尖端较细,血管呈团状。此外,尖锐湿疣的疣体经醋酸白试验后在皮肤镜下变白,血管结构几乎消失,可能是醋酸使疣体表面角蛋白短暂变性,其内血管袢短暂收缩、血流减少所致[5]。上述变化在皮肤镜下尤为明显,有助于尖锐湿疣的诊断和鉴别诊断。
疣状表皮发育不良 疣状表皮发育不良在临床上分为四型:扁平疣型、花斑癣型、点状瘢痕型和肥厚斑块型,常需与花斑癣、扁平苔藓、脂溢性角化病、扁平疣、银屑病,甚至不典型痣等皮肤病鉴别。疣状表皮发育不良本身无特异的皮肤镜表现。约30%~50%的疣状表皮发育不良皮损随患者年龄增长,有恶变倾向,最常见的为鲍恩病及鳞状细胞癌[6]。皮肤镜的应用有利于我们同时检查同一患者体表的多个皮损,及早发现有恶变倾向的皮损并手术切除,改善患者的预后[7]。
1.2 鲍恩样丘疹病 鲍恩样丘疹病的发生与人乳头瘤病毒HPV-16型感染密切相关。皮肤镜检查有助于其与尖锐湿疣、脂溢性角化病等鉴别。鲍恩样丘疹病的皮肤镜表现为非特异性模式,淡褐色至黑褐色乳头瘤样或角化过度样外观,棕灰色无结构区域,线状排列的棕灰色小点,并可见小点状、小球状或发夹状血管(图1i)[4,9]。
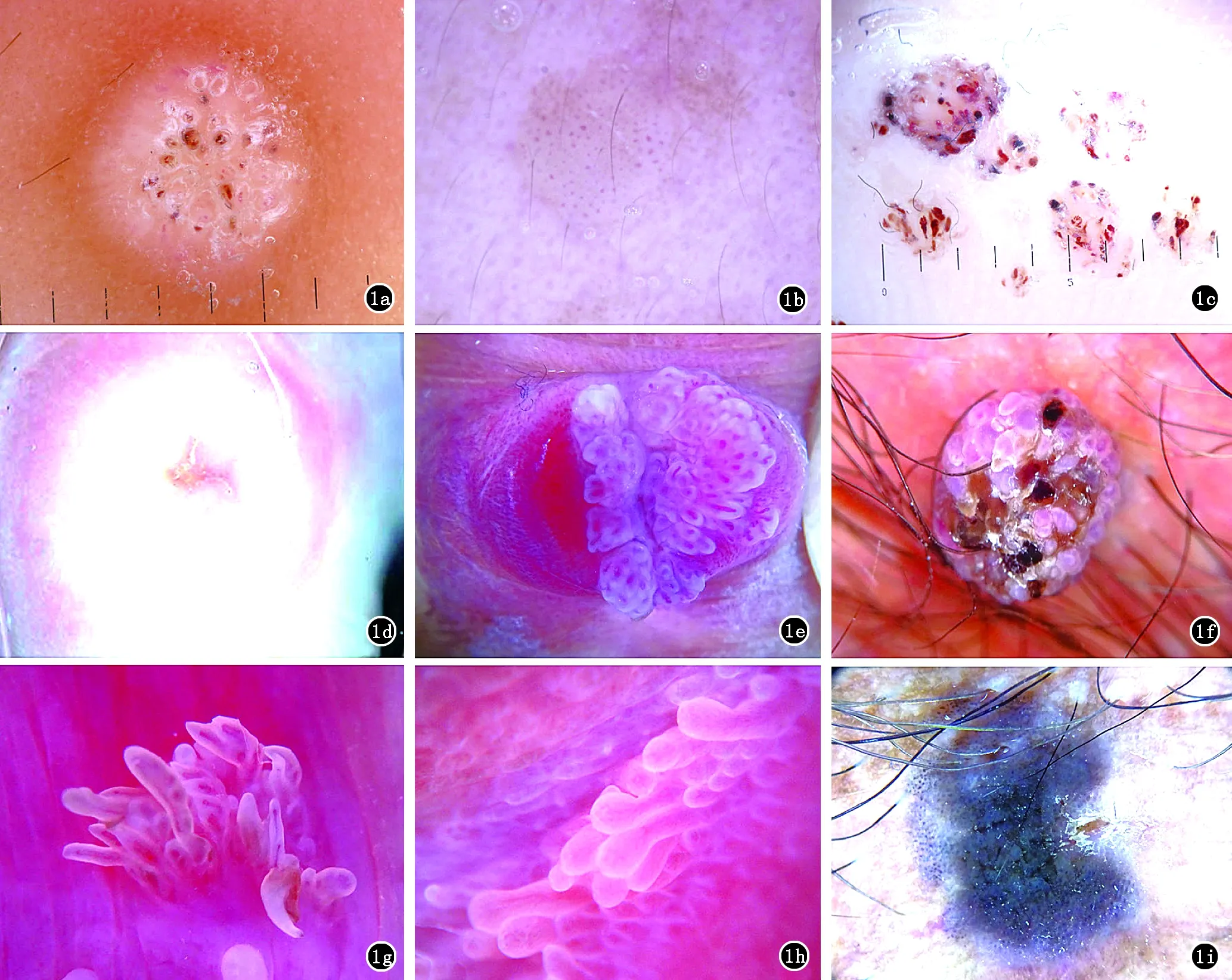
1a:寻常疣;1b:扁平疣;1c:跖疣;1d:胼胝;1e:镶嵌模式的尖锐湿疣;1f:瘤状模式的尖锐湿疣;1g:指状模式的尖锐湿;1h:假性湿疣;1i:鲍恩样丘疹病
图1 疣和鲍恩样丘疹病的皮肤镜表现
1.3 传染性软疣 传染性软疣最典型的皮肤镜表现为病变外周放射状分布的冠状血管结构[9]。冠状血管是一组循序弯曲不分枝的血管,似花冠样排列在损害的外周(2a)。然而该表现特异性较差,也常见于皮脂腺增生、皮脂腺痣、皮脂腺腺瘤等疾病。一项258例传染性软疣的皮肤镜研究结果显示,冠状血管、点状血管及放射状血管模式分别见于49.6%、7.4%和4.3%的传染性软疣,29.8%的病例同时存在两种血管模式,最常见冠状血管模式和放射状血管模式并存,仅8.9%的病例无血管结构。点状血管为直径0.01~0.02 mm的血管,呈点状,密集排列。放射状血管指血管呈放射状分布在病变外周。97.3%的传染性软疣皮肤镜下可见白色或黄白色无定型结构,病理上对应为凸向真皮的棘层肥厚的表皮,其中34.1%为圆形白色无定型结构,22.5%为四叶草形白色无定型结构,26.7%为多叶形白色无定型结构,14.0%为非特异性白色无定型结构。圆形白色无定型结构指皮损中心的白色结构呈单一均质状,圆形或类圆形(图2b)。四叶草形白色无定型结构指皮损中心的白色结构呈分散大致均等的四小块,类似四叶草状(图2c)。多叶形白色无定型结构指白色结构形态和大小不一,散在分布在皮损中心,可包括圆形和四叶草形(图2d)。白色无定型结构较血管结构更有助于传染性软疣与皮脂腺肿瘤的鉴别[10]。
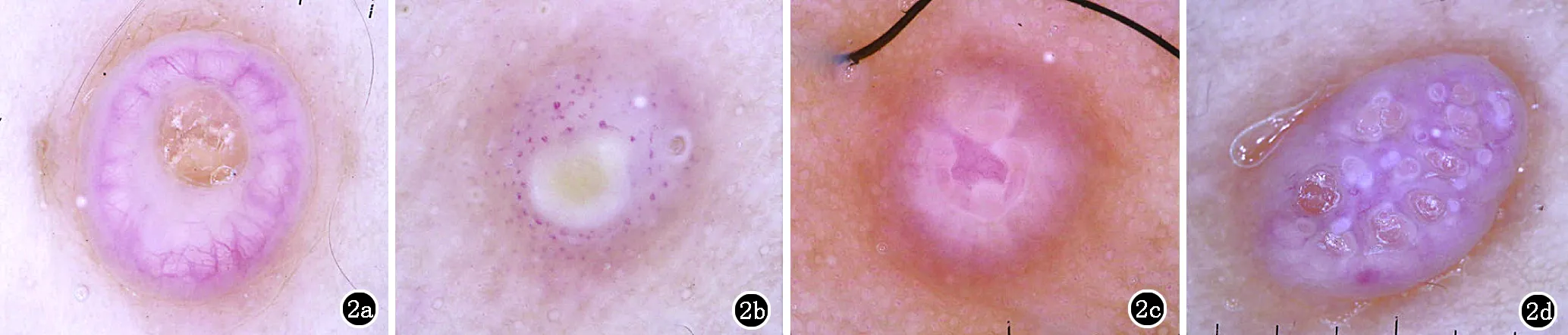
2a:冠状血管;2b:圆形白色无定形结构,周围可见点状血管;2c:四叶草形白色无定形结构;2d:多叶形白色无定形结构
图2 传染性软疣的皮肤镜表现
2 球菌感染性皮肤病
2.1 秃发性毛囊炎 秃发性毛囊炎是一种由金黄色葡萄球菌引起、具破坏性、永久性秃发的毛囊炎,其皮肤镜表现详见毛发疾病皮肤镜诊断专家共识[11]。
3 真菌感染性皮肤病
3.1 花斑糠疹 花斑糠疹在皮肤镜边界较清楚,可表现为由淡褐色欠清晰的色素性条带或色素颗粒组成的色素网(图3a),某些病例皮损表面可覆有细小鳞屑[12];也可以表现为淡褐色的均质性色素沉着,而皮沟处色素沉着缺失或减退,形成反向的脱色素网(图3b)。
3.2 头癣 头癣临床可表现为局灶性的脱发,多为断发,其特征性皮肤镜表现为逗号状发干[13,14]。头癣有时需要与斑秃、梅毒脱发等疾病鉴别,详见毛发疾病皮肤镜诊断专家共识。
此外,皮肤镜检查在一定程度上可协助鉴别白癣和黑点癣。白癣多由犬小孢子菌感染引起,皮肤镜下表现为长短不一的断发,肘状萎缩的发干,部分断发呈螺旋状,白色光泽性鳞屑附着于发干,逗号状发干并不多见。黑点癣多由断发毛癣菌感染引起,皮肤镜下可见大量逗号状发干及夹子状、问号状发干,断发紧贴头皮表面[15]。
3.3 甲真菌病 甲真菌病的皮肤镜表现在甲板主要有色素沉着、甲剥离(远端和/或侧缘)、大理石样浑浊区、出血碎片和纵向条纹(图3c),游离缘主要有甲增厚、甲下角蛋白及碎屑沉积、甲板色素沉着和甲真菌瘤,甲周皮肤则可见干燥和鳞屑[16]。有人对178例临床诊断的甲真菌病的KOH涂片镜检及皮肤镜检查分析,将甲真菌病的皮肤镜模式大致分为四种:短刺状模式(25.16%)、纵向条纹模式(60.65%)、线状边缘模式(21.94%)及远端不规则中断模式(43.22%)。短刺状模式是指甲剥离区域近端锯齿状参差不齐的边缘,也称为锯齿状边缘(图3d);纵向条纹模式的纵向条纹被认为是皮肤癣菌沿甲板向甲半月方向侵袭性生长的表现,可出现颜色改变、形成菌落、裂隙或甲下碎片(图3e);线状边缘模式是指平滑的线状边界(图3f);远端不规则中断是指增厚的甲板远端粉碎性的特点,尤其多见于全甲毁损型甲真菌病(图3g)[17]。在皮肤镜下选取短刺的尖端(锯齿状黄色条纹的近端),可提高真菌镜检的阳性率[18]。
甲真菌病主要与银屑病和扁平苔藓的甲病、外伤性甲剥离等甲改变鉴别。银屑病甲的皮肤镜特点在甲母质有甲板不规则的点状凹陷、甲板粗糙、博氏线、甲变白及斑驳的甲半月;在甲床有甲剥离、油斑、出血碎片及甲下角化过度;甲周皮肤有甲沟炎。点状凹陷是由于甲母质近端形成缺陷形成的,油斑现象的出现是由于甲床角化不全导致的局灶性甲剥离,也有红棕色的边缘,出血碎片为甲床毛细血管出血的结果[16]。扁平苔藓病甲的皮肤镜特点在甲母质有甲脆折、甲纵裂、翼状胬肉;甲床有甲剥离、出血碎片、甲下角化过度、黑甲、甲板粗糙凹陷,还可能有无甲症,31.65%的病例伴有甲沟炎[19,20]。外伤性甲剥离则表现为较平滑线状边缘,在剥离区域缺乏短刺样模式的尖峰[21]。
3.4 掌黑癣 掌黑癣是一种浅表性角质层真菌感染,好发于手掌和足底,临床特征为棕至黑色无鳞屑的斑疹,常无自觉症状,极易误诊为恶性黑素瘤或色素痣。掌黑癣的皮肤镜表现为淡褐色杂乱稀疏的纤细网状模式,不规则尘埃样、斑点状色素沉着,或与皮纹不一致的细小束状、松针状结构,而无色素网、色素小球、平行皮脊模式、平行皮沟模式、网格样模式、纤维样模式等黑素细胞性疾病的皮肤镜表现(图3h)[22,23]。
3.5 足菌肿 典型的足菌肿通过临床表现即可诊断,但某些不典型病例,临床诊断较为困难,临床仅见绿豆至黄豆大小红褐色丘疹、结节,表面鳞屑,皮肤镜下发现簇集性的黄白色小块状结构可提示诊断(图3i),病理上可能对应为含有颗粒和菌丝的肉芽肿改变,可提示诊断[24]。

3a:花斑糠疹的皮肤镜表现(不清晰的色素网);3b:花斑糠疹的皮肤镜表现(脱色素网);3c:甲真菌病的皮肤镜表现;3d:甲真菌病的短刺状模式;3e:甲真菌病的纵向条纹模式;3f:甲真菌病的线状边缘模式;3g:甲真菌病的远端不规则中断模式;3h:掌黑癣的皮肤镜表现;3i:足菌肿的皮肤镜表现
图3 真菌性皮肤病的皮肤镜表现
4 寄生虫性皮肤病
4.1 疥疮 皮肤镜可直接观察到肉眼难以分辨的疥螨虫体,对疥疮的诊断具有重要价值。采用放大倍率10~50倍的皮肤镜直接观察皮肤,可找到疥螨。观察时首先寻找疥疮隧道,蛇行隧道皮屑翘起明显处通常为隧道的入口,隧道有小水疱处通常为隧道的尽头。疥螨常位于隧道尽头小水疱前数毫米,用酒精棉球擦拭隧道尽头,可透过角质层在皮肤镜下见到由疥螨头部和两对前脚构成的咖啡色至黑色的等边三角形,类似喷气式飞机或三角滑翔机,喷气式飞机的尾迹部分对应为疥螨的隧道[25,26](图4a,b)。“尾迹”处偶可见多数褐色的小点,对应为疥螨的粪便。有时可在皮肤镜下见到疥螨圆形的身体轮廓,但由于疥螨虫体呈白色不易寻找,故皮肤镜下的观察目标主要为咖啡色至黑色的三角形结构。皮肤镜诊断疥疮的灵敏度为91%,特异度为86%,略高于传统的显微镜检查,且简便快捷[27,28]。皮肤镜结合矿物油刮检法与单纯矿物油刮检法相比显著提高了疥疮诊断的准确率[29]。
4.2 虱病 皮肤镜可直接放大观察到附着在毛发上的虫体或虱卵,以及叮咬所致的小红点,有助于明确诊断(图4c, d)。同时,还可辨别体虱、头虱和阴虱,有助于判断感染源和感染部位,选择最佳的治疗方案[30]。皮肤镜还可鉴别活的虱卵和空卵。活的虱卵在皮肤镜下为卵圆形褐色结构,而空卵为半透明结构,具有一水平裂缝的游离缘[31]。
4.3 恙螨皮炎和革螨皮炎 皮肤镜可观察到放大的恙螨幼虫或革螨的虫体,有助于明确诊断并能辨别其种类[32,33]。
4.4 皮肤蝇蛆病 皮肤蝇蛆病临床可表现为疖肿样或匍行疹样皮损(图4e),蝇蛆寄生在皮肤内,局部形成结节或水疱。疖肿型皮肤蝇蛆病在皮肤镜下可见中心红色的小孔,周围绕以扩张的血管。皮肤镜可活体动态观察蝇蛆的上下运动,运动的蝇蛆顶端可见两个小黄点,对应为蝇蛆尾端的气门,蝇蛆潜行至皮下可见皮肤表面留下的红色小孔[34]。也有人将蝇蛆的皮肤镜表现形容为鸟足样结构,对应为气门,蝇蛆外缘棘冠样分布的小黑点,对应为蝇蛆体表环状排列的黑刺(图4f)[35,36]。
4.5 潜蚤病 潜蚤病临床表现为绿豆至黄豆大小的脓疱(图4g)。皮肤镜对潜蚤病具有较大的诊断价值。皮肤镜下皮损处可见一白色至肉色的结节,中心小孔处可见似靶心的红棕色结构,对应为潜蚤的后臀部,外围较宽的白色晕,对应为虫体扩张的腹部,内含大量虫卵,白色晕中可透见蓝灰色斑,可能对应为潜蚤的外骨骼或原肠(图4h)[37-39]。
4.6 利什曼病 利什曼病的皮肤镜表现有红斑、白色星爆模式、中心溃疡、黄色泪滴、角化过度及各种血管结构等(图4i)[40-42]。红斑、角化过度和血管结构等皮肤镜表现也常见于其他皮肤病,对皮肤利什曼病的诊断缺乏特异性的诊断价值,白色星爆模式的存在可提供皮肤利什曼病的诊断线索,有助于与其他皮肤病的鉴别诊断[43]。
4.7 皮肤幼虫移行症 皮肤幼虫移行症又称匍行疹,其皮肤镜表现为线状排列的节段性分布的半透明淡褐色无结构区域(图4j),对应为线虫幼虫的虫体,空的隧道在皮肤镜下则可见红色的点状血管[1,44]。
4.8 蜱叮咬 蜱叮咬的诊断需要发现吸附在皮肤表面的蜱。在体观察蜱虫时,可将皮肤镜镜头稍微倾斜,以便获得更加清晰、完整、立体的蜱虫图像。皮肤镜的放大观察有助于鉴别蜱的种类和所处的生活周期。蜱的幼虫有6条腿,若虫和成虫有8条腿(图4k)。此外,皮肤镜的放大观察还可帮助我们确定蜱拔除后其口器是否残留在皮肤内(图4l)[45-47]。

4a:皮肤镜观察到的疥螨;4b:疥疮的皮肤镜表现;4c:阴虱的皮肤镜表现;4d:阴虱虱卵的皮肤镜表现;4e:皮肤蝇蛆病的临床表现;4f:皮肤蝇蛆病的皮肤镜表现;4g:潜蚤病的临床表现;4h:潜蚤病的皮肤镜表现;4i:皮肤利什曼病的皮肤镜表现;4j:幼虫移行病的皮肤镜表现;4k:皮肤镜下观察到的蜱;4l:拔出蜱后皮肤镜观察到蜱残存在皮肤内的口器
图4 寄生虫性皮肤病的皮肤镜表现
5 防止通过皮肤镜检查交叉感染的方法
即使每次检查后对皮肤镜探头进行消毒,探头上检测到人乳头瘤病毒的几率仍较高[48]。为避免各种感染性皮肤病和寄生虫性皮肤病通过皮肤镜探头接触传染,建议检查者使用如下方法:①可选用偏振光非接触式皮肤镜探头,无需与患处皮肤直接接触;②可将一次性的透明保鲜膜贴附于皮肤镜探头表面,其上再涂抹凝胶或矿物油,保鲜膜的隔离可防止皮肤镜探头直接与患处接触;对于面积较大的皮损及生殖器等黏膜部位的皮损,可先涂抹凝胶或矿物油于皮损表面,然后将保鲜膜覆盖在皮损上,再行皮肤镜观察,可避免交叉感染及对镜头的污染,确保每个部位均可获得清晰的皮肤镜图像;③将显微镜用的载玻片当作一次性的皮肤镜探头保护盖,载玻片置于皮损和皮肤镜探头之间,通过透明的载玻片观察皮损,可防止皮肤镜探头感染[49],同时有利于获得清晰的图像,便于观察和分析,并可滤除部分伪像。
6 结语
感染性皮肤病的诊断以病原学检查为主要依据,皮肤镜检查简便快捷,可提供大量肉眼直观不可见的结构信息,在无条件进行病原学检查的情况下,对感染性皮肤病的诊断起到重要作用。对于某些寄生虫性皮肤病,由于皮肤镜可直接放大观察到寄生虫的虫体或虫卵,可取代显微镜检查,成为该类疾病的重要诊断依据。然而,关于本共识中所涉及到的感染性和寄生虫性皮肤病的皮肤镜特点尚缺乏大样本的循证医学研究,因此在临床工作中仍需结合病史、临床表现、病原学检查以及皮肤病理活检等进行诊断和鉴别诊断。
参与本共识起草审议工作的专家(按姓氏笔画顺序):于艳,王宏伟,尤艳,乔建军,刘华绪,刘洁,孙秋宁,李小红,李航,吴军,吴秀娟,邹先彪,辛琳琳,张凡,张慧敏,陈柳青,陈胜平,林景荣,徐薇,章星琪,董慧婷,温海,彭才智,雷霞。
[1] Zalaudek I, Giacomel J, Cabo H, et al. Entodermoscopy: a new tool for diagnosing skin infections and infestations[J]. Dermalology,2008,216(1):14-23.
[2] Teoli M, Di Stefani A, Botti E, et al. Dermoscopy for treatment monitoring of viral warts[J]. Dermatology,2006,212:318.
[3] Kim HO, Bae JM, Kim YY, et al. Differential diagnosis of wartfromcallus and healed wart with aid of dermoscopy[J]. Dermatology,2006,212:307.
[4] Dong H, Shu D, Campbell TM, et al. Dermatoscopy of genital warts[J]. J Am Acad Dermatol,2011,64(5):859-864.
[5] 黄静红,冉玉平.皮肤镜观察尖锐湿疣1例[J].临床皮肤科杂志,2016,45(1):4-5.
[6] Majewski S, Jablonska S. Epidermodysplasia verruciformis as a model of papillomavirus-induced genetic cancer of the skin[J]. Arch Dermatol,1995,131:1312-1318.
[7] Segura S, Carrera CJ, Jr MJ, et al. Dermoscopy in epidermodysplasia verruciformis[J]. Dermatol Surg,2006,32(32):103-106.
[8] Marcucci C, Sabban EC, Friedman P, et al. Dermoscopic findings in bowenoidpapulosis: report of two cases[J]. Dermatol Pract Concept,2014,4(4):61-63.
[9] Martin JM, Bella-Navarro R, Jorda E. Vascular patterns in dermoscopy[J]. Actas Dermo-sifiliogr,2012,103:357-375.
[10] Ku SH, Cho EB, Park EJ, et al. Dermoscopic features of molluscum contagiosum based on white structures and their correlation with histopathological findings[J]. Clin Exp Dermatol,2015,40(2):208-210.
[11] 中西医结合学会皮肤性病学专业委员会皮肤影像学亚专业委员会.毛发疾病皮肤镜诊断专家共识[J].中国麻风皮肤病杂志,2016,32(3):129-132.
[12] Zhou H, Tang X, Han J, et al. Dermsocopy as an ancillary tool for the diagnosis of pityriasis versicolor[J]. J Am Acad Dermatol,2015,73e:205-206.
[13] Slowinska M, Rudnicka L, Schwartz RA, et al. Comma hairs: a dermatoscopic marker for tineacapitis[J]. J Am Acad Dermatol,2008,59(5 Suppl):77-79.
[14] Sandoval AB, Ortiz JA, Rodríguez JM, et al. Dermoscopic pattern in tineacapitis[J]. Rev Iberoam Micol,2010,27(3):151-152.
[15] Schechtman RC, Silva NDV, Quaresma MV, et al. Dermatoscopic findings as a complementary tool in the differential diagnosis of the etiological agent of tineacapitis[J]. An Bras Dermatol,2015,90(3 Suppl 1):13-15.
[16] Nakamura RC, Costa MC. Dermatoscopic findings in the most frequent onychopathies: descriptive analysis of 500 cases[J]. Int J Dermatol,2012,51(4):483-496.
[17] Jesussilva MA, Fernandezmartinez R, Roldanmarin R, et al. Dermoscopic patterns in patients with a clinical diagnosis of onychomycosis-results of a prospective study including data of potassium hydroxide (KOH) and culture examination[J]. Dermatol Pract Concept,2015,5(2):39-44.
[18] Leonardo BD, Lucia DRA, Di CN, et al. Dermoscopy and onychomycosis: guided nail abrasion for mycological samples[J]. An Bras Dermatol,2016,90(6):904-906.
[19] Nakamura R, Broce AAA, Palencia DPC, et al. Dermatoscopy of nail lichen planus[J]. Int J Dermatol,2013,52(6):684-687.
[20] Friedman P, Sabban EC, Marcucci C, et al. Dermoscopic findings in different clinical variants of lichen planus. Is dermoscopy useful?[J]. Dermatol Pract Concept,2015,5(4):51-54.
[21] Piraccini BM, Balestri R, Starance M, et al. Nail digital dermoscopy (onychoscopy) in the diagnosis of onychomycosis[J]. J Eur Acad Dermatol Venereol,2013,27(4):509-513.
[22] Piliouras P, Allison S, Rosendahl C, et al. Dermoscopy improves diagnosis of tineanigra: a study of 50 cases[J]. Aust J Dermatol,2011,52(3):191-194.
[23] Xavier MH, Ribeiro LH, Duarte H, et al. Dermatoscopy in the diagnosis of tineanigra[J]. Dermatol Online J,2008,14(8):15.
[24] Reis LM, Lima BZ, Zillo FC, et al. Dermoscopy assisting the diagnosis of mycetoma: case report and literature review[J]. An Bras Dermatol,2014,89(5):832-833.
[25] Prins C, Stucki L, French L, et al. Dermoscopy for the in vivo detection of sarcoptes scabiei[J]. Dermatology,2004,208(3):241-243.
[26] Griffin JR, Newman CC. Clinical, dermatoscopic, and microscopic findings of infestation with sarcoptes scabiei varhominis[J]. Mayo Clin Proc,2011,86(9):e47.
[27] Dupuy A, Dehen L, Bourrat E, et al. Accuracy of standard dermoscopy for diagnosing scabies[J]. J Am Acad Dermatol,2007,56(1):53-62.
[28] Neynaber S, Wolff H. Diagnosis of scabies with dermoscopy[J]. Canad Med Assoc J,2008,178(12):1540-1541.
[29] Park JH, Kim CW, Kim SS. The diagnostic accuracy of dermoscopy for scabies[J]. Ann Dermatol,2012,24(2):194-199.
[30] Martins LG, Bernardes FF, Quaresma MV, et al. Dermoscopy applied to pediculosiscorporis diagnosis[J]. An Bras Dermatol,2014,89(3):513-514.
[31] Di Stefani A, Hofmann-Wellenhof R, Zalaudek I. Dermoscopy for diagnosis and treatment monitoring of pediculosiscapitis[J]. J Am Acad Dermatol,2006,54(5):909-911.
[32] Nasca MR, Lacarrubba F, Micali G. Diagnosis of trombiculosis by videodermatoscopy[J]. EmergInfec Dis,2014,20(6):1059-1060.
[33] Wambier CG, Wambier SP. Gamasoidosis illustrated-from the nest to dermoscopy[J]. An Bras Dermatol,2012,87(6):926-927.
[34] Bernardes FF, Martins G, Barbara EF, et al. Dermoscopy as an auxiliary tool for the diagnosis of furuncularmyiasis[J]. An Bras Dermatol,2014,89(4):663-665.
[35] Abraham LS, Azulayabulafia L, Aguiar DP, et al. Dermoscopy features for the diagnosis of furuncularmyiasis[J]. An Bras Dermatol,2011,86(1):160-162.
[36] Bakos RM, Bakos L. Dermoscopic diagnosis of furuncularmyiasis[J]. Arch Dermatol,2007,143(1):123-124.
[37] Criado PR, Landman G, Reis VMS, et al. Tungiasisunder dermoscopy- in vivo and ex vivo examination of the cutaneous infestation due to tungapenetrans[J]. An Bras Dermatol,2013,88(4):649-651.
[38] Di SA, Rudolph CM, Hofmann-Wellenhof R, et al. An additional dermoscopic feature of tungiasis[J]. Arch Dermatol,2005,141(8):1045-1046.
[39] Bauer J, Forschner A, Garbe C, et al. Variability of dermoscopic features of tungiasis[J]. Arch Dermatol,2005,141(5):643-644.
[40] Yucel A, Gunasti S, Denli Y, et al. Cutaneous leishmaniasis: new dermoscopic findings[J]. Int J Dermatol,2013,52(7):831-837.
[41] Taheri AR, Pishgooei N, Maleki M, et al. Dermoscopic features of cutaneous leishmaniasis[J].Int J Dermatol,2013,52(11):1361-1366.
[42] Llambrich A, Zaballos P, Terrasa F, et al. Dermoscopy of cutaneous leishmaniasis[J]. Br J Dermatol,2009,160(4):756-761.
[43] Ramot Y, Nanova K, Alper-Pinus R, et al. Zosteriform cutaneous leishmaniasis diagnosed with the help of dermoscopy[J]. Dermatol Pract Concept,2014,4(3):55-57.
[44] Elsner E, Thewes M, Worret WI. Cutaneous larva migrans detected by epiluminescence microscopy[J]. Acta Derm Venereol,1997,77(6):487-488.
[45] Oiso N, Kawara S, Yano Y, et al. Diagnostic effectiveness of dermoscopy for tick bite[J]. J Eur Acad Dermatol Venereol,2010,24(2):231-232.
[46] Oiso N, Nakano A, Yano Y, et al.The diagnostic usefulness of dermoscopy for identifying six-legged larval ticks[J]. Ticks Tick Borne Dis,2010,1(4):197-198.
[47] Matsuda M, Oiso N, Yano Y, et al. Dermoscopy for tick bite: reconfirmation of the usefulness for the initial diagnosis[J]. Case Rep Dermatol,2010,3(1): 94-97.
[48] Penso-Assathiany D, Gheit T, Pretet JL, et al. Presence and persistence of human papillomavirus types 1, 2, 3, 4, 27, and 57 on dermoscope before and after examination of plantar warts and after cleaning[J]. J Am Acad Dermatol,2013,68(1):185-186.
[49] Mun JH, Park SM, Ko HC, et al. Prevention of possible cross-infection among patients by dermoscopy: a brief review of the literature and our suggestion[J]. Dermatol Pract Concept,2013,3(4):33-34.
(收稿:2016-08-30)
邹先彪,E-mail: xbzou@126.com
主要执笔者:林景荣,大连医科大学第一附属医院皮肤科,116000 邹先彪,解放军总医院第一附属医院皮肤科,北京,100037

