葡萄灰霉病菌(Botrytiscinerea)的快速分子检测
马仲文
(福建农业职业技术学院 生物技术系,福建 福州 350303)
葡萄灰霉病菌(Botrytiscinerea)的快速分子检测
马仲文
(福建农业职业技术学院 生物技术系,福建 福州 350303)
为建立快速检测葡萄灰霉病菌的方法,根据ITS序列的差异,设计了1对葡萄灰霉病菌PCR检测的特异性引物TBCF/TBCR,并利用该引物通过常规和巢式PCR对葡萄灰霉病菌进行检测。结果显示,在优化的反应体系与扩增条件下,只有以葡萄灰霉病菌基因组DNA为模板的扩增体系中具有1条386 bp的条带,而其它病菌不产生扩增反应;其常规PCR对葡萄灰霉病菌基因组DNA的检测灵敏度为100 pg/25 μL,而利用引物ITS1/ITS4和TBCF/TBCR通过巢式PCR扩增,其灵敏度可达10 fg/25 μL。研究表明建立的PCR检测方法具有特异性强、灵敏度高、检测准确而操作简单快速等特点,可用于带菌土壤及发病组织中葡萄灰霉病菌的检测。
葡萄灰霉病菌;ITS分析;特异引物;分子检测
由灰葡萄孢(Botrytiscinerea)侵染引起的葡萄灰霉病是葡萄栽培中高危害、高损失且影响果实产量、品质和安全的最主要病害之一[1]。该菌可通过侵染葡萄植株的叶片、茎杆、花和果实导致葡萄灰霉病的发生,病原菌在土壤或病残体上能以菌丝或菌核形式休眠越过冬天或夏天,温湿度适宜时萌发形成大量的分生孢子后凭风雨飞散或借农事操作传播引起葡萄植株感病,发病处新生的分生孢子能够进行重复再侵染,从而导致病情极易扩展和加重[2]。在中国,葡萄灰霉病一般年份造成20%左右的减产,严重时超过50%;该病在全国各地普通发生,且呈上升趋势,成为当前葡萄生产上的重要病害[3-4]。葡萄灰霉病常与葡萄其它病害混合发生,给病害正确诊断造成困难,而生产上则常因不明发病原因,难以采取有针对性的防治措施[5]。
传统病原菌的分类与鉴定主要基于形态学特性及致病性测定等,该方法存在着耗时长、程序繁琐、经验性强等缺点,难以对病害做到及时、准确的诊断。随着分子生物学技术的发展,利用PCR扩增病原菌核糖体ITS(internal transcribed spacer)序列进行病原菌鉴定、检测及病害诊断得到了迅速发展[6-7]。PCR扩增检测病原菌具有快速、准确和简便等优势,因而受到研究人员的重视[8]。本研究通过对葡萄灰霉病菌及其亲缘关系较近的相关病原菌的ITS序列进行比对分析,设计出1对可用于特异性检测葡萄灰霉病菌的PCR引物,以期为葡萄灰霉病菌的准确鉴定和快速检测提供技术和方法。
1 材料与方法
1.1 供试菌株
供试菌株及其来源如表1所示。

表1 供试菌株的编号、寄主及来源
1.2 葡萄灰霉病离体叶片的人工接种
采取葡萄品种(巨峰)顶叶往下第5片叶,采用菌丝块粘贴离体叶片的方法人工接种葡萄灰霉病菌。接种7 d后,从离体接种叶片上取发病组织备用。
1.3 供试材料基因组DNA提取
所有供试菌株、健康组织、田间自然发病组织和人工接种发病组织的基因组DNA均采用CTAB法[9]提取,土壤微生物基因组总DNA提取参照文献[10]的方法。
1.4 ITS序列分析及葡萄灰霉病菌特异引物的设计与合成
利用ITS通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和TIS4(5′-TCCTCCGCTTATTGATATGC-3′)扩增葡萄灰霉病菌的ITS。PCR反应体系(25 μL)包括2×Taq PCR Master Mix(北京天根生化生物科技有限公司)12.5 μL、10 μmol/L ITS1/ITS4引物各1.0 μL、DNA 模板1.0 μL(2.0×10-5~200 ng),用无菌超纯水补足至25 μL。扩增参数为94 ℃预变性5 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1.5 min,共35个循环;最后72 ℃延伸8 min。PCR产物于含0.5 μg/mL溴化乙锭(ethidium bromide, EB)的1.0%琼脂糖胶上电泳分离,电泳分离后,将目的条带切胶并利用胶回收试剂盒(北京天根生化生物科技有限公司)回收,与pMD18-T载体连接后转化感受态细胞,对细胞单菌落进行PCR验证,挑取阳性克隆送上海生工生物工程股份公司进行测序。
利用DNAman软件将测定的ITS序列和葡萄灰霉病菌同属的其它种及亲缘相近的相关病原菌ITS序列进行多重比对分析,选取序列间有差异位点的区域设计葡萄灰霉病菌特异性引物(TBCF/TBCR),引物委托上海生工生物工程股份公司合成。
1.5 PCR引物特异性验证
为确保具有强特异性的PCR扩增产物和产物的高得率,对扩增反应体系与扩增条件进行了充分的优化,建立了PCR最佳扩增条件。PCR扩增反应体系25 μL,包括2×Taq PCR Master Mix(北京天根生化生物科技有限公司) 12.5 μL、10 μmol/L引物TBCF/TBCR各1.0 μL、DNA模板1.0 μL(2.0×10-5~200 ng),用无菌超纯水补足至25 μL。扩增参数为95 ℃预变性5 min,94 ℃变性30 s,60 ℃退火45 s,72 ℃延伸30 s,共35个循环;最后72 ℃延伸10 min。利用建立好的PCR扩增条件,对所有供试菌株的基因组DNA进行扩增,扩增结束后取5.0 μL PCR产物于1.0%琼脂糖胶上进行电泳检测,电泳结束后,在凝胶成像系统上拍照并检测条带的有无。
1.6 PCR引物灵敏度检测
用紫外分光光度计对所提取的葡萄灰霉病菌基因组DNA浓度进行测定,并将基因组DNA浓度调整为10 μg /μL,并按10倍梯度进行稀释。利用常规PCR和巢式PCR对不同浓度的基因组DNA进行扩增,常规PCR的反应体系及扩增参数,以及引物同1.5。巢式PCR反应的具体步骤如下:第一轮采用ITS1/ITS4引物进行扩增,其反应体系及扩增参数同1.4;第一轮反应结束后,取1.0 μL第一轮反应产物为模板,与TBCF/TBCR引物进行第二轮扩增,反应体系和扩增参数同1.5。常规PCR和巢式PCR扩增结束后,取5.0 μL产物进行琼脂糖胶电泳检测,并在凝胶成像系统上拍照观察。
1.7 发病叶片组织中葡萄灰霉病菌的检测
取自然发病和人工接种发病的葡萄灰霉病叶片,采用CTAB提取其基因组DNA,以葡萄灰霉病菌菌株纯培养物的基因组DNA为阳性对照,通过常规PCR和巢式PCR检测发病叶片中的病原菌,其反应体系和扩增参数参照1.6。
1.8 发病田块土壤中葡萄灰霉病菌的检测
采用常规PCR和巢式PCR对1.3中所提取的葡萄灰霉病发病田块土壤微生物基因组总DNA进行扩增,检测发病田块土壤中是否存在灰霉病菌,以高压灭菌的土壤和无菌超纯水为阴性对照,以葡萄病菌菌株纯培养物的基因组DNA为阳性对照。
2 结果与分析
2.1 ITS扩增及特异引物设计
利用ITS通用引物ITS1/ITS4对供试葡萄灰霉病菌基因组DNA进行扩增,得到分子量约为551 bp的条带。将测序得到的葡萄灰霉病菌的ITS序列与GeneBank中近缘种的ITS序列进行多重比较分析,先取上游片段大小为127~146 bp、下游片段512~531 bp位置的差异位点,进行引物设计,根据序列差异,设计葡萄灰霉病菌特异引物TBCF(5′-GCTCGCCAGAGAATACCAAA-3′)和TBCR(5′-CCTACCTGATCCGAGGTCAA-3′),委托上海生工生物工程股份公司合成。
2.2 引物特异性验证
用所设计的特异性引物TBCF/TBCR对所有供试菌株基因组DNA进行扩增,电泳检测,发现仅B.cinerea基因组DNA能扩增出1条约386 bp的特异性条带,与预计结果一致(图1)。结果表明,所设计的该对引物具有特异性,能够区别B.cinerea与其它病原菌。
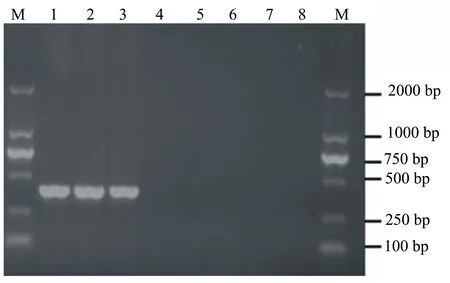
泳道M为2000 bp DNA Marker,泳道1~3为葡萄灰霉病菌,泳道4~7分别为葡萄炭疽病菌、葡萄黑痘病菌、辣椒青枯病菌和大豆炭疽菌,泳道8为阴性对照。
图1 TBCF/TBCR引物PCR扩增电泳图
2.3 引物灵敏度检测
引物TBCF/TBCR通过常规PCR可从高于100 pg(含100 pg)的菌株基因组DNA中扩增到目的条带(图2-a),其灵敏度为100 pg/25 μL;而ITS通用引物ITS1/ITS4和葡萄灰霉病菌特异引物TBCF/TBCR结合起来进行巢式PCR扩增,可从高于10 fg(包括10 fg)的菌株基因组DNA中扩增到目的条带(图2-b),其灵敏度为10 fg/25 μL。巢式PCR的灵敏度是常规PCR的10000倍。
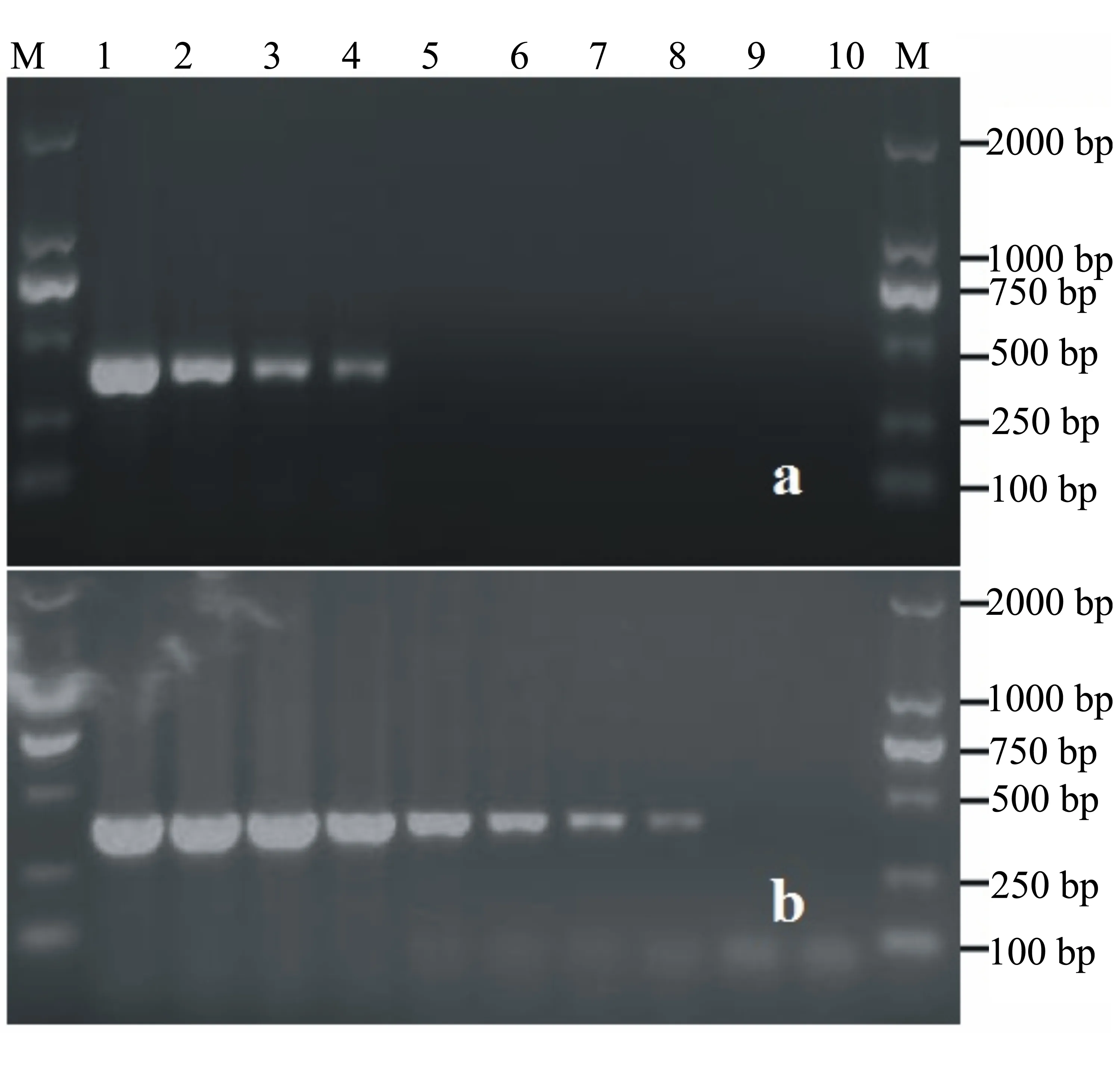
a为常规PCR对葡萄灰霉病菌的灵敏性检测结果,b为巢式PCR对葡萄灰霉病菌的灵敏性检测结果。泳道M为2000 bp DNA Marker,泳道1~10分别为:100 ng、10 ng、1 ng、100 pg、10 pg、1 pg、100 fg、10 fg、1 fg、阴性对照。
图2 葡萄灰霉病菌常规PCR和巢式PCR的检测灵敏度
2.4 发病组织、土壤中病原菌的检测
采用巢式PCR对叶片组织和土壤中葡萄灰霉病菌进行检测,结果显示,用巢式PCR可从自然发病、人工接种的葡萄叶片和发病田的土壤中检测到葡萄灰霉病菌,而健康叶片组织、高压灭菌土壤和阴性对照均未扩增到目的条带(图3),说明引物TBCF/TBCR能特异性检测到发病组织和土壤中葡萄灰霉病菌。
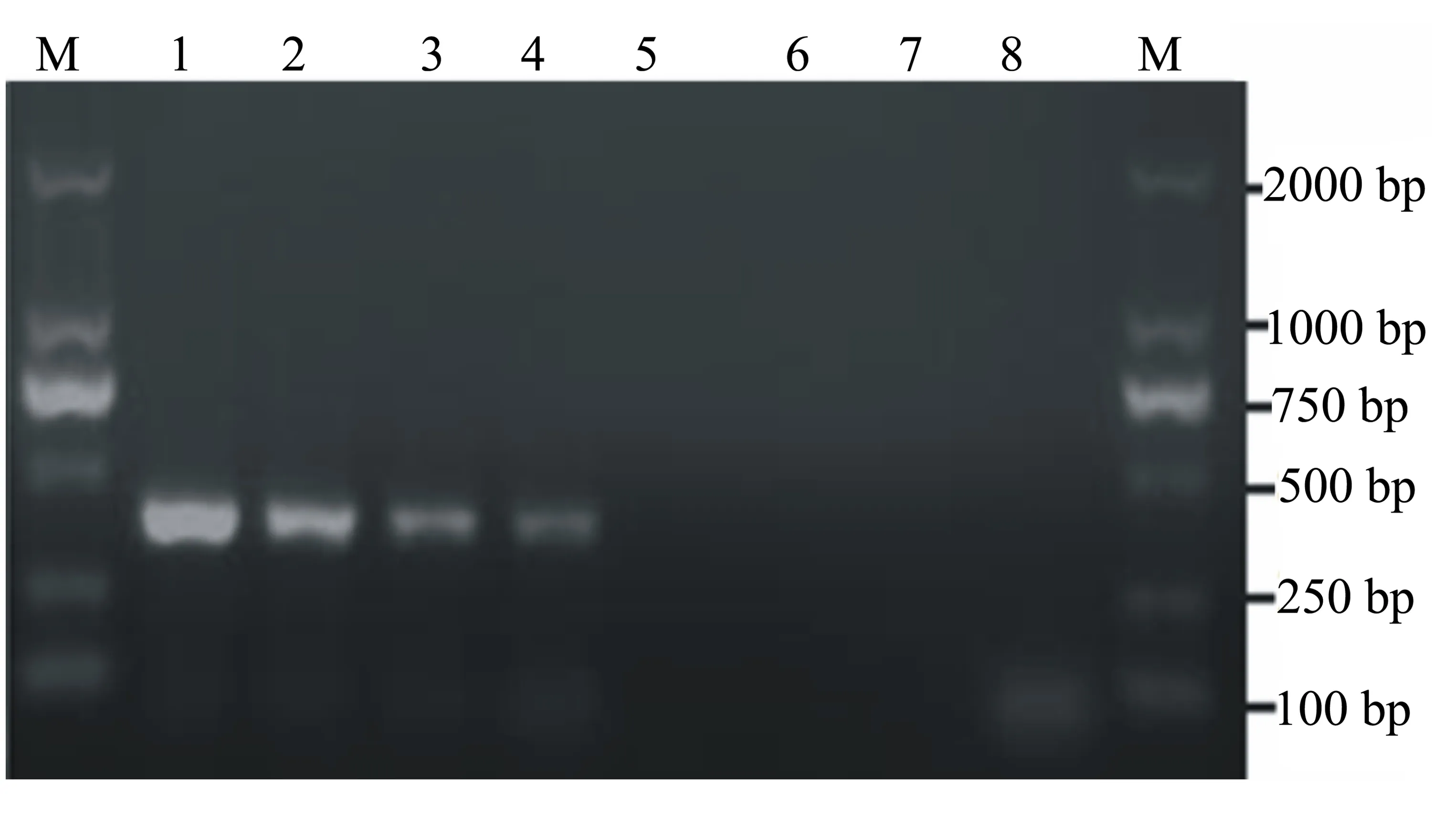
泳道M为2000 bp DNA Marker,泳道1~8分别为:阳性对照、自然发病的葡萄叶片、人工接种的葡萄叶片、发病田块的土壤、健康葡萄叶片、健康葡萄叶片、高压灭菌的土样、阴性对照。
图3 引物TBCF/TBCR对发病组织和土壤中葡萄灰霉病菌的PCR扩增检测
3 讨论
随着PCR技术的不断发展和在不同学科之间的渗透,PCR在植物病害快速诊断方面得到了广泛的应用[11-13]。与植物病害传统的形态学、致病性等诊断方法相比,PCR技术具有特异性强、快速、准确和简便等优势,尤其在那些用常规方法研究较困难的植物病害,如类病毒、植原体等,以及专性寄生病原菌的检测,PCR 技术的应用更显示出其优越性[12]。建立植物病害PCR快速检测技术,对于防止病害从发病区向未发病区传播,以及对病害的及时控制具有重要意义。
利用真菌ITS序列在种内不同菌株间高度保守,又在属间及属内不同种间存在着丰富的多态性,对ITS区进行PCR扩增、测序及序列分析,再设计特异性引物对病害的诊断和植物病原真菌的分子检测,目前已得到广泛的应用[11-13]。本研究对葡萄灰霉病菌与近缘种ITS序列进行比对分析,设计出了1对葡萄灰霉病菌PCR引物TBCF/TBCR,利用TBCF/TBCR对供试的病原菌DNA进行PCR扩增,只在葡萄灰霉病菌中能扩增出1条约386 bp的条带,而其它病原菌和阴性对照均无扩增条带,说明本研究所设计的引物对葡萄灰霉病菌具有很强的特异性。与常规PCR相比,巢式PCR可大大提高检测灵敏度[12-13],利用引物TBCF/TBCR进行常规PCR检测,其灵敏度为100 pg/25 μL,而将ITS通用引物ITS1/ITS4与引物TBCF/TBCR结合起来进行巢式PCR扩增,其灵敏度可达10 fg/25 μL,大大提高了PCR检测水平。利用巢式PCR对葡萄叶片和土壤中的葡萄灰霉病菌进行检测,可从发病组织和发病田块土壤中检测到葡萄灰霉病菌,表明利用所设计的引物建立起的葡萄灰霉病菌的PCR检测体系可用于葡萄组织和土壤中葡萄灰霉病菌的分子检测与病害的早期诊断。
本研究建立的葡萄灰霉病菌PCR检测技术只能对葡萄组织和土壤中是否存在该病菌进行定性检测,尚不能进行定量测定。随着PCR技术的不断发展和提高,目前实时荧光定量PCR已被广泛成功地应用于植物组织和土壤中病原菌的定量检测中[14-15],此项技术有望在葡萄灰霉病菌的实时监测中得到利用。
[1] Mlikota G F, Smilanick J L. Postharvest control of table grape gray mold on detached berries with carbonate and bicarbonate salts and disinfectants[J]. American Journal of Enology Viticulture, 2001, 52(1): 12-20.
[2] 伏波,姚娟妮,高小宁,等.植物内生枯草芽孢杆菌Em7菌株对葡萄灰霉病菌的抑菌活性[J].农药学学报,2016,18(4):465-471.
[3] 张玮,乔广行,黄金宝,等.中国葡萄灰霉病菌对嘧霉胺的抗药性检测[J].中国农业科学,2013,46(6):1208-1212.
[4] 陈宇飞,文景芝,李立军.葡萄灰霉病研究进展[J].东北农业大学学报,2006,37(5):693-699.
[5] 钱恒伟,赵宇,黄金光.青岛地区葡萄灰霉病病原鉴定及病害分析[J].山东农业科学,2015,47(7):87-90.
[6] 李依韦,银玲.rDNA-ITS序列分析在植物病原真菌分类鉴定中的应用[J].内蒙古民族大学学报:自然科学版,2012,27(1):66-67.
[7] 赵杰.ITS序列分析及其在植物真菌病害分子检测中的应用[J].陕西农业科学,2004(4):35-37.
[8] 王晓杰,康振生,黄丽丽.PCR技术在植物病害检测中的应用[J].云南农业大学学报,2005,20(2):179-182.
[9] 萨姆布鲁克J,拉塞尔DW.分子克隆实验指南[M].黄培唐,王嘉玺,朱厚础,等译.第一版.北京:科学出版社,2002:461-512.
[10] Volossiouk T, Robb E J, Nazar R N. Direct DNA extraction for PCR-mediated assays of soil organisms[J]. Applied and Enviromental Microbiology, 1995, 61(11): 3972-3976.
[11] Zhang Z G, Zhang J Y, Zheng X B, et al. Molecular distinctions betweenPhytophthoracapsiciandP.tropicalisbased on ITS sequences of ribosomal DNA[J]. Journal of Phyopathology, 2004, 152: 358-364.
[12] Zhang Z G, Li Y Q, Fan H, et al. Molecular detection ofPhytophthoracapsiciin infected plant tissues, soil and water[J]. Plant Pathology, 2006, 55(6): 770-775.
[13] Li S, Hartman G L. Molecular detection ofFusariumsolanif. sp.glycinesin soybean roots and soil[J]. Plant Pathology, 2003, 52(1): 74-83.
[14] 胡浩,殷幼平,张利平,等.柑桔黄龙病的常规PCR及荧光定量PCR检测[J].中国农业科学,2006,39(12):2491-2497.
[15] 姜廷波.利用PAPD-STS和实时定量PCR鉴别菠菜枯萎病原菌(Fusariumoxysporumf. sp.spinaciae)[J].植物病理学报,2006,36(3):212-218.
(责任编辑:许晶晶)
Rapid Molecular Detection ofBotrytiscinereaby PCR
MA Zhong-wen
(Department of Biotechnology, Fujian Vocational College of Agriculture, Fuzhou 350303, China)
In order to develop a technique for the rapid detection ofBotrytiscinerea, we designed a pair of specific primers (TBCF/TBCR) forB.cinereaaccording to the sequence difference of internal transcribed spacer region (ITS) of the ribosomal gene, and used these primers to detectB.cinereathrough conventional PCR and nest-PCR. The results indicated that: under optimized reaction system and amplification conditions, only a single band (386 bp) of PCR product was amplified fromB.cinereathrough the primers TBCF/TBCR, and the other tested pathogens were negative. The detection sensitivity of conventional PCR for the genomic DNA ofB.cinereawas 100 pg/25 μL, while that of nest-PCR with the primers ITS1/ITS4 and TBCF/TBCR was 10 fg/25 μL. This constructed PCR detection method is characterized by strong specificity, high sensitivity, high accuracy, and easy and rapid operation, so it can be used to detectB.cinereain soil and diseased grape tissues.
Botrytiscinerea; ITS analysis; Specific primer; Molecular detection
2016-10-08
福建农业职业技术学院科技计划项目(2015JS001)。
马仲文(1978—),男,助教,硕士,主要从事食品微生物鉴定及其发酵技术研究。
S435.72
A
1001-8581(2017)02-0067-04

