盐旱交叉胁迫对小麦种子萌发及幼苗保护酶活性的影响
华智锐,李小玲
(商洛学院 生物医药与食品工程学院,陕西 商洛 726000)
盐旱交叉胁迫对小麦种子萌发及幼苗保护酶活性的影响
华智锐,李小玲
(商洛学院 生物医药与食品工程学院,陕西 商洛 726000)
以商麦5226为材料,采用不同浓度PEG-6000溶液和不同浓度NaCl溶液模拟不同程度的干旱胁迫及盐胁迫,研究盐旱交叉胁迫下小麦胚芽鞘长度、发芽势、发芽率和小麦幼苗保护酶活性随胁迫时间的变化规律。结果表明:在不同浓度盐旱交叉处理下,随着胁迫时间的延长,胚芽鞘相对伸长速率(RER)整体呈下降趋势,超氧化物歧化酶(SOD)、过氧化物酶(POD)活性先上升再下降,过氧化氢酶(CAT)活性先下降后上升;随盐旱交叉胁迫浓度增加,胚芽鞘长度、发芽势和发芽率呈下降趋势,SOD、POD和CAT活性先上升后下降。分析认为小麦幼苗在盐旱交叉胁迫下表现出交叉适应性,适度的盐旱胁迫能增加小麦的抗逆能力。
盐旱交叉胁迫;小麦;种子萌发;幼苗;保护酶活性
我国国土幅员广阔,但由于环境的破坏,地貌的变迁,水土流失严重,造成耕地面积日益减少,盐渍地面积和干旱地分布渐渐增多。我国盐渍地面积就有3300万hm2左右 ,其中盐渍化耕地为 800万hm2,主要分布在西北和华北地区。干旱、半干旱地区主要分布在华北和西北地区[1],而这些地区是我国主要的粮食产地。小麦是世界上第一大粮食作物,是人类主要的食物来源。小麦在生长发育中会受到多种逆境胁迫,盐、旱胁迫是影响小麦生长、降低小麦产量的主要逆境因素[2]。
地处秦岭怀抱的商洛市地势复杂,耕地面积少,小麦种植区域少,自然灾害多,耕地肥力水平低,粮食产量一直没有大的突破。选育出抗盐旱的小麦品种是提高商洛盐旱地小麦单产,促进小麦大规模持续稳定增产,保障粮食安全的有效途径之一。目前小麦生产推广的主要品种虽然有较强的适应性,但小麦抗盐旱性较差,而且加工品质很难满足人民生活的需要[3]。为了能够培育出高抗性且产量高的小麦品种,必须要进行小麦的抗性研究[4]。
近年来人们对小麦进行了大量的抗逆生理研究。其中李怀伟[5]开展的干旱与低温交叉胁迫试验表明,在轻旱与低温交叉胁迫下,小麦地下茎中的可溶性糖、可溶性蛋白、脯氨酸含量增加,保护酶SOD、POD活性增强,说明适度的干旱处理能诱导小麦对低温胁迫的交叉适应性。宫德衬[6]研究发现小麦抗旱性与POD活性有关。在低浓度的干旱胁迫下,POD活性增加,对小麦的生长发育有一定的促进作用。石庆华等[4]研究了盐胁迫对小麦生理生化特征的影响,发现在适宜盐浓度处理条件下,小麦有一定的抗盐能力。目前,盐旱交叉胁迫对植物影响的研究主要包括对皂角幼苗[7]、紫荆幼苗[7]、丝瓜幼苗[8]、白烨实生苗[9]、银纱槐幼苗[10]等保护酶活性的影响,而盐旱交叉胁迫对小麦生理生化指标影响方面的研究未见报道。本试验以商麦5226幼苗为材料进行不同程度的盐旱交叉胁迫,测定小麦幼苗保护酶超氧化物歧化酶(SOD)[11]、过氧化物酶(POD)[12]、过氧化氢酶(CAT)[13]的活性和胚芽鞘长度随时间的变化趋势,观察并找出适宜的胁迫浓度,旨在为盐碱地及干旱与半干旱地区小麦抗性育种提供理论依据。
1 材料与方法
1.1 试验材料及试验设计
1.1.1 试验材料 供试验的小麦品种为商麦5226(商洛学院秦岭植物良种繁育中心)。处理试剂CaCl2(西安兰泰化工材料有限公司)、PEG-6000(西安兰泰化工材料有限公司)。选取饱满、均匀一致的小麦种子,用10% NaClO消毒10 min,再用蒸馏水冲洗干净,在室温条件下浸泡24 h备用。
1.1.2 试验设计 本试验共设定一个对照CK(蒸馏水)、9个盐旱交叉胁迫处理,其中3个盐分处理浓度为0.3%(A)、0.6%(B)、0.9%(C);3个干旱胁迫梯度为10%(T1) PEG-6000、15%(T2) PEG-6000、20%(T3) PEG-6000,具体见表1。
选取饱满、均匀一致的小麦种子,用10% NaClO消毒10 min,再用蒸馏水冲洗干净,室温浸泡24 h,取萌动一致的种子整齐摆放在30个(铺有两层滤纸)培养皿内,每皿100粒。试验共设1个对照CK(蒸馏水对照)和9个处理(表1),每个处理3个重复,放置在恒温培养箱(25 ℃,光照12 h)。处理后0、1、2、3、4 d每个处理随机取10粒种子测定胚芽鞘长度、种子的发芽率和发芽势。
取30个培养皿,每皿摆放30粒浸泡好的种子,置于28 ℃培养箱中催芽,期间轻翻种子,注意保湿。72 h后将培养皿移至培养箱外自然状态下培养[14]。待长到2叶1心时,按表1设计处理小麦幼苗,每天下午添加一次处理液,每个处理3个重复,分时间段(0、2、4、6、8 d)测定小麦幼苗保护酶活性。
1.2 测定项目与方法
1.2.1 胚芽鞘相对伸长速率 按照1.1.2中的试验方法,计算胚芽鞘的相对伸长速率(RER)[15],按公式(1):
RER=(L2-L1)/t
(1)
式(1)中:L2为后一次的测量值(cm);L1为前一次的测量值(cm);t为时间间隔(d)。

表1 小麦种子的处理设计
1.2.2 小麦种子发芽势与发芽率的测定 按照1.1.2中的方法,计算小麦种子发芽势与发芽率[16],按公式(2):
式(2)中:n3为第3天正常发芽的种子数;N为供试种子数。
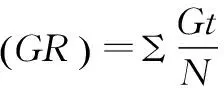
式(3)中:Gt为第7天内正常发芽的种子数。
1.2.3 小麦幼苗超氧化物歧化酶(SOD)活性的测定 酶液的提取:按1.1.2中的方法,取待测小麦幼苗叶片0.5 g放入冰浴的研钵中,加2 mL预冷的0.05 mol/L、pH 7.8磷酸缓冲液,冰浴情况下研磨成匀浆,加入磷酸缓冲液冲洗研钵,并使终体积定容至10 mL,在4 ℃下10000 r/min离心20 min,上清溶液即为SOD粗提液。
显色反应:选取型号相同的试管4支,2支为测定管,2支为对照管,分别加入显色试剂,如表2所示。
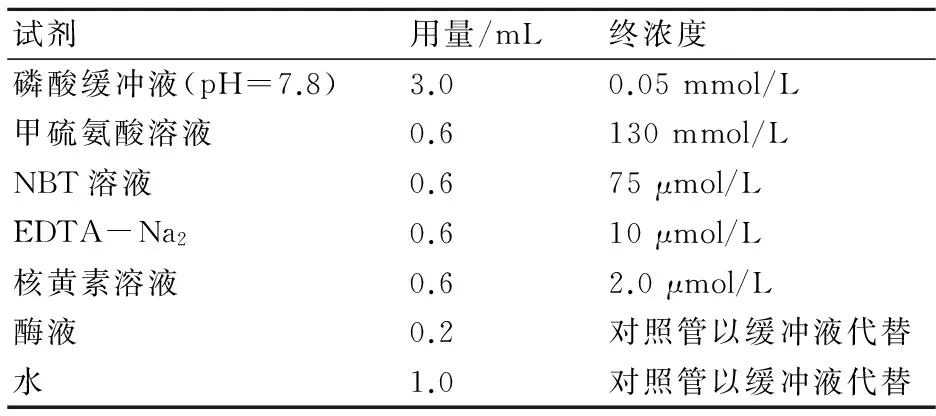
表2 SOD活性测定显色反应试剂加入表
将试剂混匀后,将1支对照管放置暗处,其他各管于光照培养箱内反应10~20 min(要求各管照光情况一致,反应温度控制在25~35 ℃之间,根据酶活性高低适当调节反应时间)。待反应结束后,用黑布罩住试管,终止反应。以遮光的对照管作为空白,在560 nm处分别测定其他各试管的吸光值[11]。
按下式计算SOD活性:
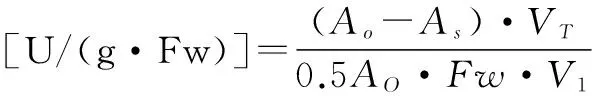
(3)
式(3)中:A0为照光对照管的吸光值;As为测定管的吸光值;VT为样品液总体积(mL);V1为测定时样品液用量(mL);Fw为样品鲜重(g)。
1.2.4 小麦幼苗过氧化氢酶(CAT)活性的测定 酶液的提取:称取小麦幼苗叶片0.5 g置于预冷的研钵中,加适量0.05 mol/L磷酸缓冲液(pH=7.0)及少量石英砂,在冰浴上研磨成匀浆,转移至10 mL量瓶中,用磷酸缓冲液冲洗研钵2次(每次2 mL),合并冲洗液移至容量瓶中,定容至10 mL,摇匀。量取提取液5 mL于离心管中,在4 ℃下10000 r/min离心15 min,倾出上清液即为酶粗提液,4 ℃下保存。
测定方法:选取10 mL具塞试管,加入2 mL酶提取液,置于沸水浴中加热煮死,冷却备用;另选取10 mL试管4支,3支为测定管(3个重复),1支为对照管。按表3加入试剂。

表3 CAT活性测定试剂加入表
将以上4支试管于25 ℃水浴锅中预热3 min后,再逐管加入0.3 mL 0.1mol/L H2O2溶液,每加1管迅速倒入石英比色皿中,然后在紫外分光光度计上测定A240(蒸馏水调零),每隔30 s读数1次,共测3 min,记录数据[13]。
结果计算:以1 min内A240减少0.1(3支测定管的平均值)的酶量为一个酶活性单位(U)。先求出3支试管各自1 min内A240减少值,公式如下:
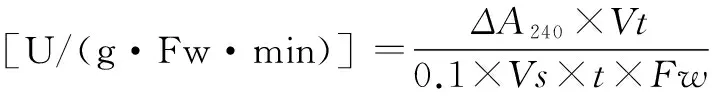
(4)
式(4)中:△A240=AS0-(AS1+AS2+AS3)/3。As0为加入煮死酶液对照管吸光值;As1、As2、As3为样品测定管吸光值;Vt为粗酶提取液总体积;Vs为测定时取粗酶液体积(mL);Fw为样品鲜重(g)。
1.2.5 小麦幼苗过氧化物酶(POD)活性的测定 粗酶液的提取:称取小麦叶片0.5 g,加20 mmol/L KH2PO45 mL,于研钵中研磨成匀浆,以4000 r/min离心15 min,收集上清液保存在冷处;残渣再用5 mL KH2PO4溶液提取1次;合并两次上清液,置于冷处备用。
酶活性的测定:取光径1 cm比色杯2只,按表4加入试剂。
加完立即开启秒表计时,于分光光度计470 nm波长下测量吸光度OD值,每隔1 min读数1次,记录数据[12]。
结果计算:以每分钟OD变化值表示酶活性大小,即以ΔA470/(g·Fw)表示。
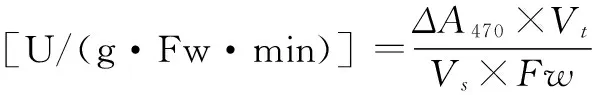
(5)
式(5)中:Vt为粗酶提取液总体积;Vs为测定时取粗酶液体积(mL);Fw为样品鲜重(g)。

表4 POD活性测定试剂加入表
1.3 数据处理
文中数据为3次重复测定的平均值,用软件SPSS 17. 0对所测数据进行处理分析,多重比较采用Duncan法(P0.05);采用Excel 2007软件作图。
2 结果与分析
2.1 不同浓度盐旱交叉胁迫处理下小麦胚芽鞘长度变化
如图1所示,盐旱交叉胁迫后,小麦胚芽鞘伸长受到抑制,抑制程度因处理浓度不同有所差别。不同浓度的盐旱胁迫下小麦胚芽鞘长度在48 h时均显著低于对照,故胚芽鞘长度与耐盐旱性有相关性,适于作为小麦早期耐盐旱筛选指标。在12 h,各处理与对照相比不显著;24 h,只有T1A处理的胚芽鞘长度比对照高28.3%,其他9个处理在24 h均低于对照;36 h,T1B处理下的胚芽鞘长度比对照低1.6%,其他处理下的胚芽鞘长度与对照相比降低幅度大于1.6%;48 h,T1A处理比对照低19%,比T1B处理高12.1%,T1B处理比对照低21.9%。

图1 不同浓度盐旱交叉胁迫对小麦胚芽鞘长度的影响
2.2 不同浓度盐旱交叉胁迫处理下胚芽鞘相对伸长速率的变化
由图2可见,随着盐旱胁迫时间的延长,胚芽鞘RER总体呈下降趋势,说明时间越长,小麦胚芽鞘受到的抑制就越强。在胁迫0~12 h,各处理的胚芽鞘的RER相差不明显;胁迫12~24 h,T1A、T3B、T1C处理胚芽鞘RER最大,表明T1A、T3B、T1C处理的胚芽鞘RER在这个时间段生长最快;胁迫12~36 h,T1B处理的胚芽鞘RER明显大于对照且大于其他处理下的RER,表明T1B处理的胚芽鞘RER在12~36 h生长最快。从0~48 h胚芽鞘生长时间看,T1A、T1B、T3B、T1C处理的胚芽鞘生长速度快于其他处理。
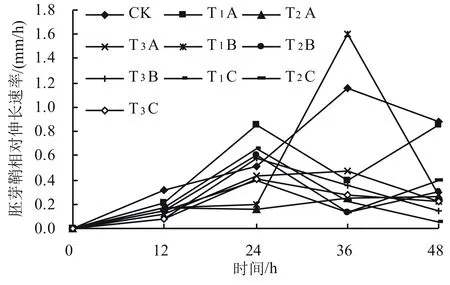
图2 不同浓度盐旱交叉胁迫对小麦胚芽鞘相对伸长速率的影响
2.3 不同浓度盐旱交叉处理下小麦发芽势(GP)与发芽率(GR)的变化
如图3所示,小麦种子的GP、GR总体上呈先上升后下降趋势,说明盐旱胁迫对小麦种子萌发有着抑制作用。处理为T1A和T1B时GP、GR达到最大,GP分别达到96.7%、83.3%,GR分别达到96.7%、96.7%,相对于对照GP分别提高了31.2%、13%,GR分别提高了16.1%。而T2A处理下的GP、GR也分别提高了13%、12%,说明一定浓度的盐旱交叉胁迫能提高小麦种子发芽率。T3C处理下的GP、GR相对于对照分别降低了32.2%、28%,说明处理浓度过大对种子的抑制越强烈。在同一盐浓度胁迫下,PEG浓度越大,GP、GR降低越大,说明干旱能抑制种子的萌发;同一PEG浓度胁迫下,盐浓度增加,GP、GR降低,说明盐也能抑制小麦的生长;而盐旱交叉胁迫后,从整体上说,T1A、T1B和T1C的GP、GR增大,说明一定浓度盐旱交叉胁迫时,盐、旱之间有互抗作用,它们之间有一定的平衡,在平衡没打破之前对小麦的发芽是有促进作用的。综上所得,T1A和T1B的盐旱胁迫抑制作用相对于其他处理比较小。

图3 不同浓度盐旱交叉胁迫对小麦发芽势和发芽率的影响
2.4 不同浓度盐旱交叉胁迫下小麦SOD活性的变化
SOD是O2-的净化剂,是膜脂过氧化防御系统的主要保护酶,它能催化活性氧发生歧化反应并产生无毒分子和过氧化氢,从而避免植物细胞遭受伤害[17]。SOD在保护酶系统中处于核心地位。在逆境中,SOD活性的高低是机体抗逆能力的标志[18]。由图4可知,随着胁迫时间的延长,小麦SOD活性基本上呈现先上升后下降的趋势。在第4天,盐旱交叉胁迫下SOD活性达到最大,表明短时间的盐旱交互作用能刺激小麦SOD活性的升高,但处理不同升高程度不同,且T1B、T2B与对照之间存在显著差异(P0.05);处理到第8天,除对照外,9个处理SOD活性均下降,但处理浓度不同下降幅度不同,且均与对照之间存在显著差异(P0.05),尤其是T1C、T2C、T3C与对照之间的差异非常明显(P=0.000),与对照相比,T1C降低了134.6%、T2C降低了143.3%、T3C降低了155.8%,说明盐旱交叉胁迫时间在适度的时间内可诱导或激活SOD,使其活性升高,但当超过这个时间后SOD活性会迅速下降,表明持续的盐旱交叉胁迫已对小麦幼苗造成了一定的伤害,小麦幼苗的抗氧化能力衰退。
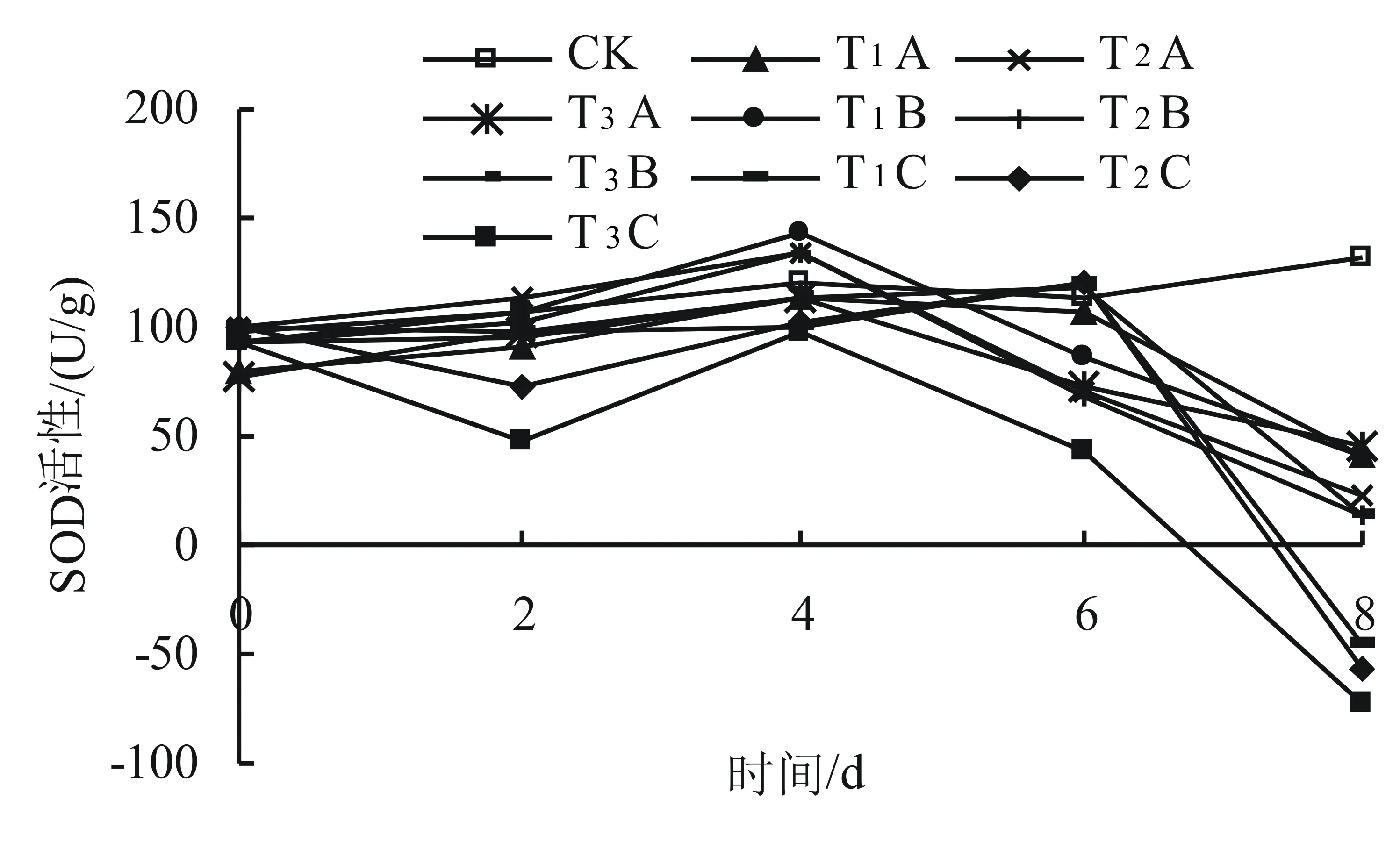
图4 不同浓度盐旱交叉胁迫对小麦幼苗SOD活性的影响
2.5 不同浓度盐旱交叉胁迫下小麦CAT活性的变化
CAT也是植物体内很重要的保护酶,它能够在逆境胁迫中清除细胞内过多生物H2O2,维持体内的活性氧代谢平衡、保护保护膜结构,减轻有毒物质对生物细胞的毒害,延迟或阻碍细胞结构的破坏,使组织保持活力[19]。由图5所知,在胁迫8 d时间内小麦CAT活性随着胁迫时间的延长总体呈现上升趋势。第8天,在轻度干旱与0.6%盐交叉胁迫下小麦的CAT活性上升到最大,上升幅度与对照相比差异显著(P0.05),表明在短时间内,盐旱交叉胁迫激活CAT,使其活性上升,还说明盐旱交叉胁迫作用还没有打破小麦自由基产生和清除之间的平衡,还没有对小麦的膜透性产生严重的伤害。
2.6 不同浓度盐旱交叉胁迫下小麦POD活性的变化
POD也是植物体内保护酶的一种,它能分解植物体内过多的过氧化物,减轻过氧化氢对机体的伤害。由图6可知,在盐旱交叉胁迫下,POD活性随胁迫时间延长而呈现先下降后上升再下降的趋势,说明对小麦在逆境下产生的自由基的清除能力是有时间性的,一定时间内机体在逆境中能刺激POD活性升高来保护机体免受自由基的伤害。第6天POD活性升高到最大,均与对照差异显著(P0.05),且T1B、T3A对比最明显(P=0.000)。第8天9个盐旱交叉胁迫下POD活性均下降,表明随着胁迫时间的延长,小麦幼苗产生的POD不足以分解小麦幼苗体内过多的过氧化氢,说明随盐旱交叉胁迫时间的延长小麦的抗氧化能力衰退。

图5 不同浓度盐旱交叉胁迫对小麦幼苗CAT活性的影响
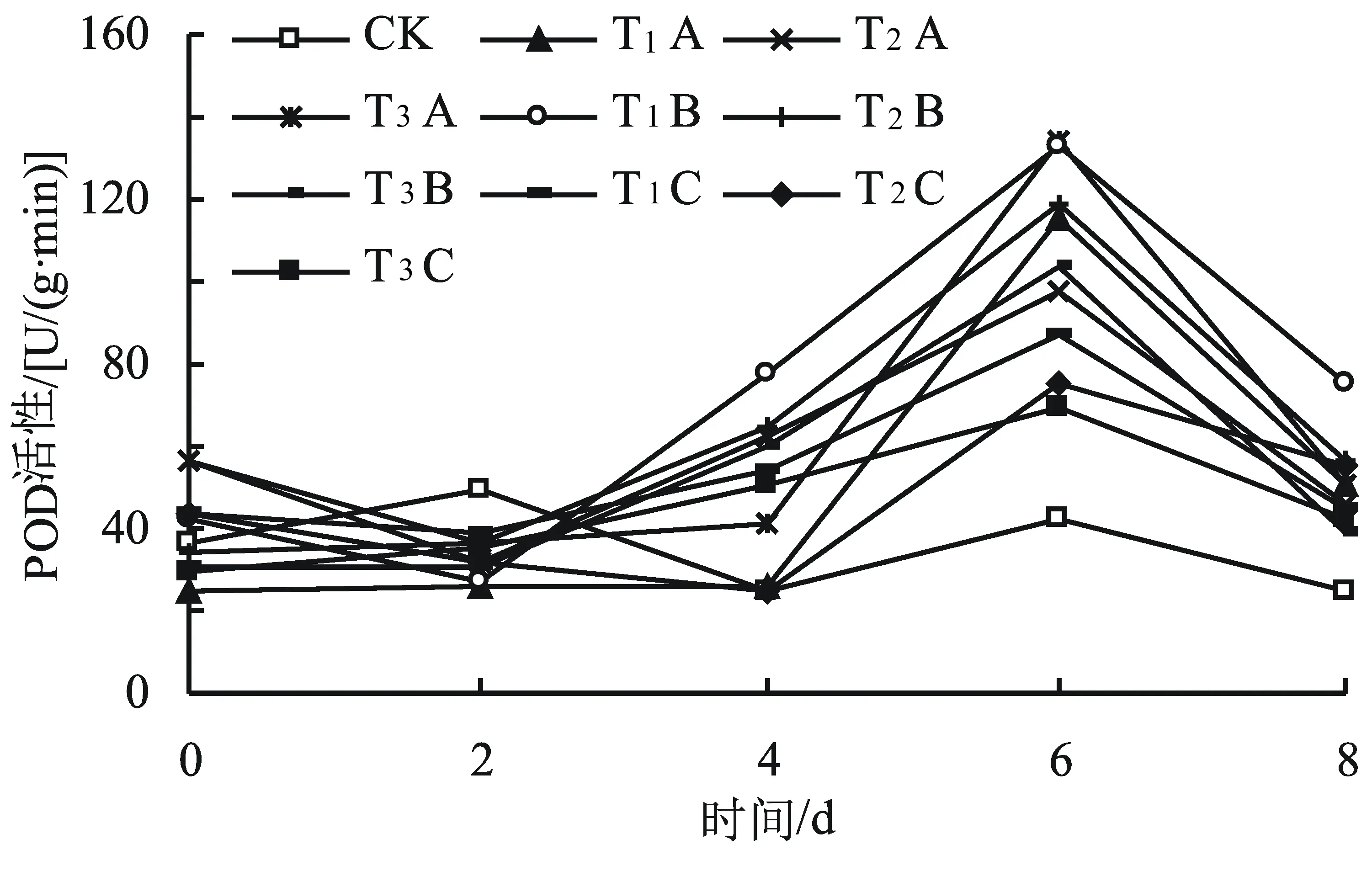
图6 不同浓度盐旱交叉胁迫对小麦幼苗POD活性的影响
3 讨论与结论
胚芽鞘长度和胚芽鞘相对伸长速率能反映种子的抗逆能力的强弱。本研究中盐旱交叉胁迫下,随胁迫浓度的不同小麦胚芽鞘长度发生改变,总体上是浓度增大,胚芽鞘长度降低。但一定的胁迫浓度处理下,种子能在一段时间内维持内部平衡,抵抗外部环境的伤害,表现为交叉适应性,因此,一定浓度的盐旱交叉胁迫处理对小麦胚芽鞘长度的影响可以作为早期小麦抗盐旱性筛选指标之一。
发芽势(GP)则反映了种子发芽的快慢和整齐度,发芽率(GR)反映了种子发芽的多少。盐旱交叉胁迫下,小麦种子的发芽率与发芽势明显下降,说明盐旱交叉胁迫对小麦种子的萌发有强烈的抑制作用。从数据上看,小麦种子的发芽势和发芽率均受盐旱交叉胁迫浓度的影响,浓度越大,小麦种子受到的抑制作用越强,而T1A和T1B处理的盐旱胁迫抑制作用相对于其他处理比较小。
SOD、POD和CAT是植物体内主要的抗氧化酶。SOD能催化O2-发生歧化反应生成H2O2,而POD和CAT则具有分解H2O2和过氧化物的作用。许多研究表明,SOD、POD和CAT的活性与植物抗逆性有关,在适度逆境诱导下SOD、POD和CAT的活性增加以提高植物适应力。Dhinsa等[20]研究表明,在胁迫实验中,酶活性一般随胁迫增强而增强,或者先增加后降低。庄伟伟[21]对银沙槐幼苗保护酶的研究发现,在适度的盐旱交叉胁迫下植物SOD、POD和CAT活性均上升,表现出交叉适应性,胁迫浓度增加时活性均下降。朱金方[22]对柽柳幼苗研究发现,中度干旱胁迫下,SOD和POD活性随盐胁迫的增强先降低后升高,随盐旱胁迫的加剧,SOD和POD活性逐渐减弱。
本试验研究中,随时间延长,不同盐旱交叉胁迫下小麦幼苗POD和SOD活性表现出相同的变化规律,都是先上升后下降,只是活性上升时间不同。POD活性在交叉胁迫第4天到达最大,随后开始下降,SOD活性在交叉胁迫第6天达到最大,随后开始缓慢下降。随胁迫时间增加,SOD和POD活性下降,虽CAT活性在第8天仍呈上升趋势,但细胞内自由基的产生与消除平衡已打破,保护酶不足以清除体内的自由基,膜系统受到破坏。盐旱交叉胁迫时,T2B胁迫前,小麦幼苗的SOD、POD和CAT活性均上升,三者协调一致,体内的保护酶系统活性升高将体内过多的自由基清除,使小麦幼苗自由基维持在一个低水平上,从而防止自由基对细胞的伤害。随着胁迫程度加强,SOD、POD和CAT的活性均表现出下降趋势。因此可说明小麦幼苗在T1B处理下可以正常生长,尽管在T2B胁迫下小麦幼苗SOD、POD和CAT活性开始下降,同时也表明,在逆境胁迫下虽然保护酶系统功能加强,但其调节能力也是有限的,重度交叉胁迫下小麦幼苗并不能通过保护酶来清除体内的自由基,较多的自由基破坏了其体内的膜系统,从而对小麦幼苗的生长造成较大影响。
研究结果表明,在一定时间内,小麦幼苗在盐旱交叉胁迫下表现出交叉适应性,适度的盐旱交叉胁迫可增加小麦的抗逆能力,以T1B(10%PEG+0.6%NaCl)表现最为明显。但是小麦幼苗在长期受到交叉胁迫且胁迫浓度大于T1B时,交叉适应性降低,体内的SOD、POD和CAT保护酶的活性不能维持较高水平。本试验通过盐旱交叉胁迫处理商麦5226后,探讨小麦幼苗保护酶的变化规律,为小麦的抗性育种提供了理论基础。但本研究主要研究小麦幼苗阶段保护酶活性的变化,不能反映整个生育期相关生理指标变化情况,况且植物体内的反应是复杂多变的,其相关规律还有待进一步研究。
[1] 周丹丹,李存华,杨庆山,等.盐胁迫对朴树叶片渗透调节物质及保护酶系统的影响[J].山东林业科技,2016(2):29-32.
[2] 靖娇娇,张颖,白志英,等.盐胁迫对小麦代换系幼苗叶片保护酶活性影响及染色体效应[J].华北农学报,2014,29(5):134-138.
[3] 于浩世,王新军,刘自刚.商洛市小麦品种区域试验初报[J].商洛师范专科学校学报,2005,19(4):43-44.
[4] 石庆华,林嘉鹏,姚正培,等.NaCl胁迫对小麦生理生化特征的影响[J].新疆农业科学,2010,47(7):1479-1484.
[5] 李怀伟.旱涝-低温交叉胁迫对小麦抗寒性的影响[D].哈尔滨:东北农业大学,2013.
[6] 宫德衬.小麦抗旱性生理指标研究[D].烟台:烟台大学,2014.
[7] 赵银河,祝钰,孙明高,等.干旱和盐分交互胁迫对紫荆、皂角幼苗保护酶活性的影响[J].山东农业大学学报:自然科学版,2007,38(2):173-177.
[8] 李妍.盐和PEG胁迫对丝瓜幼苗抗氧化酶活性及丙二醛含量的影响[J].干旱地区农业研究,2009,27(2):159-178.
[9] 孙国荣,彭永臻,阎秀峰,等.干旱胁迫对白桦实生苗保护酶活性及膜质过氧化作用的影响[J].林业科学,2003,39(1):165-167.
[10] 庄伟伟,李进,曹满航,等.盐、旱及其交叉胁迫对银沙槐幼苗保护酶活性的影响[J].干旱区研究,2010,27(5):760-765.
[11] Giannopolitiscn. Superoxide dismutase, purification and quantitative relationship with water-soluble protein in seedling[J]. Plant Physiol, 1997, 59: 315-318.
[12] 张志良.植物生理学实验指导(第4版)[M].北京:高等教育出版社,2009:154-155.
[13] 王学奎.植物生理生化实验原理和技术(第2版)[M].北京:高等教育出版社,2006.
[14] 祝社民.水杨酸对PEG胁迫下商麦5226幼苗生长的影响[J].商洛学院学报,2014,28(6):65-67.
[15] 王芳,段迪,段培,等.不同耐盐性小麦胚芽鞘伸长对NaCl胁迫的响应[J].作物学报,2007,33(12):2053-2058.
[16] 张志良,瞿伟菁.植物生理学实验指导(第3版)[M].北京:高等教育出版社,2003.
[17] 张桂菊,吴军,王玉忠,等.NaCl胁迫对光蜡树幼苗保护酶系统的影响[J].河南农业科学,2007(9):75-78.
[18] 李楠,黄佳丽,曲波.干旱胁迫对委陵菜膜质过氧化作用及保护酶活性的影响[J].中国草地学报,2011(4):485-491.
[19] 闫秀峰,于涛.水分胁迫对黄檗幼苗保护酶活性及脂质过氧化作用的影响[J].应用生态学报,2005,16(12):2354-2356.
[20] Dhinsa R S, Dhinsa P P, Thorpe T A. Leaf senescence: Correlated with increased levels of membrane permeability and lipid peroxidation and decreased levels of super-oxidation dismutase and catalase[J]. Journal of Esperimental Botany, 1981, 32: 93-101.
[21] 庄伟伟.银沙槐幼苗对干旱、盐渍及其交叉胁迫反应的研究[D].乌鲁木齐:新疆师范大学,2011.
[22] 朱金芳,夏江宝,陆兆华,等.盐旱交叉胁迫对柽柳幼苗生长及生理生化特性的影响[J].西北植物学报,2012,32(1):124-130.
(责任编辑:许晶晶)
Effects of Salt and Drought Cross Stress on Seed Germination and Protective Enzyme Activity of Wheat Seedling
HUA Zhi-rui, LI Xiao-ling
(College of Biological Pharmacy and Food Engineering, Shangluo University, Shangluo 726000, China)
Wheat variety Shangmai 5226 was used as experimental material, different concentrations of PEG-6000 solution and NaCl solution were used to simulate different degrees of drought stress and salt stress respectively, and the coleoptile length, germination potential and germination rate of wheat seeds, as well as the protective enzyme activity of wheat seedlings under salt and drought cross stress were studied. The results showed that: under different degrees of salt and drought cross stress, along with the extension of stress time, the relative elongation rate of seed coleoptile was decreased in general, and the activity of superoxide dismutase (SOD) and peroxidase (POD) increased first and then decreased, while the activity of catalase (CAT) decreased first and then increased. When the concentration of PEG-6000 and NaCl solution increased, the coleoptile length, germination potential and germination rate revealed a decreasing trend, while the activity of SOD, POD and CAT increased at first and then decreased. We think that wheat seedlings have a cross adaptation to salt and drought cross stress, and moderate salt and drought stress can increase the adversity resistance of wheat.
Salt and drought cross stress; Wheat; Seed germination; Seedling; Protective enzyme activity
2016-09-02
陕西省科技厅项目(2011K01-18)。
华智锐(1980─),男,湖北黄石人,副教授,主要从事植物抗性生理与植物育种研究。
S512.1
A
1001-8581(2017)02-0018-06

