快速溶剂萃取–高效液相色谱法测定禽蛋中磺胺嘧啶*
饶桂维,李成平,王倩,活泼
(浙江树人大学生物与环境工程学院,杭州 310015)
快速溶剂萃取–高效液相色谱法测定禽蛋中磺胺嘧啶*
饶桂维,李成平,王倩,活泼
(浙江树人大学生物与环境工程学院,杭州 310015)
建立快速溶剂萃取–高效液相色谱法测定禽蛋中磺胺嘧啶残留的方法。用单因素和正交试验对禽蛋中磺胺嘧啶的萃取条件进行优化,确定了最佳萃取条件:以甲醇为萃取剂,在130℃循环萃取4次,冲洗体积分数为80%,萃取时间为25 min。色谱柱为Hypersil ODS2柱(4.6 mm×250 mm,5 µm),流动相为甲醇–0.5%冰乙酸(25∶75),流量为1.0 mL/min,检测波长为265 nm。磺胺嘧啶的质量浓度在0.025~0.500 mg/mL范围内与色谱峰面积呈良好的线性关系,相关系数r=0.999 5,检出限为0.5 µg/kg。加标回收率在83.0%~88.2%之间,测定结果的相对标准偏差为2.2%(n=9)。方法的精密度、准确度和基质效应均符合禽蛋样品检测要求,可用于禽蛋中磺胺嘧啶含量的测定。
磺胺嘧啶;禽蛋;快速溶剂萃取;高效液相色谱法
磺胺嘧啶(SD)别名磺胺哒嗪、地亚净,化学名称为N-2-嘧啶基-4-氨基苯磺酰胺,是目前养殖业中应用最广、用量最大的抗菌药物之一,多与甲氧苄啶联用,通过双重阻断细菌的叶酸合成达到抑菌的作用[1–2]。在家禽业中常用于预防和治疗白痢、球虫病、盲肠炎、肝炎及其它细菌性疾病。目前市面上销售的禽蛋有一部分来自家庭散养及小规模养殖场,因法律意识淡薄及监管不到位,易造成禽蛋兽药残留超标。有研究发现磺胺类药物毒性较高,残留半衰期长,对人体和环境危害显著,能引起过敏反应、细菌耐药性和泌尿系统损害、造血紊乱等副作用[3–4],欧盟已将磺胺类药物列为严限使用的药物,并规定动物源食品中磺胺类药物的残留限量为0.1 µg/g[5]。
目前测定磺胺类药物的方法主要有紫外可见光分光光度法[6]、免疫层析法[7]、电化学分析法[8]、高效液相色谱法[9]和液相色谱质谱联用法[10]等。紫外可见光分光光度法简单快速,但不适合多组分磺胺类药物测定;免疫层析法操作简单,成本低,但大多只能进行定性分析,而且反应时间长;电化学分析法仪器设备简单、测定范围宽,但测定干扰因素多,对结果影响大;色谱法是目前应用最广泛的有机化合物测定方法,具有定性定量准确、灵敏度高及干扰少等优点,液相色谱质谱联用法除具有色谱法优点外,还具有更低的检测限及更强的抗干扰力,但因仪器昂贵,不适合推广应用,因此笔者采用高效液相色谱法测定禽蛋中的磺胺嘧啶。
快速溶剂萃取(ASE)技术采用压缩气体如氮气来维持系统的高压防止溶剂汽化,进而克服常压提取对溶剂温度的限制。样品的提取和分离自动完成,提取时间短,提取效率高,是一种在高温高压下高效萃取样品中组分的新方法[11–12]。美国环境保护署(EPA)已将其收录为样品处理的标准方法之一,在环境、食品和药物等领域用于样品中残留物的提取[13–16]。故笔者利用快速溶剂萃取法萃取禽蛋中的磺胺嘧啶,先通过单因素试验对萃取时间、萃取温度、冲洗体积和萃取循环次数等因素进行考察,再经正交试验确定最佳萃取参数。与常规液液萃取法相比,快速溶剂萃取法具有溶剂用量少,萃取效率高等优势,与固相萃取、分子印迹等处理方法相比,具有准确度、自动化程度高和处理成本较低等优点。
1 实验部分
1.1 主要仪器与试剂
快速溶剂萃取仪:ASE–350型,美国赛默飞世尔科技公司;
高效液相色谱仪:FL2200型,浙江福立仪器有限公司;
冷冻干燥机:FD–1D–50型,北京博医康实验仪器有限公司;
旋转蒸发器:RE–3000A型,上海亚荣公司;
电子分析天平:AB204–N型,瑞士梅特勒托利多仪器有限公司;
高速万能粉碎机:FW80型,天津泰斯特仪器有限公司;
数显匀浆机:IKA T25 型,德国IKA公司;
低速离心机:TD4Z型,湖南凯达实验发展有限公司。
磺胺嘧啶:中国药品生物制品检定所;
甲醇、乙酸:HPLC级;
鸡蛋、鸭蛋、鹌鹑蛋样品:购自超市,洗净去壳后,以10 000 r/min匀浆,冷冻干燥后,经研钵研磨均匀,低温下密封保存。
实验所用其它试剂为分析纯;
实验用水为超纯水。
1.2 提取方法
准确称取1.0 g样品,置于萃取池内,加适量硅藻土,设定提取时间为25 min、循环次数为4次、萃取温度为130℃,冲洗体积分数为80%,以甲醇为提取剂,进行操作。提取完毕,将提取液转移到10 mL离心管中,以20 000 r/min离心15 min,取上清液并在40℃水浴下氮吹至干,加入流动相溶解,定容至1 mL,过0.22 µm 尼龙滤膜后待测。若样品中分析物浓度过高,则用甲醇进行适量稀释。
1.3 色谱条件
色谱柱:依利特Hypersil ODS柱(250 mm×4.6 mm,5 µm);柱温:30℃;流动相:甲醇–0.5%冰乙酸溶液(25∶75);流量:1 mL/min;检测波长:265 nm;进样体积:10 µL。
1.4 标准溶液的配制
(1)磺胺嘧啶标准储备溶液。精确称取干燥的磺胺嘧啶标准品10 mg,用甲醇溶解并定容至10 mL棕色容量瓶中,配制成1.0 mg/mL的标准储备液,于–20℃下避光保存(2个月内使用)。
(2)磺胺嘧啶标准工作溶液。移取磺胺嘧啶标准储备液适量,用甲醇配制成所需浓度的标准工作溶液,密封于4℃下避光保存备用(7天内使用)。
2 结果与讨论
2.1 萃取单因素试验考察
以甲醇为提取剂,以鸡蛋空白基质为样品,在进行加标回收率测定后,选取最高回收率的加标量加入样品,对ASE冲洗体积分数、提取温度、提取次数和提取时间进行单因素试验,测定样品回收率,从而确定后续正交试验的参数范围。
2.1.1 冲洗体积分数
ASE的不同冲洗体积分数对磺胺嘧啶萃取有一定影响。设定萃取时间为15 min,萃取温度为60℃,循环次数为1次的条件下,研究不同冲洗体积分数对磺胺嘧啶萃取效果的影响。将鸡蛋空白基质各加标100 mg,经ASE萃取后按1.2方法制备成供试品溶液,在1.3色谱条件下进行测定,计算加标回收率,结果见表1。

表1 不同冲洗体积时的回收率 %
由表1可知,在冲洗体积分数达到80%时回收率最高;随着冲洗体积分数的增加,回收率逐渐稳定,可能是冲洗比较充分,管路已无样品残留。故冲洗体积分数确定为80%。
2.1.2 萃取温度
以循环次数为1次,萃取时间为15 min,冲洗体积分数80%为固定条件,分别取鸡蛋空白基质各加标100 mg,与等量硅藻土混匀,置于萃取池内,分别在60,80,100,120,140℃下萃取,通过测定萃取液中磺胺嘧啶的含量计算回收率,结果见表2。

表2 不同萃取温度时的回收率
由表2可知,磺胺嘧啶的回收率随萃取温度的升高而增加,在120℃之后趋于平稳,萃取温度升高时回收率变化不大。由于萃取仪的操作温度范围为40~200℃,操作温度过高易造成各项仪器误差,因此萃取温度选择为120℃。
2.1.3 萃取时间
分别取鸡蛋空白基质各加标100 mg,与等量硅藻土混匀,置于萃取池内,在萃取温度120℃,萃取次数1次,冲洗体积分数80%的条件下,设定萃取时间为5,10,15,20,25 min分别进行萃取,测定磺胺嘧啶含量,计算回收率,试验结果见表3。
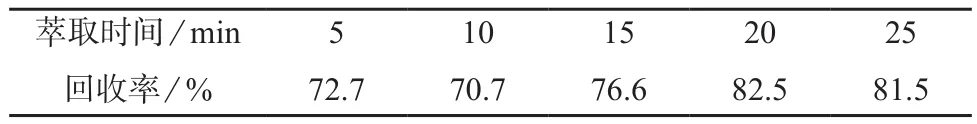
表3 不同萃取时间时的回收率
由表3可知,当萃取时间为20 min时,磺胺嘧啶的回收率达到最大值(82.5%),故萃取时间选择为20 min。
2.1.4 萃取次数
在冲洗体积分数为80%,萃取时间为20 min,萃取温度为120℃的条件下,分别取鸡蛋空白基质各加标100 mg,与等量硅藻土混匀,置于萃取池内。分别萃取1,2,3,4,5次,测定萃取液中磺胺嘧啶的含量,试验结果见表4。由表4可知,磺胺嘧啶的回收率随着萃取次数的增加而增加,萃取3次以上时,趋势平缓。最终选择萃取次数为4次。

表4 不同萃取次数时的回收率
2.2 萃取正交试验
在完成单因素试验后,确定了萃取温度、萃取时间、冲洗体积分数和循环次数各水平的正交试验范围,进行4因素3水平的正交试验设计[17],以获得最佳的磺胺嘧啶ASE萃取条件,各因素水平见表5。

表5 各因素水平设定值
从冲洗体积分数、萃取时间、萃取次数、萃取温度4个因素试验结果中分别优选出最优的4个条件作为每个因素的3个水平,分别取鸡蛋空白基质各加标100 mg,以磺胺嘧啶的回收率为考察指标进行考察,进行L9(34)的正交试验,结果见表6。

表6 正交试验结果
在正交试验中,K1,K2,K3为各因素的3个水平得率的平均值,极差R表示同因素K最大值与最小值之差,极差的大小表明了因素对样品中磺胺嘧啶萃取回收率影响的大小。对试验数据进行分析后得出,影响磺胺嘧啶萃取回收率的顺序为冲洗体积分数>萃取温度>萃取时间>萃取次数。萃取次数影响最不明显,这可能与ASE萃取效率比较高有关系。根据3个因素K值的大小,得出采用快速溶剂萃取法对禽蛋类磺胺嘧啶的最优萃取条件为A2B3C3D3。即冲洗体积分数为80%,萃取温度为130℃,萃取时间为25 min,萃取次数为4次。
2.3 标准工作曲线、检出限及定量限
利用磺胺嘧啶标准储备液配制质量浓度分别为0.025,0.050,0.100,0.200,0.300,0.400,0.500 mg/mL的系列标准工作溶液,在1.3条件下进行测定。以磺胺嘧啶的色谱峰面积(Y)为纵坐标,质量浓度(X)为横坐标,进行线性回归,得到标准曲线方程为Y=43.065X–0.453 9,r2=0.999 5,线性范围为0.025~0.500 mg/mL。
将0.025 mg/mL标准工作溶液不断稀释进样分析,以3倍信噪比计算检出限,得到磺胺嘧啶的检出限为0.5 µg/kg;以10倍信噪比计算定量限,得方法的定量限为2.0 µg/kg。
2.4 精密度试验
移取0.50 mg/mL的磺胺嘧啶标准工作溶液适量,在1.3色谱条件下平行测定6次,记录色谱峰面积,结果见表7。由表7可知,色谱峰面积测定结果的相对标准偏差为1.20%,说明该方法具有良好的精密度。

表7 精密度试验结果
2.5 回收试验
以鸡蛋空白基质作为空白样品,进行加标回收试验[18]。取9份样品分别加入50,100,150 mg/kg 3个水平的磺胺嘧啶对照品,每个水平平行测定3次。按1.2方法进行提取,制备供试品溶液,按照1.3色谱条进行测定,计算加标回收率,结果见表8。由表8可知,采用3个水平、3次平行共计9次测定,平均加标回收率为83.0%~88.2%,平均回收率为85.5%,测定结果的相对偏差为2.2%,可见所建方法具有较高的精密度和准确度。

表8 加样回收试验结果
2.6 样品测定
用本方法对市售的鸡蛋、鸭蛋、鹌鹑蛋各10份样品进行检测,其中1份样品检出磺胺嘧啶,含量为3.12 mg/kg,其它样品均未检出。对照品色谱图、阳性样品色谱图分别见图1、图2。

图1 对照品溶液色谱图

图2 样品溶液色谱图
3 结论
(1)经过单因素和正交试验确定,采用快速溶剂萃取法(ASE)萃取禽蛋中磺胺嘧啶的最佳萃取条件:冲洗体积分数为80%,萃取温度为130℃,萃取时间为25 min,萃取次数为4次。在该最佳萃取条件下,禽蛋中磺胺嘧啶的回收率可达85.5%。ASE萃取法具有消耗溶剂少,萃取效率高等优点,在食品中非法添加剂的萃取方面具有一定的优势[19–20]。
(2)采用快速溶剂萃取–高效液相色谱法测定禽蛋中磺胺嘧啶含量,方法操作简便,准确度高,重现性好,专属性强,可作为禽蛋中磺胺嘧啶含量的常规测定方法。
[1] 陈杖榴.兽医药理学[M].北京:中国农业出版社,2009: 266–270.
[2] Wang Xiliang,Li Kui,Shi Deshi,et al. Development and validation of an immunochromatographic assay for rapid detection of sulfadiazine in eggs and chickens[ J]. Journal of Chromatography B,2007,847(2): 289–295.
[3] 黄华,陈君慧,冯楠,等.动物源性食品中磺胺类药物残留前处理和检测方法研究进展[J].食品工业科技,2013,34(4): 378–381.
[4] 刘思思,杜鹃,陈景文,等.加速溶剂萃取–高效液相色谱–串联质谱联用测定莱州湾海水养殖区野生鱼肌肉中19种抗生素及2种磺胺代谢产物残留[J].色谱,2014,32(12): 1 320–1 325.
[5] 吴西梅,杨业,杨春穗,等.高效液相色谱质谱测定肉品中的磺胺二甲嘧啶[J].中国卫生检验杂志,2004,14 (2): 164–165.
[6] 张从良,文春波,王岩,等.紫外分光光度法测定土壤中磺胺嘧啶的含量[J].分析科学学报,2007,23(5): 616–618.
[7] 王喜亮,金秀蛾,李奎,等.免疫层析法测定动物源性食品中磺胺嘧啶的残留[J].中国抗生素杂志,2008,33(6): 350–618.
[8] 张会妮,李琪,李广,等.利用碳纳米管——nafon修饰电化学传感器对磺胺嘧啶电化学性质的研究[J].甘肃科技,2014,30(4): 40–41.
[9] 许志刚,杜卓,胡玉玲,等.甲氧苄啶分子印迹涂层搅拌棒在复杂样品痕量甲氧苄啶和磺胺药物分析中的应用[J].分析化学,2012,40(7): 1 002–1 010.
[10] 洪武兴,罗聪亮,刘益锋,等.液质联用法罗非鱼中磺胺嘧啶不确定度的评定[J].现代食品科技,2009,25(11): 1 069–1 071.
[11] 叶明立,朱岩. ASE加速溶剂萃取技术在食品、农残方面的分析应用[J].现代科学仪器,2003(1): 35–36.
[12] Carabias-Martinez R,Rodriguez-Gonzalo E,Revilla P,et al. Pressurized liquid extraction in the analysis of food and biological samples[ J]. Journal of Chromatography A,2005,1 089(1/2): 1–17.
[13] 万建波,徐辰,李绍平,等.葛根异黄酮成分的加压溶剂提取法研究[J].分析化学,2005,33(10): 1 435–1 438.
[14] 唐巧玉,周毅峰.快速溶剂萃取法提取水芹中总黄酮工艺研究[J].食品科学,2010,31(22): 190–193.
[15] 饶桂维,梅瑜,陈贝贝,等.快速溶剂萃取法提取枇杷核中总黄酮的研究[J].食品工业科技,2013,34(19): 213–215.
[16] 丁轲,张彤楠,韩涛.快速溶剂萃取联合高效液相色谱法测定不同产地酸枣仁中皂苷A、B的含量[J].食品工业科技,2014,35(23): 265–270.
[17] 王钦德.食品试验设计与统计分析[M].北京:中国农业大学出版社,2003: 152–362.
[18] 郑小严,欧阳立群,戴明,等.高效液相色谱法同时测定染发剂中8种合成染料[J].分析测试学报,2015,34(1): 86–90.
[19] Supradip Saha,Suresh Walia,Aditi Kundu,et al. Optimal extraction and fingerprinting of carotenoids by accelerated solvent extraction and liquid chromatography with tandem mass spectrometry[ J]. Food Chemistry,2015,177(6): 369–375.
[20] Heo Jiyoung,Suna Kim,Kang Jaehyun,et al. Determination of lutein from green tea and green tea by-products using accelerated solvent extraction and UPLC[ J]. Journal of Food Science,2014,79(5): 816–821.
Determination of Sulfadiazine in Eggs by Accelerated Solvent Extraction and High Performance Liquid Chromatography
Rao Guiwei, Li Chengping, Wang Qian, Huo Po
(College of Biology and Environmental Engineering, Zhejiang Shuren University, Hangzhou 310015, China)
A extraction and analytical method with accelerated solvent extraction (ASE) and high performance liquid chromatography was developed to determine sulfadiazine in eggs. Single factor and orthogonal experiment were adopted to optimize the extraction conditions. The results showed that the optimum conditions of extraction were as follows: methanol was as extraction solvent, 130℃for four times in 25 min and ring volume fraction of 80%. The separation of samples was carried on Hypersil ODS2 column (4.6 mm×250 mm,5 µm) with mobile phase of methanol–0.5% acetic acid(25∶75) and detection wavelength of 265 nm. The mass concentration of sulfadiazine was linear with chromatographic peak area in the range of 0.025–0.500 mg/mL with correlation coeffcient of 0.999 5. The detection limit was 0.5 µg/kg. The spiked recoveries were in the range of 83.0%–88.2% with relative standard deviation of 2.2%(n=9). The precision,accuracy,mean recoveries and the matrix effect were satisfed with the requirements of eggs measurement. The method is suitable for the determination of sulfadiazine in eggs.
sulfadiazine; egg; accelerated solvent extraction; high performance liquid chromatography
O657.6
:A
:1008–6145(2017)01–0020–05
10.3969/j.issn.1008–6145.2017.01.005
*浙江省教育厅研究项目(2014J80002);浙江树人大学校一级科研项目(2013A1103)
联系人:活泼;E-mail:xka-8@163.com
2016–09–22

