ICP–AES法测定药用植物中22种元素*
张健,范宝磊
(1.贵州省地矿局103地质大队,贵州铜仁 554300; 2.湖北科技学院药学院,湖北咸宁 437100)
ICP–AES法测定药用植物中22种元素*
张健1,范宝磊2
(1.贵州省地矿局103地质大队,贵州铜仁 554300; 2.湖北科技学院药学院,湖北咸宁 437100)
建立微波消解–电感耦合等离子发射光谱(ICP–AES)测定贵州梵净山特色药用植物中Ni,Cd,As,Co等22种元素含量的方法。以硝酸–过氧化氢(3∶1)为消解体系,样品经微波消解后,用ICP–AES法对厚朴皮与厚朴根、野生艾纳香和人工种植艾纳香中22种元素含量及其差异进行分析。仪器工作条件:RF功率为1.25 kW,等离子体气流量为15.1 L/min,辅助气流量为1.0 L/min,雾化器气体流量为0.6 L/min。各元素在检测范围内有良好的线性,线性相关系数为0.986 7~0.999 6,检出限在0.001 2~0.012 3μg/g之间;加标回收率在95.55%~102.4%之间,测定结果的相对标准偏差为0.8%~3.6%(n=5)。该方法快速、准确、可靠,可用于药用植物样品中的微量元素分析。
药用植物;微量元素;厚朴;艾纳香
中药具有疗效显著、毒副作用小的特点,在我国有着悠久的医用历史,并且在全世界得到了越来越广泛的应用[1]。我国的中药资源极为丰富,全国范围内药用资源共计12 807种,其中动物1 500余种,植物11 146种,矿物80种,许多用量较大的药材实现了人工栽培(或饲养),我国是世界上最大的药材生产国[2]。据统计,贵州全境有中药资源4 290种,其中植物药3 924种,梵净山国家自然保护区是全国中药(材)著名的道地产区之一,有全国出名的道地药材10余种[3–5]。准确了解和掌握中药制剂中的有效和有毒、有害成分,进行科学客观的安全性评估,是我国新医药学工作的一项重要内容,而关于药用植物中元素组成测定与评价的研究是其中的重点之一[6–7]。厚朴和艾纳香是贵州梵净山特色药用植物,目前未见对其元素全面分析和研究的报道。
元素的分析方法有原子吸收法、原子荧光发、等离子发射光谱法(ICP–AES)以及等离子发射质谱法[8–9]。ICP–AES分析技术因具有检出限低、基体效应小,精密度高,线性范围宽及多元素同时分析等诸多优点而得到广泛应用,因此ICP–AES分析技术已成为现代检测技术的一个重要组成部分[10]。笔者以微波消解–ICP–AES检测技术,建立了厚朴和艾纳香中22种元素的分析方法。同时对厚朴皮与厚朴根、野生艾纳香和人工种植艾纳香中元素组成的差异进行了对比分析。为我国中药材出口质检提供理论数据,并且有利于促进新药的研发及现有药剂疗效的提高。
1 实验部分
1.1 主要仪器与试剂
全谱直读电感耦合等离子体原子发射光谱仪:Thermo 6000型,配有CID(电荷注入检测器)、高盐雾化器、iTEVA操作软件,美国热电公司;
微波消解系统:MD6C–4H型,北京盈安美诚科学仪器有限公司;
超纯水机:New Human POWERⅡ型,韩国Human 公司;
Ni,Cd,As等22种元素的标准储备溶液:质量浓度均为1 000 µg/mL,国家标准物质研究中心;
硫脲:50 g/L,分析纯,长沙化学试剂有限公司;
抗坏血酸:50 g/L,分析纯,长沙化学试剂有限公司;
硝酸:优级纯,南京化学试剂股份有限公司;
过氧化氢:分析纯,上海国药化学试剂公司。
1.2 样品前处理方法
参考GB/T 5009–2003《 食品卫生检验方法 理化部分》[11],野外采集样品,称重并分类,统一进行编号(由江口苗药科技有限公司提供)。然后在恒温干燥箱中低温干燥,温度控制在70℃左右,烘干后的样品称重并计算与新鲜物的相关值后进行粉碎磨细至75µm(200目),随即装入聚乙烯袋,于干燥器中密封保存。针对不同植物性中药样品类型和不同消解方法的实际需要,按表1要求的量进行取样[11]。

表1 不同样品的取样量 g
1.3 仪器工作条件
ICP–AES测工作条件列于表2。

表2 ICP–AES工作参数
1.4 标准溶液配制
所用玻璃器具均用1∶1王水浸泡12 h后洗净晾干。对标准储备溶液进行稀释配制系列标准溶液。溶液酸度与样品溶液酸度保持一致。测定时与样品同步,现配现用。同时配制标准空白溶液以及样品空白溶液。
2 结果与讨论
2.1 样品消解体系选择
微波消解用溶剂体系有王水、王水–过氧化氢、硝酸–过氧化氢等,均能得到较好的消解效果,经试验比较确定本研究采用硝酸–过氧化氢体系。主要程序如下:准确称取0.500 0 g样品于消化罐中,加入5~6 mL硝酸和1~2 mL过氧化氢,加盖,过夜消解12 h后释放罐体内气体,再进行加压消解,低温消解5 min,静置5 min,然后逐步升压继续消解10 min。冷却后,打开消化罐,置于低温电热板上或水浴蒸至近干后,加入适量盐酸提取,转入50 mL容量瓶中,并用超纯水定容得试样溶液,同时做试剂空白。
准确吸取两份10 mL试样溶液于50 mL烧杯中,加入2.0 mL硝酸和0.6 mL高氯酸,盖上表面皿于低温电热板上缓慢消解,直至白烟冒尽,溶液澄清。取下冷却,分别加入高纯水10 mL和6.0 mol/L盐酸溶液5 mL,继续消解至溶液冒白烟,冷却。前者加入50 g/L硫脲和50 g/L抗坏血酸混合液(体积比1∶1) 2.0 mL,后者加入10 g/L铁氰化钾溶液1.0 mL提取至25 mL容量瓶中,用纯水定容摇匀,得到的试液用以测定As和Se的含量。
2.2 仪器工作参数优化和分析谱线选择
以灵敏度高、检出限低、谱图峰形好、共存元素干扰少作为仪器参数优化依据,从仪器谱线库所提供的22种待测元素推荐波长、背景和强度等参数,选择2~3条谱线。最终选择的仪器参数列于表2,各元素的分析谱线见表3。
2.3 标准工作曲线及检出限
准确吸取各单元素标准储备溶液,用5%硝酸为溶剂配制各元素的质量浓度均为0,0.02,0.1,1.0,2.0 mg/L的系列标准溶液,在最佳实验条件下进行测定,以谱线强度(Y)为纵坐标,待测元素的质量浓度(X)为横坐标进行线性回归。
在优化的仪器测定条件下,重复测定空白溶液10次,计算测定结果的标准偏差(s),按国际纯粹与应用化学联合会(IUPAC)规定,按LOD=3s计算各待测元素的检出限。各元素的工作曲线方程、检出限及相关系数见表3。
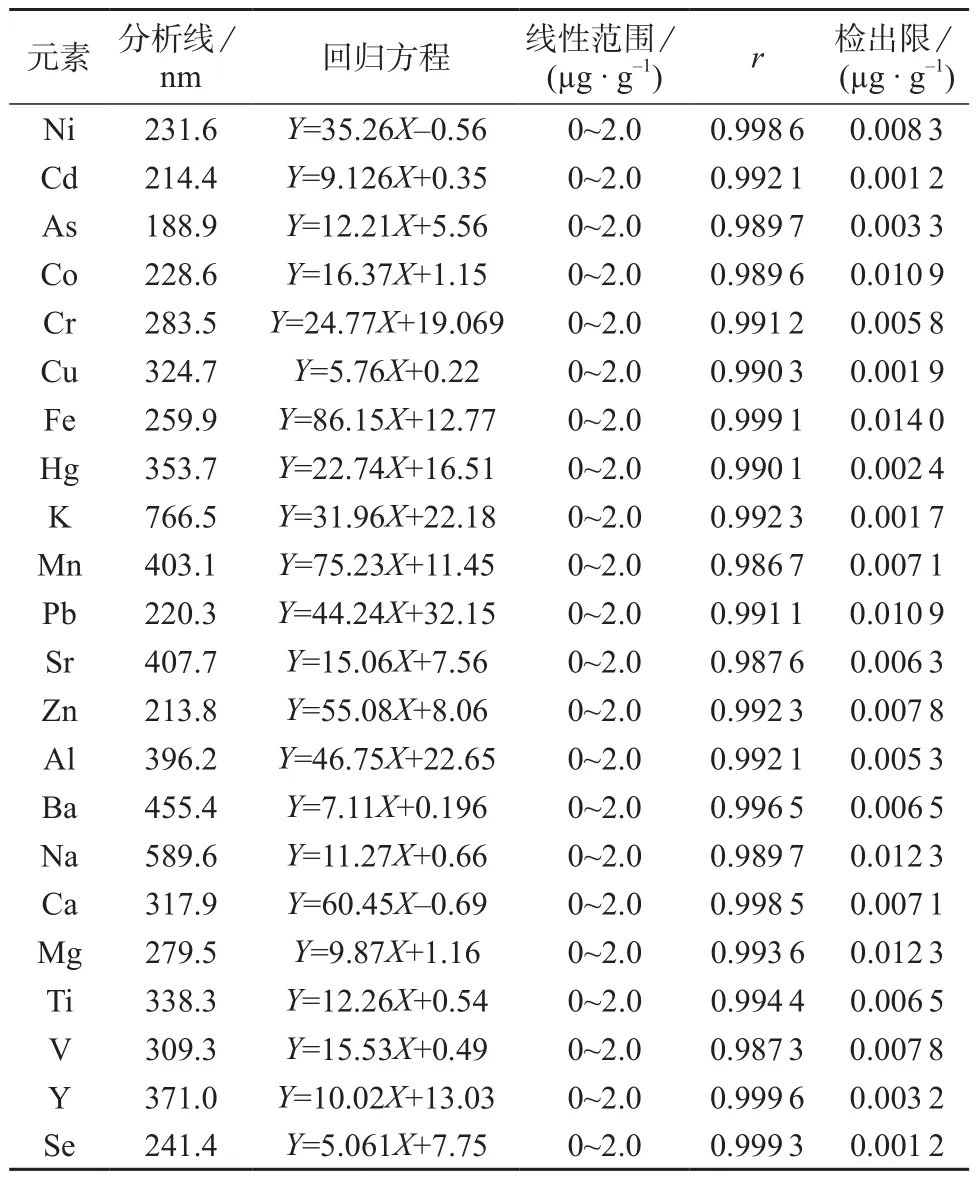
表3 各元素的分析线、回归方程、检出限及相关系数
2.4 厚朴中微量元素分析结果
选取11个厚朴样品,分取根、皮制样,平行测定3次,测定结果见表4。厚朴皮和根中元素含量折线图见图1。

表4 厚朴样品中22种微量元素的含量 µg/g

图1 厚朴皮和根中元素含量折线图
厚朴样品中22种元素含量较高的依次是Ca,K,Mg,Fe,Na;对厚朴皮和厚朴根中22种元素进行对照分析,结果表明,厚朴的皮及根均未检出重金属Hg的含量,其它重金属元素Pb,Cd的含量也很低[12];厚朴皮中Ca和Mg两种元素的含量高于根部的含量,皮的含钙量接近根的两倍,说明厚朴所吸收的钙质在皮中得到更好的富集,同样镁在皮部也有一定的富集。
2.5 艾纳香中微量元素分析结果
对梵净山野生艾纳香和人工种植的艾纳香样品中微量元素的含量进行了分析,结果见表5。
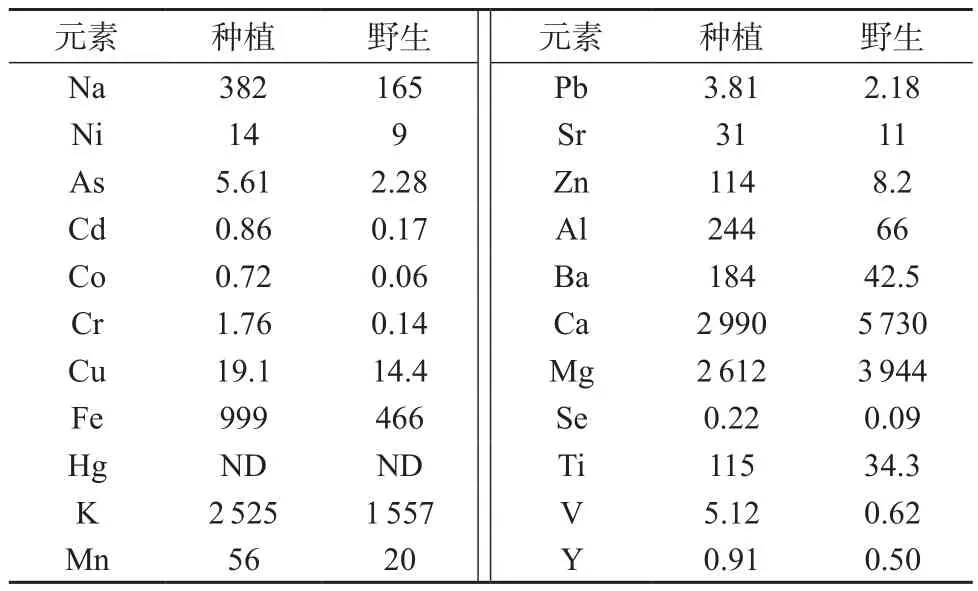
表5 艾纳香中微量元素的含量 µg/g
由表5可知,艾纳香中微量元素含量丰富[13],22种元素中含量较高的依次是Ca,Mg,K,Fe,Na,其它重金属含量很低;艾纳香中还含有一定的稀土元素。对野生艾纳香和人工种植艾纳香中22种元素进行对比分析发现,野生艾纳香与人工种植艾纳香相比,Ca,Mg元素的含量有明显差异。野生艾纳香中Ca,Mg元素的含量远远高于人工种植艾纳香,说明野生环境生长条件有利于艾纳香对Ca,Mg元素的吸收。因此在进行人工种植时,应模拟艾纳香的野生环境条件,提高人工种植产品的质量。
野生艾纳香与人工种植艾纳香微量元素含量对照,见图2。

图2 野生艾纳香与人工种植艾纳香中元素含量折线图
由图2可以看出,野生艾纳香与人工种植艾纳香存在微量元素上的明显差异。野生艾纳香中微量元素锰、锌、锶、铝、钛等元素的含量高于人工种植艾纳香,说明野生环境生长条件利于多种微量元素的吸收。野生环境生长的艾纳香,微量元素的吸收远高于人工种植环境,所以在进行人工种植时,水、土壤、养分等人工种植的微量元素环境很重要。
2.6 精密度与回收试验
取样品5份,按1.2方法进行样品处理后,分别进行测定,进行精密度试验;另取样品加入各种元素的标准溶液,分别测定并计算回收率,精密度及回收率见表6。

表6 精密度与回收试验结果(n=5)
由表6可知,测定结果的相对标准偏差在0.8%~3.6%之间,加标回收率在95.55%~102.4%之间,可见所建方法精密度、准确度较高,可用于分析药用植物样品中的微量元素。
3 结论
(1)建立的微波消解–ICP–AES法测定药用植物中22种微量元素的方法,能够一次进样,同时分析22种微量元素,样品测试背景干扰较少,各元素分析线性范围宽,检测结果的精密度和准确度良好。
(2)该方法测定结果与原子吸收光谱法(AAS)测定的部分相同元素的测定结果[14]相一致,证明本法结果准确、可靠。
(3)采用所建方法对人工培植与天然生长的药用植物艾纳香及厚朴皮和根中微量元素含量的差异进行进行分析,为药用植物的元素指纹图谱建立、物质特征的挖掘、药性剖析及产地判断提供依据。
[1] 陈德昌,现代实用本草(上)[M].北京:人民卫生出版社,1997: 754–761.
[2] 国家药典委员会.中华人民共和国药典(第一部)[M].北京:中国医药科技出版社,2015.
[3] 颜立红,祁承经,刘小雄.华中地区藤本种子植物区系的研究[J].植物研究,2006,26(4): 1–6.
[4] Xiong W,Li X,Hu J,et al. Study on Synchronous Extraction and Isolation of Bioactive Compounds from Ampelopsis Grossedentata[J]. Food Research and Development,2011,32(10): 183–186.
[5] 张玉武,杨红萍.贵州梵.净山国家级自然保护区藤本植物的研究[J].武汉植物学研究,2001,19(4): 269–298.
[6] 周克瑜,许长照.必需微量元素与营养[J].华西医科大学学报,2001,2(1): 20–22.
[7] 秦俊法,陈磐华.中国的植物药微量元素研究·微量元素:一切植物药的基本成分[J].广东微量元素科学,2010(11): 1–18.
[8] 崔莎莎,唐晓萍,王强,等. ICP–OES法测定绿茶中7种重金属元素的溶出量[J].化学分析计量,2015,24(5): 48–51.
[9] 黄晶.智能石墨消解ICP–MS法测定空气PM2.5中的Pb和Cd[J].化学分析计量,2016,25(1): 41–43.
[10] Gao Q H,Wu C S,Wang M. The jujube(Ziziphus Jujuba Mill.) fruit: A review of current knowledge of fruit composition and health benefts[J]. Journal of Agricultural and Food Chemistry,2013,61: 3 351–3 363.
[11] 张孝芳,张卓勇,范国强.现代分析技术在药物分析和质量控制中的应用[J].中国卫生工程学,2005,4(3): 581–585.
[12] GB 2672–2012 食品安全国家标准食品中污染物限量[S].
[13] JECFA. Summary report of the seventy-second meeting of the Joint FAO/WHO Expert Committee on Food Additives (summary and conclusions)[R]. Rome: 2010.
[14] 范宝磊,张健,索有瑞.微波消解原子吸收和原子荧光法测定藤茶中的微量元素[J].分析科学学报,2010,26(5): 611–613.
DXRF获批用于土壤和固体废物元素分析新方法ASTM D8064–16
不久前最新发布的ASTM D8064–16标准测试法已被批准使用能量色散X射线荧光(简称EDXRF)光谱测定法,来进行土壤和固体废物中重金属元素的量化分析。该测定法使用了多个单色光束,又称为高精度X射线荧光(HDXRF)。
ASTM D8064适用于各种土壤基质对于铬、镍、砷、镉、汞和铅的测定。由于这些元素被广泛应用于众多工业流程,并且残留在很多废弃的工厂里,因此推动了准确、快速、简易现场测试方法的需求,这个方法就是HDXRF。
XOS先进技术发展总监陈泽武博士表示,该标准测试法已被成功用于土壤和固体废物中的重金属的测定。XOS公司研发的HD Rocksand®采用了HDXRF技术,是一款用于现场分析土壤和水中超低含量重金属的便携式分析仪。HD Rocksand能做的远不止简单的筛查,也提供了符合EPA 6200和ASTM D8064标准的量化检测解决方案。
(李)
Determination of 22 Elements in Medicinal Plants By ICP–AES
Zhang Jian1, Fan Baolei2
(1. 103 Geological Party, Guizhou Bureau of Geology and Mineral Resources, Tongren 554300, China 2. Hubei University of Science and Technology,Xianning 437100, China)
A method for the determination of 22 elements content in medicinal plants of Fanjing Moutain in Guizhou province by inductively coupled plasma atomic emission spectrometer(ICP–AES) was developed. The samples were pretreated by using vacuum microwave digestion in HNO3–H2O2(3∶1) solution system,then 22 elements content in skin and root of magnolia,and the wild and artifcial Blumea balsamifera were analyzed. The ICP–AES instrument conditions were as follows: RF power was 1.25 kW,the gas fow rate of plasma gas was 15.1 L/min,auxiliary air fow rate was 1.0 L/min,and atomizing gas fow rate was 0.6 L/min. The good linearity was obtained for 22 elements in detection range with linear correlation coefficients of 0.986 7–0.999 6. The detection limits were 0.001 2–0.012 3 µg/g. The additon recoveries ranged from 95.55% to 102.4%,and the relative standard deviations were 0.8%–3.6%(n=5). The method is rapid and accurate,which can be used to analyze trace elements in medicinal plants.
medicinal plant; trace element; magnolia; blumea
O657.3
:A
:1008–6145(2017)01–0008–04
10.3969/j.issn.1008–6145.2017.01.002
*国家自然科学基金项目(D20142806);湖北省心脑血管与糖尿病重点实验室专项(2015CFC777)
联系人:范宝磊;E-mail: fanb1_1211@sina.com
2016–10–12

