食道支架的可疑不良事件分析
【作 者】李尧,王新敏,卞蓉蓉,孙骏,赵敏
江苏省药品不良反应监测中心,南京市,210002
食道支架的可疑不良事件分析
【作 者】李尧,王新敏,卞蓉蓉,孙骏,赵敏
江苏省药品不良反应监测中心,南京市,210002
目的 分析总结食道支架的可疑医疗器械不良事件发生情况及问题,为进一步提高食道支架的使用安全提出建议。方法 对2012年-2015年美国食品药品监督管理局 MAUDE数据库中153例食道支架有关伤害病例报告和1994年-2015年96篇涉及食道支架不良事件的国内文献进行统计分析。结果 食道支架有关的伤害事件主要表现为消化道出血、断裂、胸痛、食管瘘等,构成比排名前三的是胸痛及异物感、胃食道反流和出血。结论 监管部门和有关单位应加强风险责任意识,建立健全监测相关的工作制度,保障公众使用食道支架的安全。
食道支架;医疗器械不良事件监测;风险因素;文献分析
0 引言
食道支架是指通过手术操作,经输送器置入人体食道,起扩张并长期支撑食道作用的由金属丝编织而成的管状结构。食道支架系统由食道支架和置入器两个部分组成。食道支架通常是自扩张式支架,材质是镍钛记忆合金或不锈钢丝等,可覆有硅胶膜;功能是支撑因病变而狭窄的食道,保证腔道畅通。置入器用于传送和释放支架,所用材料为医用高分子,如聚氨酯和聚醚。
1 不同材料食道支架的差异
食道支架按照支架金属材质分为不锈钢丝食道支架和镍钛记忆合金食道支架(见图1)。不锈钢丝食道支架以医用不锈钢丝制成的“Z”型骨架通过呈节段性的分段连接结构连接而成,内外均覆高强度的医用硅橡胶膜。镍钛记忆合金支架由镍钛记忆合金编织而成的自膨式网状支架,由于镍钛合金具有稳定的形态记忆效应,因此又称记忆合金支架。镍钛合金食道支架与不锈钢丝食道支架在材质、生产工艺以及产品特性上有较大区别,汇总情况见表1。

图1 不锈钢丝覆膜支架(左)和镍钛记忆合金支架(右)Fig.1 Stainless steel covered stent(left) and nickel-titanium shapememory alloy stent(right)
2 资料与方法
2.1 资料来源
检索美国食品药品监督管理局 MAUDE数据库,在2012年至2015年期间食道支架有关伤害病例报告共有153例。检索中国知网数据库(CNKI)1994年至2015年发表文献,涉及食道支架不良事件文献共有96篇。

表1 镍钛合金食道支架与不锈钢丝食道支架的差异Tab.1 The difference of stainless steel covered stent and nickeltitanium shape-memory alloy stent
2.2 方法
笔者汇总上述资料,运用Microsoft Excel软件,从不良事件发生例数、不良事件临床表现及发生原因等方面进行系统分析。
3 结果
3.1 MAUDE数据库分析结果
MAUDE数据库中,与食道支架有关的伤害事件共153例,其中死亡病例报告43例,导致显著伤害的病例报告110例,死亡病例主要表现为消化道大出血、支架扩张问题、支架移位、断裂和支架周围组织增生糜烂等,导致显著伤害的不良事件情况有支架移位、脱落、出血、支架内部损坏或侵蚀、术后吞咽困难、异物感、支架阻塞、食道划伤或粘膜损伤、胸痛、食管撕裂溃疡、食管瘘等[2]。具体数据统计与事件表现见表2。
3.2 文献情况分析
对有关文献进行综合分析,统计筛选出与植入食道支架不良事件相关的481例报告[3-14]。具体数据统计与原因分析见表3。
4 食道支架风险因素分析
食道支架可疑不良事件原因复杂,可分为固有风险和使用风险。
4.1 食道支架常见固有风险点
医疗器械固有风险包括生产工艺、设计缺陷、材料选择及运输与储存环境等。食道支架固有风险包括:①原材料中杂质超标、丝材不均匀或断裂等,可能导致消化道出血;②覆膜支架硅胶膜粘连,支架无法正常扩张;③覆膜镍钛合金支架的硅胶膜硫化不完全,导致膜强度不够,易破,达不到堵瘘的治疗目的;④定型或热处理时间不充分,支架支撑力受影响;⑤生产环境微生物控制不合格。4.2 食道支架常见使用风险点
医疗器械不良事件的发生也与操作不当、患者自身体质等因素有关。食道支架的使用风险点包括:①未按说明书选择合适规格的支架;②操作过程中引入的微生物污染;③超适应症使用;④术后护理不当,如过早进食冰冷食物导致支架收缩或进食大块、粗纤维、硬质、粘性的食物,引起支架滑脱或移位;⑤对镍钛过敏的患者对镍钛记忆合金支架的置入可能产生过敏反应;⑥瘢痕性体质的患者置入支架后,可能在支架两端产生严重的内膜增生,从而再次发生狭窄。
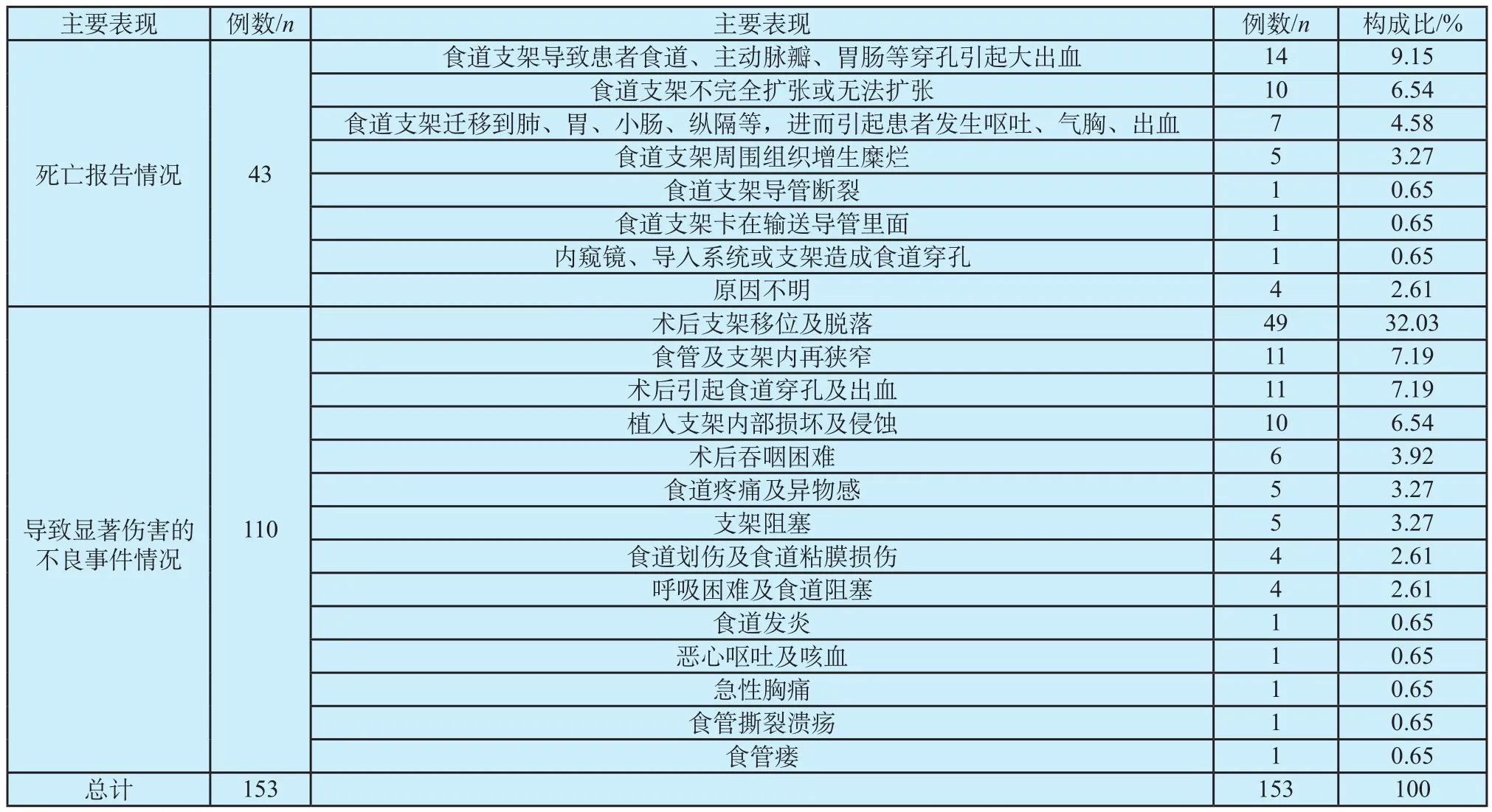
表2 MAUDE数据库中食道支架不良事件主要表现Tab.2 The main performance of adverse events caused by Esophageal stent in MAUDE database
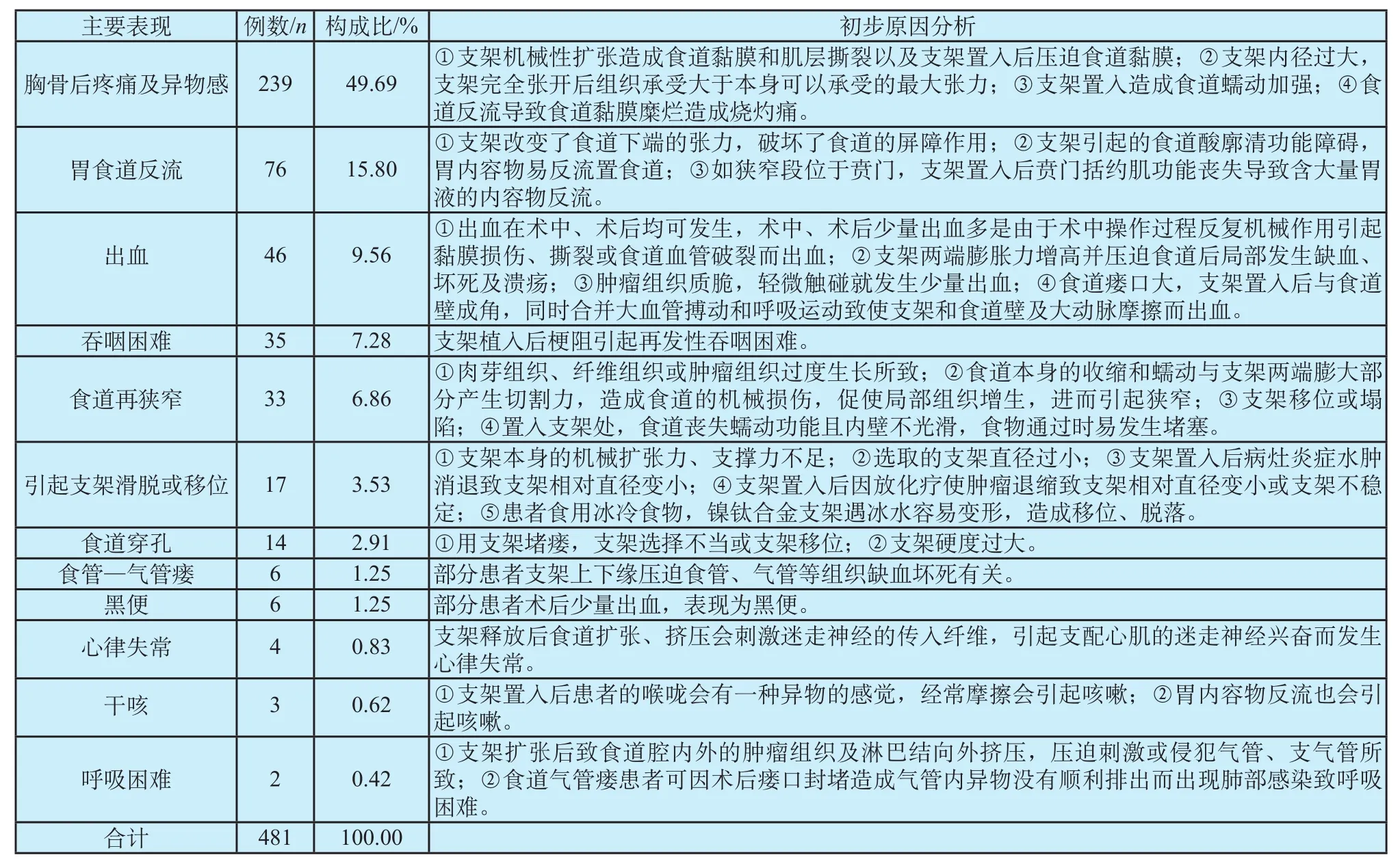
表3 文献报道中食道支架不良事件主要表现和初步原因分析Tab.3 The main performance and preliminary analysis of adverse events caused by Esophageal stent in literature
5 对策与建议
根据上述风险评价结果,结合监测数据,为了进一步降低风险,减少不良事件的重复发生,对食道支架的风险需要采取的控制措施提出如下建议。
5.1 对监管部门的建议
建议监管部门应进一步强化追溯机制,推行食道支架登记制度,建立完整的信息数据库,为问题产品的发现与召回扫清障碍;提高不良事件报告质量,完善患者、支架的基本信息和不良事件原因分析,有利于分析再评价食道支架的安全性;建立健全预警系统,搜集国内外的食道支架不良事件信息,及时发布预警信息,督促相关企业采取修改说明书、召回等相应的控制措施降低产品风险。
5.2 对生产和经营企业的建议
建议食道支架生产企业关注产品原材料与设计的改进与完善,如尽可能选择选用性能优异的原材料丝、硅胶膜材料,通过设计验证优化覆膜工艺参数、硫化参数,不断完善产品说明书、标签、警示语等;严格按作业指导书,在整个生产过程中特别灭菌环节,确保整个生产过程符合要求并可控;制定完善的不良事件收集和事件处理制度,及时采取风险管理措施,改进产品。
5.3 对使用单位的建议
建议食道支架使用单位加强培训与管理,医务人员应掌握规范的手术要求与操作技术,正确选择食道支架的使用范围,按照说明书要求制定科学合理的治疗方案;加强术前、术后的康复指导,合理护理;加强食道支架的管理,应严格执行医疗器械质量验收记录,建立符合进货资质控制、验收控制、储存控制、使用控制、术后随访等要求的文件制度;积极填报不良事件监测报告,发现突发、群发的问题应立即上报,以便及时发现用械风险。
6 结语
由于食道支架适用人群多为肿瘤晚期病人,尽管食道支架的置入属于姑息治疗,无法从根本上治疗疾病,但它能解决患者进食困难和缓解痛苦,提高生活质量,这就要求产品本身不良事件发生率降到最低。建议各级食品药品监督部门、卫生行政管理部门、监测技术机构、基层报告单位共同努力,加强对食道支架不良事件监测,督促生产企业开展再评价,探索持续改善产品,保障食道支架的安全有效。
[1] FDA. MDR Database Search[DB/OL].2016-01-01. http://www. accessdata.fda.gov/scripts/cdrh/cfdocs/cfMDR/Search.cfm.
[2] 谭必勇, 宋红, 姚勇. 食道支架置入术治疗食道狭窄及并发症防治[J]. 实用中西医结合临床, 2006 , 6 (1): 41-42.
[3] 李琦, 周广美, 房立丽. 22例高龄食道癌患者食道支架置人术的护理[J]. 中国伤残医学, 2012, 20(12): 160.
[4] 钟立明, 魏欣, 胡鸿. 食道癌支架治疗术的非手术操作风险139例分析[J]. 西部医学, 2011, 23 (4) : 629-631.
[5] 黄明, 杨银山, 周劲梅. 贲门失弛缓症可回收支架治疗的疗效评价[J]. 现代生物医学进展, 2013, 13 (14): 2739-2741.
[6] 罗知平. 内镜下射频治疗食道支架置入术后再狭窄[J].西部医学, 2007, 19(5): 841-842.
[7] 李春荣. 食道癌支架植入术的护理体会[J].中国实用医药, 2012, 7(2): 224-225.
[8] 谢蓉, 张洋, 谢明锦. 胃镜监视下食道支架置入术并发症98例临床研究[J]. 医学信息, 2010, 23( 8): 2846-2847.
[9] 邵建平. 食道支架置入术并发症的原因分析及护理[J]. 现代实用医学, 2009, 21(12): 1363-1364.
[10]杜仕建, 戴学兵. 食道支架置入术术后并发症的临床分析及对策[J]. 求医问药, 2011, 9(8): 45.
[11] 高革, 曹建彪, 李恕军. 食道支架置入术治疗贲门失弛缓症防止移位和脱落的研究[J]. 河北医药, 2009, 31(20): 2767-2768.
[12] 游善喜, 王继东, 邹海军. 食管支架置入术并发症58例[J].临床研究现代医学, 2007, 35(4): 293-295.
[13] 向述天, 李占峰, 刀永功. 可回收自膨防返流覆膜食道支架治疗食道贲门失弛缓症[J]. 医学信息手术学分册, 2007, 20(6): 499-501.
Medical Device Adverse Events Primary Analysis on Esophageal Stents
【Writers】LI Yao, WANG Xinmin, BIAN Rongrong, SUN Jun, ZHAO Min Center for ADR Monitoring of Jiangsu Province, Nanjing, 210002
ObjectiveTo probe into the characteristics and influencing factors of ADR cases induced by Esophageal stents, so as to provide effective resolutions for safety use.MethodsBy retrieving published MDR cases induced by Esophageal stents in FDA MAUDE database and CNKI database, 153 cases of adverse events in MAUDE database from 2012 to 2015 and 96 valid documents between 1994 and 2015 were obtained, screened and analyzed retrospectively.ResultsThe main MDR performance were gastrointestinal bleeding, chest pain, foreign body sensation, etc, due to the risk inherent in the product or risk during use.ConclusionThe public safety of Esophageal stents use can be ensued according to perfecting related laws, establishing and regulating the MDR monitor system and strengthening the responsibility of authority, manufacturers, suppliers and medical institutions.
esophageal stents, medical device adverse events monitoring, risk factor, analysis
R571
A
1671-7104(2017)01-0048-03
10.3969/j.issn.1671-7104.2017.01.013
2016-05-17
李尧,E-mail: 474006289@qq.com

