基于荧光断层成像-CT双模态光源可行区选取方法
【作 者】阚星星,陈春晓,王章立
南京航空航天大学生物医学工程系,南京市,211100
基于荧光断层成像-CT双模态光源可行区选取方法
【作 者】阚星星,陈春晓,王章立
南京航空航天大学生物医学工程系,南京市,211100
在荧光断层成像(FMT)中,借助CT数据可以实现小动物体内荧光光源的重建及融合显示。该文提出了一种基于荧光断层成像CT双模态图像光源可行区的选取方法,利用多角度荧光图像估计荧光光源的位置和深度信息,然后根据双模态图像的坐标转换关系,在CT数据中设置可行区。实验结果表明,使用该方法选取光源可行区,能够有效降低逆向重建小动物体内光源的病态性,提高光源的重建精度。
荧光断层成像;可行区;双模态成像
0 引言
荧光断层成像(Fluorescence Molecular Tomography, FMT)是基于分子和基因水平的一种新的三维成像技术,可以在体、无创地观测细胞的特异性变化。FMT技术利用外植入的特异性光学分子探针与生物体内的靶分子或靶细胞结合,经激发光激发后,会形成能反映体内靶细胞结构的光源。通过高性能检测设备采集该光源经散射、透射后到达生物体表面的荧光图像,并利用重建算法便可获得荧光基团在生物体内的三维分布[1-3]。
在FMT系统中,利用高性能CCD相机获得的生物体体表的荧光分布逆向求解体内光源,是一个严重的病态问题。Cong[4]研究表明通过设定光源可行区,可降低光源重建的病态性,可行区设置越接近真实光源,重建光源的位置和能量越精确。如果结合后验信息采用多级自适应有限元方法对可行区内网格进行重新划分,可以进一步提高重建光源的精度[5]。张倩[6]根据生物体体表的荧光分布信息,设计了一种可行区自动选取方法,经过多次迭代来确定可行区的中心点。但以上方法都需要进行可行区初始化设定,存在很大的主观性。本文设计了一种基于荧光断层成像—CT双模态光源可行区选取方法,通过在二维荧光图像中估计光源的深度及位置,并将该深度和位置信息融合到CT体数据中以进一步优化可行区的设置。该方法能有效提高生物体体内荧光光源的重建精度。
1 双模态光源可行区选取方法
1.1 基于荧光图像的光源深度和位置估计方法
光源可行区的选取会限定求解生物体内光源的分布区域,因此,如果能通过体表信息正确估计体内光源的深度和位置信息,可以优化可行区的设置。陈延平[7]根据生物组织内光传播的扩散模型和外推边界条件,利用生物体边界上两个不同位置的光强比Rf,最小化模型值与测量值之差来估计体内光源的深度。但该方法只利用了单幅荧光图像信息,适用于类似球体且体积较小的光源。当体内光源较大时,估计的深度和位置信息误差较大。本文提出了利用小动物多个角度的体表荧光图像来估计体内光源深度和位置,算法流程如图1所示。
估计光源深度的主要步骤为:
(1)结合面积直方图[8]与连通域计算方法对体表二维荧光图像进行分割,确定感兴趣区域和质心。如图2所示,白色虚线包围区域为光源感兴趣区域,S为该区域的质心。
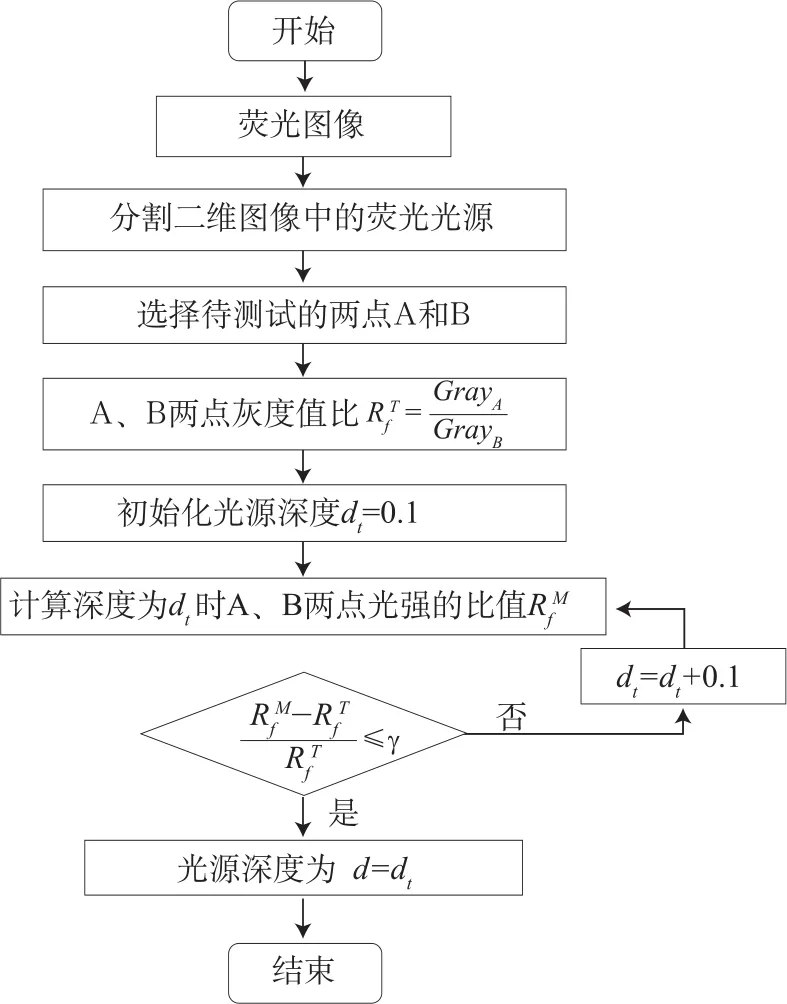
图1 光源深度估计流程图Fig.1 The flow chart of light source estimation
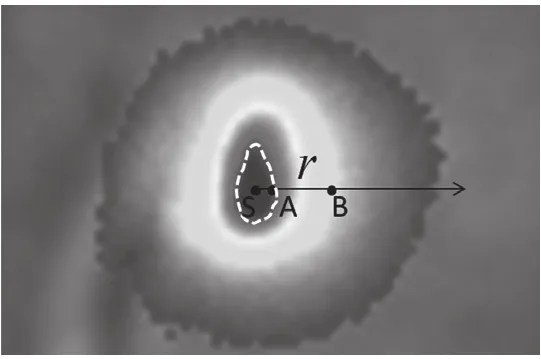
图2 测试点A、B的选择方法Fig.2 The figure of selecting A and B
(2)在光源感兴趣区边缘选择点A,在其光强扩散方向距离为r的地方选择点B,则A、B两点灰度值比:

(3)当光源深度为d时,在Robin边界条件[9]下,A、B两点的光强值比为:

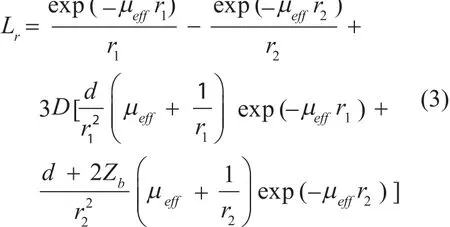
Lr的计算方式如下:其中,Zb为边界值,为扩散 ,D系数,Reff为有效反射系数。 μeff=[3μa(μa+μs' )]1/2, μa为吸收系数,为约化散射系数。位置A处,r1=d,r2=d+2Zb;位置B处,r1=(d2+r2)1/2,r2=[(d+2Zb)2+r2]1/2。
(4)为简化估计光源深度的过程,本文将生物体组织作为匀质,这样光强值比仅与光源深度d和两个位置之间的距离r有关 。当的值小于设定的阈值γ时,d为该角度下光源的深度。
为提高荧光光源位置和深度定位的准确性,本文从采集的八个角度全表面二维荧光图像中自动选取三个光斑面积最大的图像进行处理,分别得到三个角度下光源深度的估计值及坐标信息。
1.2 基于CT结构数据的光源可行区设置方法
结合二维荧光图像预估的光源深度信息和CT结构数据设置光源可行区,可以有效避免通过主观方法设置可行区带来的随机性问题。为了将多角度二维荧光图像预估的光源位置和深度信息分别融合到CT结构数据,利用其质心设置光源可行区范围,需要建立FMT系统的成像坐标系和CT数据坐标系。
Chen等研究表明,FMT系统中光在透镜系统中的传播模型可采用小孔成像模型[10-11]。本文依据小孔成像模型建立了FMT系统的成像坐标系oxyz,如图3所示。成像系统坐标系的建立规则如下,探测平面的右下角设为坐标原点,并以该面为oxz平面,小孔平面与该面平行。光轴垂直于oxz平面并指向小孔,y轴平行于光轴,v为物距,u为像距。图3中坐标系ox'y'z'是CT数据坐标系。
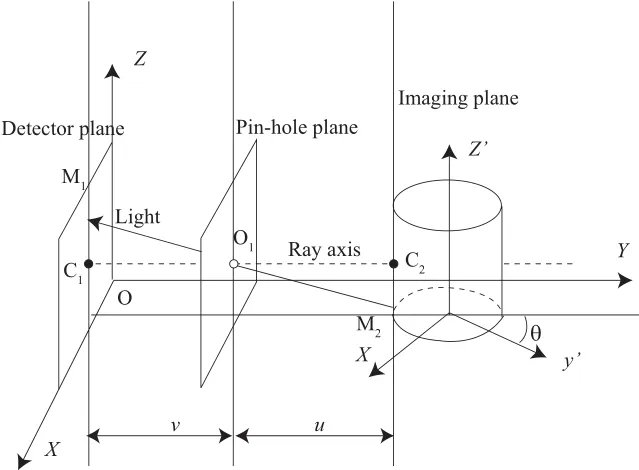
图3 FMT系统成像坐标系Fig.3 FMT imaging system coordinate
为了将CT数据坐标系转换至FMT成像坐标系中,需要对其进行旋转和平移操作。在采集CT数据时,利用小动物固定支架,确保轴z'与z轴平行,这样只存在围绕z'旋转的θ角,可以简化旋转变换。 为了确定平移量,在小鼠支架上做了两个标记点。下面阐述两种模态图像匹配标记点的设置方法及空间投影坐标关系的计算方法。
在yoz平面确定CT坐标在y轴方向和z轴方向的平移量,如图4所示。已知探测平面中心点坐标C1(0, cz);两个标记点在探测平面的坐标分别为L1(0, z1)和标记点在CT坐标系中的坐标分别为
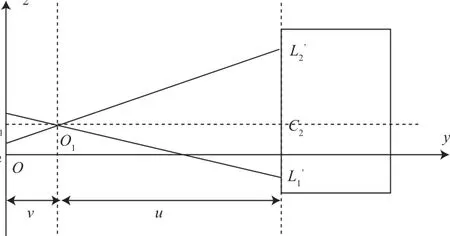
图4 成像系统坐标系yoz平面Fig.4 yoz plane of imaging system
根据小孔成像规则,成像比:
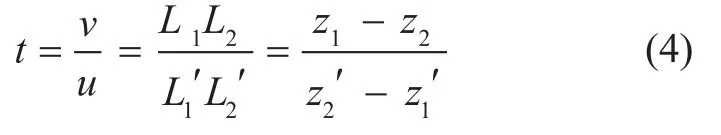
物距u可在FMT成像系统中测量得到,根据式(4)可以求出像距v。因此,y轴方向和z轴方向的平移量为:
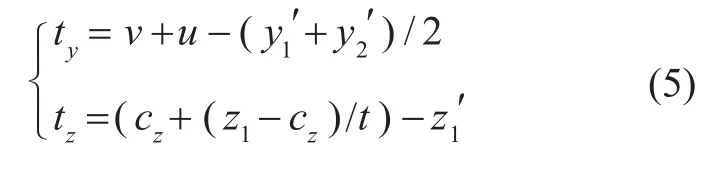
x轴方向的平移量在xoy平面确定,根据标记点L2所在断层图像x轴方向中心点M'和投影的中心点M计算,如图5所示。
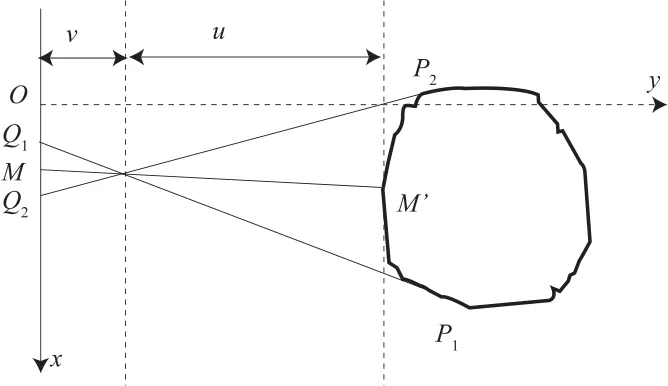
图5 成像系统坐标系xoy平面Fig.5 xoy plane of imaging system
则x轴方向的平移量为:
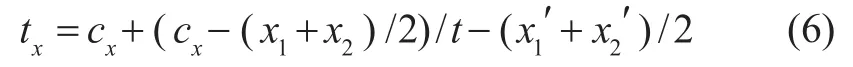
综上,CT坐标系到成像坐标系的转换矩阵为:

假设二维荧光图像中计算的光源在FMT成像系统探测平面的坐标为S(sx, 0, sz),深度为ds。根据光路可逆原理,计算光源中心点在成像系统坐标系中的坐标St(sxt, syt, szt)
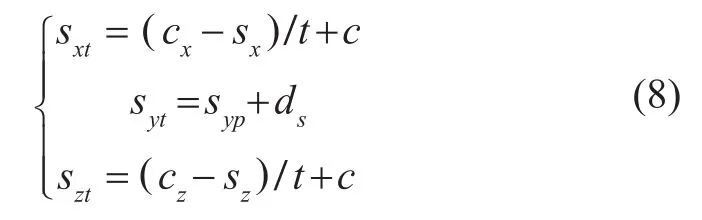
其中,syp为直线
与成像物体交点的y坐标。最终,光源中心点在CT体数据中的坐标为:

通过以上步骤,将多角度荧光图像中三个光斑面积最大的荧光图像估计的光源位置和深度信息融合到CT体数据,求其质心,并作为光源可行区设置的中心点。再根据分割二维荧光图像中斑块的形状,设置三维光源可行区形状,如球形、圆柱体等,并在CT数据中进行标记。本文采用约束Delaunay体网格生成算法对小动物体数据进行网格剖分,并对可行区内的网格进行细化。
最后,根据能量映射关系和空间坐标对应关系,将二维荧光图像映射到三维物体表面,使用基于模型降阶和Tikhonov正则化方法重建小动物体内光源的大小和位置[12-13]。
2 实验与结果
2.1 FMT成像系统
为了验证本文提出的光源可行区设置方法的有效性,本文利用课题组搭建的FMT成像系统,采集小鼠全表面荧光图像,如图6所示。FMT成像系统主要包括实验暗箱、小鼠支架、滤光片、氙灯、Princeton的PIXIS 1024B型背照式制冷CCD、Tamron的M118FM25微距定焦镜头等。通过控制电机旋转小鼠支架,CCD相机可采集小动物8个角度(每隔45o)的荧光图像和相同几何位置条件下的白光图像。实验过程中,采用特制的小鼠支架固定小鼠,保证小鼠的头部、肢体和尾部实现同轴旋转。
2.2 实验设计
本文设计了内部植入光源的小鼠实验对提出的可行区设置方法的有效性进行了验证。内置光源使用ICG(激发光720 nm,发射光830 nm),滤光片中心波长为720 nm和832 nm(semrock BrightLine系列),带宽25 nm。将体重为20 g的小鼠麻醉后,腹部脱毛,然后把15.71 mL的ICG溶液密封在内径2 mm高5 mm的透明塑料管内,埋入小鼠腹部,缝合伤口。将小鼠放置到小鼠支架中,固定好。在小鼠支架上制作标记点,实现荧光图像和CT数据的配准。将小鼠支架放入FMT成像系统中,采集小鼠8个角度的荧光图像;将小鼠支架放入CT设备中,采集小鼠的CT体数据。
2.3 实验结果
采用本文提出的方法设置光源可行区,双模态数据的处理流程如图7所示。CT数据中,真实光源中心点的坐标为(533, 552, 143)。基于荧光断层成像—CT图像确定双模态坐标关系,根据多角度荧光图像预估的光源位置及深度,定位到CT体数据中的坐标为(547, 563, 141),设置光源可行性区并进行标记,对标记过的CT数据进行有限元离散、网格剖分等处理,生成的网格信息如表1所示。
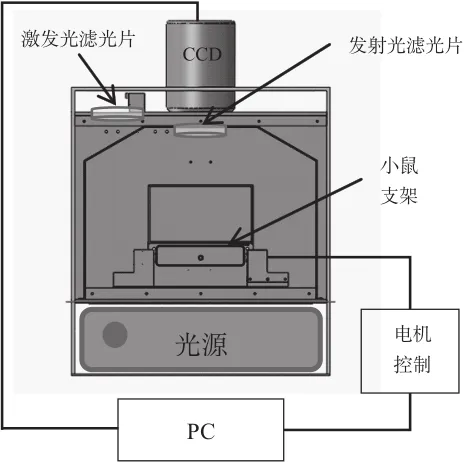
图6 FMT系统示意图Fig.6 FMT system diagram
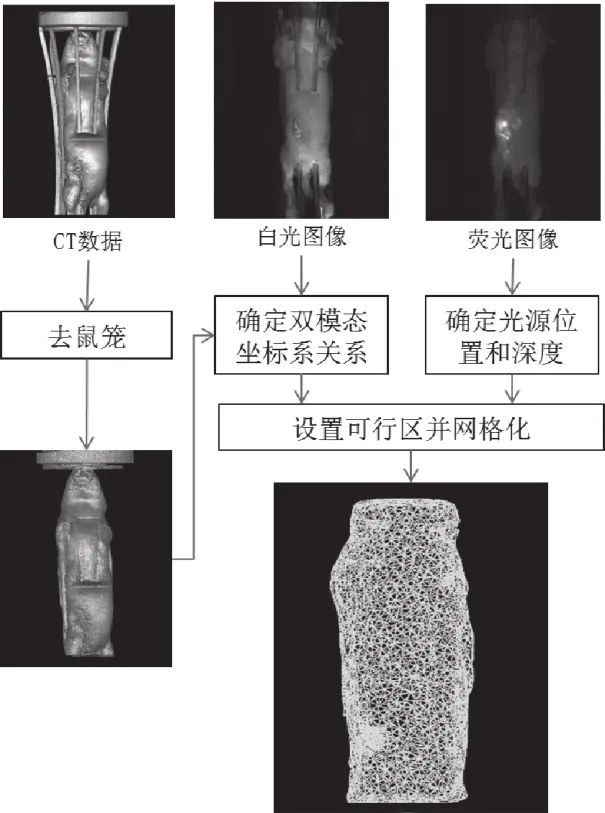
图7 双模态数据处理流程Fig.7 Dual-modality data processing flow
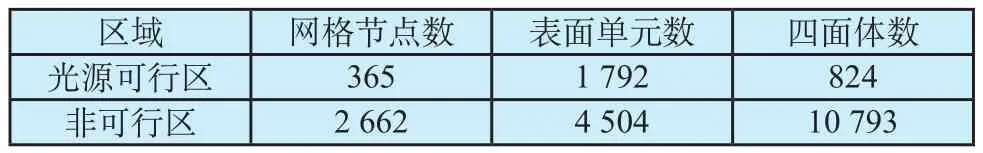
表1 网格信息Tab.1 Mesh Information
根据能量映射关系和空间坐标对应关系,将二维荧光图像映射到三维网格表面,使用有限元方法逆向重建出生物体内荧光光源的位置和大小。重建荧光光源的节点数为47,四面体数为182。图8为重建光源与CT数据的融合效果,其中不规则实体为重建光源。
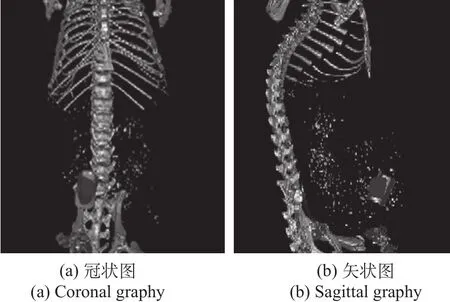
图8 CT中重建光源与真实光源位置图Fig.8 The position of reconstructed and true source in CT
为进一步验证本文提出的双模态可行性区域选取方法的可行性,本文对采用不同方法设置可行区重建体内光源的位置和体积进行比较,如表2所示。方法1为仅利用荧光图像信息根据经验设置可行区,方法2为采用本文提出的方法设置可行区。
从表2可以看出,采用本文提出的光源可行区设置方法,逆向重建后光源的中心点与体积误差都小于仅利用荧光图像信息设置可行区方法重建的结果。
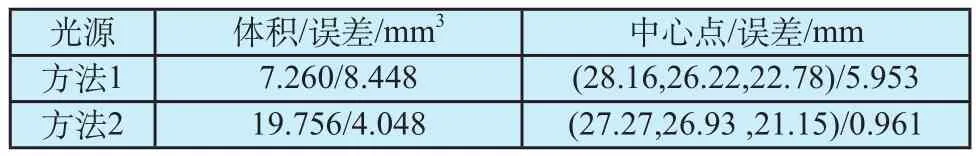
表2 不同可行区设置方法对重建结果的影响Tab.2 The influence of different feasible region setting method on the reconstruction results
3 结论
本文提出了一种基于荧光断层成像—CT双模态图像光源可行区的选取方法。结合多角度荧光图像和CT数据,实现体内荧光光源深度信息的估计,以优化可行性区的设置,并通过在CT数据中标记光源可行区,依据CT轮廓信息实施体网格划分,及对可行区内的网格进行细化等,可以有效降低FMT三维逆向重建的病态性,提高体内光源的重建准确度。
[1] 周源, 刘飞, 阮秋琦, 等. 基于荧光分子断层成像的多模成像系统研究进展[J]. 国际生物医学工程杂志, 2014, 37(1): 43-48.
[2] 陈延平, 白净. 荧光分子断层成像系统的研究进展与比较[J]. 中国生物医学工程学报, 2009, 28(3): 463-468.
[3] Ntziachristos V. Fluorescence molecular imaging[J]. Ann Review Biomed Eng, 2006, 8(1): 1-33.
[4] Cong W, Wang G, Kumar D, et al. Practical reconstruction method for bioluminescence tomography[J]. Opt Express, 2005, 13(18): 6756-6771.
[5] Lv Y, Tian J, Cong W, et al. A multilevel adaptive finite element algorithm for bioluminescence tomography[J]. Opt Express, 2006, 14(18): 8211-8223.
[6] 张倩, 陈春晓, 刘高, 等. 光源最优可行区自动选取算法在生物发光断层成像中的应用[J]. 中国医疗器械杂志, 2014, 38 (6): 393-397.
[7] 陈延平, 白净. 快速估计荧光分子断层成像中单个荧光物的深度[J]. 光谱学与光谱分析, 2010, 30(6):1516-1519.
[8] 王志刚,王伟,许晓鸣. 一种新的图像分析方法—面积直方图[J]. 计算机工程与应用, 2002, 38(12): 48-50.
[9] 孙粒. 基于多种先验知识的生物发光断层成像重建方法研究[D]. 北京: 北京工业大学, 2010.
[10] Chen X L, Gao X B, Qu X C, et al. A study of photon propagation in free-space based on hybrid radiosity-radiance theorem[J]. Opt Express, 2009, 17(18):16266-16280.
[11] Chen X L, Gao X B, Chen D F, et al. 3D reconstruction of light flux distribution on arbitrary surfaces from 2D multi-photographic images[J]. Opt Express, 2010, 18(19): 19876-19893.
[12] 杨伟. 活体小动物体内三维生物发光断层成像的研究[D]. 南京:南京航空航天大学, 2012.
[13] 张倩. 三维生物发光断层成像系统搭建与算法研究[D]. 南京: 南京航空航天大学, 2014.
Method of Permissible Source Region Selection Based on FMT lmage and CT Data
【Writers】KAN Xingxing, CHEN Chunxiao, WANG Zhangli
Department of Biomedical Engineering, Nanjing University of Aeronautics and Astronautics, Nanjing, 211100
In Fluorescence Molecular Tomography (FMT), the reconstruction and fusion display of inner light source can be realized with the aid of CT data. A method is proposed in this paper to select permissible source region based on FMT image and CT data. The position and depth of light source can be estimated in FMT image. According to the coordinate relation of the two mode image, the light source position can be marked in CT data and mesh was produced on the marked CT data. Experimental results show that, the method can reduce the ill-posedness of the inverse problem and improve the accuracy of reconstruction of inner light source.
Fluorescence Molecular Tomography, source region, dual-modality imaging
TP391.41
A
1671-7104(2017)01-0009-04
10.3969/j.issn.1671-7104.2017.01.003
2016-04-14
江苏省普通高校研究生实践创新计划项目(SJLX15_0115)
陈春晓,教授,博士生导师,E-mail: ccxbme@nuaa.edu.cn

