NLRP3炎症小体与心房颤动的相关性研究
许键,何燕,罗蓓蓓,向春林,黄艳群,舒成霖,王蓉
NLRP3炎症小体与心房颤动的相关性研究
许键,何燕,罗蓓蓓,向春林,黄艳群,舒成霖,王蓉
目的:通过检测心房颤动(房颤)患者外周血NLRP3的表达水平,探讨 NLRP3炎症小体与房颤的相关性。
心房颤动;炎症介导素类
Method: A total of 60 AF patients were enrolled and divided into 2 groups: Paroxysmal AF (PAF) group and Non-paroxysmal atrial fibrillation (nPAF) group, n=30 in each group; in addition, there was a Control group including 26 healthy subjects from physical examination. NLRP3 expression in peripheral blood mononuclear cells (PBMCs) was measured by flow cytometry; blood levels of IL-1β, IL-6, CRP and NT-proBNP were detected by ELISA. The correlations among different factors were studied by liner regression analysis and the differences were compared among groups.
Result:①Compared with Control group, PAF and nPAF groups had increased PBMCs level of NLRP3 and blood levels of IL-1β, IL-6, CRP, NT-proBNP, P<0.05, while NLRP3 level was similar between PAF group and nPAF group, P>0.05.②PAF and nPAF groups showed elevated blood level of NT-proBNP than Control group, P<0.05. ③PBMCs level of NLRP3 was positively related to left atrial diameter (r=0.579, P<0.05) and negatively related to left ventricular ejection fraction (r=-0.490, P<0.05) in both AF groups.
Conclusion:①NLRP3 inflammasome was closely related to AF, which may provide a therapeutic target for AF treatment.②AF was closely related to inflammatory response.③Downstream product of NLRP3 may cause the inflammatory response which could induce the occurrence, development and maintenance of AF in relevant patients.
Key wordsAtrial fibrillation; Inflammatory mediators
(Chinese Circulation Journal, 2017,32:72.)
心房颤动(房颤)是临床最常见的心律失常之一,目前全球房颤人数估计为3 350万人,预计2060年房颤患病人数将再增加2倍[1],其主要危害是脑卒中和外周血管栓塞等并发症,已成为心血管疾病发病和死亡的主要原因之一[2]。迄今为止,房颤的发生机制尚未完全阐明,现有大量证据显示炎症与房颤密切相关[3-5]。
炎症小体属于胞浆型模式识别受体 (PRR),由多种蛋白质组成的蛋白复合体,它通过半胱天冬氨酸酶(Caspase-1)调控白细胞介素(IL)-1β前体(pro-IL-1β)、IL-18前体(pro-IL-18)、IL-33前体(pro-IL-33)等,促使其转化为有活性的IL-1β、IL-18及IL-33等,进而参与天然免疫系统的激活[6,7]。NLRP3炎症小体由NLRP3、凋亡相关斑点样蛋白(ASC)和Caspase-1组成,NLRP3是NLRP3炎症小体多种蛋白质成分中最核心的组成部分。国内外研究表明,NLRP3炎症小体在心肌缺血再灌注、心肌梗死及心力衰竭等多种心血管疾病中发挥重要的作用,具有极高的临床研究价值[8]。现有证据表明,炎症可能通过影响心脏的电重构和(或)心肌重构,参与了房颤的发生、发展。本课题将研究NLRP3在房颤患者外周血单核淋巴细胞(PBMCs)中的表达水平,探究 NLRP3炎症小体与房颤患者临床指标的相关性,探究房颤发生的预警信号和潜在干预靶点。
1 资料与方法
1.1 研究对象
选择2014-06至2016-03我院收治的房颤患者60例,所有入选患者均有12导联体表心电图或24 h动态心电图记录的房颤图形。分为阵发性房颤(PAF)组30例,男性22例、女性8例,平均年龄(58.54±7.96)岁,吸烟18例(60%),高血压5例(17%);非阵发性房颤(nPAF)组30例,男性20例、女性10例,平均年龄(56.00±10.76)岁,吸烟16例(53%),高血压7例(23%)。另收集同期健康体检者26例作为正常对照组,男性17例、女性9例,平均年龄(54.58±6.61)岁,吸烟13例(50%),高血压4例(15%)。3组间性别构成、年龄、吸烟、高血压等临床资料差异均无统计学意义(P>0.05),具有可比性。入选患者均签署知情同意书,此研究方案获得本院伦理委员会批准。
诊断标准:根据美国心脏病学会和美国心脏协会(ACC/AHA)最新房颤指南对房颤进行分类,PAF:发作后7 d内能够自行或干预后终止的房颤;nPAF:发作后持续时间超过7 d的房颤;长程持续性房颤:发作持续时间超过12个月的房颤,一般不能自行转复为窦性心律,需要进行药物或者电复律;永久性房颤:持续时间超过12个月,不能终止或终止后又复发,无转复愿望。nPAF包括持续性房颤、长程持续性房颤和永久性房颤。
排除标准:(1)器质性心脏病的房颤患者,如瓣膜性心脏病、先天性心脏病、扩张型心肌病或缺血型心肌病等;(2)合并有冠心病、心肌梗死、活动期的心肌炎、急性心肌损伤、糖尿病、甲状腺功能异常、矽肺、痛风及类风湿关节炎等疾病患者;(3)急性或慢性炎症性疾病患者(如细菌、真菌、病毒感染等);(4)有严重肝功能、肾功能、肺功能损害患者;(5)近3天内均未服用抗炎类药物,2个月内无手术史或外伤史。
1.2 实验方法
主要试剂:人外周血淋巴细胞分离液(北京索莱宝科技有限公司);NLRP3、IL-6 I抗(Abcam公司),山羊抗兔FITC-Ⅱ抗(Santa cruz公司);IL-1β、C反应蛋白(CRP)及N末端B型利钠肽原(NT-proBNP)(深圳市达科为生物工程有限公司)。
标本准备:所有研究对象需禁食禁水8 h以上,清晨抽取静脉血,分别置于抗凝管2 ml、普通干燥管5 ml。
血清分离:取外周静脉血5 ml,以3000 r/min 4℃离心20 min后上层为血清,装入1.5 ml EP离心管中冻存于-80℃超低温冰箱用以测定血清中IL-1β、IL-6、CRP及NT-proBNP的浓度。
PBMCs分离:(1)用移液枪取乙二胺四乙酸(EDTA) 抗凝管外周全血4 ml加入10 ml离心管,等体积生理盐水充分混匀。(2)另取2只10 ml离心管分别加入人外周血淋巴细胞分离液4 ml,沿着离心管壁分别将上述混匀液体等体积加于淋巴细胞分离液液面上,后以400 r/min 4℃离心20 min。(3)离心结束后可见管中液体分为3层,中间层可见一层较为清晰的环状乳白色细胞层,即为PBMCs层,将该层细胞移入另一离心管中。用4~5 ml生理盐水将PBMCs细胞吹悬后,以400 r/min 4℃离心20 min,弃上清,重复洗涤2次。加入1 ml生理盐水重悬细胞,并转移至1.5 ml EP管中,以400 r/min 4℃离心20 min,干燥后存于-80℃超低温冰箱待行流式细胞检测。
流式细胞检测:(1)在流式管中加入细胞悬液(1×106个/ml);(2)向细胞悬液中加入100 µl试剂A
(fixation,固定剂),室温孵育15 min;(3)用3 ml PBS缓冲液洗涤1次,1 200~1 500 r/min离心5 min,弃上清,振荡,重悬细胞;(4)向细胞
悬液中加入试剂B(permeabilization 破膜剂),加入NLRP3 Ⅰ抗(20~50 µl,浓度1:50)或PBS(作为空白对照组),加入50 µl山羊抗兔FITC-Ⅱ抗,振荡1-2S并室温避光孵育20 min;(5)用3 ml PBS洗涤1次,1 200~1 500 r/min离心5 min,弃上清,重悬细胞于BPS中,立即分析或置于0.5 ml的0.1%多聚甲醛固定液中,暗处2℃~8℃储存,固定的细胞在24 h以内分析。
酶联免疫吸附法(ELISA)实验:利用ELISA法检测研究对象外周血血清中IL-1β、IL-6、CRP及NT-proBNP的浓度,按试剂盒说明书进行检测。
器械检查指标:12导联心电图由心电图室专业医师使用12导联心电图仪记录并分析结果。
超声心动图检查:由超声科医师使用心脏彩色多普勒超声诊断仪(Philips IE33,美国)测量并记录左心房内径(LAD)、室间隔厚度(IVST)、左心室后壁厚度(LVPWT)、左心室舒张末期内径(LVDD)及左心室射血分数(LVEF)。
1.3 统计学分析
应用SPSS16.0统计软件分析。计量资料符合正态分布采用均数±标准差表示,正态资料的组间差异比较采用两独立样本t检验,计数资料组间比较采用卡方检验;通过线性回归进行指标的相关性分析,双变量服从正态分布的资料进行双变量相关分析时选择Pearson相关分析,不符合正态分布的采用Spearman相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 3组研究对象外周血中各指标水平比较(表1)
PAF组和nPAF组患者外周血NLRP3、IL-1β、IL-6、CRP、NT-proBNP水平均高于正常对照组,差异均有统计学意义(P均<0.05)。PAF组和nPAF组患者间NT-proBNP水平比较差异有统计学意义(P<0.05)。
表1 3组研究对象外周血中各指标水平比较

表1 3组研究对象外周血中各指标水平比较
注:PAF:阵发性房颤;nPAF:非阵发性房颤;IL:白细胞介素;CRP:C反应蛋白;NT-proBNP:N末端B型利钠肽原。与正常对照组比较*P<0.05;与PAF组比较△P<0.05
?
2.2 房颤患者(PAF组和nPAF组)外周血NLRP3表达水平和超声心动图各项指标的Spearman相关性分析(表2)
房颤患者(PAF组和nPAF组)外周血PBMCs中NLRP3水平与左心房内径(LAD)呈正相关(r=0.579,P<0.05),与左心室射血分数(LVEF)呈负相关(r=-0.490,P<0.05)。
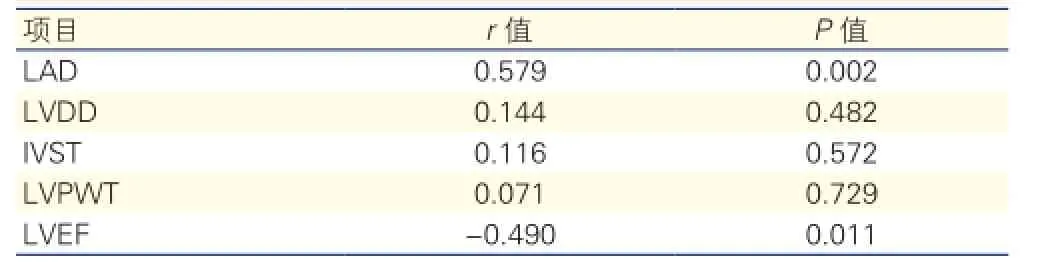
表2 房颤患者(PAF组和nPAF组)NLRP3水平和超声心动图各项指标的Spearman相关性分析
3 讨论
NLRP3炎症小体是一种分子量约为700 Kda的大分子多蛋白复合体,由NLRP3、ASC及Caspase-1组成[9],其主要来源于外周血单核淋巴细胞。其中,Caspase-1是NLRP3炎性小体的效应蛋白,负责将无活性的pro-IL-1β、pro-IL-18切割成为具有活性的IL-1β、IL-18,进而激活下游炎性介质,导致机体局部或全身发生严重的炎症反应。另外,NLRP3炎症小体还可以通过激活Caspase-1,介导细胞凋亡。细胞凋亡是一种Caspase-1依赖的程序性细胞死亡,它同时具有细胞凋亡和细胞坏死的形态特征,包括:细胞核脱氧核糖核酸(DNA)损伤,细胞膜微孔形成,细胞器肿胀,细胞外液渗入胞质诱导细胞肿胀裂解,最终导致胞浆内炎症介质释放[10,11]。在急性心肌梗死、心力衰竭及心肌缺血再灌注等动物模型试验中NLRP3炎症小体表达上调,并促进心肌炎症损伤及纤维化,最终导致心功能下降[12-14]。这些研究提示NLRP3 炎症小体的异常激活与心血管疾病密切相关。
在房颤患者的心房组织中发现炎症细胞浸润、血清炎症因子水平显著增高[15],说明炎症在房颤患者中发挥重要的作用。炎症反应可能与心房电重构和结构重构有关[16-18],而上述重构与房颤的发生发展及维持密切相关。
为了阐明NLRP3炎症小体是否参与了房颤的发生、发展,我们检测了房颤患者及健康人群外周血PBMCs中的NLRP3表达水平及血浆IL-1β、IL-6、CRP、NT-proBNP的浓度。我们发现PAF组和nPAF组患者外周血NLRP3表达水平均高于正常对照组(P<0.05),但PAF组和nPAF组间患者比较,差异无统计学意义(P>0.05),在数值上nPAF组(18.70±6.94)大于 PAF组(16.44±6.29)。表明NLRP3炎症小体与房颤密切相关,且房颤持续时间越长,炎症反应可能越强烈,但具体的作用机制尚不明确,需要进一步研究。
本研究发现,PAF组和nPAF组患者IL-1β、IL-6、CRP水平均高于正常对照组(P<0.05);但PAF组和nPAF组间比较差异无统计学意义(P>0.05)。此前有研究表明,房颤患者外周血IL-1β表达上调[16,19],与本研究发现PAF组和nPAF组外周血IL-1β水平升高相一致。IL-1β是一种重要的促炎因子,它可通过促进IL-6、CRP及肿瘤坏死因子α(TNF-α)表达而促进局部或全身的炎症反应[20]。炎性反应中间产物及炎性因子可以作用于L型钙通道、钙泵、钠-钙交换体等,致使心肌收缩、舒张时间和幅度下降,从而使有效不应期和动作电位时程下降,诱发房颤[21]。心房的炎症水平与心房传导的不均一性成正比,严重的炎症反应可以增加了房颤的发生和持续时间[22,23]。此外,研究表明炎症是诱导心房纤维化的原因之一,其机制与炎症刺激细胞因子、生长因子、血管紧张素Ⅱ等表达异常以及影响细胞机械牵张力有关,促进成纤维细胞增殖、迁移和分化成肌纤维母细胞[24]。IL-1β作为NLRP3 炎性小体激活的主要产物,可以引起心肌细胞增生肥大、凋亡,刺激成纤维细胞增殖,影响间质胶原的代谢。在缺血性心肌病中IL-1β可导致钙瞬变受损、心脏纤维化及重构[14]。在心肌梗死大鼠模型中发现,心肌细胞IL-1β基因表达增高,并与LVDD及胶原含量呈明显正相关,说明IL-1β可能参与了心肌梗死后的左心室重构[25]。另外,在动物实验中通过抑制IL-1β的表达,可以减轻胶原增生、改善心肌重塑[26]。由此可见,IL-1β可能通过炎症反应促使心脏结构重构和(或)电重构,导致房颤的发生、发展。此外,本研究还发现,PAF组和nPAF组患者NT-proBNP水平均高于正常对照组(P<0.05),PAF组和nPAF组间NT-proBNP水平比较差异有统计学意义(P<0.05)。NT-proBNP主要是由心房和心室细胞共同合成,当心脏不断扩大或者心脏负荷超标时NT-proBNP分泌会有所增加。PAF组NT-proBNP水平较nPAF组升高,考虑为房颤持续时间越长及心房高频收缩,心房逐渐扩大及心房应力增加,此时主要由心房肌分泌NT-proBNP亦随之增加。目前,NLRP3炎症小体及其下游因子IL-1β是否参与NT-proBNP的分泌尚不明确,还有待进一步验证。
此外,本研究还发现房颤患者(PAF组、nPAF组)外周血PBMCs中NLRP3水平与LAD呈正相关(r=0.579,P<0.05),与LVEF呈负相关(r=-0.490,P<0.05)。说明房颤患者外周血NLRP3炎症小体与LAD、LVEF具有密切关联性,我们推测房颤患者外周血中NLRP3 炎症小体的异常激活,释放具有活性的IL-1β,进而激活下游信号转导通路,促进IL-6、CRP等炎症因子的表达而促发心脏局部或全身的炎症反应,进一步产生心房结构重构和(或)电重构,而诱发房颤的产生发展及维持。
结论:(1)房颤患者外周血PBMCs中NLRP3表达水平高于正常对照组,提示NLRP3炎症小体与房颤密切相关,其在干预房颤发生发展及维持过程中可能具有积极的临床价值,可能为房颤提供更多的有效治疗策略。(2)房颤患者血清中NLRP3炎症小体的下游因子IL-1β及其相关炎症因子IL-6、CRP水平均高于正常对照组,进一步说明房颤与炎症反应密切相关。(3)房颤患者NLRP3表达水平与LAD、LVEF具有相关性,其可能通过NLRP3炎症小体的下游相关炎症因子产生炎症反应,导致心脏结构重构或电重构而诱发房颤的产生发展及维持。
综上所述,本研究为房颤的早期预测以及深入认识房颤发生的相关机制提供了一定理论基础。房颤患者外周血NLRP3炎症小体及其下游因子水平升高与房颤之间密切相关,可能成为房颤治疗的潜在靶点。本研究为小样本、单中心研究,受病例的选择、组间的可比性、实验室检测方法等因素影响,以及知识水平有限,所提供的数据有一定的局限性,尚需大样本、多中心的研究进一步确定NLRP3炎症小体与房颤的关系。
[1] Krijthe BP, Kunst A, Benjamin EJ, et al. Projections on the number of individuals with atrial fibrillation in the European Union, from 2000 to 2060. Eur Heart, 2013, 34: 2746-2751.
[2] 易茜. 心房结构重构在心房颤动的发生及维持中的作用. 中国循环杂志, 2015, 30: 813-816.
[3] Galea R, Cardillo MT, Caroli A, et al. Inflammation and C-reactive protein in atrial fibrillation: cause or effect?. Tex Heart Inst J, 2014, 41: 461-468.
[4] Hu YF, Chen YJ, Lin YJ, et al. Inflammation and the pathogenesis of atrial fibrillation. Nat Rev Cardiol, 2015, 12: 230-243.
[5] 郑黎晖, 姚焰, 吴灵敏, 等. 孤立性阵发性心房颤动患者高敏C反应蛋白与P波离散度的关系. 中国循环杂志, 2014, 29: 983-986.
[6] Schroder K, Tschopp J. The inflammasomes. Cell, 2010, 140: 821-832.
[7] Latz E. The inflammasomes: mechanisms of activation and function. Curr Opin Immunol, 2010, 22: 28-33.
[8] Garg NJ. Inflammasomes in cardiovascular diseases. Am J Cardiovasc Dis, 2011, 1: 244-254.
[9] Neuman RB, Bloom HL, Shukrullah I, et al. Oxidative stress markers are ssociated with persistent atrial fibrillation. Clin Chem, 2007, 53: 1652-1657.
[10] Bergsbaken T, Fink SL, Cookson BT. Pyroptosis: host cell death and inflammation. Nat Rev Microbiol, 2009, 7: 99-109.
[11] Kepp O, Galluzzi L, Zitvogel L, et al. Pyroptosis-a cell death modality of its kind?. Eur J Immunol, 2010, 40: 627-630.
[12] Kawaguchi M, Takahashi M, Hata T, et al. Inflammasome activation of cardiac fibroblasts is essential for myocardial ischemia/reperfusion injury. Circulation, 2011, 123: 594-604.
[13] Takahashi M. NLRP3 inflammasome as a novel player in myocardial infarction. Int Heart J, 2014, 55: 101-105.
[14] Bracey NA, Beck PL, Muruve DA, et al. The NLRP3 inflammasome promotes myocardial dysfunction in structural cardiomyopathy through interleukin-1β. Exp Physiol, 2013, 98: 462-472.
[15] Conway DS, Buggins P, Hughes E, et al. Prognostic significance of raised plasma levels of interleukin-6 and C-reactive protein in atrial fibrillation. Am Heart J, 2004, 148: 462-466.
[16] Chung MK, Martin DO, Sprecher D, et al. C-reactive protein elevation in patients with atrial arrhythmias: inflammatory mechanisms and persistence of atrial fibrillation. Circulation, 2001, 104: 2886-2891.
[17] Engelmann MD, Svendsen JH. Inflammation in the genesis and perpetuation of atrial fibrillation. Eur Heart J, 2005, 26: 2083-2092.
[18] Lee JW, Park NH, Choo SJ, et al. Surgical outcome of the maze procedure for atrial fibrillation in mitral valve disease: rheumatic versus degenerative. Ann Thorac Surg, 2003, 75: 57-61.
[19] Wang H, Yan HM, Tang MX, et al. Increased serum levels of microvesicles in nonvalvular atrial fibrillation determinated by ELISA using a specific monoclonal antibody AD-1. Clin Chim Acta, 2010, 411: 1700-1704.
[20] Dinarello CA, Meer JW. Treating inflammation by blocking interleukin-1 in humans. Semin Immunol, 2013, 25: 469-484.
[21] 英硕, 齐文慧, 贾莉莉. 炎性反应与心房颤动发病机制的研究进展.中华老年心脑血管病杂志, 2014, 16: 544-546.
[22] Kumagai K, Nakashima H, Saku K. The HMG-CoA reductase inhibitor atorvastatin prevents atrial fibrillation by inhibiting inflammation in a caninesterile pericarditis model. Cardiovasc Res, 2004, 62: 105-111.
[23] Ishii Y, Schuessler RB, Gaynor SL, et al. Inflammation of atrium after cardiac surgery is associated with inhomogeneity of atrial conduction and atrial fibrillation. Circulation, 2005, 111: 2881-2888.
[24] Yue L, Xie J, Nattel S. Molecular determinants of cardiac fibroblast electrical function and therapeutic implications for atrial fibrillation. Cardiovasc Res, 2011, 89: 744-753.
[25] Ono K, Matsumori A, Shioi T, et al. Cytokine gene expression after myocardial infarction in rat hearts: possible implication in left ventricular remodeling. Circulation, 1998, 98: 149-156.
[26] 李彬, 廖玉华, 程翔, 等. 卡维地洛对心肌梗死后大鼠心肌IL-1β表达及胶原沉积的影响. 中华医学杂志, 2005, 85: 416-418.
Correlation Study Between NLRP3 inflammasome and Atrial Fibrillation
XU Jian, HE Yan, LUO Bei-bei, XIANG Chun-lin, HUANG Yan-qun, SHU Cheng-lin, WANG Rong.
Department of Geriatric Cardiology, The First Affiliated Hospital of Guangxi Medical University, Nanning (530021), Guangxi, China Corresponding Author: HE Yan, Email: hyxjwxy@126.com
Objective: To explore the relationship between NLRP3 inflammasome and atrial fibrillation (AF) by examining peripheral blood level of NLRP3 inflammasome and other inflammatory factors in relevant patients.
2016-04-22)
(编辑:王宝茹)
国家自然科学基金(81260039);第一批广西医学高层次骨干人才培养“139”计划项目;广西医疗卫生适宜技术研究与开发课题(S201303-06)
530021 广西壮族自治区南宁市,广西医科大学第一附属医院 老年心内科
许键 主治医师 硕士 主要研究方向为心律失常诊治 Email:158430022@qq.com 通讯作者:何燕 Email:hyxjwxy@126.com
R54
A
1000-3614(2017)01-0072-05
10.3969/j.issn.1000-3614.2017.01.017
方法:选择2014-06至2016-03我院收治的房颤患者60例,其中阵发性房颤(PAF)组30例,非阵发性房颤(nPAF)组30例,26例健康体检者作为正常对照组。收集3组的临床资料,利用流式细胞术检测外周血单核淋巴细胞(PBMCs)中NLRP3表达水平,利用酶联免疫吸附法(ELISA)检测血清白细胞介素(IL)-1β、IL-6、C反应蛋白(CRP)及N末端B型利钠肽原(NT-proBNP)水平。比较3组间各指标差异,通过线性回归进行指标的相关性分析。
结果:(1)PAF组和nPAF组患者外周血PBMCs中NLRP3、IL-1β、IL-6、CRP水平均高于正常对照组(P均<0.05),但PAF组和nPAF两组患者间NLRP3表达水平差异无统计学意义(P>0.05)。(2)PAF组和nPAF组患者NT-proBNP水平均高于正常对照组(P均<0.05),PAF组和nPAF组间比较差异有统计学意义(P<0.05)。(3)房颤患者(PAF组和nPAF组)外周血PBMCs中NLRP3水平与左心房内径(LAD)呈正相关(r=0.579,P<0.05),与左心室射血分数(LVEF)呈负相关(r=-0.490,P<0.05)。
结论:(1)NLRP3炎症小体与房颤密切相关,可能为房颤临床治疗的重要干预靶点。(2)房颤与炎症反应关系密切。(3)可能通过NLRP3炎症小体的下游相关炎症因子产生炎症反应,导致心肌重构或电重构进而诱发房颤的产生、发展。

