不同剂量阿托伐他汀对急性ST段抬高型心肌梗死患者血小板反应性的影响
徐晓蓉,李奎宝,王攀,刘宇,卢长林,杨新春,杨中甦
不同剂量阿托伐他汀对急性ST段抬高型心肌梗死患者血小板反应性的影响
徐晓蓉,李奎宝,王攀,刘宇,卢长林,杨新春,杨中甦
目的:探讨不同剂量阿托伐他汀对急性ST段抬高型心肌梗死(STEMI)患者行急诊经皮冠状动脉(冠脉)介入治疗(PCI) 后残余血小板功能和血小板反应性的影响。
心肌梗死 ;降血脂药;血小板
(Chinese Circulation Journal, 2017,32:26.)
急性ST段抬高型心肌梗死(STEMI)患者因冠状动脉(冠脉)内粥样斑块不稳定,出现裂隙或破裂,引起血小板聚集,形成血栓,导致冠脉管腔完全阻塞而引起的。血小板聚集是经皮冠状动脉介入治疗(PCI)后缺血并发症发展的一个重要过程。双重抗血小板治疗(阿司匹林和氯吡格雷)是PCI期间减弱血小板功能的黄金治疗标准。然而,尽管双重抗血小板治疗在众多临床试验中显示很好的疗效,但仍有一部分接受PCI的患者将经历复发性缺血性或血栓事件。如果患者表现出氯吡格雷低反应性和对二磷酸腺苷(ADP)的高血小板反应性,可能会增加复发事件的风险[1]。他汀类药物作为急性心肌梗死的一线用药,除了调脂作用外,还具有稳定粥样斑块、改善血管内皮功能、抗炎、抗氧化及抑制血小板活性等作用[2]。若通过高剂量他汀药物治疗进一步达到稳定破裂的斑块并抑制血小板活化,改善血小板的高反应性,抑制血栓形成,从而降低STEMI患者PCI术后血栓事件的风险,可能对这部分患者的预后带来很大益处。而高剂量他汀治疗对于亚洲人群的耐受性较欧美人群差,故本研究设计治疗疗程为7天,以减少不良反应的发生。血栓弹力图(TEG)分析仪是一种床旁快速血小板功能检测方法,近年来已被临床不断采用,是一种方便快捷,且可靠性较强的方法,可观察使用抗血小板药物后残余的血小板功能,并评估患者对抗血小板药物的反应性。本研究旨在利用血栓弹力图测定不同剂量阿托伐他汀对行急诊PCI的STEMI患者残余血小板功能和血小板反应性的影响。
1 资料与方法
研究对象: 选择自2012-08至2014-02我院心内科收治的确诊为STEMI并行急诊PCI的患者120 例,男88 例(73.3%),女32例,年龄43~83岁,平均年龄(63.48±10.51)岁。纳入标准: 符合美国心脏病学会/美国心脏协会( ACC /AHA)制定的STEMI的诊断标准[3]。排除标准:(1)妊娠;(2)哺乳期;(3)肿瘤患者;(4)肝肾功能不全;(5)对比剂过敏史;(6)多发性肌炎;(7)合并心原性休克;(8)左心室射血分数(LVEF)<40%;(9)曾口服过他汀类药物治疗者。研究方案经我院伦理委员会批准。
治疗方法及分组:120例患者于PCI 前30 min给予负荷剂量氯吡格雷600 mg (安万特公司 )+ 阿司匹林300 mg (拜耳公司),次日起服用维持剂量氯吡格雷75 mg/ d + 阿司匹林100 mg/ d。若无禁忌证,所有患者均常规应用β受体阻滞剂、硝酸酯类药物、血管紧张素转换酶抑制剂(ACEI)或血管紧张素Ⅱ受体阻滞剂(ARB)。在常规抗血小板、抗凝、扩冠等治疗基础上,120例患者急诊PCI后均接受常规剂量的低分子肝素治疗。按随机数字表随机分成阿托伐他汀20 mg/d 治疗组(标准组,n=60),于急诊PCI后当晚给予阿托伐他汀20 mg,此后每晚服用1次;阿托伐他汀40 mg /d治疗组(强化组,n=60),于急诊PCI后当晚给予阿托伐他汀40 mg,此后每晚服用1次。两组患者按上述用药要求均连续服用7天。
标本的采集和检测: 120例患者于急诊PCI前(服他汀药物前)及服他汀药物后第7天空腹采血,行血脂水平的检测。入院常规检查血常规、尿常规、便常规、肝肾功能、心肌肌钙蛋白I(cTnI)等。
血栓弹力图血凝块的最大强度(MA)、ADP诱导的血小板纤维蛋白凝块强度 (MAADP)及血小板抑制率的测定:于急诊PCI前(服他汀药物前)及于服药后第7天晨空腹采取静脉血。接受血小板糖蛋白Ⅱb/Ⅲa 受体( GPⅡb/Ⅲa)抑制剂治疗的患者均在停止治疗至少18 h后采血。采血2 h内应用TEG凝血分析仪5000型及试剂盒(Haemoscope公司,美国)进行检验,测定MA值、MAADP 及花生四烯酸(AA )和ADP 诱导的血小板抑制率。经改进后的TEG通过加入激活剂F因子(由蝮蛇血凝酶和血小板XⅢa因子组成)产生纤维蛋白网。当加入血小板激活剂AA或ADP后,将激活未被抗血小板药物抑制的血小板,并与纤维蛋白联结形成血凝块[4]。MAAA代表AA诱导的血凝块强度;MAADP代表ADP诱导的血凝块强度; 纤维蛋白的凝块强度为MAfibrin; 凝血酶诱导的凝块强度为MAthrombin。AA 和ADP 诱导的血小板抑制率由计算机软件根据以下公式计算:抑制率(%)= 100%-(MAAA或MAADP-MAfibrin)/ ( MAthrombin- MAfibrin)×100%
血小板高反应性定义[5]: (1)对ADP的高反应性定义为:在服用氯吡格雷的情况下,由2 μmol/L的ADP诱导的血小板抑制率≤30%。(2)对AA高反应性的定义为: 患者在服用阿司匹林的情况下,由1 mmol/L的AA诱导的血小板抑制率≤50%。
随访:两组患者服用不同剂量的阿托伐他汀治疗7天后,所有患者继续服用阿托伐他汀20 mg/d以维持心肌梗死的二级预防治疗。出院后每个月门诊随诊,同时进行对患者的访视。未能来随诊的患者,进行电话随访。观察患者出院后3个月内是否出现临床事件包括不稳定心绞痛(UA)、非致命的心肌梗死、支架内再狭窄、支架血栓形成、再次干预其他血管、脑血管事件及心血管死亡。
统计学方法:应用SPSS 16.0软件行统计分析,连续变量以表示,对符合正态分布的连续变量的比较采用两个独立样本t检验,非正态分布的计量资料以中位数和四分位数间距(IQR)表示。计数资料采用卡方检验。检验水准α=0.05,所有检验均为双侧检验。P<0.05 为差异有统计学意义。
2 结果
两组患者的临床资料比较(表1):两组患者的各项临床资料比较,差异均无统计学意义(P>0.05),具有可比性。

表1 两组患者的临床资料比较 [例(%)]
两组患者他汀药物治疗7天后血脂水平的比较(表2):服用他汀药物前,两组患者LDL-C水平的比较差异无统计学意义。治疗7天后,两组的LDL-C水平较治疗前均呈下降趋势,但差异无统计学意义(P>0.05);强化组患者的LDL-C水平较标准组差异亦无统计学意义(P>0.05)。血总胆固醇(TC)。高密度脂蛋白胆固醇(HDL-C)和甘油三酯(TG)的水平在两组间治疗前后差异均无统计学意义(P>0.05)。
两组患者他汀药物治疗7天后MAADP值的比较(表2):服用他汀药物前,两组患者MAADP值比较差异无统计学意义 (P>0.05)。治疗7天后:与治疗前比较,两组患者MAADP值均明显降低(P<0.05);强化组MAADP值较标准组有明显减低,差异均有统计学意义(P<0.05)。
表2 两组患者他汀药物治疗7天后血脂水平和MAADP的比较

表2 两组患者他汀药物治疗7天后血脂水平和MAADP的比较
注: TC:总胆固醇;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白固醇;TG:甘油三酯。MAADP:ADP诱导的血小板纤维蛋白凝块强度。与同组治疗前比较*P<0.05 ,与治疗7天后标准组比较△P<0.05
?
两组患者他汀药物治疗7天后ADP高反应性和AA高反应性发生率的比较:强化组出现ADP高反应性的发生率低于标准组(18.3% vs 31.7%),差异有统计学意义(P< 0.05); 标准组AA高反应性发生率(18.3%)与强化组(13.3%)相比差异无统计学意义(P>0.05);标准组ADP和AA均为高反应性的发生率(18.5%)与强化组(11.6%)相比差异也无统计学意义(P>0.05)。
3个月随访期间临床事件的比较(表3):两组患者在随访期间的不稳定性心绞痛、非致死性心肌梗死、再次干预其他血管和脑血管事件的发生率差异均无统计学意义(P>0.05);强化组患者未出现支架内再狭窄及支架内血栓,较标准组有下降的趋势,但差异无统计学意义;两组患者均无心血管疾病死亡或靶血管重建。
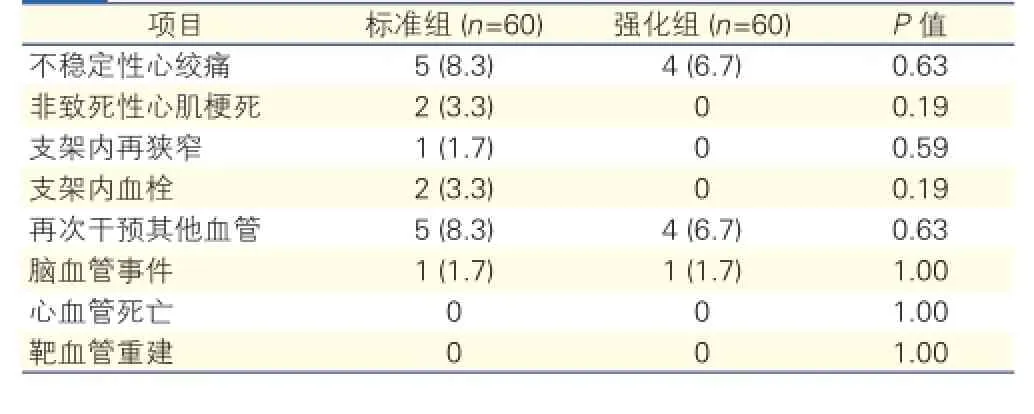
表3 两组患者3个月随访期间临床事件的比较[例(%)]
3 讨论
近年来已有众多临床试验证实他汀类药物具有“调脂外的多向性效应”,即除了调脂作用外,还可以稳定粥样斑块、改善血管内皮功能、抑制血管内皮的炎症反应、抗凝、抗血小板等[6,7]。在急性冠脉综合征患者中血小板活化起着重要作用。血小板功能亢进是促成血栓形成、动脉粥样硬化的重要环节。经改进后的血栓弹力图测定MAADP反映纤维蛋白和活化的血小板共同形成的最大血凝块强度,观察使用抗血小板药物后残余的血小板功能。Gurbel等[8]设计了225例择期行PCI服用阿司匹林和氯吡格雷的患者,采用血栓弹力图和光学比浊法(LTA)测量血小板功能,通过分析发现,MAADP>47 mm是长期缺血事件最好的预测值,是反映血小板活性和临床预测缺血事件发生的有效指标,血栓弹力图检测ADP诱导的血小板聚集率减低的患者PCI术后出现缺血事件的比例明显减少。其他一些作者研究也显示,血小板抑制率不足与PCI后血栓形成和临床的缺血事件有关[9]。在急性心肌梗死行PCI的患者发生ADP高反应性的几率远较稳定性心绞痛患者PCI术后升高明显[10]。事实上,血小板高反应(HPR)与几个预测临床预后的变量如急性冠脉综合征、糖尿病、体重过重、高龄和LVEF减低及CRP升高等相关。
在本研究中,常规抗血小板、抗凝、扩冠治疗基础上给予阿托伐他汀20 mg/d 或阿托伐他汀40 mg/d,治疗7天后,经血小板弹力图检测的MAADP值在强化组较标准治疗组明显下降,差异均有显著性(P<0.05)。而两组间在治疗7天后测定血LDL-C的水平差异无统计学意义,提示他汀类药物对血小板功能的影响是独立于血脂的变化。他汀药物治疗7天后出现ADP高反应性的患者在强化组较标准组的发生率明显减少,差异有显著性意义(P<0.05)。出现AA高反应性的患者的比例在强化组和标准组之间无统计学差异(P<0.05)。提示早期短疗程强化他汀治疗降低了患者抗血小板药物后残余的血小板活性,一定程度上改善了血小板的高反应性,尤其是对氯吡格雷药物的反应性。而有研究发现高剂量的阿托伐他汀治疗可显著减低炎症因子白细胞介素-6(IL-6)、 C反应蛋白(CRP)及肿瘤坏死因子-α(TNF-α)水平及血小板活性,降低稳定性心绞痛患者30天内心血管不良事件的发生率[11]。Sikora等[12]研究发现应用他汀药物治疗后,反映血小板活化的指标ADP诱导的血小板聚集有显著下降,与本研究的结果相似。
还有研究发现他汀治疗3天后,体内反应血小板激活的最强物质血小板CD40L,可溶性 CD40L(sCD40L)可出现下降。提示他汀通过抑制血小板CD40L和CD40L诱导的血栓形成直接发挥抗栓作用,在服药早期迅速发挥效应,且是独立于其降脂作用的。并且体外实验显示在抑制血小板CD40L和被CD40L刺激的单核细胞激活的血栓活化作用,他汀具有剂量依赖性[13]。与我们的研究结果有一定相似,本研究发现高剂量他汀于服药7天后出现了反映残余的血小板功能的MAADP值较标准治疗组明显下降,这进一步证实了高剂量他汀治疗可在急性心肌梗死早期起到抑制血小板活性的作用。既往文献曾报道他汀类药物影响血小板活性的其他可能机制:通过降低血小板被低密度脂蛋白及其氧化产物的刺激;降低血小板质膜的胆固醇浓度;由于减少细胞内类异戊二烯和凝血恶烷A2的产生,降低信号转导;并增加一氧化氮生物利用度等降低血小板的激活等[14,15]。
近年已有众多研究证实高剂量他汀治疗减少主要心血管事件的发生,给冠心病患者带来更好的获益[16,17]。对于急性心肌梗死患者,尤其是急诊PCI后存在的血小板激活及血小板高反应性,进一步降低血小板活性,可能减少患者PCI后血栓事件的发生。我们的研究结果发现在STEMI急诊PCI后早期给予短疗程的高剂量他汀治疗较常规剂量可更显著地抑制血小板活性,降低血小板高反应性。在本研究的3个月临床事件的随访中,强化组患者未出现支架内再狭窄及支架内血栓,较标准组有下降的趋势,但无统计学差异。
本研究的局限性:入选例数相对少,患者临床随访时间较短,可能造成对临床事件发生率评价的影响。可进一步观察高剂量他汀对血小板功能的影响,与临床预后变化的相关性。还需待大规模的随机对照临床试验进一步证实。
综上所述,对于STEMI,尤其是急诊PCI后存在的血小板激活及血小板高反应性的患者,在常规抗凝,双重抗血小板应用时早期给予短疗程的高剂量他汀治疗,可进一步降低血小板活性,降低血小板高反应性。未来可进一步扩大样本量,延长随访时间,观察他汀对降低STEMI患者PCI后血栓事件的风险和减少心血管缺血事件的影响。
参考文献
[1] Sambu N, Radhakrishnan A, Dent H, et al. Personalised antiplatelet therapy in stent thrombosis: observations from the Clopidogrel Resistance in Stent Thrombosis (CREST) registry. Heart, 2012, 98: 706-711.
[2] Pasceri V, Patti G, Nusca A, et al. Randomized trial of atorvastatin for reduction of myocardial damage during coronary intervention: results from the ARMYDA (Atorvastatin for Reduction of Myocardial Damage during Angioplasty) study. Circulation, 2004, 110: 674-678.
[3] Loomba RS, Arora R. ST elevation myocardial infarction guidelines today: a systematic review exploring updated ACC/ AHA STEMI guidelines and their applications. Am J Ther, 2009, 16: e7-e13.
[4] Mahla E, Suarez TA, Bliden KP, et al. Platelet function measurementbased strategy to reduce bleeding and waiting time in clopidogreltreated patients undergoing coronary artery bypass graft surgery: the timing based on platelet function strategy to reduce clopidogrelassociated bleeding related to CABG (TARGET-CABG) study. Circ Cardiovasc Interv, 2012, 5: 261-269.
[5] Bliden KP, DiChiara J, Tantry US, et al. Increased risk in patients with high platelet aggregation receiving chronic clopidogrel therapy undergoing percutaneous coronary intervention: is the current antiplatelet therapy adequate? J Am Coll Cardiol, 2007, 49: 657-666.
[6] Ye H, He F, Fei X, et al. High-dose atorvastatin reloading before percutaneous coronary intervention increased circulating endothelial progenitor cells and reduced inflammatory cytokine expression during the perioperative period. J Cardiovasc Pharmacol Ther, 2014, 19: 290-295.
[7] Arnold SV, Kosiborod M, Tang F, et al. Patterns of statin initiation, intensification, and maximization among patients hospitalized with an acute myocardial infarction. Circulation, 2014, 129: 1303-1309.
[8] Gurbel PA, Bliden KP, Navickas IA, et a1. Adenosine diphosphate induced platelet fibrin clot strength: a new thrombelastographic indicator of long term poststenting ischemic events. Am Heart J, 2010, 160: 346-354.
[9] Golukhova EZ, Ryabinina MN, Bulaeva NI, et al. Clopidogrel response variability: impact of genetic polymorphism and platelet biomarkers for predicting adverse outcomes poststenting. Am J Ther, 2015, 22: 222-230.
[10] Leé S, Vargová K, Hizoh I, et al. High on clopidogrel treatment platelet reactivity is frequent in acute and rare in elective stenting and can be functionally overcome by switch of therapy. Thromb Res, 2014, 133: 257-264.
[11] Li Q, Deng SB, Xia S, et al. Impact of intensive statin use on the level of inflammation and platelet activation in stable angina after percutaneous coronary intervention: a clinical study. Med Clin (Barc), 2013, 140: 532-536.
[12] Sikora J, Kostka B, Marczyk I, et al. Effect of statins on platelet function in patients with hyperlipidemia. Arch Med Sci, 2013, 9: 622-628.
[13] Sanguigni V, Pignatelli P, Lenti L, et al.Short-term treatment with atorvastatin reduces platelet CD40 ligand and thrombin generation in hypercholesterolemic patients. Circulation, 2005, 111: 412-419.
[14] Tziomalos K, Athyros VG, Mikhailidis DP, et al. Statin discontinuation: an underestimated risk? Curr Med Res Opin, 2008, 24: 3059-3062.
[15] Jagroop IA, Persaud JW, Mikhailidis DP, et al. A new rapid method to measure human platelet cholesterol: a pilot dtudy. Clin Appl Thromb Hemost, 2011, 17: 578 -584.
[16] Ricottini E, Madonna R, Grieco D, et al. Effect of High-Dose Atorvastatin Reload on the Release of Endothelial Progenitor Cells in Patients on Long-Term Statin Treatment Who Underwent Percutaneous Coronary Intervention (from the ARMYDA-EPC Study). Am J Cardiol, 2016, 117: 165-171.
[17] Mytas D, Zairis M, Karanasos A, et al. Effect of statin pretreatment on the outcome of ST-segment elevation myocardial infarction in patients without prior history of coronary artery disease. Hellenic J Cardiol, 2013, 54: 422-428.
Impact of Different Atorvastatin Doses on Platelet Reactivity in Patients With Acute ST-elevation Myocardial Infarction
XU Xiao-rong, LI Kui-bao, WANG Pan, LIU Yu, LU Chang-lin, YANG Xin-chun, YANG Zhong-su.
Heart Center, Beijing Chaoyang Hospital, Capital Medical University, Beijing (100020), China Corresponding Author: Yang Zhong-su, Email: yzhs66@163.com
Objective: To explore the impact of different atorvastatin doses on platelet function and highreactivity in patients with acute ST-elevation myocardial infarction (STEMI) after emergent percutaneouscoronary intervention (PCI) therapy.Methods: A total of 120 STEMI patients with emergent PCI therapy were randomly divided into 2 groups: Standard group, the patients received atorvastatin 20 mg/day and Intensive group, the patientsreceived atorvastatin 40 mg/day, all patients were treated for 7 days. n=60 in each group. Blood lipids and biochemistry were examined before PCI and 7 days after atorvastatin treatment respectively;platelet fibrin clot strength induced by ADP (MAADP), AA and ADP induced platelet inhibition rate were measured by thrombelastography (TEG) test.Results: With 7 days treatment, compared with Standard group, Intensive group showed decreased MAADP (38.40±17.40) mm vs (45.70±14.50) mm, P<0.05. On day 7 of atorvastatin treatment, compared with Standard group, Intensive group had reduced occurrence rate of high ADP reactivity (18.3% vs 31.7%), P<0.05. The occurrence rate of high AA reactivity was similar between 2 groups (13.3% vs 18.3%), P>0.05. The patients were followed-up for 3 months and the end point events including unstable angina, non-fatal MI, in-stent restenosis, in-stent thrombosis, and cardiovascular death or target vessel revascularization were similar between 2 groups, P>0.05.Conclusion: Early stage and short term administration of high dose atorvastatin could obviously inhibit platelet activity in STEMI patients after emergent PCI; such intensive atorvastatin treatment had no reduction on end point events in 3 months follow-up period.
Myocardial infarction; Lipid-lowering drngs; Platelet
2016-03-05)
(编辑:曹洪红)
100020 北京市,首都医科大学附属北京朝阳医院 心脏中心
徐晓蓉 主治医师 博士 主要从事冠心病诊疗 Email: medicinexxr@163.com 通讯作者:杨中甦 Email: yzhs66@163.com中图分类号:R541 文献标识码:A 文章编号:1000-3614(2017)01-0026-05 doi:10.3969/j.issn.1000-3614.2017. 01.007
方法:行急诊PCI的120例STEMI患者按随机数字表随机分成阿托伐他汀20 mg/d 治疗组(标准组,n=60)、阿托伐他汀40 mg/d治疗组(强化组,n=60)。120例患者分别于急诊PCI前及他汀药物治疗后第7天取血,行血脂及生化检测。并通过血栓弹力图测定二磷酸腺苷(ADP)诱导的血小板纤维蛋白凝块强度(MAADP)和花生四烯酸(AA)和ADP诱导的血小板抑制率。
结果:经血栓弹力图检测的MAADP值在治疗7天后,强化组较标准组明显下降[(38.40±17.40) mm vs(45.70±14.50) mm,P<0.05],差异有统计学意义。于治疗第7天ADP高反应性的发生率在强化组较标准组明显较少(18.3% vs 31.7%,P<0.05)。AA高反应性的发生率在强化组和标准组无差异(13.3% vs 18.3%,P>0.05)。随访3个月临床终点事件(包括不稳定性心绞痛,非致死性心肌梗死,支架内再狭窄,支架内血栓及心血管疾病死亡或靶血管重建)在两组间差异均无统计学意义(P>0.05)。
结论:STEMI患者急诊PCI后早期给予短疗程的高剂量他汀治疗较常规剂量可更显著地抑制血小板活性,降低血小板高反应性。强化治疗3个月临床终点事件未出现显著下降。

