复合生物营养剂对水体环境的影响
曾东,吴海燕,倪学勤*,谢永斌,欧星平,崔兰
(1.四川农业大学动物医学院动物微生态研究中心,四川 雅安 625014;2.动物疫病与人类健康四川省重点实验室,四川 雅安 625014)
复合生物营养剂对水体环境的影响
曾东1,2,吴海燕1#,倪学勤1,2*,谢永斌1,欧星平1,崔兰1
(1.四川农业大学动物医学院动物微生态研究中心,四川 雅安 625014;2.动物疫病与人类健康四川省重点实验室,四川 雅安 625014)
采用水族箱试验,研究不同营养物质组合的复合生物营养剂对水体环境的影响。试验分为4个组,CK组为空白对照组,A、B、C组为施用复合生物营养剂组,其有机营养物质、无机盐和微量营养物质质量比的比例分别为16∶78∶6、32∶62∶6和48∶46∶6。结果表明:C组的溶解氧(DO)含量显著低于其余各组;A组的有害物质含量最高,其氨氮(NH3–N)含量显著高于CK组和B组,但与C组的差异无统计学意义,其亚硝酸氮(NO2–N)含量显著高于其余各组;A组和B组的营养效果较好,其水体总氮(TN)、总磷(TP)含量均高于其余各组;各营养剂处理组水体中芽孢杆菌(Bacillus)的数量显著高于CK组,而气单胞菌(Aeromonas)的数量则显著低于CK组;相对于CK组,各营养剂处理组浮游生物的丰度和多样性都有不同程度的提高,其中以B组最明显;TN含量和TP含量是影响原核生物群落变化的主要因子,而DO含量和NH3–N含量是影响真核生物群落变化的主要因子。综合分析结果表明,有机营养物质、无机盐、微量营养物质质量比为32∶62∶6的复合生物营养剂具有较好的改善水体环境的作用。
复合生物营养剂;水质;微生物;浮游生物
Keywords: compound bio-nutrient; water quality; microorganisms; plankton
在水产养殖中普遍通过使用营养剂来增加水体营养,促进饵料生物大量繁殖,进而获得较高的生产效益[1–2]。传统水产养殖中主要使用的营养剂有无机营养剂、有机营养剂及无机–有机复合营养剂三大类。这三类营养剂虽然都能以较低的投入获得较高的产量,但都存在一系列导致水体污染和水产病害的问题[3]。随着近年来人们环境保护意识的提高,水质管理和环境污染治理日益受到重视[4]。由于复合生物营养剂具有调控水质和改善环境的功能,营养也更全面,所以,在水产养殖行业的应用前景广泛[5]。笔者研究不同营养物质组合的复合生物营养剂(compound bio-nutrient,CB)对养殖水体环境的作用效果,以期为复合生物营养剂在水产养殖行业的进一步推广应用提供参考依据。
1 材料与方法
1.1 材料
复合生物营养剂(compound bio-nutrient,CB)由四川农业大学动物微生态研究中心研制,主要由有机营养物质、无机盐和微量营养物质组成。
有机营养物质发酵鸡粪由四川什邡市福绿农资有限公司提供。发酵鸡粪较其他有机营养物质具有更优的营养物质组成,氮、磷、钾含量高,有害微生物数量低,对浮游生物的促生长效果更显著。
无机盐组分:磷酸二氢铵42%,尿素32%,氯化铵26%,均采用分析纯。
微量营养物质组分:FeSO4·7H2O 10‰,ZnSO4·7H2O 10‰,MnSO4·H2O 2‰,CuSO4·5H2O 5‰,CoCl2·6H2O 0.05‰,CaCO369.95‰,Lys 23‰,Met 23‰,水产复合维生素23‰,腐殖酸钠667‰,枯草芽孢杆菌(Bacillus subtilis)JS01167‰(由四川农业大学微生态研究中心提供,其有效活菌数为4.76×1010CFU/g)。
1.2 试验设计
试验分为CK、A、B、C共4个组,CK组不施用营养剂,作为空白对照,A、B、C组为施用复合生物营养剂组,其有机营养物质、无机盐和微量营养物质质量比分别为 16∶78∶6、32∶62∶6和48∶46∶6,每个处理 3个重复。试验在四川农业大学水产教学实验基地水族箱中进行。水族箱规格为70 cm×40 cm×40 cm。水源为曝气自来水。试验期间温度为24.6~28.8 ℃,自然光照。试验期为35 d。试验期间每隔14 d施用1次营养剂,于添加营养剂后第7天检测水体的理化指标和微生物数量,于试验结束时对不同处理组水体的浮游生物进行变性梯度凝胶电泳测定。
1.3 样品采集与处理
采集水族箱中心处的水样。所测定的水质指标包括溶解氧(DO)、氨氮(NH3–N)、亚硝酸氮(NO2–N)、总氮(TN)、总磷(TP)共5种物质的含量。水质分析参照文献[6]中的方法进行。
于每个水族箱中采集水样40 mL,用无菌生理盐水进行 10倍系列稀释后测定微生物数量。将异养菌(heterotrophic bacteria)和气单胞菌(Aeromonas)分别接种于R2A培养基和RS培养基;将芽孢杆菌(Bacillus)和弧菌(Vibrio) 分别涂布于 NA培养基和TCBS培养基[7]。每个稀释度重复3次,于28 ℃培养24~48 h后计数,结果以每1 mL水体微生物群落数量的对数值表示。
于每个水族箱采集水样500 mL,8 000 r/ min离心20 min后,将沉淀样品分装于2 mL EP管,–20℃冻存,备用。浮游生物样品DNA的抽提参考文献[8]进行。原核生物16S rDNA基因采用通用引物F357GC(5'–CGCCCGCCGCGCCCCGCGCCCGGC CCGCCGCCCCCGCCCCCCTACGGGAGGCAGC AG–3')和 R518(5'–ATTACCGCGGCTGCTGG–3')[9]进行PCR扩增,真核生物18S rDNA基因采用通用引物F1427GC(5'–CGCCCGCCGCGCCCCGCGCC CGGCCCGCCGCCCCCGCCCCTCTGTGATGCCC TTAGATGTTCTGGG–3')和R1616(5'–GCGGTGTG TACAA AGGGCAGGG–3')[8]进行PCR扩增。PCR产物采用10%的聚丙烯酰胺通过DcodeTM电泳检测系统(Bio–Rad)进行DGGE分析[10]。原核的变性剂梯度为35%~65%,真核的变性剂梯度为30%~55%。用1×TAE缓冲液于200 V、60 ℃电泳5 min,于100 V、60 ℃电泳16 h后用硝酸银染色,通过凝胶成像系统扫描成像[11]。
1.4 数据分析
水质和微生物指标数据采用 SPSS 19.0进行One–Way ANOVY分析,用Duncan’s 进行多重比较;DGGE电泳图谱采用BIO–RAD Quantity One进行分析[12];将各 DGGE带谱视为独立的分类单元(OTU),采用非加权配对算术平均法(UPGMA)进行聚类分析,并计算Shannon–Wieave多样性指数[13]和Pielou均匀度指数[14];用Canoco 5对环境因子和浮游生物群落结构的关系进行冗余分析(RDA)。
2 结果与分析
2.1 复合生物营养剂对水质的影响
由表1可见,C组的DO含量显著低于其余各组(P<0.05),而CK、A组、B组DO含量间的差异无统计学意义。各营养剂处理组的NH3–N含量显著高于对照组(P<0.05),其中以A组的最高,C组的次之;水体的NO2–N含量以A组的最高,且A组与其余各组的差异显著(P<0.05),而B组和C组间的差异无统计学意义。各营养剂处理组的 TN含量和TP含量水平较CK均有明显提高,以A组的TN含量最高,A、B组与CK组的差异显著(P<0.05),而CK组与C组的差异无统计学意义;TP含量水平以A组和B组的较高,显著高于CK组和C组的(P<0.05),而CK组与C组间的差异无统计学意义。

表1 各处理水体的理化指标Table 1 Physiochemical parameters of water in different treatments
2.2 复合生物营养剂对微生物群落数量的影响
由图1可知,C组(其有机营养物质含量最高)水体中异养菌和芽孢杆菌的数量显著高于其余各组(P<0.05);A组和B组芽孢杆菌的数量与CK组具有显著差异(P<0.05),但这二组间的差异无统计学意义。各营养剂处理组气单胞菌的数量显著低于CK组(P<0.05),C组则显著高于A组和B组(P<0.05),而A组和B组间的差异无统计学意义。弧菌的数量各组间的差异均无统计学意义。

图1 各处理水体的微生物数量Fig.1 Aquatic microorganisms amount in different treatments
2.3 复合生物营养剂对浮游生物群落结构的影响
在原核生物DGGE图谱(图2)中,B组的平均条带数最多,检测到23条,A、C组的次之,CK组的最少,仅13条。B组的多样性指数和均匀度指数最大,分别为3.12和0.86,CK组的最小,分别为2.56和0.71。

图2 各处理水体原核生物16S rDNA片段的DGGE电泳图谱Fig.2 DGGE profiles of prokaryote 16S rDNA fragments in different treatments
真核生物DGGE图谱(图3)与原核生物的检测结果基本一致,以B组的条带数最多,检测到16条,A、C组的次之,CK组的最少,仅7条。多样性指数和均匀度指数均以B组的最大,分别为2.70和0.74,对照组的最小,分别为1.95和0.54(表2)。原核生物和真核生物的UPGMA聚类分析结果(图4,图5)显示,CK组均能聚为一族,而各营养剂处理组较为分散,说明CK组的相似性较高,而各营养剂处理组间的差异较大。

图3 各处理水体原核生物16S rDNA片段的系统聚类树Fig.3 Cluster analysis on prokaryote 16S rDNA fragments in different treatments

图4 各处理水体真核生物18S rDNA片段的DGGE电泳图谱Fig.4 DGGE profiles of eukaryote 18S rDNA fragments in different treatments
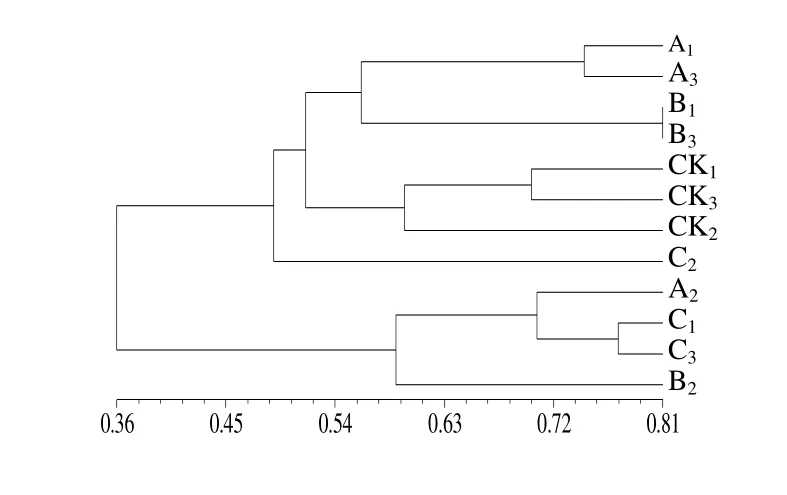
图5 各处理水体真核生物18S rDNA片段的系统聚类树Fig.5 Cluster analysis of eukaryote 18S rDNA fragment in different treatments

表 2 各处理水体浮游生物的条带数和多样性指数及均匀度指数Table 2 Number of DGGE bands, Shannon-wiener diversity index and Pielou evenness index of plankton communities in different treatments
2.4 浮游生物群落结构与环境因子的关系
图6反映了原核生物群落结构与5种环境理化因子之间的关系。RDA排序图的2个主要轴的特征值分别为0.321和0.153,这2轴所代表的环境因子能够解释 47.46%原核生物物种的变化信息。RDA分析结果显示,TP、TN、NO2–N 含量构成原核生物群落结构的主要影响因子,均与第2轴具有较大的相关性,相关系数分别为0.813 6、0.779 5、0.750 2。从排序图中可看出,CK组和C组均分布在环境轴的反方向上,其原核生物群落结构与各环境因子呈负相关,并与B组原核生物群落结构DO含量呈正相关,并与TN含量和TP含量有一定的相关性。

图6 各处理水体原核生物群落的RDA分析结果Fig.6 Ordination on data from prokaryotic plankton in different treatments using redundancy analysis (RDA)
图7反映了真核生物群落结构与5种环境理化因子之间的关系。RDA排序图的2个主要轴的特征值分别为0.249和0.147。这2轴所代表的环境因子能够解释 39.53%真核生物物种的变化信息。NH3–N、DO含量为影响真核生物群落结构的主要因子,分别与第1轴和第2轴呈正相关,相关系数分别为0.506 8、0.513 1。由排序图可知,B组真核生物群落结构与 DO含量呈正相关,但与 NH3–N含量呈负相关;C组真核生物群落结构与 NH3–N含量呈显著正相关。

图7 各处理水体真核生物群落的RDA分析结果Fig.7 Ordination on the data from eukaryotic plankton in different treatments using redundancy analysis (RDA)
3 结论与讨论
不同类型的营养剂对水体环境的作用效果不同。无机营养剂对水体的N、P水平具有显著的提升作用,对浮游生物的促生长效果更佳[15–16],但营养盐浓度过高时易造成水质不稳定,有害物质含量上升,并引发水体富营养化现象[17]。发酵有机营养剂具有更复杂的微生物区系,能够使水体中的微生物数量显著提高[18]。有研究[19]表明,高剂量的有机营养剂易引发厌氧分解,导致大量有毒气体如CO2、H2S和NH3等的产生,使浮游生物量及池塘产量降低。本研究中,A组具有较高的营养水平及最高的NH3–N含量和NO2–N含量,是无机盐含量过高的表现。C组水体中微生物数量高、NH3–N含量显著上升、DO含量降低与水体自身有机物含量过高有关。B组的水质状况好于A组和C组的,有害物质含量和有害菌数量均较低,说明B组水质的营养物质组成丰富且合理,可促进水体微生物多样性和代谢活性提高[20],进一步促进营养物质的利用、循环与转化,使得水体中有害物质NH3–N和NO2–N的含量降低,不至引起有害菌的大量增殖。此外,益生菌对水体微生物群落有重要影响,能够改善水体生物群落结构,抑制有害菌的繁殖[21]。本研究结果表明,复合生物营养剂能显著提高水体芽孢杆菌的数量,显著降低气单胞菌的数量,但对弧菌无明显影响。
本试验中的DGGE检测结果显示,使用营养剂后水体中浮游生物的物种更丰富,多样性也更高,而各营养剂处理组中以 C组获得的浮游生物条带数较少,这可能与其无机盐含量低且水质较差、水体中浮游生物数量少有关[19]。B组获得的条带数最多,约为对照组的2倍,说明该组的营养组成更符合浮游生物的生长需要,水体微生物种群的结构较优化,浮游生物的繁殖量大[22]。微生物对复杂有机物具有矿化作用,能够提高水体磷酸盐水平,促进浮游生物的丰度和初级生产力的提高[23–24]。本研究中的相关性分析结果显示:浮游生物的多样性与TN含量、TP含量和DO含量等密切相关,说明该试验条件下浮游生物对营养盐具有较好的响应。RDA排序图显示,CK组分布较集中,C组的次之,A、B组较为分散。聚类分析结果与RDA排序结果一致,表明施用营养剂后水体中浮游生物的群落结构都有较大改变,浮游生物群落相似性降低,尤其以无机盐含量较高的A组和B组最明显,表明高含量无机盐使水质波动较大,使浮游生物的繁殖和演替迅速,种类的稳定性受到一定影响[16]。由于水族箱中的生态系统较简单,水源中的浮游生物较少,因此,本试验中获得的浮游生物种类比前人研究中的少。在今后的研究中可适当引入藻源生物(人工添加藻种或使用藻相较好的湖泊水),以获得更高的浮游生物多样性,使研究结果更加符合水产养殖需求。
综合分析结果表明,含有32%有机营养物质、78%无机盐和 6%微量营养物质的复合生物营养剂对水体环境的改善效果更好,而复合生物营养剂在水产养殖中对养殖动物的增产效果有待研究。
[1]汤江武,吴逸飞,薛智勇,等.肥料在水产养殖中的应用及前景[J].淡水渔业,2003,33(4):62–63.DOI:10.3969/j.issn.1000–6907.2003.04.024.
[3]董双林.高效低碳——中国水产养殖业发展的必由之路[J].水产学报,2011,35(10):1595–1600.DOI:10.3724/SP.J.1231.2011.17600.
[4]孙平.水产养殖环境的污染及其控制对策[J].农业科技与信息,2016(15):46–47.
[5]倪汉金,高光明.推广微生态制剂和生物鱼肥促进水产养殖健康发展[J].科学养鱼,2007(6):4–5.
[6]雷衍之.养殖水环境化学实验[M].北京:中国农业出版社,2006.
[7]RONALD M Atlas.Handbook of Microbiological Media [M].4th Ed.Washiongton,D.C.:CRC Press,2010.
[8]DÍEZ B,PEDRÓs-ALIÓ C,MARSH T L,et al.Application of denaturing gradient gel electrophoresis (DGGE) to study the diversity of marine picoeukaryotic assemblages and comparison of DGGE with other molecular techniques[J].Appl Environ Microbiol,2001,67(7):2942–2951.DOI:10.1128/AEM.67.7.2942–2951.2001.
[9]MUYZER G,De WAAL E C,UITTERLINDEN A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction- amplified genes coding for 16S rRNA[J].Appl Environ Microbiol,1993,59(3):695–700.
[10]颜庆云,余育和,冯伟松.武汉东湖浮游生物宏基因组与环境重金属的关系[J].中国环境科学,2010,30(z1):52–56.
[11]Van ORSOUW N J,LI D,VIJG J.Denaturing gradient gel electrophoresis (DGGE) increases resolution and informativity of Alu-directed inter-repeat PCR[J].Mol Cell Probes,1997,11(2):95–101.DOI:10.1006/mcpr.1996.0089.
[12]王琴,熊邦喜,朱玉婷,等.主养草鱼池塘三种混养模式下鱼类肠道菌群 PCR–DGGE比较[J].农业生物技术学报,2012,20(3):308–315.DOI:10.3969/j.issn.1674–7968.2012.03.012.
[13]SHANNON C E.A mathematical theory of communication[J].M.d.Computing:Computers in Medical Practice,1997,14(4):306–317.
[14]SHANNON C E,WEINER W.The Mathematical Theory of Communication[M].Urbana,IL:University of Illinois Press,1949.
[15]MISCHKE C C,ZIMBA P V.Plankton community responses in earthen channel catfish nursery ponds under various fertilization regimes[J].Aquaculture,2004,233(1):219–235.DOI:10.1016/j.aquaculture.2003.09.044.
[16]MORSI H H,Al-SHATHLY M R,HEMEDA M M.Utilization of organic (rice straw extract) and inorganic compounds as a fertilizer for phytoplankton and zooplankton under laboratory conditions[J].Journal of American Science,2014,10(3):16–28.
[17]秦伯强,王小冬,汤祥明,等.太湖富营养化与蓝藻水华引起的饮用水危机——原因与对策[J].地球科学进展,2007,22(9):896–906.DOI:10.3321/j.issn:1001–8166.2007.09.003.
[18]DAS M,AYYAPPAN S,DASH B,et al.Heterotrophic bacterial populations and dehydrogenase activity in fish ponds under different fertilisation practicesHeterotrophic bacteria[J].Indian Journal of Fisheries,2013,60(3):87–90.
[19]GARG S K,BHATNAGAR A.Determination of dosage of Azotobacter and organic fertilizer for optimum nutrient release,net primary productivity and fish growth in fresh water fish ponds[J].Aquaculture International,2002,10(2):87–107.
[20]HU X,LIU Q,LI Z,et al.Metabolic and phylogenetic profile of bacterial community in Guishan coastal water (Pearl River Estuary),South China Sea[J].Journal of Ocean University of China,2014,13(5):857–864.DOI:10.1007/s11802–014–2294–1.
[21]肖国华,高晓田,赵振良,等.一种复合微生态制剂对养殖水体中生物因子的影响[J].微生物学通报,2013,40(7):1154–1162.
[22]黄辨非,邱海燕.生物渔肥对水泥池浮游生物种群的影响[J].渔业现代化,2011,38(4):27–31.DOI:10.3969/j.issn.1007–9580.2011.04.006.
[23]TRIPATHY P P,AYYAPPAN S.Evaluation of Azotobacter and Azospirillum as biofertilizers in aquaculture[J].World Journal of Microbiology and Biotechnology,2005,21(8):1339–1343.DOI:10.1007/ s11274–005–3787–2.
[24]ABBAS W T,M ALI S,I A Wafa M.Evaluation of Azotobacter and Azospirillum biofertilizers as a probiotics in oreochromis niloticus aquaculture[J].Journal of Fisheries and Aquatic Science,2011,6(5):535–544.DOI: 10.3923/jfas.2011.535.544.
责任编辑:王赛群
英文编辑:王 库
Effects of compound bio-nutrient on water environment
ZENG Dong1,2, WU Haiyan1#, NI Xueqin1,2*, XIE Yongbin1, OU Xingping1, CUI Lan1
(1.Research Center of Animal Micro-Ecological, College of Veterinary Medicine, Sichuan Agricultural University, Ya’an, Sichuan 625014, China; 2.Key Laboratory of Animal Disease and Human Health of Sichuan Province, Ya’an, Sichuan 625014, China)
Water tank experiments were conducted to evaluate the effects of compound bio-nutrient (CB) combination of various nutrient ratios on water environment.In this study, group CK was the blank control group, group A, B and C were CB combinations of organic nutrients, inorganic salts and micronutrients, with the proportion of 16∶78∶6, 32∶62∶6 and 48∶44∶6, respectively.Results showed that dissolved oxygen (DO) concentration in group C had a significant decline, harmful substances content was the highest in group A, in which ammonia nitrogen (NH3–N) level was significantly higher than that in group CK and group B, but there was no significantly difference between group C, and its nitrite (NO2–N) content was increased remarkably compared with other groups.CB gave a great increase to the content of total nitrogen (TN) and total phosphorus (TP), especially in group A and B.A sharp increase of Bacillus counts and a significant decline of Beromonas counts were recorded in all groups treated with CB.In addition, there were an obvious improvement in the abundance and diversity of plankton in all treatments, especially in group B.The results from RDA analysis revealed that TN and TP were the major environmental factor affecting prokaryotes communities, while DO and NH3–N taken effect to eukaryotes communities.In general, the 32∶62∶6 combination of CB in organic nutrients, inorganic salts and micronutrients had good effects on water environmental improvement.
S963.9
:A
:1007-1032(2017)01-0058-06
��志辉.鱼池施肥的理论和实践[J].大连水产学院学报,2000,15(1):1–9.
10.3969/j.issn.1000–9957.2000.01.001.
2016–07–16
2016–10–31
四川省科学技术厅科技支撑项目(2013NZ0042)
曾东(1961—),男,四川丹棱人,教授,主要从事动物微生态研究,zend@sicau.edu.cn;#并列第1作者,吴海燕(1991—),女,广东高州人,硕士研究生,主要从事动物微生态研究,petrel90@163.com;*通信作者,倪学勤,教授,主要从事动物微生态研究,xueqinni@foxmail.com

